拟南芥雄性不育突变体opw(only pollen wall)候选突变基因的克隆
2016-12-14庞朝廷吴文艳高菊芳
庞朝廷, 张 婷, 李 娜, 吴文艳, 高菊芳
(上海师范大学 生命与环境科学学院,上海 200234)
拟南芥雄性不育突变体opw(only pollen wall)候选突变基因的克隆
庞朝廷, 张 婷, 李 娜, 吴文艳, 高菊芳
(上海师范大学 生命与环境科学学院,上海 200234)
在T-DNA插入突变体Salk_059463株系的群体中,筛选到两株雄性不育突变体,对T-DNA序列上的一对引物进行PCR鉴定,结果表明:其基因组中没有T-DNA插入.遗传分析表明这两株雄性不育突变体由同一单个隐性基因控制,引起不育的主要原因是从花药发育的第8期开始,小孢子细胞质内容物逐渐减少直至消失,到花药发育的第12期,药室内的小孢子只剩下一个花粉壁空壳,故该突变体命名为opw(only pollen wall).利用图位克隆的方法对OPW基因进行了定位,结果表明OPW基因位于第二条染色体上分子标记T28M21和T3G21之间的12 kb区间内,该区间内一共有21个基因注释.通过克隆区间内的基因并测序发现opw-1突变体基因组中At2g40140基因编码序列的外显子在第289和第290个碱基之间插入了一个A碱基,而opw-2突变体基因组中At2g40140基因编码序列的外显子在第412和第413个碱基之间插入了一个T碱基,造成的编码序列移码使第424至第426碱基成为终止密码子,故At2g40140是编码OPW的候选基因.
拟南芥; 雄性不育; 花粉壁空壳; 图位克隆
0 引 言
植物雄性不育是指植物在有性繁殖过程中不能产生正常的花药、花粉或雄配子的遗传现象.Heslop-Harrison[1]按世代交替把雄性不育划分为孢子体不育和配子体不育两种类型.孢子体不育指花粉育性受孢子体(植株)基因型控制,表现为纯合突变体不能产生种子;而配子体不育是指花粉育性直接受雄配子体(花粉)本身基因型控制,表现为杂合突变体花粉缺陷比率1∶1,而无法产生纯合突变体.
花粉在花药中的发育过程涉及一系列复杂而精细的分子机制,包括早期的细胞分化和命运决定、减数分裂、花粉壁形成以及花粉细胞核有丝分裂等等.AG、SPL/NOZZLE、BAM1/BAM2、WUS、EMS1/EXS等基因与早期的细胞分化和命运决定相关[2-8];SYN1、AHP2、AtSPO11-1、ATK1、ATK5、ASK1、MPS1等基因的功能分别涉及染色体的黏着、配对、联会、重组、分离和胞质分裂等关键过程[9-10].花粉壁发育的分子机制极其保守,主要涉及胼胝质壁的合成、初生外壁的形成以及花粉外壁和花粉内壁形成等[11].研究发现CALS5(Callose Synthase5)、CDKG1、ARF17、DEX1、NEF1、RPG1、NUP、CESA(Cellululose Synthase) 和AtUSP(Arabidopsis UDP-sugar pyrophosporylase)等基因与花粉壁的正常发育相关[12-21],进一步的研究还表明在绒毡层发育过程中,遗传通路“DYT1-TDF1-AMS-MS188”负责花粉外壁外层的形成;“DYT1-TDF1-AMS-TEK”负责花粉外壁内层的形成[22-23].
小孢子从四分体中释放出来之后,除了形成花粉壁之外,其细胞核还要经历两次有丝分裂、细胞质还需积累营养物质才能形成成熟的花粉粒.然而,哪些基因控制着这些过程仍不清楚.本文作者报道的是从Salk_059463株系的群体中筛选到的由单个隐性基因控制的拟南芥雄性不育突变体,其花粉壁发育基本正常,但从花药发育的第8期开始,小孢子细胞质内容物逐渐减少直至消失,到花药发育的第12期,药室内的小孢子只剩下一个花粉壁空壳,故该突变体命名为opw(only pollen wall).利用图位克隆的方法克隆了OPW候选基因,测序结果表明突变体基因组中At2g40140基因编码序列的外显子部分有一个单碱基插入,造成编码序列提前出现终止密码子,故At2g40140是编码OPW的候选基因,该基因可能参与小孢子的后续发育.
1 材料与方法
1.1 植物材料
拟南芥(Arabidopsis thaliana)分别以Columbia(Col)和Lansberg erecta(Ler)为遗传背景,拟南芥雄性不育突变体opw-1和opw-2从Salk_059463中分离获得,背景为Col.
1.2 方 法
1.2.1 等位分析
以Col♂×opw-1♀F1代为父本,opw-2为母本或者Col♂×opw-2♀F1代为父本,opw-1为母本杂交获得测交种子.种植测交所得种子,观察后代植株的表型,如果出现可育植株和不育植株1∶1分离的现象,则判断opw-1和opw-2等位.
1.2.2 遗传分析
以野生型Col为父本,突变体opw-1为母本进行杂交得到F1代种子,F1代植株自交得到F2代种子.种植F2代种子,观察F2代植株表型,统计F2代植株中可育植株与不育植株的比例.
1.2.3 雄性不育基因opw的初定位和精细定位
收集用野生型Ler作为父本与突变体杂交所得到的F2遗传群体中的突变体植株用于基因定位.基因初定位的方法及所用分子标记同[24],一旦找到了连锁的分子标记,就在该分子标记附近设计新的分子标记(表1),对突变体单株进行基因型分析,对目的基因作进一步定位.
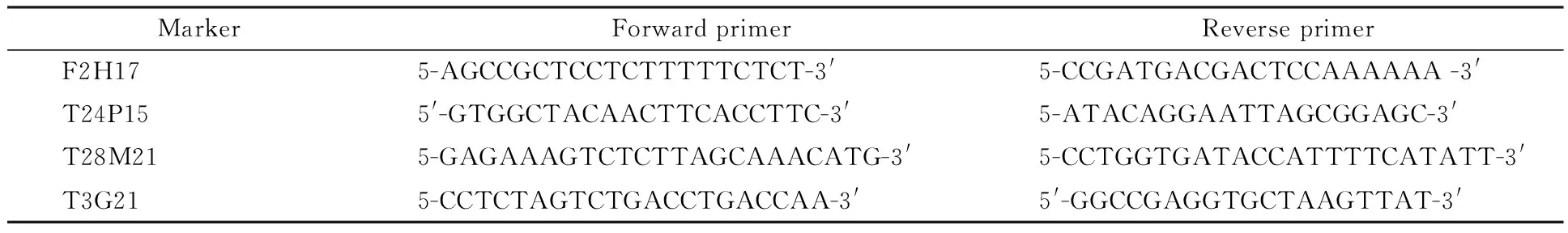
表1 本研究所涉及的分子标记引物序列
1.2.4opw基因克隆
根据精细定位的结果,以www.arabidopsis.org网提供的基因序列为依据设计引物,将其中的基因克隆后送杰李生物技术有限公司测序,根据测序结果确定候选基因.
1.2.5 DNA提取、PCR反应和多态性检测
方法同[24].
1.2.6 花药发育的光学显微镜和扫描电子显微镜观察
方法同[25].
2 结果与分析
2.1 突变体opw-1和opw-2的表型分析
突变体opw-1和opw-2是从Salk_059463植株群体中分离获得的,用T-DNA序列上的一对引物进行PCR鉴定,鉴定结果表明其基因组中没有T-DNA插入.突变体在生长过程中表现出正常的营养生长和花发育,但是,与野生型植株比较,突变体的果荚短小,成熟后不含种子(图1上).而用Col或Ler野生型植株的花粉与其杂交,可以获得种子,说明其雌蕊是正常的,该突变体是雄性不育突变体.对13期花药进行亚历山大染色,发现突变体的药室中的花粉粒,只有染成绿色的花粉壁,没有染成紫红色的细胞质内容物,结合后续的扫描电镜和树脂半薄切片结果,故将突变体命名为花粉壁空壳opw-1和opw-2(图1).

图1 野生型和突变体植株形态和花粉育性比较.(a) 野生型(WT)植株具有正常的果荚;(b)、(c) opw-1和opw-2突变体植株具有短小的果荚; (d)亚历山大染色野生型(WT)花药中的花粉显示可育的紫红色; (e)、(f) opw-1和opw-2突变体花药中的花粉为不育的绿色
2.2 突变体opw-1和opw-2是等位突变体
由于突变体opw-1和opw-2的表型极为相似,为了验证两者是否等位,以Col♂×opw-1♀F1代为父本,opw-2为母本杂交获得测交种子,后代植株75株,其中可育植株37棵,不育植株38棵;以Col♂×opw-2♀F1代为父本,opw-1为母本杂交获得测交种子,后代植株57棵中可育植株30棵,不育植株27棵.两种测交的结果均表明不育植株和可育植株的比例接近1∶1,经卡方检测表明实际比例和理论比例没有明显差异,突变体opw-1和opw-2是等位突变体.
2.3 突变体opw-1的遗传分析
为了确定opw-1突变体是否由单个基因控制,将野生型Col作为父本,突变体作为母本杂交得到F1一代种子,F1代植株均为可育的野生型表型.F1代植株通过自交得到F2代种子.观察F2代植株表型,并统计F2一代中可育植株与不育植株的比例.结果显示可育植株与不育植株比为893∶38,接近3∶1.经卡方检测表明实际比例和理论比例没有明显差异,表明该突变体表型是隐性单基因控制的.
2.4 突变体opw-1和opw-2的遗传定位
为了进一步研究opw突变体并最终克隆opw基因,通过遗传定位以确定该突变基因在染色体上的位置.首先,选用了在拟南芥基因组五条染色体上均匀分布的20对分子标记进行了基因的初定位连锁分析.以这些分子标记为引物进行PCR扩增,结果表明突变基因opw-1与和opw-2均与第2条染色体上的分子标记 F12L6连锁.利用新设计的分子标记(表1)对2000株突变体opw-1 和1800株opw-2基因多态性进行分析,将opw基因定位在第2条染色体分子标记T28M21和T3G21之间的12 kb的区间内(图2).

图2 opw基因定位在第2条染色体上分子标记T28M21和T3G21之间的12 kb的区间内
该区间内一共注释有21个基因,通过克隆区间内的基因并测序发现opw-1突变体基因组中At2g40140基因编码序列的外显子部分在第280与290个碱基之间插入了一个碱基A,opw-2突变体基因组中At2g40140基因编码序列的外显子部分在第412与413个碱基之间插入了一个碱基T,均造成编码序列移码,从而使突变体编码At2g40140基因序列中的第424-426碱基出现了TAA终止密码子,造成编码序列提前终止(图3),故At2g40140是编码OPW的候选基因.
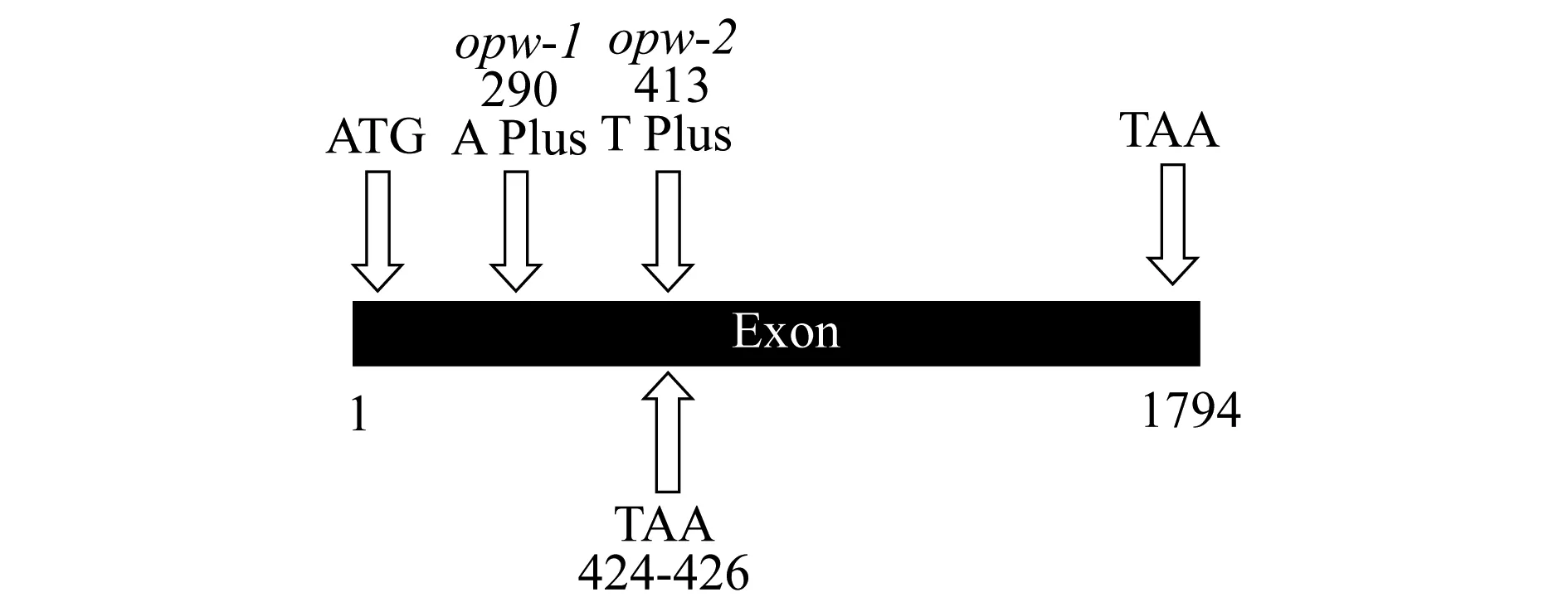
图3 opw-1和opw-2突变体基因组中At2g40140基因编码序列的突变示意图
2.5OPW基因功能的初步分析
为了了解OPW基因在花粉发育过程中的作用,利用树脂半薄切片技术对突变体opw-1花药发育过程进行了细胞学观察,结果表明在花药发育的第1至第7期,突变体opw-1花药发育的细胞学变化与野生型的相比,未出现明显的变化(图4(a)和(e)、(b)和(f)).花药发育的第8期,野生型四分体中释放出来的小孢子已形成完整的细胞壁,形态呈不规则多边形(图4(c));而突变体四分体中释放出来的小孢子形态呈圆形(图4(g)),提示小孢子细胞壁出现了问题.在花药发育的第9至第10期,野生型药室中小孢子花粉外壁基本形成(图4(d)),细胞质进入单核液泡期(图4(i)),花粉外壁和胞质着色较深;而突变体药室中小孢子花粉外壁虽能形成(图4),但小孢子内容物逐渐减少,胞质着色较淡(图4(m)).在花药发育的第11至第13期,野生型药室中小孢子的细胞核经过了两次有丝分裂,形成细胞质浓密的成熟花粉粒子(图4(j)、(k)),扫描电镜下花粉外形饱满,为长椭圆状,花粉外壁结构完整,具有典型的萌发沟(图4(l));而突变体药室中小孢子的细胞内容物逐渐降解消失,只剩下花粉壁(图4(n)、(o)),扫描电镜下花粉外壁结构较完整,也具有典型的萌发沟,但形状不够饱满(图4(p)).从上述突变体花药发育过程中小孢子的形态变化中可以预测OPW基因功能可能主要涉及花粉外壁形成之后的小孢子后续发育过程,即小孢子细胞核的有丝分裂及胞质营养物质积累过程.
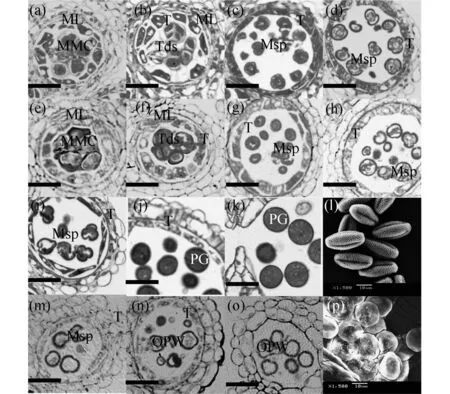
图4 野生型和opw-1突变体花药横切面和花粉外貌观察.(a)和(e):第6期花药横切;(b)和(f):第7期花药横切;(c)和(g):第8期花药横切;(d)和(h):第9期花药横切;(i)和(m):第10期花药横切;(j)和(n):第11期花药横切;(k)和(o)O:第12期花药横切(标尺=20 μm);(l)和(p):第13期花药中花粉的外貌.(a)~(d)和(i)~(l):野生型;(e)~(h)和(m)~(p) :opw-1突变体.
3 讨 论
3.1 At2g40140是OPW的候选基因
为了克隆OPW基因,首先建立了野生型Ler作为父本与突变体杂交所得的F2遗传群体,以其中的突变体作为图位克隆的材料.然后根据网上公布的拟南芥基因组多态性数据库,在拟南芥5条染色体上选择In /Del标记,并利用软件Primer 5.0设计引物,用2.5%的琼脂糖凝胶电泳验证2个亲本Ler和Col之间的多态性.由于opw-1和opw-2突变体初定位的结果都表明与第2条染色体上的分子标记F12L6紧密连锁,结合opw-1和opw-2突变体13期花药亚历山大染色和扫描电镜的结果极其相似,故又进行了测交实验.以Col♂×opw-1♀F1代为父本,opw-2为母本杂交或以Col♂×opw-2♀F1代为父本,opw-1为母本杂交的结果都是后代植株中可育植株和不育植株出现了1∶1分离的现象,表明两个突变体是等位突变体.
精细定位的结果表明opw基因定位在第2条染色体分子标记T28M21和T3G21之间的12 kb的区间内(图2).通过克隆区间内的基因并测序发现opw-1和opw-2这两个等位突变体基因组中At2g40140基因编码序列的外显子部分有一个单碱基插入,造成编码序列提前出现终止密码子(图3),故判断At2g40140是编码OPW的候选基因.下一步的工作是构建At2g40140基因的互补载体,通过遗传转化和功能互补验证最终确定OPW基因.
3.2OPW的功能与小孢子发育为成熟花粉粒相关
野生型小孢子从四分体中释放出来后,除了完成花粉壁发育以外,其细胞核还要经历两次有丝分裂,并且合成大量营养物质才能形成成熟的花粉粒.对突变体opw-1花药发育过程进行的细胞学观察发现花粉发育在花药发育的第8期开始显现异常(图4(g)),在花粉壁初步形成以后,小孢子内容物逐渐减少,只剩下空的花粉壁(图4(o)),扫描电镜下花粉外壁结构较完整,也具有典型的萌发沟,但形状不够饱满(图4(p)).从上述突变体花药发育过程中小孢子的形态变化中可以预测OPW基因功能可能主要涉及花粉外壁形成之后的小孢子后续发育过程,即小孢子细胞壁发育以及细胞核的有丝分裂及胞质营养物质积累过程.由于突变体opw-1是受单个隐性基因控制的雄性不育突变体,对OPW基因功能的深入研究可以帮助我深入理解孢子体基因如何调控雄配子的发育.
致谢 本文的实验工作在上海师范大学植物功能基因实验室完成.感谢ABRC提供突变体种子.
[1] Gottschalk W.The genetic control of microsporogenesis in higher plants [J].Nucleus,1974,17:133-166.
[2] Scott R J,Spielman M,Dickinson H G.Stamen structure and function [J].Plant Cell,2004,16(Suppl):46-60.
[3] Yang W C,Ye D,Xu J,et al.The SPOROCYTELESS gene ofArabidopsisis required for initiation of sporogrnesis and encodes a novel nuclear protein [J].Genes and Development,1999,13(16):2108-2117.
[4] Schiefthaler U,Balasubramanian S,Sieber P,et al.Molecular analysis of NOZZLE,a gene involved in pattern formation and early sprogenesis during sex organ development inArabidopsis thaliana[J].Plant Molecular Biology,1992,20(6):1097-1110.
[5] Ishii T,Kimura M,Yamamoto T,et al.The homeotic protein AGAMOUS controls microsporogenesis by regulation ofSPOROCYTELESS[J].Nature,2004,430(6997):356-360.
[6] Hord C L,Chen C,Deyoung B J,et al.The BAM1/BAM2 receptor-like kinases are important regulators ofArabidopsisearly anther development [J].Plant Cell,2006,18(7):1667-1680.
[7] Deyhlef F,Sarkar A K,Tucker E J,et al.WUSCHELregulates cell differentiation during anther development [J].Developmental Biology,2007,302(1):154-159.
[8] Zhao D Z,Wang G F,Speal B,et al.TheEXCESS MICROSPOROCYTES1 encodes a putative leucine-rich repeat receptor pprotein kinase that controls somatic and reproductive cell fate in theArabidopsisanther [J].Genes & Development,2002,16:2021-2031.
[9] Ma H.Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants [J].Annual Review of Plant Biology,2005,56(1):393-434.
[10] Mercier R,Grelon M.Meiosis in plants:ten years of gene discovery [J].Cytogenetic and Genome Research,2008,120(3-4):281-290.
[11] Arrizumi T,Toriyama K.Genetic regulation of sporopollenin synthesis and pollen exine development [J].Annual Review of Plant Biology,2011,62(1),437-460.
[12] Dong X,Hong Z,Sivaranakrishnan M,et al.Callose synthase (CalS5) is required for exine formation during microgametogenesis and for pollen viability inArabidopsis[J].Plant Journal,2005,42(3):315-328.
[13] Huang X Y,Niu J,Sun M X,et al.CDKG1 is associated with spliceosome to regulateCALLOSE SYNTHASE5 splicing and pollen wall formation inArabidopsis[J].Plant Cell,2013,25(2):637-648.
[14] Yang J,Tian L,Sun M X,et al.AUXIN RESPONSE FACTOR17 is essential for pollen wall pattern formation inArabidopsis[J].Plant Physiology,2013,162(2):720-731.
[15] Paxson-Sowders D M,Dodrill C H,Owen H A,et al.DEX1,a novel plant protein,is required for exine pattern formation during pollen development inArabidopsis[J].Plant Physiology,2001,127(4):1739-1749.
[16] Ariizumi T,Hatakeyama K,Hinata K,et al.Disruption of the novel plant protein NEF1 affects lipid accumulation in the plastids of the tapetum and exine formation of pollen,resulting in male sterility inArabidopsis thaliana[J].Plant Journal,2004,39(2):170-181.
[17] Guan Y F,Huang X Y,Zhu J,et al.RUPTURED POLLEN GRAIN 1,a member of the MtN3/saliva gene family,is crucial for exine pattern formation and cell integrity of microspores inArabidopsis[J].Plant physiology,2008,147(2):852-863.
[18] Chang H S,Zhang C,Chang Y H,et al.No primexine and plasma membrane undulation is essential for primexine deposition and plasma membrane undulation during microsporogenesis inArabidopsis[J].Plant Physiology,2012,158(1):264-272.
[19] Zhu J,Lou Y,Xu X F,et al.A genetic pathway for tapetun development and function inArabidopsis[J].Journal of Intetegrative Plant Biology,2011,53(11):892-900.
[20] Lou Y,Xu X F,Zhu J,et al.The tapetal AHL family protein TEK determines nexine formation in the pollen wall [J].Nature Communication,2014,5(1):3855.
[21] Blackmore S,Wortlry A H,Skvarla J J,et al.Pollen wall development in flowering plants [J].New Phytologist,2007,174(3):483-498.
[22] Persson S,Paredez A,Carroll A,et al.Genetic evidence for three unique components in primary cell-wall cellulose synthase complexes inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(39):15566-15571.
[23] Schnurr J A,Storey K K,Jung H J,et al.UDP-sugar pyrophosphorylase is essential for pollen development inArabiidopsis[J].Planta,2006,224(3):520-532.
[24] 易君,高菊芳,张在宝,等.拟南芥雄性不育突变体 ms1502的遗传及定位分析 [J].云南植物研究,2006,28(3):283-288.
Yi J,Gao J F,Zhang Z B,et al.Genetic and mapping analysis ofArabidopsis Thalianamale sterile mutant ms1502 (Cruciferae) [J].Acta Botanica Yunnanica,2006,28(3):283-288.
[25] 高菊芳,杨太为.荧光显微术在鉴别花粉壁相关基因功能中的应用 [J].上海师范大学学报(自然科学版),2010,39(6):615-622.
Gao J F,Yang T W.Application of fluorescence microscopy in distinguish the functions of pollen wall development related genes inArabidopsis[J].Journal of Shanghai Normal University (Natural Sciences),2010,39(6):615-622.
(责任编辑:顾浩然)
Cloning of Gene of male sterile mutant opw(only pollen wall)in Arabidopsis thaliana
PANG Chaoting, ZHANG Ting, LI Na, WU Wenyan, GAO Jufang
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Two male sterile mutant lines with normal vegetative and flora development but no seed yields were screened out from Salk_059463 line,a population ofArabidopsis ecotypeColumbia (Col) mutagenized by T-DNA insertion (provided by ARBC).The identification of T-DNA insertion site showed that there were no T-DNA sequences in the genome of these two mutants.Genetic analysis indicated that the mutants were allele and controlled by the same single recessive nuclear gene namedonly pollen wall,of which the cytoplasm of microspores becomes vanished from anther development stage 8,and there are only pollen wall of pollen grains in the anther at the anther development stage 12.TheOPWgene was mapped to a region of 12 kb between the molecular makers T28M21 and T3G21 on chromosome 2 using map-based cloning technique.There are 21 genes annotations in that region.Cloning and sequencing the At2g40140 of the mutants,we found that there was a single A base insertion between 289 to 290 bases in theopw-1 and another single T base insertion between 412 to 413 bases in theopw-2,therefore caused the end code appear in 424-426 bases.So At2g40140 is considered the candidate gene of theOPW.
Arabidopsis thaliana; male sterile;only pollen wall; map-based cloning
2015-07-06
国家自然科学基金(30970268);上海师范大学大学生创新项目
高菊芳,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:gaojufan@shnu.edu.cn
Q 78; Q 943
A
1000-5137(2016)05-0624-07
10.3969/J.ISSN.1000-5137.2016.05.018
