冰砂糖寿组培快繁研究
2016-12-14牟豪杰吕永平汪一婷李海营
牟豪杰, 王 燕, 吕永平, 汪一婷, 李海营
(浙江省农业科学院病毒学与生物技术研究所,浙江杭州 310021)
冰砂糖寿组培快繁研究
牟豪杰, 王 燕, 吕永平, 汪一婷, 李海营*
(浙江省农业科学院病毒学与生物技术研究所,浙江杭州 310021)
[目的] 探讨冰砂糖寿组培快繁的最佳条件。[方法]以冰砂糖寿幼嫩花序为外植体,研究冰砂糖寿组培快繁技术。[结果] 于MS + 5 mg/L 6-BA + 0.5 mg/L IBA+30 g/L蔗糖+7g/L琼脂 的诱导培养基上成功诱导出愈伤组织,在分化培养基MS+0.3 mg/L 6-BA+30 g/L蔗糖+7 g/L琼脂上继代培养可分化成不定芽,将不定芽转接到增殖培养基MS + 0.3 mg/L 6-BA + 0.1 mg/LNAA+30 g/L蔗糖+7 g/L琼脂上增殖速度较快,增殖系数达3.79。将其移栽至营养基质(混合泥炭∶粗砂=1∶1)中,移栽成活率可达95%。[结论]建立了冰砂糖寿花序再生及快繁体系,为其规模化生产提供理论依据。
冰砂糖寿;愈伤组织;不定芽
冰砂糖寿(Haworthiakegazato)为百合科(Liliaceae)瓦苇属(Haworthia)植物,该属植物根据植株叶的形态,分为硬叶和软叶2类。硬叶类植物叶面常被白色斑点,或结节成条状,具有极高的观赏价值。冰砂糖寿属于硬叶类植株,其叶片小巧,表面布满白色小刺如冰晶状,是极其珍贵的多肉植物品种之一。但由于其繁殖率很低,传统的繁殖大多采用分株、叶插和种子繁殖,不易成活且生长缓慢,同时,冰沙糖寿是杂合体,其有性杂交与母本差异较大,而植物组织培养繁殖速度快、繁殖系数大,繁殖后代整齐一致,能保持原有品种的优良性状。 21 世纪初,与冰砂糖寿同属的康平寿[1]、截形十二卷[2]、克里克特寿[3]、西山寿[4]、Haworthiamirabilis[5]和美吉寿[6]等多肉植物均有组织培养成功的报道,但未见其应用于产业化生产。笔者以冰砂糖寿幼嫩花序为外植体,研究其组织培养及快繁技术,以期为其规模化生产提供理论依据。
1 材料与方法
1.1 试验材料 供试材料为冰砂糖寿(Haworthiakegazato)幼嫩花序。
1.2 试验方法
1.2.1 外植体消毒。选取冰砂糖寿幼嫩花序为外植体,去除闭合花蕾的外苞片,再将花蕾连同花柄逐个切下。外植体先用浓洗衣粉溶液浸泡1 h后再用自来水冲洗干净,然后在70%乙醇溶液和有效氯浓度1% 的次氯酸钠溶液中分别浸泡40 s和6 min,最后用无菌水冲洗3~5遍,每遍2 min。
1.2.2 愈伤组织的诱导与增殖。将消毒后的花蕾在无菌条件下先用解剖刀将其基部切伤后接种于愈伤组织诱导培养基(MS + 5 mg/L 6-BA + 0.5 mg/L IBA+30 g/L蔗糖+7 g/L琼脂)中,并使伤口接触到培养基。于(23±2)℃暗培养42 d后转于光照条件(光照时间16 h/d, 光照强度约为60 μmol/(m2·s)下培养。
1.2.3 愈伤组织的分化。将诱导出致密、球状、淡黄色的愈伤组织暗培养14 d后,挑取生长量较大、色泽鲜亮、质地较硬的愈伤组织,接种在附加不同浓度分裂素及配比的培养基中,6-BA浓度分别为 0.1、 0. 3、 0.5 mg/L,进行单因素试验,在光照时间16 h/d、光照强度60 μmol/(m2·s)、温度(23±2)℃ 条件下培养。28 d后统计不定芽分化情况,每次试验接种至少20 块愈伤组织,重复3 次。
将诱导出的不定芽丛分成小丛接种在附加生长素和细胞分裂素的不同浓度及配比的培养基中,6-BA浓度分别为 0.1、0.3、0.5 mg/L,NAA浓度分别为 0、0. 1、0.3 mg/L,进行双因素试验,统计不定芽的分化情况。
1.2.4 壮苗与移栽。将增殖培养基上具有典型母本形态的丛生芽在无菌条件下切割成单株后转接至壮苗培养基(1/2MS+30 g/L 蔗糖+7 g/L琼脂)中,待植株达1.5~2.0 cm且出现明显成株形态时即可切除其根部并清洗,然后置于通风避光处3~10 d晾至微皱缩后, 种于装有基质6 cm×6 cm 营养钵基质(混合泥炭:粗沙=1∶1)中。种植完成后移入温室内的小塑料拱蓬中保湿,同时用 0.5 g/L多菌灵处理。14 d后适当通风,注意及时喷水,保持基质湿润;21 d后逐渐增大通风量。 夏季移栽时,移栽后前28 d应适当遮阴[7]。
2 结果与分析
2.1 不同浓度6-BA对愈伤组织分化的影响 幼嫩花蕾培养28~35 d后子房基部显著膨大且组织逐渐玻璃化;培养42~49 d后先形成淡黄色愈伤组织(图1 A)。将暗培养14 d后致密、球状、淡黄色的冰砂糖寿愈伤组织置于添加不同浓度6-BA 的MS培养基中,约 21 d后出现深绿色小突起(图1 B),而后开始不定芽的分化(图1 C),接种35~42 d后分化出丛生芽(图1 D)。随着 6-BA 浓度的升高成芽率逐渐升高,当6—BA浓度达0.5 mg/L时,虽然不定芽诱导率达到最高(78.7%±15.9%),但产生的丛生芽过于稠密,叶片小,植株生长不明显且愈伤组织褐化严重,不适合进一步增殖;而当6-BA浓度达0.3 mg/L时,产生的丛生芽叶片较大,生长健壮(图1E)。因此, MS+0.3 mg/L 6-BA+30 g/L蔗糖+7 g/L琼脂培养基最有利于芽的分化(表 1)。

图1 冰砂糖寿的组培再生体系Fig.1 tissue culture regeneration system of Haworthia kegazato
Table 1 Effects of different 6 - BA concentration on callus differentiation

处理Treatment6-BA浓度6-BAconcent-ration∥mg/L愈伤组织接种数Numberofcallusvacci-nation∥个不定芽数Numberofadventitiousbud∥个诱导率Inductionrate∥%①0.1653046.9±9.1②0.3614574.1±14.5③0.5635078.7±15.9
2.2 不同浓度激素对不定芽增殖的影响 由表 2 可知,随着 6-BA 浓度的升高增殖系数呈上升趋势,而当 6-BA浓度达 0.5 mg/L 时,苗纤细过密,叶片小而薄,不利于产业化生产。从种苗产业化角度考虑,最适合冰砂糖寿不定芽增殖的培养基是MS + 0.3 mg/L 6-BA + 0.1 mg/L NAA+30 g/L蔗糖+7 g/L琼脂,其增殖系数可达3.79。
2.3 移栽成活率 不定芽在壮苗培养基(1/2MS+30 g/L蔗糖+7 g/L琼脂)上培养至植株达1.5~2.0 cm且出现明显成株形态时,在营养基质(混合泥炭∶粗沙=1∶1)中移栽,其移栽成活率可达95%。
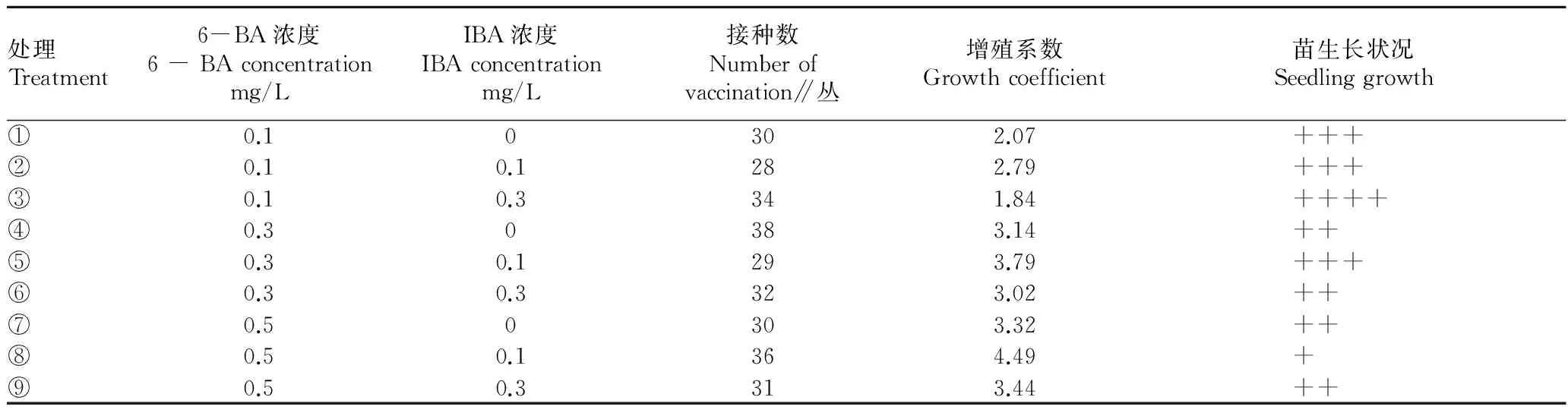
表2 不同浓度激素对不定芽增殖的影响
注:+.苗纤细,叶片小而薄; ++.苗纤细,叶片较小; +++.苗粗壮,叶片较厚; ++++.苗粗壮,叶片肥厚。
Note:+ stands for stender,smal and thin leaf;++ stands for slender plants and small leaf;+++ stands for granular plants and thick leaf;++++ stands for granular plants and thicker leaf.
3 结论
该试验中,冰砂糖寿花序接种于MS + 5 mg/L 6-BA + 0.5 mg/L IBA+30 g/L蔗糖+7 g/L琼脂的诱导培养基上42~49 d成功诱导出愈伤组织;暗培养14 d后的致密、球状、淡黄色的愈伤组织在分化培养基( MS+0.3 mg/L 6-BA+30 g/L蔗糖+7 g/L琼脂)上35~42 d继代可分化成不定芽丛,分化芽在MS + 0.3 mg/L 6-BA + 0.1 mg/L NAA+30 g/L蔗糖+7 g/L琼脂培养基上增殖速度最快,丛生芽生长健壮,增殖系数达3.79。将其移栽在营养基质(混合泥炭∶粗沙=1∶1)中,其移栽成活率可达95%。
[1] 孙涛,金蕊,李德森. 康平寿的组织培养与快速繁殖[J]. 植物生理学报,2003, 39(3):232.
[2] 孙涛,李德森. 截形十二卷的组织培养与快速繁殖[J]. 植物生理学报,2002, 38(6):586.
[3] 左志宇,李建希,安晓云,等. 克里克特寿的组织培养与快速繁殖[J]. 植物生理学报,2007,43(2):311-312.
[4] 宋晓涛,沈萌,左志宇,等. 十二卷属植物西山寿的组织培养与快速繁殖[J]. 植物生理学报,2007,43(5):883-884.
[5] PANDEY K N,SABHARWAL P S,CALKINS.Effects of ionizing radiation (60Co gamma rays) on growth and morphogenesis ofHaworthiamirabilis,haw. Callus tissue[J]. In vitro, 1979, 15(4):246-251.[6] 王泉,左志宇,宋晓涛,等. 百合科多肉植物美吉寿的组织培养与快速繁殖[J]. 植物生理学报,2008, 44(1):123-124.
[7] 牟豪杰,徐刚,汪一婷,等. 多浆植物组培苗移栽技术初探[J]. 浙江农业科学, 2005(6):450-451.
[8] 杜泽湘. 石榴新品种“九州红”组织培养及快繁技术研究[J]. 安徽农业科学, 2013,41(9):3770-3771.
Tissue Culture and Rapid Propagation ofHaworthiakegazato
MOU Hao-jie, WANG Yan,LV Yong-ping, LI Hai-ying*
(Zhejiang Academy of Agricultural Sciences,Institute of Virology and Biotechnology, Hangzhou, Zhejiang 310021)
[Objective]The aim was to study tissue culture and rapid propagation ofHaworthiakegazato.[Method]With young inflorescence ofHaworthiakegazatoas explant, tissue culture and rapid propagation ofHaworthiakegazatowas studied. [Result] Embryogenic callus was initiated fromHaworthiacomptoniana×H.correctacv.'Aboukyuuinflorescencecultured on MS medium supplemented with 5 mg/L 6-BA, 0.5 mg/L IBA, 30g/L sucrose, and 7g/L agar. Subculture of these embryogenic calli on the MS + 0.3 mg/L 6-BA+ 30 g/L sucrose+7 g/L agar medium resulted in shoots and micropropagation of shoots on the MS + 0.3 mg/L 6-BA+0.1 mg/L NAA +30 g/L sucrose7 g/L agar medium with muitiplication coefficient of 3.79.The transplanting survival rate was 95% in nutritional substrates.[Conclusion] A subsequent plant regeneration from inflorescence callus ofHaworthiakegazatowere established, to provide theoretical basis for large-scale production.
Haworthiakegazato;Callus;Shoots
牟豪杰(1977- )男,浙江杭州人,助理研究员,从事花卉组培产业化研究。*通讯作者,助理研究员,硕士,从事生物技术方面的研究。
2016-09-14
S 682.33
A
0517-6611(2016)32-0140-02
