番石榴叶多酚的提取及其抗氧化作用研究
2016-12-13徐金瑞侯方丽黄建蓉胡勇钟南京
徐金瑞,侯方丽,黄建蓉,胡勇,钟南京
(广东药学院食品科学学院,广东中山528458)
番石榴叶多酚的提取及其抗氧化作用研究
徐金瑞,侯方丽,黄建蓉,胡勇,钟南京
(广东药学院食品科学学院,广东中山528458)
以番石榴叶为原料,采用超声波辅助技术优化番石榴叶中多酚物质的提取工艺;通过测定还原力、清除DPPH自由基能力和抑制猪油的氧化作用,探讨番石榴叶多酚的抗氧化作用。结果表明,确定最佳提取工艺参数为:超声波提取温度55℃、时间20min,料液比1∶70(g/mL),乙醇浓度50%,在此条件下多酚含量达114.82mg/g。抗氧化研究表明,番石榴叶多酚能有效抑制猪油的氧化,且具有较好的还原力和清除DPPH自由基的能力。
番石榴叶;多酚;超声波提取;抗氧化作用
油脂氧化是食用油脂及含油脂食品败坏变质的主要原因之一。油脂氧化对人体健康的危害目前已很明确[1],为了延缓油脂氧化,目前最有效的措施通常是添加抗氧化剂,其中主要以化学合成的抗氧化剂如丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)及特丁基对苯二酚(TBHQ)等为主。但相关研究表明合成抗氧化剂存在一定的危害性[2],如BHA对白鼠有致癌作用,BHT可引起动物肝脏增大等。因此,从自然界寻求高效、低毒且经济的天然抗氧化剂,已成为当前食品科学研究的热点之一。
番石榴(Psidium guajava L.)属于桃金娘科,原产于美洲,现在我国广东、广西、四川、福建等地均有栽培,其叶可全年采摘,资源十分丰富。现代药理及临床研究表明[3-4],番石榴叶中含有多种重要的芳香类二级代谢产物,有学者认为正是这些化合物赋予番石榴叶多种药用功效,如降血糖、抑菌、抗轮状病毒等[5-6]。但目前鲜有关于番石榴叶中多酚物质抗氧化活性的研究报道。同时,针对当前人们对合成抗氧化剂安全性存在较多质疑,若能明确番石榴叶多酚的抗氧化作用,将其作为天然抗氧化剂加以开发和利用,必然具有重要的应用价值。
基于此,本文对番石榴叶中多酚物质的提取工艺及其抗氧化作用进行了探讨,可为番石榴叶的开发利用提供科学的理论参考。
1 材料与方法
1.1 材料与试剂
番石榴叶:采自中山市五桂山镇某果园,将叶洗净、烘干、粉碎,过40目筛备用;猪油:市售,新鲜猪板油洗净,文火炼制而成,4℃保存;DPPH(1,1-二苯基-
2-三硝基苯肼):购自SIGMA公司;BHT为食品级:市购;抗坏血酸、铁氰化钾、三氯乙酸、三氯化铁、无水乙醇、乙酸、异辛烷、碘化钾、硫代硫酸钠、重铬酸钾、焦性没食子酸、硫酸亚铁、酒石酸钾钠:均为分析纯,市购。
1.2 主要仪器
V-1200型紫外-可见分光光度计:上海美谱达仪器有限公司;DFY-500型高速中药粉碎机:温岭市林大机械有限公司;YM-650CT型超声波提取机:上海豫明仪器有限公司;RE-2000型旋转浓缩蒸发仪:上海亚荣生化仪器厂;FD-1E-80型冷冻干燥机:上海楚定分析仪器有限公司;pHS-3C型pH计:上海精密科学仪器股份有限公司。
1.3 方法
1.3.1 多酚含量的测定—酒石酸亚铁比色法[7]
吸取1mL待测样液于25mL比色管中,加入4mL蒸馏水和5mL酒石酸亚铁溶液,混合后,用pH 7.5磷酸盐缓冲液定容,混匀;同时以蒸馏水代替样品提取液作空白,于540 nm波长处测定吸光度。另以0~50μg/mL的焦性没食子酸标准溶液代替样液制作标准曲线,得到回归方程y=2.669x-0.008 9,R2=0.999 5。1.3.2 番石榴叶多酚提取工艺设计
1.3.2.1 单因素试验
称取1 g番石榴叶粉,按一定料液比加入不同浓度乙醇溶液,在一定温度下超声辅助提取一定时间,过滤,滤液用相应浓度的乙醇溶液定容至原体积,测其多酚含量。
1.3.2.2 正交试验设计
在单因素试验基础上,以多酚含量为指标,对影响多酚提取的温度、料液比、超声时间、乙醇浓度等进行四因素三水平L9(34)正交试验,见表1。

表1 正交试验设计表Tab le1 Factorsand levelsof orthogonal tests
1.3.3 番石榴叶多酚的制备
称取适量番石榴叶粉,按1∶70(g/mL)的料液比加入50%的乙醇,置于超声波提取器中55℃提取20 min,过滤,将提取液置于旋转蒸发仪中浓缩,冷冻干燥成粉,备用(使用前以蒸馏水配成所需浓度用于1.3.4试验)。
1.3.4 抗氧化试验
1.3.4.1 还原力的测定-普鲁士蓝法[8]
取不同浓度的样品液2 mL,依次加入 2 mL 2.5 mol/L磷酸缓冲液(PBS,pH=6.6)和2mL 1%六铁氰化钾溶液,摇匀,50℃水浴保温20min,冷却后,再加入2mL 10%三氯乙酸,3 000 r/min离心10min,取上清液2mL,依次加入2mL蒸馏水和0.4mL 0.1%三氯化铁,混匀,于700 nm下测其吸光值(以蒸馏水代替样品提取液作空白)。
1.3.4.2 清除DPPH·的能力[9]
于2mL 0.2mmol/LDPPH·溶液中加入2mL样品,摇匀于室温下放置30min,用无水乙醇作参比液,于517 nm下测定其吸光值Ai;同时测定2mL 0.2mmol/L DPPH·溶液与2mL无水乙醇混合液的吸光值Ac;再测2mL样品液与2mL无水乙醇混合液的吸光值Aj,根据以下公式计算样品对DPPH·的抑制率:
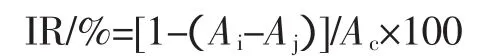
式中:Ai为加样品液时DPPH·溶液的吸光值;Aj为样品液在测定波长的吸光值度;Ac为未加样品液时DPPH·溶液的吸光值。
1.3.4.3 抑制油脂的氧化—Schaal烘箱法[10]
将番石榴叶多酚分别按0.10%、0.30%、0.50%(添加物/油)的添加量加入猪油中,充分搅匀。将经过处理的猪油和空白对照置于(62±1)℃烘箱中强制氧化,定时搅拌,每隔1天取样,测定其过氧化值(POV)。
过氧化值测定参照GB/T 5538-2005《动植物油脂过氧化值测定》的测定方法[11]。
2 结果与分析
2.1 乙醇浓度对提取效果的影响
称取1 g番石榴叶粉,在料液比1∶40(g/mL),超声波提取器作用温度45℃、时间20min条件下,分别考察30%~70%乙醇提取对番石榴叶多酚含量的影响,结果见图1所示。
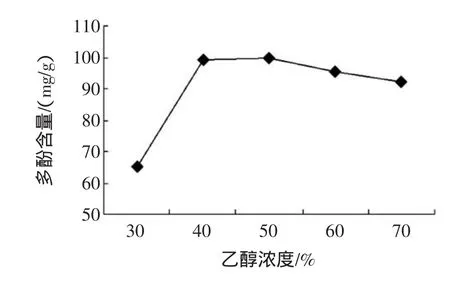
图1 乙醇浓度对提取效果的影响Fig.1 Effectofethanolconcentration on extraction result
图1表明,随着乙醇浓度的升高,多酚含量持续增高,且在乙醇50%时达最高,之后随乙醇浓度增大多酚含量趋于下降,而且从试验现象来看,乙醇浓度越高,提取液颜色越深,加大了色素等其他类物质的溶出,不利于多酚的纯化。综合考虑,以50%乙醇作提取剂较适宜。
2.2 温度对提取效果的影响
称取1 g番石榴叶粉,在料液比1∶40(g/mL),乙醇浓度50%,超声波提取器作用时间20min条件下,考察不同温度(35、45、55、65℃)提取时对番石榴叶多酚含量的影响,结果见图2所示。

图2 温度对提取效果的影响Fig.2 Effectof tem peratureon extraction result
图2表明,随着提取温度的提高,多酚含量先明显增大后趋于平缓,在55℃时达到最大值,超过55℃后多酚含量略有降低。说明在一定范围内提高温度能够促进物料及溶剂分子运动和有效成分的溶解,从而提高多酚的提取效果,但温度过高时会破坏多酚物质,而且也增加了能耗,因此提取温度以55℃较为适宜。
2.3 提取时间对提取效果的影响
称取1 g番石榴叶粉,在料液比1∶40(g/mL),乙醇浓度50%,超声波提取器温度55℃条件下,考察不同超声作用时间(10min~50min)提取时对番石榴叶多酚含量的影响,结果见图3所示。
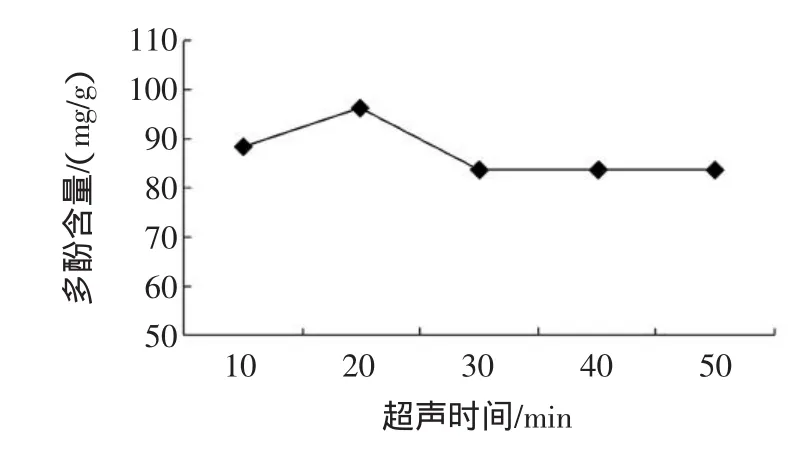
图3 时间对提取效果的影响Fig.3 Effectof tim eon extraction result
图3表明,随着超声波处理时间的延长,多酚含量先上升到一定峰值后下降,最后趋于稳定,其中在超声时间为20 min时,多酚含量达到最高点,而超过20 min后,多酚含量明显下降,在30min过后多酚含量基本不变。其原因可能是处理时间过长时,番石榴叶多酚结构发生变化,有效成分降解,而杂质逐渐溶出,导致多酚含量降低。因此,提取时间以20min较为适宜。
2.4 料液比对提取效果的影响
称取1 g番石榴叶粉,在乙醇浓度50%,超声波提取器温度55℃、时间20min条件下,考察不同料液比(1∶20~1∶80,g/mL)提取时对番石榴叶多酚含量的影响,结果见图4所示。
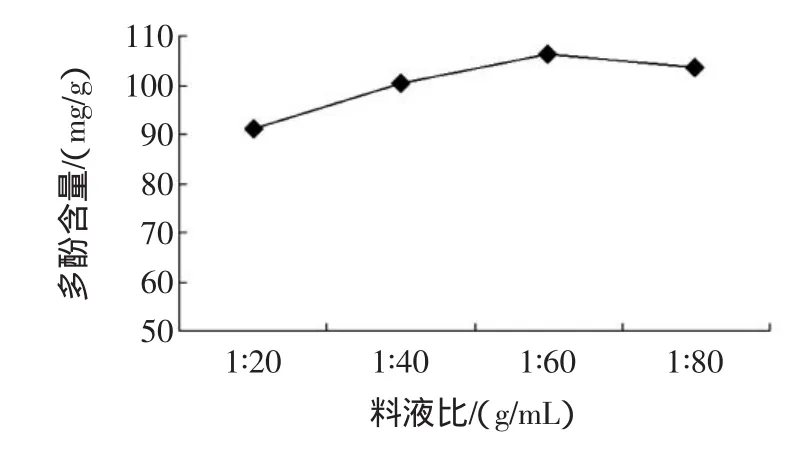
图4 料液比对提取效果的影响Fig.4 Effectof the ratio ofmaterial to solventon extraction result
图4表明,随着提取液用量的增大,多酚含量逐步提高,当增至1∶60(g/mL)时,多酚含量达到最大,可能是番石榴叶中的多酚类物质此时已基本溶出,再提高提取液用量,多酚含量反而略有降低,推测是番石榴叶中的杂质成分竞争性溶出,不利于提取多酚类物质。因此,料液比以1∶60(g/mL)较为适宜。
2.5 番石榴叶多酚的最佳提取工艺
为了考查各因素交互作用对提取物含量的影响,对影响多酚提取的乙醇浓度、料液比、超声波提取时间和温度等因素进行L9(34)正交试验,结果见表2。
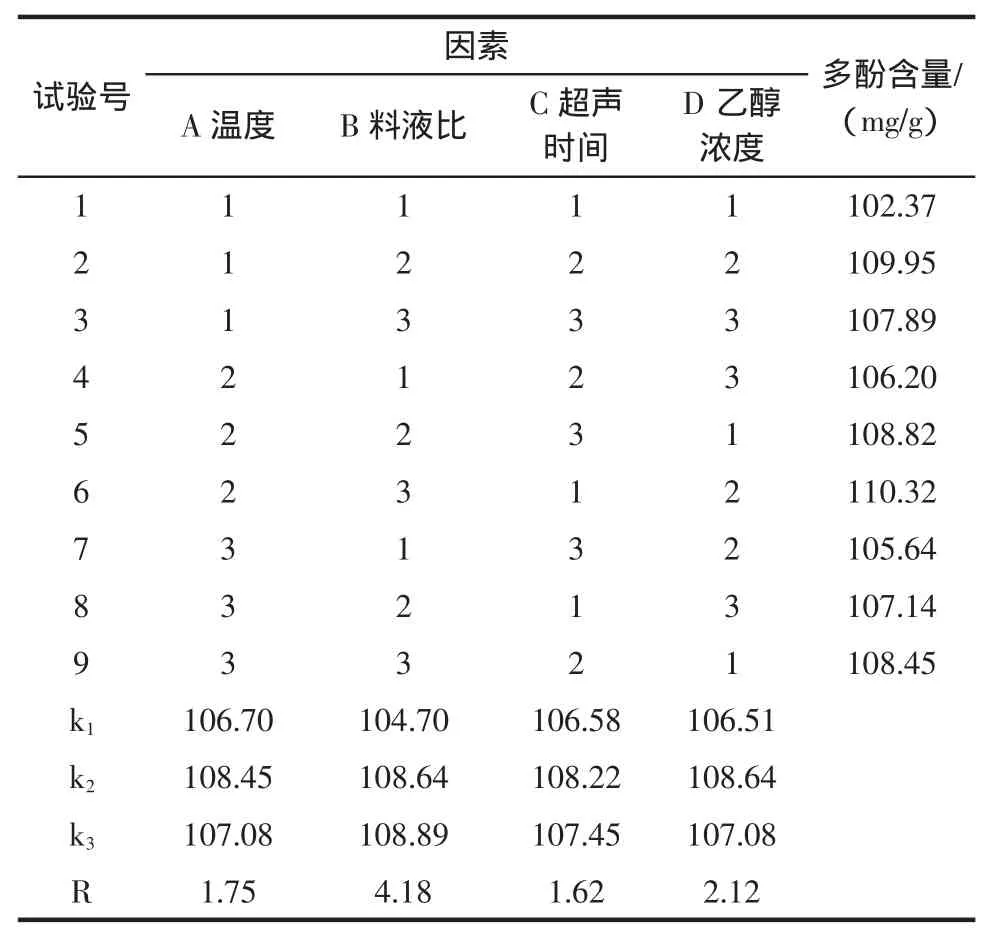
表2 正交试验结果Table2 The resultsof orthogonal tests
由表1结果可知,番石榴叶中多酚物质超声波提取的最佳工艺组合为A2B3C2D2,即最佳的提取温度为55℃、料液比1∶70(g/mL)、超声波时间20min、乙醇浓度50%。各因素对提取效果的影响主次顺序为B>D>A>C,即料液比>乙醇浓度>温度>超声处理时间。但最佳的提取工艺组合A2B3C2D2并没有出现在正交试验列表中,故对A2B3C2D2条件进行了结果验证。结果表明,在正交试验所优化的最佳提取条件下多酚含量为114.82mg/g。
2.6 不同浓度番石榴叶多酚的还原力
还原力是表示具有抗氧化活性的物质提供电子能力的重要指标,抗氧化剂通过自身的还原作用给出电子而使自由基变为稳定的分子,从而达到抗氧化的作用。许多研究证实,抗氧化活性同还原力密切相关,还原力越强,抗氧化性越强。还原力大小以吸光度值A700nm表示,结果见图5。
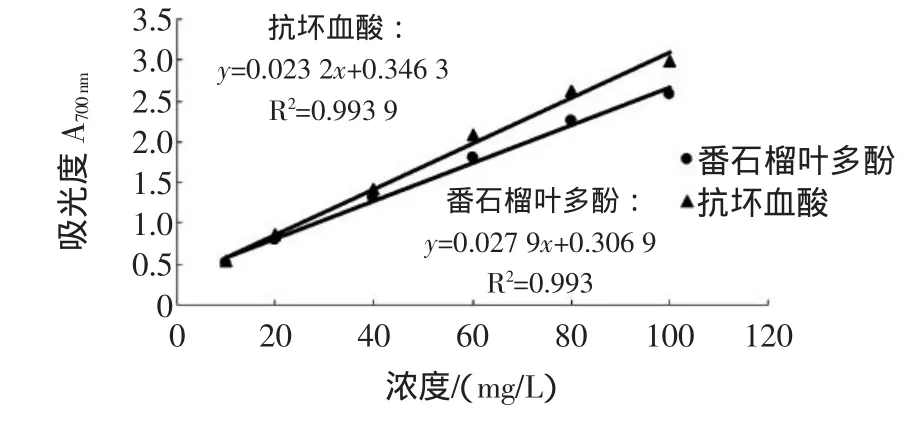
图5 番石榴叶多酚与抗坏血酸的还原力Fig.5 The reducing power of ascorbic acid and polyphenols from guava leaf
图5表明,番石榴叶多酚的还原力随浓度的增大而增大。通过比较其与抗坏血酸标准液的半抑制率EC50[根据各自的线性回归方程,计算吸光度为0.5时所需样品的浓度(mg/L),该值越小,还原力越强],可知抗坏血酸EC50=6.63mg/L,而番石榴叶多酚EC50=6.92mg/L,说明番石榴叶多酚的还原能力与抗坏血酸的基本相当,略弱于抗坏血酸。
2.7 番石榴叶多酚清除DPPH·的能力
DPPH·是一种很稳定的以氮为中心的自由基,若受试物能够清除其,则表示受试物具有降低羟基自由基、烷基自由基或过氧自由基及打断脂质过氧化链反应的作用。因此,目前多被广泛用于评价抗氧化剂清除自由基能力的快速方法。番石榴叶多酚与抗坏血酸清除DPPH·的能力见图6。
由图6可知,随浓度增加,番石榴叶多酚和抗坏血酸均对DPPH·的清除作用增大。通过比较其与抗坏血酸标准液的半抑制率EC50[抑制率为50%时对应样品的浓度(mg/L),该值越小,清除DPPH·的能力越强],得到抗坏血酸EC50=46.76mg/L,而番石榴叶多酚EC50= 49.19mg/L,说明番石榴叶多酚清除DPPH·的能力与抗坏血酸的基本相当,但稍弱于抗坏血酸。
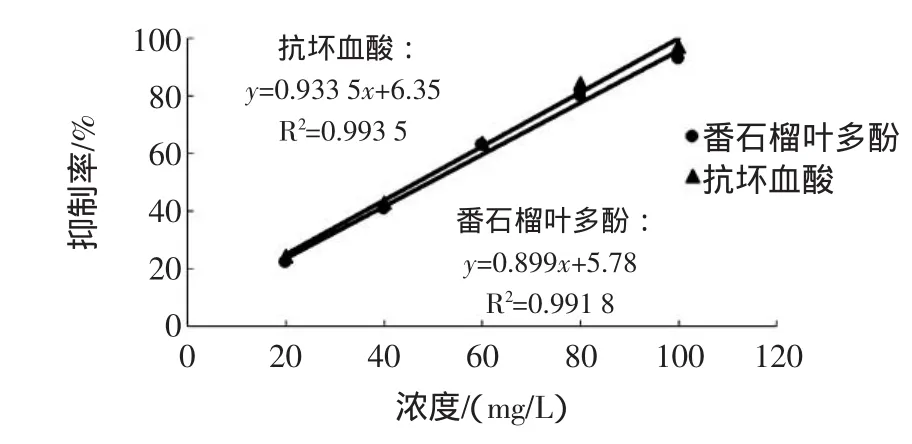
图6 番石榴叶多酚与抗坏血酸清除DPPH·的能力Fig.6 Thescavenging DPPH·ability of ascorbic acid and polyphenols from guava leaf
2.8 番石榴叶多酚抑制油脂的氧化作用

图7 番石榴叶多酚对猪油氧化的抑制作用Fig.7 The inhibiting oxidation on lard oilof polyphenols from guava leaf
由图7可知,添加不同量的番石榴叶多酚对猪油均有一定的抗氧化作用。在0.10%~0.50%范围内,随多酚添加量的提高,抗氧化作用也逐渐增强,但其作用效果总体上弱于0.02%BHT的抗氧化效果。实际上,所试多酚为粗提物,若能进一步对其加以纯化可能会增强其抗氧化作用,另外,番石榴多酚为天然有机物质,其稳定性受环境因素影响较大,与化学合成的抗氧化剂相比稳定性差也是影响其抗氧化活性的重要原因。关于对番石榴叶多酚的纯化及其稳定性研究还有待于进一步探讨。
3 结论
1)番石榴叶中多酚物质的最佳提取工艺条件是:以50%乙醇溶液为提取剂,料液比1∶70(g/mL)超声波提取温度55℃、时间20min,在此条件下多酚含量达114.82mg/g。
2)抗氧化试验研究表明,番石榴叶多酚能有效抑制猪油的氧化,且具有较好的还原力和清除DPPH自由基的能力,提示其可作为油脂的天然抗氧化剂加以开发利用。
[1]M Jerez,FJDeive,JSineiro,et al.Antioxidant activity of pine bark procyanidins in bulk corn oil and corn oil-in-water emulsions[J]. European Journal of Lipid Science and Technology,2011,113(11): 1402-1411
[2]ENaeeme,AMaryam,H Fereshteh.Evaluating the potential of naturalcurcumin foroxidativestability ofsoybean oil[J].Natural Product Research,2014,28(17):1375-1378
[3]JWWu,CLHsieh,HYWang,etal.Inhibitory effectsofguava(Psidium guajava L.)leaf extracts and its active compoundson the glycation processofprotein[J].Food Chemistry,2009,113(1):78-84
[4]RNae Hyung,PKyung-Ran,KSung-Moo,etal.A hexane fraction of guava Leaves(Psidium guajava L.)induces anticancer activity by suppressing AKT/mammalian target of rapamycin/ribosomal p70 S6 kinase in human prostate cancer cells[J].JournalofMedicinal Food, 2012,15(3):231-241
[5]MRV Fernandes,ALTDias,RR Carvalho,etal.Antioxidant and antimicrobial activities of Psidium guajava L.spray dried extracts[J]. IndustrialCropsand Products,2014,60(1):39-44
[6]JMi,JSeung-Weon,SK Cho,etal.Anti-Inflammatory Effectsof an Ethanolic ExtractofGuava(Psidium guajava L.)Leaves In Vitroand In Vivo[J].JournalofMedicinal Food,2014,17(6):678-685
[7] 刘蓓蓓,陈胜璜,邹菊英,等.酒石酸亚铁比色法测定黄鹂芽中茶多酚的含量[J].中南药学,2011,9(10):740-741
[8] 黄仁术,胡晓梦,何惠利.大别山野葛根异黄酮超声辅助提取工艺的响应面优化与还原力测定[J].中国药学杂志,2015,50(1): 57-63
[9] 徐金瑞,张名位,刘兴华,等.黑大豆种皮花色苷体外抗氧化活性研究[J].营养学报,2007,29(1):54-57
[10]潘俊娴,李昕,陈士国,等.杨梅叶原花色素对猪油抗氧化作用的研究[J].食品工业科技,2015,36(20):111-115
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 5538-2005动植物油脂过氧化值测定[S].北京:中国标准出版社,2005:1-6
Extraction and Antioxidition of Polyphenols from Leaves of Guava
XU Jin-rui,HOU Fang-li,HUANG Jian-rong,HUYong,ZHONGNan-jing
(Collegeof Food Science,Guangdong PharmaceuticalUniversity,Zhongshan 528458,Guangdong,China)
The ultrasonic extraction technology of polyphenols in guava leafwas optimized,and its reducing power,scavenging DPPH·ability and inhibiting oxidation on lard oilwere also researched.The results showed that the optimum parameter ofultrasonic extraction were as follows:ultrasonic extracton temperature 55℃,extraction time20min,the ratioofmaterial to solvent1∶70(g/mL),ethanol concentration 50%,and under this condition,the extracting rate ofpolyphenols in dried guava leafwas114.82mg/g.Theantioxidation research indicated that the polyphenols from guava leafhad could effectively inhibit the oxidation of lard oil,and had good reducing powerand scavenging DPPH·ability.
guava leaf;po lyphenols;ultrasonic extraction;antioxidation
10.3969/j.issn.1005-6521.2016.23.010
2015-12-17
国家自然科学基金(31401521);广东药学院食品科学学院学科建设基金(43555015)
徐金瑞(1976—),女(汉),副教授,博士,主要从事生物活性物质与功能食品方面研究。
