金针菇提取物不同组分的抗氧化活性
2016-12-13李晨肖林刚胡亚鹏梁宗锁董娟娥
李晨,肖林刚,胡亚鹏,梁宗锁,董娟娥,*
(1.西北农林科技大学生命学院,陕西杨凌712100;2.陕西众兴高科生物科技有限公司,陕西杨凌712100)
金针菇提取物不同组分的抗氧化活性
李晨1,肖林刚2,胡亚鹏2,梁宗锁1,董娟娥1,*
(1.西北农林科技大学生命学院,陕西杨凌712100;2.陕西众兴高科生物科技有限公司,陕西杨凌712100)
通过比较金针菇提取物不同组分(石油醚相、乙酸乙酯相、正丁醇相及水相)的总酚含量和抗氧化活性(还原力、DPPH自由基、羟自由基的清除能力和超氧阴离子自由基清除能力),明确高的抗氧化活性组分群。结果表明,其中乙酸乙酯相的总酚含量(15.8mg/g)、还原力(15.70%)、DPPH自由基清除率(28.30%)、羟自由基清除率(33.53%)和超氧阴离子自由基清除率(33.20%)均为最高,为金针菇的有效组分。金针菇提取物中的总酚含量与抗氧化活性具有极显著正相关性(p<0.05);因此,酚类物质是金针菇具有抗氧化能力的物质基础,乙酸乙酯可作为金针菇提取物的萃取剂。
金针菇;多酚;抗氧化活性;提取物
金针菇(Flammulina velutipes)又名毛柄金钱菌、构菌和冬菇。隶属于口蘑科金钱菌属[1]。金针菇营养极其丰富,富含有18种氨基酸和多种维生素其次还含有多糖、粘多糖、构菌素等多种活性物质;且富含钙、磷、铁等多种矿物。目前,以金针菇为原料加工的食品众多,如金针露、低糖金针菇脯、金针菇蜜饯、金针菇菌油等[2-5]。目前,对于金针菇的研究主要集中在其多糖、氨基酸、蛋白质及其产品的开发只有少量关于金针菇总酚类含量的报道,对金针菇酚类物质不同萃取相及其抗氧化作用的研究几乎没有。酚类物质是以醋化或糖普化形式存在的活性酚羟基,赋予酚类物质抗氧化性等多种生理功能和药用价值[6]。研究金针菇酚类物质有利于金针菇的深度开发,有效利用金针菇资源。
本试验通过乙醇回流法提取金针菇多酚类物质,依次用石油醚,乙酸乙酯、正丁醇萃取,并测定不同萃取相的多酚的含量、还原力、DPPH自由基、羟自由基的清除能力和超氧自由基清除能力,确定抗氧化活性高的组分群。促进金针菇产业可持续发展,提高金针菇生产的经济效益和促进金针菇资源的综合利用方面具有重要的实际意义。研究结果将为后续探明金针菇抗氧化的物质基础以及开发相关食品或保健品提供参考依据。
1 材料与仪器
1.1 材料
取适量鲜金针菇于50℃真空干燥箱中烘干至恒重,粉碎,过20目筛,密封储存,备用。
1.2 主要试剂及仪器
2,2-二苯基-1-苦基肼(DPPH)、Folin-Ciocalteu试剂:购自Solarbio公司;2-D-脱氧核糖:购自上海阿拉丁试剂有限公司;没食子酸标准品(批号110831-200904):中国药品生物制品检定所;2,6-二叔丁基-4-甲基苯酚(BHT):购自国药集团化学试剂有限公司;无水乙醇、石油醚、乙酸乙酯、正丁醇、铁氰化钾、三氯乙酸、过氧化氢、氯化铁、硫代巴比妥酸、磷酸氢二钠、磷酸二氢钠均为分析纯。
紫外-可见分光光度计(UV-1800):上海美谱达仪器有限公司;分析天平(AG204):METTLER TOLEDO;旋转蒸发器(RE52AA):上海亚荣生化仪器厂;离心机(TGL-16):高速台式冷却离心机。
2 研究方法
2.1 提取物不同组分的制备
称取一定量金针菇粉,用石油醚脱脂后,以料液比1∶10(g/mL)的比例,加入80%的乙醇-水溶液,在80℃下回流提取3次,每次1 h,合并提取滤液,45℃旋转薄膜蒸发浓缩至干,得提取物。配置成0.1mg/mL的水溶液用于测定多酚含量及抗氧化活性。
取提取物100 g,充分分散于500mL蒸馏水中,依次用石油醚、乙酸乙酯、正丁醇进行萃取,得不同极性的萃取相和萃余相(水相)。分别将各萃取相和萃余相低温抽真空浓缩,干燥,得提取物的不同组分;分别将各极性部位配制成0.1mg/mL的水溶液,进行多酚含量和抗氧化活性测定。
2.2 多酚含量测定
按照Turkmen等[7]的方法。精确吸取1mL提取物及各极性部位的水溶液,加入0.5mL Folin-Ciocalteu(福林酚)试剂混匀,静置5min后加入7.5%碳酸钠溶液4mL,室温下避光反应2 h,在725 nm下测吸光值。以没食子酸(0.1mg/mL~5.0mg/mL)作为标品,绘制标准曲线。根据标准曲线计算多酚含量(mg/g)。本研究计算得到的标准曲线为:y=8.673 8x-0.095 68,R2=0.999 48。式中:y为浓度;x为吸光值。
2.3 还原力测定
采用Oyaizu[8]的方法。精确吸取1mL上述提取物和各极性部位(0.1mg/mL)溶液,加0.5mL磷酸盐缓冲液(0.2mol/L,pH 6.6)和0.5mL 1%铁氰化钾溶液,50℃水浴20min。迅速冷却,加入0.5mL 10%三氯乙酸(TCA),混合均匀,12 000 r/min离心10min,取上清液1.0mL加2.0mL蒸馏水和0.2mL 0.1%氯化铁溶液反应10min,700 nm下测定吸光值。样品还原力表示为0.1mg/mL抗坏血酸的还原力的百分比。以蒸馏水为空白。
2.4 DPPH自由基清除率测定
按照Brand等[9]的方法,略有修改。取1mL不同浓度提取物或各相(0.1mg/mL),加入3mL 0.2mmol/L的DPPH自由基乙醇溶液,混匀,加入4.0mL乙醇溶液,于室温下避光反应30min后,在波长517 nm下测定吸光值,蒸馏水代替提取液作为对照。按公式计算样品对DPPH自由基的清除率。式中AC为空白样品的吸光值,AS为不同浓度样品的吸光值。抗坏血酸与BHT的浓度为0.1mg/mL。

2.5 羟自由基清除率测定
按照Ren等[10]的方法,取1mL提取物或各相,加入0.1mL(10mmol/L)FeSO4·7H2O,0.1mLEDTA(10mmol/L),0.5mL 10mmol/L 2-D-脱氧核糖溶液,0.9mL磷酸盐缓冲溶液(0.1mol/L,pH 7.4)混匀,加入0.2mL H2O2(10mmol/L),37℃反应60min。加入1.0mL 2.8%TCA终止反应,再加入1.0mL 1.0%硫代巴比妥酸,沸水浴15min。冷却后于532 nm下测吸光值。以磷酸盐缓冲溶液(pH 7.4)为空白对照。按下列公式计算样品对羟自由基的清除率。抗坏血酸与BHT的浓度为0.1mg/mL。式中AC为空白样品的吸光值,AS为不同浓度样品的吸光值。

2.6 清除超氧阴离子自由基(O2-·)能力的测定
按照Randall等[11]的方法,略有修改。精确吸取0.5mL各待测液,每支试管加入3mL 0.1mol/L Tris-HCl磷酸盐缓冲液(pH 8.2),水浴平衡20min,加入0.3mL 7mmol/L的邻苯三酚准确反应4min,加入1mL 10mol/LHCl终止反应,在波长420nm处测吸光度,按下式计算清除率。抗坏血酸与BHT的浓度为0.1mg/mL。式中Ac为空白对照液的吸光度(以蒸馏水代替样品液的吸光度);As为不同浓度样品的吸光值。
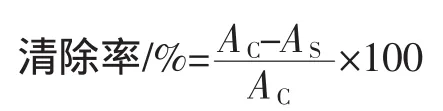
2.7 数据分析
试验数据使用SPSS18.0软件进行ANVOA统计分析,采用SNK法进行显著性检验(p<0.05),其中酚类物质含量与抗氧化活性的关系运用Pearson相关性分析。每个样品重复3次,结果以平均值±标准差(x±s)表示。
3 结果与分析
3.1 金针菇提取物与不同组分的多酚含量
采用福林酚法测定金针菇提取物不同组分中多酚含量,结果见图1。

图1 金针菇提取物不同组分多酚的含量Fig.1 Totalphenolcontentof F.velutipes w ith differentpolarities
结果显示,提取物不同组分中均含有一定量的酚类物质,且含量有显著差异(p<0.05)。其中,乙酸乙酯相中多酚含量为15.8mg/g,显著高于其它萃取相,其次为正丁醇相,显著高于水相和石油醚相。说明金针菇中的酚类物质在中等级性的有机溶剂中溶解度较大。因此,乙酸乙酯可作为金针菇中酚类物质的萃取溶剂。
另外,根据常规提取方法,一般在提取前对金针菇粉末进行石油醚脱脂处理。本文考察了石油醚脱脂是否可以导致酚类物质损失。结果发现,脱脂的石油醚中的确含有酚类物质,因此在提取金针菇多酚类化合物时不应该对金针菇粉末进行石油醚脱脂操作。
3.2 金针菇提取物不同组分还原力测定
还原力大小用0.1mg/mL抗坏血酸还原力的百分比表示,金针菇提取物不同组分还原力的测定结果见图2。
结果表明,各极性部位均有一定的还原力,不同组分之间还原力有显著差异(p<0.05)。其中乙酸乙酯相的还原力为15.7%,其次为提取物,均显著高于其他萃取相,说明不同组分还原力与多酚物质含量有一定的正相关性。

图2 金针菇提取物不同组分还原力的测定Fig.2 Reducing power of F.velutipes with different polarities
3.3 金针菇提取物不同组分DPPH自由基清除能力测定
金针菇不同组分均有一定的DPPH自由基清除能力结果见图3。

图3 金针菇提取物不同组分DPPH自由基清除能力Fig.3 DPPH radicalscavenging capacity of F.velutipes with different polarities
结果显示,不同组分清除能力不同,且差异显著(p <0.05)。其中乙酸乙酯相的DPPH自由基清除能力最高28.3%,显著高于其他萃取相,为DPPH自由基清除的有效部位,其次为提取物、水相和正丁醇相。水相与正丁醇相的DPPH自由基清除能力基本相同,可能是因为正丁醇与水出现了一定的互溶。
3.4 不同组分羟自由基清除能力
金针菇不同组分的羟自由基清除能力测定结果见图4。

图4 金针菇提取物不同组分羟自由基清除能力Fig.4 Hydroxyl radicalscavenging capacity of F.velutipes with different polarities
结果显示不同组分清除能力不同,且差异显著(p <0.05)。其中乙酸乙酯相的羟自由基清除能力最高33.53%,是清除羟自由基的有效部位,其次为提取物26.22%,与酚类物质的含量呈正相关。尽管乙酸乙酯相的羟自由基清除能力低于阳性对照抗坏血酸和BHT,但仍然具有很强的羟自由基清除能力,由于抗坏血酸和BHT均为高纯度的分析纯,而金针菇的不同提取组分是由多种物质组成的混合物,如将其进一步提纯,其羟自由基清除能力可能将大幅度提升。
3.5 不同组分总超氧阴离子自由基清除能力
金针菇不同组分的超氧阴离子自由基清除能力测定结果见5。

图5 金针菇提取物不同组分超氧阴离子自由基清除能力Fig.5 Superoxideanion radicalscavenging capacity of F.velutipes w ith differentpolarities
结果显示,不同组分清除能力不同,且差异显著(p<0.05)。其中乙酸乙酯相的超氧阴离子自由基清除能力为33.20%,其次为提取物、正丁醇相和水相,最后为石油醚相。乙酸乙酯相是清除超氧阴离子自由基清除的有效部部位。乙酸乙酯相的超氧阴离子自由基清除能力虽不能与抗坏血酸相媲美,但其超氧阴离子自由基清除的能力与阳性对照BHT相比无显著差异。
4 结论与讨论
金针菇是世界第三大食用菌,具有高的营养价值[12]。近年研究表明,金针菇含有多糖、蛋白、氨基酸、火菇素、黄酮等多种生理活性物质[13]。目前的研究主要集中在金针菇栽培、多糖的提取及抗氧化活性[14],对酚类物质的研究报道较少。多酚类化合物具有多种生理活性,如抗氧化、抗肿瘤、预防心血管疾病、缓解疲劳、抗炎等功效[14-16]。本文通过检测金针菇提取物不同组分酚类物质含量,发现乙酸乙酯萃取相的酚类物质含量最高,说明其在乙酸乙酯等中等极性的有机溶剂中的溶解度最大。另外发现,金针菇在提取前用石油醚进行脱脂处理,会使一些溶于石油醚的极性较小的酚类物质溶出,造成损失,因此在提取金针菇多酚类化
合物时不宜进行石油醚脱脂操作。
对金针菇提取物不同组分的抗氧化活性研究发现,不同组分的抗氧化活性与酚类成分的含量存在极显著的正相关,其中乙酸乙酯相的还原力(15.70%)、DPPH自由基清除率(28.30%)、羟自由基清除率(33.53%)和超氧阴离子自由基清除率(33.20%)均高于其他萃取(余)相,表明金针菇酚类物质是抗氧化的活性成分,乙酸乙酯萃取相为金针菇提取物的活性部位。
综上所述,金针菇提取物不同组分均有抗氧化活性,其中乙酸乙酯萃取相的总酚含量及抗氧化活性最强,因此,乙酸乙酯可作为金针菇的萃取剂,为金针菇的进一步开发提供了一定的理论基础;为研究金针菇抗氧化的物质基础以及开发相关食品或保健品提供参考依据。
[1]许昭仪,李浩,张平.金针菇生活史各阶段核相研究[J].菌物学报, 2015,34(3):386-393
[2]伍明,郑林用,许晓燕,等.金针菇活性物质及其作用研究进展[J].中国食用菌,2011,30(3):6-8
[3]邹宇晓,廖森泰,何轩辉,等.纯化工艺对金针菇多糖体外抗肿瘤活性的影响[J].中国食品学报,2013,13(6):9-14
[4]Endo Y,TsurugiK N.Glycosidase activity of ricin A.Machanism of action of toxic ricin on eucaryotic ribosomes[J].JBiolChem,1987, 262(17):8128-8130
[5]Hsieh K Y,Hsu C L,Lin JY,etal.Oral administration ofan edible mushroom-derived protein inhibits the developmentof food-allergic reactions inmice[J].Clinic ExperimentalAllergy,2003,33(11):595-565
[6]叶桐,贾友青.香菇中酚类物质的微波提取工艺的研究[J].食品工程,2015(2):16-30
[7]Turkmen N,Sari F,Velioglu Y S.The effectof cookingmethods on total phenolicsand antioxidant activity of selected green vegetables [J].Food Chemistry,2005,93(4):713-718
[8]OyaizuM.Studieson productsof thebrowning reaction.Antioxidative activities of browning reaction products prepared from glucosamine [J].Japanese JournalofNutrition,1986,44(6):307-315
[9]Brand-WilliamsW,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30
[10]Ren J,ZhaoM,ShiJ,etal.Purificationand identificationofantioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry,2008,108(2):727-736
[11]Randall JRuch,shu-jun Cheng,James E Klauning.Prevention of cytotoxicityand inhibitionof Intercellularcommunication byantioxidant catechins isolated from Chinese green tea[J].Carcinogenesis, 1989(10):1003
[12]郑义,李超,王乃馨.金针菇多糖的研究进展[J].食品科学,2010, 31(17):425-428
[13]于荣利,秦旭升,宋凤菊.金针菇研究进展[J].食用菌学报,2004, 11(4):63-68
[14]Khurana S,Piche M,Hollingsworth A,et al.Oxidative stress and cardiovascular health:therapeutic potentialof polyphenols[J].Can J PhysiolPharmacol,2013,91(3):198-212
[15]何雪梅,孙健,李丽.蔗梢多酚类化合物抗氧化与抗肿瘤活性研究[J].食品工业科技,2015,36(23):343-347
[16]IshikawaNK.Tahara S.FukushiY,etal.Highlyoxidized cuparenetype sesquiterpenes from amycelial cultureof Flammulina velutipes [J].Phytochemistry,2000,54(8):777-782
Antioxidant Activity of Flmmulina velutipes w ith Different Polarities
LIChen1,XIAOLin-gang2,HUYa-peng2,LIANGZong-suo1,DONG Juan-e1,*
(1.Collegeof Life Sciences,NorthwestA&FUniversity,Yangling712100,Shaanxi,China;2.Shaanxi Zhongxing High-tech Biological Technology Co.,Ltd.,Yangling712100,Shaanxi,China)
In this study,by comparing the Flmmulina velutipes extract and different polar parts(petroleum ether,ethylacetate,n-butanolphase and water phase)wasevaluated based on the detection of the contentof total phenols,reducing power,DPPH radical scavenging activity,hydroxyl radical scavenging rate and superoxide anion radical scavenging rate in order to find themost effective ones with higher antioxidant activity as wellas total phenols.Results show that the total phenol contentofethylacetate phase(15.8mg/g),reducing power(15.70%)and DPPH radical scavenging rate(28.30%),hydroxyl radical scavenging rate(33.53%)and superoxideanion radicalscavenging rate(33.20%),totalphenol contentand antioxidantactivity have significantcorrelation(p<0.05);In summary,phenolic compounds resulted in antioxidantactivity of F.velutipes. Ethylacetate can beused asa crudeextractings from Flmmulinavelutipes extraction agent.
Flmmulina velutipes;totalphenols;antioxidantactivity;extractive
10.3969/j.issn.1005-6521.2016.23.002
2016-02-26
陕西省科技统筹创新工程计划(No.2015KTTSNY03-07)
李晨(1994—),女(汉),硕士研究生,研究方向:天然产物提取分离。
*通信作者:董娟娥,女,教授,博士生导师,研究方向:天然产物提取分离。
