高粱抗丝黑穗病SCAR标记的建立
2016-12-12李玥莹李春阳邢慧清张馨月逄洪波晏铭谣
李玥莹, 李春阳, 邢慧清, 张馨月, 逄洪波, 晏铭谣
(沈阳师范大学 生命科学学院, 沈阳 110034)
高粱抗丝黑穗病SCAR标记的建立
李玥莹, 李春阳, 邢慧清, 张馨月, 逄洪波, 晏铭谣
(沈阳师范大学 生命科学学院, 沈阳 110034)
选用高粱丝黑穗病感病恢复系矮四、抗病恢复系2381R以及二者F2代抗感个体为试验试材,采用CTAB法提取高粱基因组DNA, 并应用RAPD筛选技术对高粱基因进行分子标记,选取了100对RAPD随机引物对其进行扩增,有88对引物扩增出条带。分析结果表明:88对引物中S405在抗感品种间扩增出差异谱带。进一步对抗感群体进行分离分析,得出抗丝黑穗病基因重组率为11.7%。将S405扩增出的差异片段进行克隆测序,差异谱带的片段长度为320 bp。根据差异谱带的碱基排列顺序,设计特异性引物,然后进行序列扩增,将RAPD分子标记转化为SCAR分子标记,并将该标记命名为S405-320,为高粱优良品种的筛选和培育奠定一定的基础。
高粱; 丝黑穗病; RAPD; SCAR
0 引 言
高粱[Sorghumbicolor(L) Moench]属禾谷类作物,产量高,抗逆性强,具有抗旱、耐涝、耐盐碱的特性[1],高粱植株各个部分都有潜在的利用价值,是重要的粮食作物、饲料作物以及生物燃料作物[2-3]。高粱丝黑穗病是影响高粱生产发展的重要病害之一[4-5],在各高粱产区均有发生, 给农业生产造成很大损失,严重制约高粱产业发展,实践证明,选育抗病品种是防治丝黑穗病最为有效的途径[6]。选育抗病品种是一项非常复杂的工作,传统的方法育种效率不高[7],随着分子生物学技术的迅猛发展,利用SSR(Simple Sequence Repeat)、RAPD(Random Amplified Polymorphism DNAs)及SCAR(Sequence characterized Amplified Region)等分子标记技术,找到感丝黑穗病品种和抗丝黑穗病品种之间的区别, 定位抗病基因,从本质上防治高粱丝黑穗病[8]。RAPD因具有样品用量少,检测速度快,灵敏度好,成本较低等优点,现已广泛应用于生物的抗病品种的鉴定[9-11]。本研究利用RAPD分子标记技术对高粱抗、感丝黑穗病品种经行RAPD-PCR扩增,根据测序结果设计引物,将RAPD分子标记转化为SCAR分子标记,提高RAPD的稳定性,这对抗丝黑穗病品种的选育具有较大的实用价值,为高粱优良品种的筛选和培育提供一定的基础。
1 材料与方法
1.1 材 料
1.1.1 实验材料
高粱丝黑穗病感病恢复系矮四,抗病恢复系2381R,以及其二者经去雄杂交、自交的后代2381R/矮四群体(感病20株,抗病40株),均由辽宁省农业科学院提供。
1.1.2 实验仪器
高速冷冻离心机,PCR扩增仪,电泳槽,微量移液枪,紫外凝胶成像,电子分析天平,微波炉,水浴锅,制冰机等。
1.1.3 实验试剂
TBE电极缓冲液,CTAB(十六烷基三甲基溴化铵)缓冲液,EB(溴化乙锭),氯仿/异戊醇,溴酚蓝溶液,异丙醇,琼脂糖,75%乙醇,10 mmol/L dNTPs,5 U/μL Taq酶,100条随机引物(S401-S500)购自上海生工生物技术公司。
1.2 实验方法
1.2.1 试材培养
将高粱种子浸泡8 h,然后将其种植于花盆中,在光照培养箱中进行培养,温度设为28 ℃,湿度设为75%,光照培养13 h,黑暗培养11 h。培养一周后采摘高粱苗期叶片,进行DNA的提取实验。
1.2.2 高粱DNA的提取
采用CTAB法[12-14]提取高粱苗期叶片的总DNA。
1.2.3 DNA纯度检测
取7 μL提取的DNA于1%含0.5 μg/mL EB的琼脂糖凝胶中电泳,电压设为100 V,电泳30 min,在紫外凝胶成像仪中观察并拍照,检测DNA的谱带情况。
1.2.4 近等基因池的建立
采用分离群体分组分析法(BSA法)对高粱抗感丝黑穗病群体进行分析[15]。感池由20株感丝黑穗病株叶片,抗池由40株抗丝黑穗病株叶片所提取的DNA,各取1 μL混匀而成。
1.2.5 RAPD-PCR反应条件
PCR扩增反应体系(25 μL):ddH2O 17.0 μL,MgCl22.5 μL(25 mmol/L),10×Buffer 2.5 μL,DNA模版(25 ng/μL)1.0 μL ,dNTPs(10 mmol/L)0.5 μL,Taq酶(5 U/μL)0.5 μL,引物(10 μmol/μL)1.0 μL。
反应条件:
94 ℃预变性 3 min

72 ℃延伸 10 min
1.2.6 产物检测
取RAPD-PCR产物5 μL于1.5%含0.5 μg/mL EB的琼脂糖凝胶中电泳,电压100 V,电泳60 min,在紫外凝胶成像仪中观察并拍照,检测PCR产物有无降解情况。
1.2.7 多态性片段的回收及克隆测序
回收引物扩增的条带,PCR扩增,送大连宝生物公司进行克隆测序。
1.2.8 SCAR标记的建立
根据测序结果,在序列的两端设计特异性SCAR引物。
SCAR-PCR反应体系(25 μL):ddH2O 17 μL,MgCl2(25 mmol/L)2.5 μL,10×Buffer 2.5 μL,dNTPs(10 mmol/L)1.0 μL,Taq酶(5 U/μL)0.25 μL,引物引物Ⅰ(10 μmol/μL)0.5 μL,引物Ⅱ(10 μmol/μL)0.5 μL,DNA模版(100 ng/μL)1.0 μL。
反应条件:
95 ℃预变性 3 min
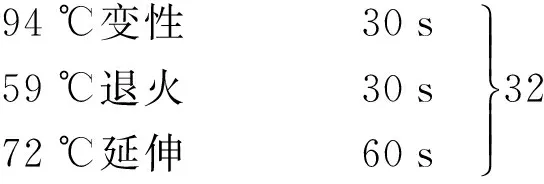
72 ℃延伸 10 min
1.2.9 共分离分析
重组率(r)=交换个体数/(抗丝黑穗病群体数+感丝黑穗病群体数)×100%
遗传距离(cM)=[1/4*ln(1+2r)/(1-2r)]*100
2 结果与分析
2.1 DNA纯度检测

图1 DNA的提取检测结果Fig.1 The detection result of DNA extraction
采用琼脂糖凝胶电泳法对提取的DNA质量进行检测,结果表明提取出的DNA没有降解,纯度符合实验要求,结果如图1所示,可用于接下来的RAPD-PCR实验。
2.2 高粱抗丝黑穗病基因的RAPD分析
选取100条(S401-S500)RAPD随机引物,对亲本、感池、抗池和后代群体的DNA模板进行RAPD分析。结果表明:12条引物没有扩增出条带,88条引物扩增出条带,扩增率为88%。扩增结果如图2所示,从左至右,分别是Marker,引物S401、S403、S405、S421、S422、S442的扩增结果。每条引物扩增的4个条带从左至右分依次是抗丝黑穗病亲本、感丝黑穗病亲本、抗丝黑穗病基因池和感丝黑穗病基因池的扩增条带。其中引物S405扩增条带具有多态性,在抗亲、抗池比感亲、感池多扩增出一条谱带,在320 bp左右。其他引物并没有发现DNA片段长度多态性。

图2 引物 S401、S403、S405、S421、S422、S442的PCR扩增结果
2.3 高粱抗丝黑穗病基因RAPD多态性差异的共分离分析
对引物S405进行共分离分析, 分析了F2代分离群体60株(感病20株,抗病40株)。 扩增结果见表1,在感丝黑穗病群体中,有5株扩增出了多态性片段。在抗丝黑穗病群体中,有2株没有扩增出多态性片段,得出重组率为11.7%,遗传距离为11.9 cM,该片段与抗病基因紧密连锁。

表1 S405扩增片段多态性在F2代中的共分离分析Tab.1 Co-segregation analysis of amplified polymorphism fragment in F2 using primer S405
S405引物在抗病和感病群体的单株部分扩增结果见图3。

图3 引物S405的PCR部分扩增结果
2.4 多态性片段的回收及克隆测序
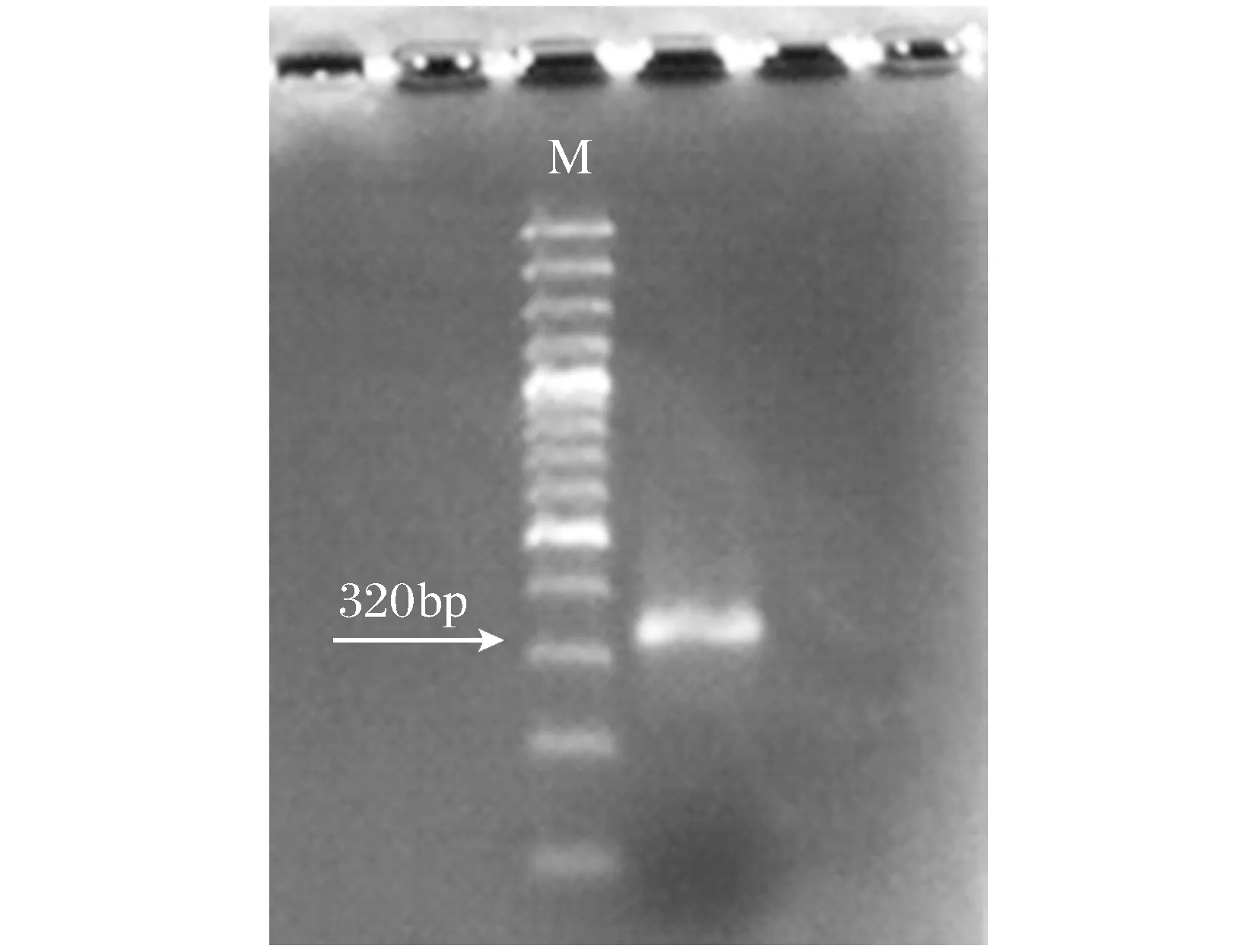
图4 S405回收的片段Fig.4 The recycling polymorphism fragment of S405
将引物S405扩增的多态性片段回收纯化,电泳结果如图4所示。回收的片段长度为320 bp与目标片段的大小相同,并进行了克隆测序。
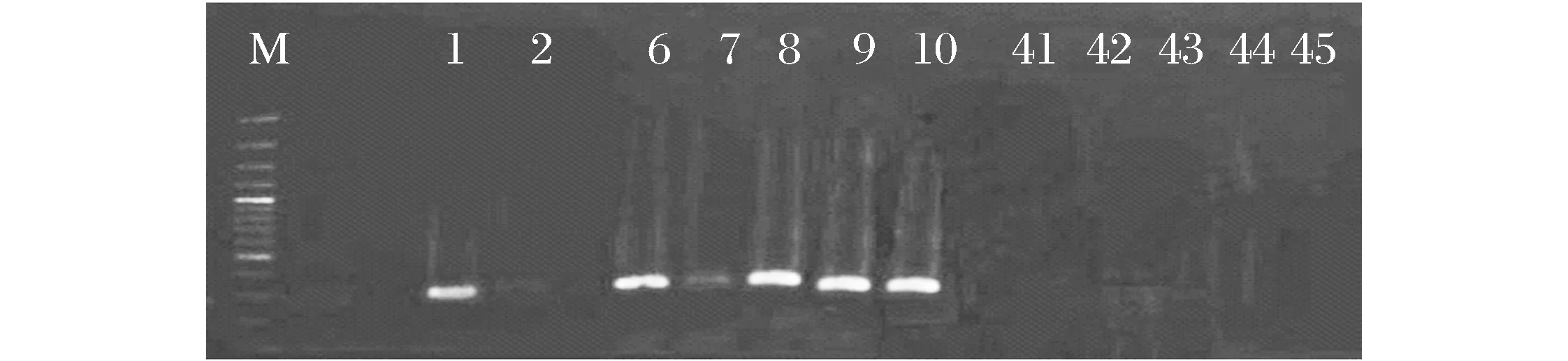
图5 S405的SCAR标记对部分单株的检测结果抗亲(1),感亲(2),F2抗单株(6~10),F2感单株(41~45)Fig.5 The PCR detection for some individuals with the specific S405 SCAR primers Marker Resistant parent(1), Susceptible parent(2), F2 resistant-segregation individuals(6~10),F2 susceptible segregation individuals(41~45)
2.5 SCAR标记的建立
2.5.1 SCAR引物的设计
根据测序结果,合成了SCAR的引物,序列如下:
S405F:5′-TCGCTAACACGCACACCTAA-3′
S405R:5′-GAACGTGTTGGGGAACAAGG-3′
2.5.2 SCAR标记检测结果
用2.5.1的一对引物对父母本及F2代抗感个体单株进行PCR扩增,结果表明SCAR标记与高粱抗丝黑穗病基因的RAPD标记的连锁性相比无变化,结果如图5所示,1为抗丝黑穗病亲本、2为感丝黑穗病亲本、6~10为F2抗丝黑穗病单株、41~45为F2感丝黑穗病单株,其中抗丝黑穗病亲本和抗丝黑穗病单株都扩增出了谱带,长度约为320 bp;感丝黑穗病亲本和感丝黑穗病单株都没有扩增出任何普带。PCR产物都只为一条320 bp的谱带,说明了SCAR标记的特异性强,并且F2单株扩增结果表明遗传距离和RAPD扩增结果一致,这证明成功的把RAPD分子标记转化为了重复性好、稳定性好的SCAR标记。
3 结 论
3.1 抗丝黑穗病基因的RAPD分析
本实验随机选取了100个RAPD引物对高粱丝黑穗病感病恢复系矮四、抗病恢复系2381R和感病群体、抗病群体进行RAPD扩增。结果显示:在100个随机引物中,有88个引物能对DNA扩增出条带,扩增率为88%。经过实验得出S405在感丝黑穗病亲本与抗丝黑穗病亲本、感丝黑穗病基因池与抗丝黑穗病基因池之间的多态性条带一致;对其进行RAPD多态性差异的共分离分析,得出S405与抗丝黑穗病基因的重组率为11.7%,遗传距离为11.9 cM。
3.2 将RAPD分子标记转化为SCAR标记的分析
将引物S405扩增的多态性片段进行测序,结果表明片段长度约为320 bp。进一步设计了SCAR引物,应用SCAR引物对抗、感病群体的单株进行扩增,扩增结果表明其连锁性与RAPD分子标记一致,证明RAPD标记已经成功转化为SCAR标记。
[1]董良利,赵威军. 高粱丝黑穗病研究综述[J]. 山西农业科学, 2006,34(2):82-85.
[2]倪先林,赵甘霖,刘天朋,等. 高粱重要抗性性状的基因定位研究进展[J]. 福建农业学报, 2012,27(6): 652-660.
[3]张春来,杨慧勇,柳青山,等. 高粱抗丝黑穗病遗传与分子育种[J]. 山西农业科学, 2013,41(3): 201-206.
[4]马宜生. 高粱抗丝黑穗病育种初报[J]. 辽宁农业科学, 1982(4): 33-37.
[5]PROM L K, PERUMAL R, ERATTAIMUTHU S R, et al. Virulenec and molecular genotyping studies of Sporisorium reilianum isolates in sorghum[J]. Plant Dis, 2011,95(5):523-529.
[6]姜钰,徐秀德,胡兰,等. 高粱丝黑穗病菌对高粱体内防御酶系活性的影响[J]. 沈阳农业大学学报, 2014,45(5):617-620.
[7]邹剑秋,朱凯,王艳秋,等. 高粱丝黑穗病菌3号生理小种抗性遗传研究及抗病基因分子标记[J]. 中国农业科学, 2010,43(4):713-720.
[8]李玥莹,彭霞,倪娜,等. 高粱DNA的提取纯化及抗丝黑穗病基因的初步分析[J]. 安徽农业科学, 2008,36(5):1776-1777.
[9]石太渊,张华,冯立军. PCR、RAPD技术在植物研究中的应用[J]. 国外农学—杂粮作物, 1995(5):16-18.
[10]陆水怡,李南珠,邹剑秋,等. 高粱抗丝黑穗病基因的分子标记RAPD分析[J]. 沈阳师范大学学报(自然科学版), 2009,27(3):365-368.
[11]谭云,李忠海,黎继烈,等. RAPD分子标记技术在植物研究上的应用[J]. 安徽农业科学, 2013,41(25):10236-10238.
[12]陆丹,牛楠,李玥莹. 高粱基因组DNA提取方法的比较与优化[J]. 生物技术, 2010,20(3):49-52.
[13]GAO J M, XIA B X, YANG H, et al. Comparative study on four methods for quick extraction of sorghum genomic DNA[J]. Agri Sci Technol, 2011,12(5):666-687.
[14]LIN F, CHEN X M. Molecular mapping of genes for race-specific overall resistance to stripe rust in wheat cultivar express[J]. Theo Appl Genet, 2008,116:797-806.
[15]DOYLE J J, KOYLE J L. Isolation of plant DNA fresh tissue[J]. Focus, 1990,12:13-15.
Research on establishment of head smut of sorghum by using SCAR marker
LIYueying,LIChunyang,XINGHuiqing,ZHANGXinyue,PANGHongbo,YANMingyao
(College of Life Science, Shenyang Nomal University, Shenyang 110034, China)
The DNA of the sorghum Head Smut disease-resistant restorer lines and susceptible-resistant restorer lines dwarf four, Head Smut resistance and susceptibility was extracted by CTAB method and marked with molecular marker to sorghm gene by RAPD in this paper. In the optimal RAPD reaction system, 100 random primers were used to screen the markers linked to the resistance gene, 88 pairs amplified products. The results show that S405of 88 pairs of primers between disease-resistant and susceptible-resistant cultivars are amplified differences bands, further segregation analysis the resistance gene to Head Smut was 11.7 %. S405amplified polymorphic bands were cloned and sequenced with the length of 320 bp. According to the nucleotide sequences of differences bands to design specific primer was designed for perform PCR, the RAPD markers were succeeded conversing to SCAR marker, the marker named S405-320, to lay a foundation for the selection and cultivation of improved varieties of sorghum.
sorghum; head smut; RAPD; SCAR
2016-01-09。
辽宁省教育厅科学研究一般项目(L2012387); 沈阳市科技局科技计划项目(F15-1991--22).
李玥莹(1966-),女,辽宁沈阳人,沈阳师范大学教授,博士。
1673-5862(2016)04-0468-05
S432
A
10.3969/ j.issn.1673-5862.2016.04.019
