一株在有氧条件下转化丙酮醇为1,2-丙二醇的大肠杆菌菌株的研究
2016-12-12邓静静胡洪波张雪洪
邓静静 胡洪波 张雪洪
(上海交通大学生命科学技术学院 微生物代谢国家重点实验室,上海 200240)
一株在有氧条件下转化丙酮醇为1,2-丙二醇的大肠杆菌菌株的研究
邓静静 胡洪波 张雪洪
(上海交通大学生命科学技术学院 微生物代谢国家重点实验室,上海 200240)
本实验室在前期构建了一株能高效利用甘油合成丙酮醇的大肠杆菌工程菌株,如果能在有氧条件下将丙酮醇转化为1,2-丙二醇,则可以大幅提高1,2-丙二醇的合成速率。以大肠杆菌BW25113ΔglpK为出发菌株,筛选得到一株可以在有氧条件下代谢甘油的突变菌株PDO1。结果表明,该菌株可以在有氧条件下将丙酮醇转化为1,2-丙二醇,1,2-丙二醇的产量达到0.73 g/L,转化率达到0.493 g/g丙酮醇。突变株PDO1的甘油脱氢酶酶活和胞内的NADH百分比分别是对照株的75.9倍和1.64倍,由此推测,甘油脱氢酶酶活的提高以及NADH的相对提高,使得突变株可以在有氧条件下通过甘油脱氢酶途径代谢甘油,并转化丙酮醇为1,2-丙酮醇。
大肠杆菌;1,2-丙二醇;甘油;丙酮醇;静息细胞发酵
随着生物柴油产业规模的不断扩大,其大量累积的副产物甘油正日益成为生物柴油生产企业的负担。因此,利用微生物将甘油转化为高附加值的产物成为热门研究课题,例如,把甘油转化为1,3-丙二醇、氢气、乙醇、莽草酸、1,2-丙二醇等[1-3]。其中,1,2-丙二醇因具有低毒性和良好的溶剂特性等优点被广泛应用于不饱和聚酯、食品、医药、化妆品、洗涤用品、增塑剂、防冻剂等领域[4,5]。利用微生物方法生产1,2-丙二醇因具有反应条件温和、对环境污染少等优点,日益受到人们
的关注。
已有的文献报道中,大多数是利用大肠杆菌在厌氧条件下把甘油转化为1,2-丙二醇,其合成途径如图1所示[6]。基因gldA编码的甘油脱氢酶不仅是甘油厌氧代谢途径的初始酶,也可在厌氧条件下将丙酮醇转化为1,2-丙二醇,但是当大肠杆菌以甘油为碳源进行厌氧发酵时,存在菌体生长缓慢和产物产率低等缺点[7]。本实验室在前期研究中构建了一株在有氧条件下能利用甘油高效合成丙酮醇的大肠杆菌工程菌株[2],如果大肠杆菌能在有氧条件下通过甘油脱氢途径代谢甘油,则该菌株也有可能在有氧条件下将丙酮醇转化为1,2-丙二醇。
本研究以大肠杆菌PDO0为出发菌株,筛选得到一株可以在有氧条件下以甘油为唯一碳源生长的突变株PDO1。静息细胞转化实验证明该菌株可以在有氧条件下将丙酮醇转化为1,2-丙二醇,并测定该菌株的甘油脱氢酶的酶活以及NADH水平,旨在为有氧条件下利用甘油合成1,2-丙酮醇研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、引物和质粒 本实验所用菌株、引物和质粒见表1。

表1 菌株、质粒和引物列表
1.1.2 培养基 无机盐培养基:每1 L的溶液A含Na2HPO4·12H2O 17.19 g,KH2PO42.99 g,NaCl 0.58 g,(NH4)2·SO45.95 g。每1 L的溶液B含CaCl24.3 g,FeCl3·6H2O 16.7 g,MnCl2·4H2O 1 g,ZnCl21.7 g,CuCl2·2H2O 0.43 g,CoCl2·6H2O 0.6 g,H4MoNa2O60.6 g。另外配制120.18 g/L MgSO4和0.5 g/L thiamine。溶液A高压灭菌以后,每1 L溶液A过滤灭菌加入1 mL溶液B、1 mL MgSO4溶液和1 mL thiamine溶液。甘油筛选平板:在无机盐培养基中添加5 g/L甘油,1.5%琼脂,50 mg/L卡那霉素。
1.1.3 试剂及仪器 丙酮醇(>98.0%)和1,2-丙二醇(>99.0%)购自梯希爱(上海)化成工业发展有限公司。GC-FID 7890气相色谱仪,安捷伦公司。毛细管色谱柱CB-VAX(30 m×0.25 mm×0.33 μm),兰州东立龙信息技术有限公司。全自动微生物生长曲线分析仪,Bioscreen公司。NAD+/NADH测试盒(编号ECNP-100),博世生物公司。
1.2 方法
1.2.1 突变菌株的筛选 以大肠杆菌菌株PDO0为出发菌株,菌体用PB缓冲液悬浮后涂布甘油筛选平板,37℃培养箱培养。
1.2.2 生长曲线的测定 野生型菌株BW25113、出发菌株PDO0和突变菌株PDO1接种于添加5 g/L甘油的无机盐培养基,初始OD600为0.2,用全自动生长曲线测定仪检测OD600,检测72 h。
1.2.3 菌株有氧条件转化丙酮醇为1,2-丙二醇的验证 突变菌株PDO1和BW25113在添加5 g/L甘油
的300 mL无机盐培养基中有氧发酵,培养到OD600为1左右,将全部菌体离心收集,PB缓冲液洗涤2次后,转接到添加5 g/L丙酮醇的20 mL PB缓冲液中,37℃,有氧发酵24 h。发酵液离心取上清,用甲醇稀释10倍后过滤备用,丙酮醇和1,2-丙二醇的标准样品用甲醇稀释配制浓度梯度。气相检测方法:100℃保持1 min;以温度上升速度20℃/min上升到230℃后,保持3 min。
1.2.4 基因gldA的敲除和回补 采用P1噬菌体转导法敲除突变菌株PDO1的gldA基因,构建得菌株PDO2[8-10];基因回补即以电转法将质粒pCA24N-gldA导入PDO2菌株,构建得菌株PDO3。菌株构建后,接种添加5 g/L甘油的20 mL无机盐培养基,摇瓶发酵,检测生长情况。
1.2.5 甘油脱氢酶酶活的测定 菌株PDO1和BW25113在甘油无机盐培养基中培养到稳定阶段后,取菌液做酶活测定[11,12]。
1.2.6 辅酶NAD+/NADH量测定 突变菌株PDO1和BW25113在添加5 g/L甘油的无机盐培养基中培养到稳定生长期后,按照NAD+/NADH试剂盒说明书进行操作。
2 结果
2.1 突变株的生长特性
菌株PDO0在甘油筛选平板上涂布多次以后,得到一个单菌落,命名为PDO1。检测72 h的生长曲线如图2所示。出发菌株PDO0由于敲除了在有氧条件下代谢甘油的必须基因glpK,几乎不生长。野生型菌株BW25113在12 h即达到生长稳定期,突变菌株PDO1在18 h开始生长,在48 h达到生长稳定期,最终OD600和BW25113一样。突变菌株PDO1虽然生长速度比野生型菌株BW25113缓慢,但是相对于不能在有氧条件下生长的出发菌株PDO0,生长特性有显著改变。

图2 菌株PDO0,PDO1,BW25113在甘油无机盐培养基中的生长曲线
2.2 突变株有氧条件下转化丙酮醇为1, 2-丙二醇
经GC-FID检测,丙酮醇和1,2-丙二醇标准样品出峰时间分别为4.1 min和7.2 min。静息细胞转化实验后,菌株PDO1的发酵液中可以检测到1,2-丙二醇(图3-A),而对照菌株BW25113的发酵液中未检测到1,2-丙二醇(图3-B)。如图3-C所示,菌株BW25113消耗丙酮醇的量为0.72 g/L,菌株PDO1消耗丙酮醇的量为1.48 g/L,合成1,2-丙酮醇的量为0.73 g/L,转化率达到0.493 g/g丙酮醇。

图3 静息细胞发酵菌液的检测情况
2.3 基因gldA的作用
为了确认是否因为基因gldA的突变导致突变株PDO1具有有氧条件下代谢甘油的特性,对突变株PDO1中的基因gldA进行测序,测序结果证明基因gldA没有突变。为了证实突变株PDO1中是否存在其他有氧代谢甘油的途径,我们敲除了PDO1中的gldA基因,得到突变株PDO2,并将质粒pCA24N-gldA导入菌株PDO2,得到回补菌株PDO3。图4的生长曲线表明菌株PDO2不可以利用甘油生长,菌株PDO3可以利用甘油生长,表明基因gldA是菌株PDO1在有氧条件下代谢甘油的必需基因。
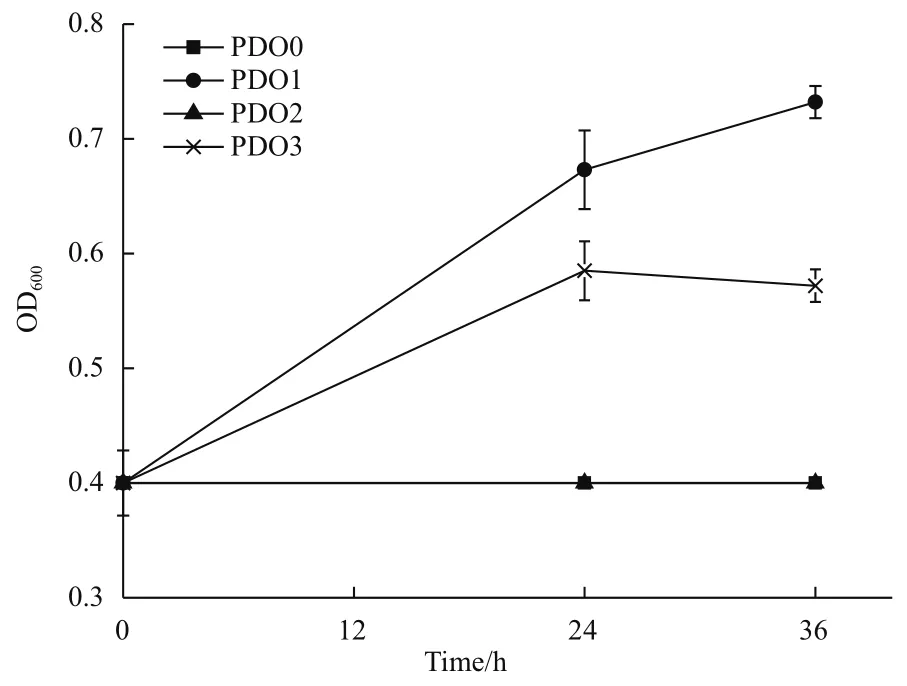
图4 菌株PDO0,PDO1,PDO2,PDO3在甘油无机盐培养基中的生长曲线
2.4 突变株甘油脱氢酶酶活水平提高
以上实验已经证明gldA是突变株PDO1利用甘油生长的必需基因,此外,我们测定了PDO1中甘油脱氢酶的活性。如图5所示,对照菌株的甘油脱氢酶酶活为37 U/mg蛋白总量,突变株PDO1的酶活为2 809 U/mg蛋白总量,是BW25113酶活的75.9倍。这表明突变株PDO1中甘油脱氢酶活性显著的提高可能是其能利用甘油厌氧代谢途径代谢甘油的原因。
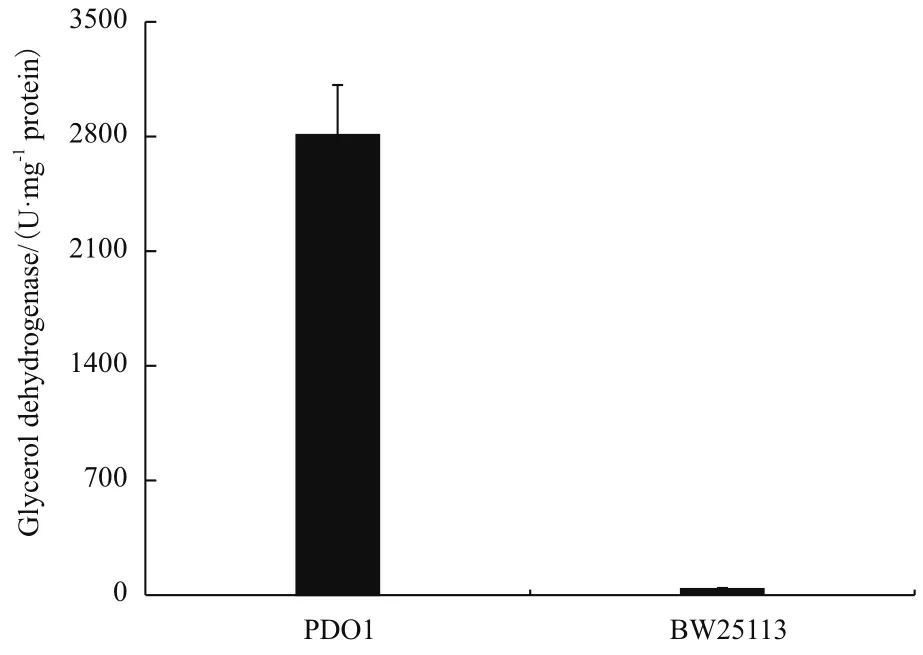
图5 菌株BW25113和PDO1的甘油脱氢酶酶活
2.5 突变菌株的NADH相对增加
基因gldA编码的甘油脱氢酶催化甘油脱氢时需要辅酶NAD+的参与,催化丙酮醇合成1,2-丙二
醇则需要辅酶NADH的参与。为了考察胞内NADH和NAD+对菌株特性的影响,测定了突变菌株PDO1中NAD+和NADH的含量。结果如图6所示,菌株PDO1的NAD+和NADH总量明显比BW25113少,但是菌株PDO1的NADH占辅酶总量的百分比却显著比BW25113多,是后者的1.64倍,NADH水平的提高可能为丙酮醇转化为1,2-丙二醇提供了必须的NADH。
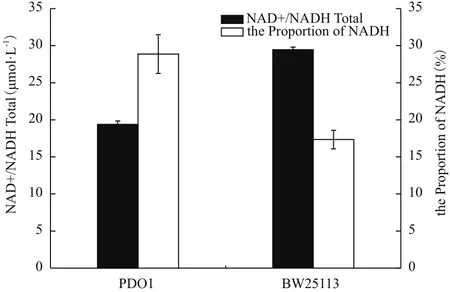
图6 菌株在甘油无机盐培养基中的NAD+和NADH总量及NADH百分比
3 讨论
在本研究中,以甘油激酶基因缺失的菌株PDO0为出发菌株,筛选得到了一株有氧条件下以甘油为唯一碳源生长的菌株PDO1。另外,用静息细胞发酵证实菌株可以在有氧条件下将丙酮醇转化为1,2-丙二醇,而且转化率达到0.493 g/g丙酮醇。
基因gldA是菌株PDO0甘油厌氧代谢途径以及合成1,2-丙二醇的关键基因,测序结果表明突变株PDO1中该基因并没有突变。基因gldA的敲除和回补实验表明基因gldA是突变菌株好氧条件下代谢甘油的必需基因。由此猜测可能是突变菌株中相关调控基机制改变增加了基因gldA的表达量,随后的甘
油脱氢酶酶活检测证实了这点。突变株PDO1中基因gldA表达的显著提高可能是在有氧条件下代谢甘油的原因。
NAD+和NADH是细胞内重要的电子载体,参与到多种氧化还原反应[13]。大肠杆菌在厌氧条件下代谢甘油以及产1,2-丙二醇途径中,甘油的脱氢以及1,2-丙二醇的合成都依赖于NAD+和NADH的相互转化。Bekers等[13,14]的研究表明,NADH和NAD+的比例对代谢途径的流向有至关重要的作用,而且Rachit和Huang等[15]敲除ubiC基因阻断了NADH在微氧条件下的氧化,提高1,2-丙二醇的产量。在有氧条件下,胞内NADH会被迅速氧化,细胞内NADH相对少,在厌氧培养时,NADH才能维持在一个相对较高的水平[16,17]。而突变株PDO1细胞内的NADH在有氧培养时仍然维持在一个较高的水平,因此可能是菌株PDO1胞内NADH的相对提高以及基因gldA表达水平的上升促使了突变菌株在有氧条件下转化丙酮醇为1,2-丙酮醇。
以前的研究均在厌氧条件下发酵产1,2-丙二醇,但是大肠杆菌以甘油为唯一碳源时,在厌氧条件下生长缓慢。本研究中得到的突变菌株可以在有氧条件下转化丙酮醇为1,2-丙二醇,但是也存在生长缓慢的问题。因此,在后面的研究中,可以通过突变菌株在甘油培养基中的适应性进化,提高其在有氧条件下的生长速度,实现在有氧条件下的快速生长以及高产1,2-丙二醇。
4 结论
在本研究中,以大肠杆菌BW25113ΔglpK为出发菌株,通过筛选得到一株可以在有氧条件下代谢甘油的突变菌株PDO1。静息细胞发酵表明菌株PDO1可以在有氧条件下将丙酮醇转化为1,2-丙二醇,1,2-丙二醇的产量达到0.73 g/L,转化率达到0.493 g/g丙酮醇。
随后基因gldA的研究表明gldA是突变菌株必需,而且该基因表达水平显著比对照株高,另外突变株胞内NADH水平也比对照菌株高。因此,我们推测突变菌株基因gldA表达水平的提高以及NADH的相对提高使得菌株可以有氧条件下利用甘油生长且生产1,2-丙二醇。
[1] Clomburg JM, Gonzalez R. Anaerobic fermentation of glycerol:a platform for renewable fuels and chemicals[J]. Trends in Biotechnology, 2013, 31(1):21-28.
[2] Zhu HL, Yi XY, Liu Y, et al. Production of acetol from glycerol using engineered Escherichia coli[J]. Bioresource Technology, 2013, 149(4):238-243.
[3] Yang FX, Hanna MA, Sun RC. Value-added uses for crude glycerol-a byproduct of biodiesel production[J]. Biotechnology for Biofuels, 2012, 5(6):1-10.
[4] 郑军. 1, 2 丙二醇国内外生产现状及发展前景[J]. 热固性树脂, 2009, 24(1):58-62.
[5] Bennett GN, San KY. Microbial formation, bitechnological production and application of 1, 2-Propanediol[J]. Applied Microbiology & Biotechnology, 2001, 55(1):1-9.
[6] Ramon G, Abhishek M, Yandi D, et al. A new model for the anaerobic fermentation of glycerol in enteric bacteria:Trunk and auxiliary pathways in Escherichia coli[J]. Metabolic Engineering, 2008, 10(5):234-245.
[7] Liu Q, Xiong DW, Hu HB, et al. Hydrogen production from glycerol using a genetically engineered Escherichia coli HW2 strain[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(5):1133-1137.
[8] 曲璟秋, 刘翠花. 应用基因敲除快速构建大肠杆菌突变体改造
脂肪酸代谢途径[J]. 微生物学报, 2013, 53(6):608-614.
[9] Madyagol M, Al AH, Levarski Z, et al. Gene replacement techniques for Escherichia coli genome modification[J]. Folia Microbiologica, 2011, 56(3):253-263.
[10] Tomoya B, Takeshi A, Miki H, et al. Construction of Escherichia coli K-12 in-frame, single gene knockout mutants:the keio collection[J]. Molecular Systems Biology, 2006, 2(1):8-11.
[11] Jin RZ, Tang J, Lin E, et al. Experimental evolution of a novel pathway for glycerol dissimilation in Escherichia coli[J]. Journal of Molecular Evolution, 1983, 19(6):429-436.
[12] Piattoni CV, Figueroa CM, Diez MDA, et al. Production and characterization of Escherichia coli glycerol dehydrogenase as a tool for glycerol recycling[J]. Process Biochemistry, 2013, 48(3):406-412.
[13] Bekers KM, Heijnen JJ, Gulik WM. Determination of the in vivo NAD:NADH ratio in Saccharomyces cerevisiae under anaerobic conditions, using alcohol dehydrogenase as sensor reaction[J]. Yeast, 2015, 32(8):541-557.
[14] Bakker BM, Overkamp KM, Van AJ, et al. Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae[J]. FEMS Microbiol, 2001, 25(1):15-37.
[15] Rachit J, Jin H, Yuan QP, et al. Engineering microaerobic metabolism of E. coli for 1, 2-propanediol production[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(3):1-7.
[16] Zhang YP, Huang ZH, Du C, et al. Introduction of an NADH regeneration system into Klebsiella oxytoca leads to an enhanced oxidative and reductive metabolism of glycerol[J]. Metabolic Engineering, 2008, 11(2):101-106.
[17] Sun FF, Dai CY, Xie J, et al. Biochemical issues in estimation of cytosolic free NAD/NADH Ratio[J]. PLoS One, 2012, 7(5):1-10.
(责任编辑 马鑫)
Research on an Escherichia coli Strain Capable of Transferring Acetol to 1,2-Propanediol Aerobically
DENG Jing-jing HU Hong-bo ZHANG Xue-hong
(Key Laboratory of Microbial Metabolism,School of Life Sciences and Biotechnology,Shanghai Jiao Tong University,Shanghai 200240)
We constructed an engineered Escherichia coli strain that can efficiently convert glycerol to acetol in our lab,the productivity of 1,2- Propanediol(1,2-PDO)may increase significantly if the strain can convert acetol to 1,2-PDO under aerobic condition. A mutant strain named PDO1 was screened from original strain E. coli BW25113ΔglpK,which metabolized glycerol aerobically. The further experiments showed that the strain PDO1 converted acetol to 1,2-PDO with the yield of 0.73 g/L and conversion rate of 0.493 g/g acetol under aerobic condition. The activity of glycerol dehydrogenase and the proportion of NADH were 75.6 and 1.64 times higher than that of control respectively. It is inferred that the increase of glycerol dehydrogenase activity and NADH level resulted in the mutant strain PDO1 metabolizing glycerol by glycerol dehydrogenase under aerobic condition and the conversion of acetol to 1,2-PDO .
Escherichia coli;1,2-Propanediol(1,2-PDO);glycerol;acetol;resting cells fermentation
10.13560/j.cnki.biotech.bull.1985.2016.12.025
2016-03-01
“973”项目(2012CB721005),国家自然科学基金项目(J1210047)
邓静静,女,硕士研究生,研究方向:大肠杆菌利用甘油生产高价值产物的研究;E-mail:977613938@qq.com
胡洪波,男,副教授,研究方向:微生物代谢工程;E-mail:hbhu@sjtu.edu.cn
