甘氨酸高温热解含氮产物生成机理及实验研究
2016-12-12龚千代艾锦瑾
龚千代,刘 亮,田 红,刘 成,艾锦瑾
(长沙理工大学 能源与动力工程学院, 湖南 长沙 410114)
·化学与化学工程·
甘氨酸高温热解含氮产物生成机理及实验研究
龚千代,刘 亮,田 红,刘 成,艾锦瑾
(长沙理工大学 能源与动力工程学院, 湖南 长沙 410114)
以甘氨酸分子为研究对象,用密度泛函理论B3LYP/6-31G基组对甘氨酸热解过程中的各反应物、过渡态、中间体及产物进行了结构优化和频率计算,并采用热重红外联用仪对甘氨酸进行了实验。研究结果表明,初反应以R1-1,R1-2以及R2-1为主。其中R2-1为氨基的脱离,所以热解的最终含氮产物中NH3所占比例最大。随后的实验也证明了这一点。R1-1和R1-2为两分子脱水形成DKP的反应。该路径的次反应包括R1-8和R1-14,最终产物分别是HCN和HNCO,在实验的最终产物中也被检出。在初反应中占劣势的路径R3-1有两条次反应路径R3-3和R3-11,其中前者的焓变相对较小,是该路径上的主要反应。最后将实验结果与理论计算结果进行对比,发现吻合度较好。
甘氨酸;高温热解;密度泛函理论;含氮产物;热重红外联用
热解是生物质燃烧气化的初始阶段,研究生物质热解过程燃料氮的转化规律,可为生物质能源的清洁利用提供理论依据。在生物质中,80%~85%(质量分数)的氮主要来源于蛋白质。将生物质蛋白质中的氨基酸作为生物质含氮模型,通过研究其裂解机理来研究生物质热解生成含氮气体的生成机理受到越来越多国内外学者的关注。
KM Hansson和LE Amand等人[2]以聚亮氨酸作为生物质含氮模型,在流化床内将其热解至700~800 ℃,通过傅里叶变换红外光谱仪检测到HCN,NH3和HNCO的生成,没有检测到NO和NO2。Jie Li等人[3]用热重红外联用,将甘氨酸在氮气氛围下加热到800℃,观测到了NH3,HNCO和HCN的生成。Ramesh.K.S等人[4]观察到马来酰亚胺和琥珀酰亚胺是天冬氨酸热解的主要产物,并提出了天冬氨酸可能的热解路径[5]。在理论计算方面,黎新等人[6]利用DFT方法对亮氨酸的热分解机理进行了研究,认为亮氨酸热分解是以首先失去NH3生成环氧中间产物后失去CO2为主。刘朝等人[7-9]采用量子化学方法对纤维素、木质素等热解机理进行了大量研究。罗海银等人[10-11]利用采用DFT方法研究了多环芳烃中苯的形成机理和木质素二聚体裂解机理,并提出了可能的反应路径。密度泛函理论(DFT)在考虑电子相关效应的同时,不仅可进行大分子体系的计算,而且计算结果准确、可靠[12]。本文选取生物质中分布较广泛的甘氨酸作为研究对象[13],采用Gaussian09量化软件包中的密度泛函理论(DFT)B3LYP/6-31G方法对甘氨酸高温热解中可能发生的反应路径进行量化计算,并采用热重-红外联用仪进行热解实验,对模拟结果进行验证。
1 理论计算
1.1 计算方法
使用Gaussian09量化软件包中的密度泛函理论(DFT)B3LYP/6-31G方法对甘氨酸高温热解中可能发生的反应路径进行分子模拟。首先设计反应路径,并对反应路径中的各反应物、过渡态、中间体及产物等进行几何构型优化及频率计算。采用TS方法寻找过渡态,且由IRC内禀反应坐标来验证反应路径的正确性。通过计算得到的相关热力学数据来判断反应的可能性。在计算中加入关键词temperature=1 500K来实现高温热解氛围。
1.2 反应路径
为了解甘氨酸高温热解过程中氮元素的释放机理,结合文献[14-16],设计了3条反应路径。其中,第1,2条反应路径中各含有两条次反应路径。图1为反应路径R1的初反应,图2分别为反应路径R2和反应路径R3,图3为反应路径R1的两个次反应。

图1 甘氨酸高温热解反应路径R1的初反应示意图Fig.1 First stage reaction of R1 of glycine during high temperature pyrolysis
R1反应的初反应分为两个,分别是2个甘氨酸分子失去1个—H或—OH后生成1个二聚体IM11,随后IM11又先后经历了失去OH—和H—后生成六元环IM12,即DKP。DKP的裂解包含两个次反应路径,分别是R1-8和R1-14。其中,R1-8中DKP经C—C断键开环生成ts1e,然后生成两种产物IM32和IM13,这两种产物最后都可逐步裂解生成P31,即HCN。R1-14中DKP经C—N断键开环生成ts1g,生成产物P11HNCO和四元环IM15,IM15最终可裂解生成HNCO。R2反应为氨基从甘氨酸分子上脱落,最终吸附1个H原子生成P21,即NH3。R3反应的初反应是甘氨酸分子经脱羧后吸附1个H原子生成IM31,即甲胺。随后IM31的裂解包含两个次反应路径,分别是R3-3和R3-11。其中,R3-3是甲氨分子逐步裂解脱氢最终生成产物P31,即HCN;R3-11为甲胺分子上的氨基脱落后吸附1个H原子生成产物NH3。
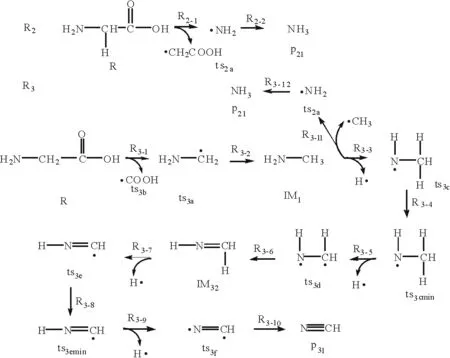
图2 甘氨酸高温热解反应路径R2,R3反应示意图Fig.2 R2,R3 of glycine during high temperature pyrolysis

图3 甘氨酸高温热解反应路径R1的次反应示意图Fig.3 Second stage reaction of R1 of glycine during high temperature pyrolysis
1.3 结果与讨论
表1为反应物R,中间体IM11,IM31,产物P11,P21,P31和过渡态ts1a,ts1b经优化后的几何结构和结构参数。
将优化后的反应物、过渡态、中间体和产物进行频率计算,经频率分析可知,各驻点都没有虚频,说明优化得到结构是合理的,各过渡态有且只有一个虚频,见表2,并对各过渡态进行了IRC验证。
根据动力学分析的原理,将优化后的反应物、过渡态、中间体和产物进行频率计算,得到了各构型在1500K环境、经零点能校正后的总能量,如表3。

表1 部分优化构型的几何结构和参数

表2 过渡态的虚频(i·cm-1)

表3 各构型在1 500K环境下的总能量
表4给出了3条反应路径的初反应路径的热力学数据。对比4条初反应路径的焓变ΔH,可以发现R1-1路径的焓变最小,为444.58 kJ/mol;R2-1路径次之,为477.05 kJ/mol;R1-2路径的焓变为513.82 kJ/mol;R3-1路径的焓变最大,为550.44 kJ/mol。从热力学的角度考虑,吸热越少,反应越容易发生。因此,可以判断在甘氨酸热解的初反应路径中,以R1-1,R1-2及R2-1路径为主,即以脱水成环反应和氨基的脱离为主。Jufang Hao等人[16]也通过实验结果认为甘氨酸热解的脱氨和脱水反应的活化能比脱羧反应的活化能低得多。
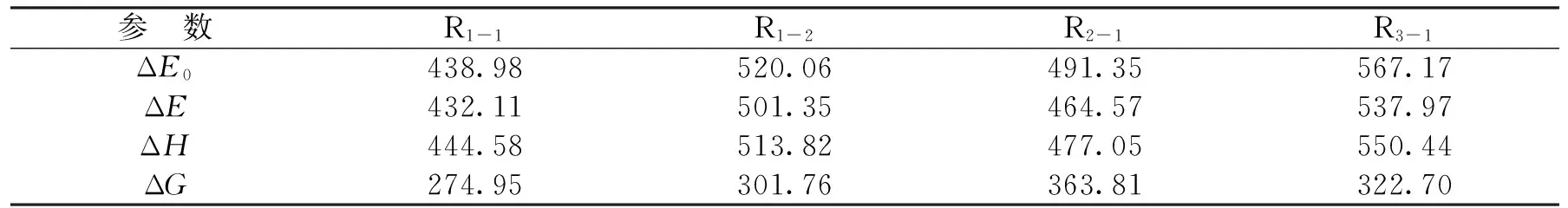
表4 初反应路径的热力学参数

表5 次反应的焓变
表5给出了所有次反应路径的焓变。其中,在初反应中比较占优势的R2-1的次反应R2-2为ts2a吸附1个H原子生成NH3,这部分反应的焓变为-552.95 kJ/mol。由于这条路径的反应步骤最少,意味着这条路径的反应容易发生。因此在气化后的含氮产物中,该条路径的最终产物NH3将会占较大比例。
R1-1和R1-2的次反应为过渡态ts1a和ts1b结合生成中间体IM11,反应的焓变为-456.84 kJ/mol。随后IM11经历脱水缩合后形成中间体IM12,即DKP。IM12可继续裂解,其裂解路径可分为两种:R1-8和R1-14,反应的焓变分别为401.16 kJ/mol和396.71 kJ/mol,相差较小,说明两种裂解路径都有可能发生。其中,R1-8中DKP的C—C键断裂开环,最终裂解生成的产物为P31,即HCN;R1-14中DKP的C—N键断裂开环,最终裂解生成的产物为P11,即HNCO。
R3-1反应生成的过渡态ts3a则吸附1个H原子生成中间体IM31,反应的焓变为-417.25 kJ/mol。IM31的裂解路径分为R3-3和R3-11两条,R3-3为IM31中N原子上失去1个H原子;R3-11为IM31中C—N键断裂后生成过渡态ts2a, ts2a最终生成P21,即NH3。两条路径的焓变分别为401.05 kJ/mol和446.07 kJ/mol,说明在这个反应中R3-3占优势,其反应生成的过渡态ts3c经历几次脱氢反应最终生成产物P31,即HCN。
2 实验部分
为了验证理论计算的合理性,利用热重-红外联用技术对甘氨酸在高温热解过程中含氮产物的生成规律进行了研究。
2.1 实验设备及条件
实验所用TG-FTIR为德国NETZSCH公司生产的STA 499C Jupiter型热重分析仪以及美国Thermo Fisher科技公司生产的Nicolet FTIR分析仪。实验所用甘氨酸试剂为美国Amresco公司生产,纯度>99%,质量分数。实验载气采用高纯氦气(>99.999%,体积分数),载气流量为20mL/min,升温初始温度为30℃,终止温度为1 200℃。用电子天平量取试剂,质量为10.00mg(±0.10mg),升温速率为20 K/min。热重分析仪自动记录实验过程中样品质量的变化信号,试样热解过程中释放的气体产物由与热重分析仪直接相连的红外光谱分析仪进行在线检测分析。
2.2 热重实验结果与分析
图4表示甘氨酸的热解失重曲线图。由此可知,随着温度的升高,可以观测到甘氨酸的3个失重阶段。第一个失重阶段是在200~310 ℃范围内的快速失重,失重率为50%左右。第二和第三阶段分别为310~430 ℃和460~1200 ℃,这两个阶段的失重速率较小。

图4 甘氨酸热解失重曲线图Fig.4 The curves of TG and DTG absorbance intensity during glycine pyrolysis process
2.3 红外光谱实验结果与分析

图6 HNCO,HCN和NH3的析出特性曲线Fig.6 IR absorbance vs. temperature curves of identified evolved gaseous species evolved from glycine pyrolysis
图5表示甘氨酸热解100~1200 ℃红外吸收光谱图。由此可知,在温度升高到200 ℃以前,没有明显的热解产物出现。300 ℃时开始有大量的热解产物出现,随后随着温度的上升,热解产物慢慢减少。这个规律与Li Jie等人[3]的以800 ℃为终温的甘氨酸热解实验相类似。图6表示NH3,HCN和HNCO的吸光度随温度的变化曲线。由此可知,HCN的析出峰有3个,分别是280 ℃,400 ℃以及660 ℃,与郝菊芳等人[17]的实验结果相似。在280 ℃时的少量HCN析出可能是由于少量氨基酸发生了脱羧反应生成了甲胺,甲胺进一步脱氢最后生成HCN。高温阶段下的HCN则是由焦炭氮中腈的二次分解生成[18]。在400℃左右时生成的HCN则是由中间产物DKP裂解后生成,即R1-8,因为该温度恰好是DKP热解失重速率最大的区间[19]。同理,图6中HNCO的唯一析出峰也是在这个区间,说明HNCO也是由中间产物DKP裂解后生成,即R1-14。在500℃~800℃区间,HCN的产量略有增长,而HNCO的产量则降低,除了可能是有焦炭氮中的腈二次分解生成了HCN之外,还有可能是有HNCO转化为HCN。NH3的产量从250℃开始大量增加,在300℃左右达到最高值之后,又开始快速减少,与郭明山等人[20]的结论一致。这印证了计算部分中最终产物NH3将会占较大比例的结论,说明NH3是由氨基酸分子中氨基的直接脱离产生,即R2-1。但不同的是,郭明山等人的实验在400℃以上便不再检测到NH3的生成。而在本实验中,当温度达到350℃后,NH3产量下降的速度开始减缓,并一直保有一定产量直到最终。对比周建强等人[19]的DKP的热解实验结果,表明350℃之后的NH3可能是由于DKP的热解而生成。
3 结 论
从各热力学数值分析发现,在甘氨酸高温热解路径的4条初反应中,从各热力学数值分析发现,R1-1的焓变最小,说明裂解初期R1-1反应占优势,在初反应中焓变较小的R2-1这条路径的反应步骤最少,路径容易发生,因此在热解后的含氮产物中,该路径的最终产物NH3占较大比例。随后的甘氨酸高温热解实验中,NH3的产量从250℃开始大量增加,也证明了这一点。
随着裂解程度的加深,中间产物DKP开始裂解,次反应路径增多。通过研究次反应路径中各热力学参数发现,路径R1中 R1-8和R1-14的焓变相近,分别为391.10kJ/mol和391.80 kJ/mol,说明两条反应都有可能发生,其最终生成的含氮产物主要有P31和P11,即实验中检测到的HCN和HNCO。
[1] REN Qiangqiang, ZHAO Changsui. Evolution of fuel-N gas phase during biomass pyrolysis[J]. Renewable and Sustainable Energy Reviews,2015,50:408-418.
[2] HANSSON K M, SAMUELSSON J, TULLIN C. Formation of HNCO, HCN, and NH3from the pyrolysis of bark and nitrogen-containing model compounds[J]. Combustion and Flame, 2004,137: 265-277.
[3] LI J, WANG Z Y. Evaluate the pyrolysis pathway of glycine and glycyl-glycine by TG-FTIR[J]. Journal Of Analytic and Applied Pyrolysis, 2007,80:247-253.
[4] SHARMA R K, CHAN W G, SEEMAN J.I. Formation of low molecular weight heterocycles and polycyclic aromatic compounds (PAC) in the pyrolysis of a-amino acids[J].Journal of Analytic and Applied Pyrolysis,2003,66 (1-2): 97-121.
[5] RAMESH K, SHARMA W, CHAN W G. Product composition from pyrolysis of some aliphatic α-amino acids[J]. Journal Of Analytic and Applied Pyrolysis,2006,75:69-81.
[6] 黎新. 亮氨酸热分解机理的DFT研究[J]. 西南师范大学学报(自然科学版),2007,32(5):39-42.
[7] 黄金保, 刘朝, 任丽蓉,等. 木质素模化物紫丁香酚热解机理的量子化学研究[J]. 燃料化学学报,2013,41(6):657-666.
[8] 黄晓露. 木质素模型化合物热解的微观机理研究[D].重庆:重庆大学,2012.
[9] 黄金保. 纤维素快速热解机理的分子模拟研究[D].重庆:重庆大学,2010.
[10] 罗海银, 曹小玲, 田红,等. 多环芳烃中苯的形成机理研究[J]. 四川大学学报(自然科学版),2015,52(2):363-369.
[11] 罗海银, 田红, 唐世斌,等.α-O-4型木质素二聚体裂解机理的研究[J]. 兰州大学学报(自然科学版),2016,52(2):271-276.
[12] 曹小玲, 张航, 邓盛祥.β-1型木质素二聚体高温蒸汽气化机理的理论研究[J]. 燃料化学学报,2014,42(7):813-819.
[13] REN Qiangqiang, ZHAO Changsui. Formation of NOxprecursors during wheat straw pyrolysis and gasification with O2and CO2[J]. Fuel, 2010,89:1064-1069.
[14] HANSSON K M, AMANDA L E, HABERMANN A. Pyrolysis of poly-L-leucine under combustion-like conditions[J]. Fuel, 2003,82:653-660.
[15] VLADIMIR A B, DOUDA J. Pyrolysis of poly-glycine and poly-L-alanine: analysis of less-volatile products by gaschromatography/Fourier transform infrared spectroscopy/mass spectrometry[J]. Journal of Analytical Applied Pyrolysis,2000,55:235-246.
[16] HAO Jufang, GUO Jizhao. TG-FTIR, Py-two-dimensional GC-MS with heart-cutting and LC-MS/MS to reveal hydrocyanic acid formation mechanisms during glycine pyrolysis[J]. Journal of Thermal Analysis and Calorimetry,2014,115:667-673.
[17] 郝菊芳. 热裂解反应中氢氰酸形成机理研究[D]. 中国科学院研究生院,2013.
[18] REN Qiangqiang, ZHAO Changsui. NOx and N2O precursors (NH3and HCN) from biomass pyrolysis: Interaction between amino acid and mineral matter[J]. Applied Energy,2013,112: 170-174.
[19] 周建强, 高攀, 董长青. 秸秆含氮模型化合物热解氮转化规律的实验研究[J]. 燃料化学学报,2015,43(12):1427-1432.
[20] 郭明山,金晶,林郁郁.城市污泥慢速热解过程中氮的转化规律[J].化工进展,2016,35(1):302-307.
(编 辑 陈镱文)
Theoretic and experiment study on nitrogen-containing products of glycine during high temperature pyrolysis
GONG Qiandai, LIU Liang, TIAN Hong, LIU Cheng, AI Jinjin
(School of Energy & Power Engineering, Changsha University of Science & Technology, Changsha 410114, China)
Glycine are investigated as a research object by using DFT B3LYP/6-31G. All the reactants, transition states, intermediates and products during the pyrolysis are optimized and their frequencies are calculated. The experiment is conducted using a thermogravimetric analyzer coupled with a Fourier transform infrared spectrometer (TG-FTIR). The results show that at the beginning of the reaction, the main pathways are R1-1,R1-2and R2-1. R2-1is the separation of the amino group, hence NH3accounts for the largest percentage in the final nitrogen-containing products, the experiment also proved it. R1-1and R1-2are dehydration between two molecules. The secondary reaction of this pathway includes R1-8and R1-14, their final nitrogen-containing product is HCN and HCNO, which was detected in the experiment. R3-1, which is at a disadvantage during the first stage, includes two second pathways, R3-3and R3-11. R3-11is the main pathway for the less enthalpy changes. Then the result of experiment is compared with the result of calculation, and the matching degree is relatively high.
glycine; pyrolysis; DFT; nitrogen-containing products; TG-FTIR
2016-04-11
国家自然科学基金资助项目(51276023);湖南省自然科学基金资助项目(2015JJ4005)
龚千代,女,湖南湘潭人,从事生物质燃烧及气化研究。
刘亮,男,湖南岳阳人,教授,从事燃烧理论及污染物生成机理及控制技术研究。
TK16;TK6
A
10.16152/j.cnki.xdxbzr.2016-05-014
