常春藤对甲醛和弱光胁迫的解剖结构及生理特征响应
2016-12-12张永福莫丽玲牛燕芬夏体渊王定康耿开友
张永福,莫丽玲,牛燕芬,夏体渊,王定康,耿开友
(1.昆明学院 农学院,云南 昆明650214;2.昆明学院 科研处,云南 昆明650214)
常春藤对甲醛和弱光胁迫的解剖结构及生理特征响应
张永福1,莫丽玲1,牛燕芬1,夏体渊1,王定康1,耿开友2
(1.昆明学院 农学院,云南 昆明650214;2.昆明学院 科研处,云南 昆明650214)
以2种常春藤Hedera盆栽苗为试验材料,在密封的玻璃容器中,设置甲醛、弱光及甲醛+弱光3个胁迫处理和1个对照,处理4个月后,分别采样测定叶的解剖结构及根、叶的生理生化指标,探讨甲醛和弱光环境胁迫处理对2种常春藤解剖结构和生理特性及适应性的影响。结果表明:洋常春藤Hedera helix的栅栏组织厚度、气孔长度和气孔宽度在甲醛和弱光胁迫下均显著(P<0.05)减小,而甲醛胁迫使叶厚和海绵组织厚度增大,弱光下气孔密度增大;中华常春藤Hedera nepalensis的叶厚、栅栏组织厚度、海绵组织厚度、气孔长度、气孔宽度和气孔密度在各胁迫下均减小。各胁迫使2种常春藤的根系活力均显著(P<0.05)下降;在甲醛和弱光双重胁迫下,洋常春藤的甲醛质量分数高于中华常春藤;中华常春藤的叶绿素质量分数在甲醛胁迫下下降,而弱光下则上升,洋常春藤与之相反;双重胁迫使2种常春藤的叶绿素质量分数显著(P<0.05)下降,类胡萝卜素质量分数显著(P<0.05)上升。弱光下2种常春藤根系和叶片的超氧化物歧化酶(SOD)活性下降,而甲醛和双重胁迫使2种常春藤根系和叶片的超氧化物歧化酶活性及根系的过氧化物酶(POD)活性显著(P<0.05)下降。此外,各胁迫还使2种常春藤的过氧化氢和丙二醛质量摩尔浓度、相对电导率及氧自由基产生速率上升。可见,中华常春藤对弱光的适应性强于洋常春藤,而洋常春藤对甲醛的抗性强于中华常春藤。图5表1参21
植物学;常春藤;甲醛胁迫;弱光胁迫;解剖结构;生理响应
光作为重要的环境因子,对植物生长、发育和演化具有极其重要的作用,同时又影响植物形态和生理功能[1]。光照强度长时间大幅度低于植物光饱和点将产生弱光胁迫,影响植物的形态建成和生理生化过程[2-3]。弱光影响植物最直接的生理表现是光合速率降低[4],同时植物激素、抗氧化剂及次生代谢等生理进程也受到明显影响。甲醛是一种无色、有强烈刺激性气味的气体,为挥发性有机物,易溶于水,在室温下易释放。世界卫生组织指出,当室内甲醛超过0.1 mg·m-3时,就应当引起人们足够的重视[5],许多建筑材料和胶黏剂均含有甲醛,室内装修后甲醛会不断向环境释放,释放周期可长达10余年。室内装修材料及生活用品带来的甲醛严重威胁着人们的身体健康而广受关注[6]。目前,可通过物理、化学、生物工程以及绿色植物净化方法控制室内甲醛污染,由于前3种方法效果不理想且局限性较大,因此利用植物吸收室内装修产生的甲醛成为当今研究的热点。室内光照强度明显低于室外,植物的生长发育势必受到较大的影响。国内外相关研究大多局限于弱光[7-8]或甲醛[9-10]等单一因子对植株生长发育和生理生态等方面的影响,有关甲醛和光照强度交互作用对植物解剖结构和生理生态特性及相关适应性影响的研究还未见报道。常春藤Hedera是常见的常绿木质藤本植物,对环境的适应性强,适于室内外栽植,叶有香气,形态优美,且易繁殖,已成为主要的观赏植物之一。目前,对常春藤甲醛吸收能力已有广泛的研究,但对弱光下常春藤对甲醛胁迫的解剖特征及生理响应的研究还未见报道。因此,本研究选取中华常春藤Hedera nepalensis和洋常春藤Hedera helix半年生扦插盆栽苗进行甲醛和弱光环境培养试验,探讨2种常春藤苗抗性系统对一定范围弱光环境和甲醛胁迫影响的解剖及生理响应,揭示它们对甲醛和弱光胁迫的适应和调节机制,以及甲醛胁迫在植物忍耐弱光适应性调节过程中发挥的作用,以期为常春藤室内栽培和光照提供理论依据。
1 材料与方法
1.1 材料培养
供试材料为昆明学院校园内边坡地被植物中华常春藤Hedera nepalensis(简写为HN)和洋常春藤H. helix(简写为HH)的半年生扦插苗。选取根系健壮,枝叶繁茂的植株移栽至20 cm×20 cm的营养钵中,然后转移到100 cm×60 cm×100 cm的玻璃容器中,各个玻璃容器分别放置中华常春藤和洋常春藤各10盆,且分别浇Hoagland营养液1次200 mL·盆-1·周-1(pH 5.5),以维持植株正常生长。
植物材料在玻璃容器中正常培养2周后,分别进行以下4个处理:T1为甲醛处理,T2弱光处理,T3为甲醛+弱光处理,ck为对照,重复3次·处理-1。T1和T3甲醛处理的方法为在玻璃容器中央悬挂1个脱脂棉球,把1.0 mL体积分数为40%的甲醛溶液滴到脱脂棉球上,甲醛不能下滴,让其挥发,然后玻璃容器的上方用玻璃板和密封圈封好,防止容器内的甲醛挥发出来。T2和T3用遮阳网罩住玻璃容器进行遮光处理,遮光的光照强度是未遮光的1/10。处理4个月后,采样分别测定叶的解剖结构及根、叶的生理生化指标。甲醛的量和弱光的光照强度由预实验确定。
1.3 测定指标及方法
叶片横切结构观察的方法:取成熟叶片用剪刀沿中脉2侧剪成0.5 cm×0.5 cm的小块,置于标准
固定液(FAA)中固定48 h,梯度乙醇逐级脱水,苯胺番红和苯胺固绿对染,二甲苯透明,常规石蜡切片,厚度为8 μm,在Olympus光学显微镜下观察、摄影及测量。
叶表皮气孔观察的方法:上述固定后的叶片小块,置于铬酸-硝酸离析液中离析24 h,用清水洗净,番红染液染色,梯度乙醇脱水,二甲苯透明后制片,在Olympus光学显微镜观察、摄影及测量。
甲醛质量分数的测定参照张书林的方法[11];根系活力的测定采用氯化三苯基四氮唑(TTC)-琥珀酸钠显色法,叶绿素和类胡萝卜素质量分数的测定采用体积分数为96%乙醇提取法,超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光反应法测定,过氧化氢酶活性采用硫酸钛-浓氨水法测定,相对电导率采用电导仪测定法,丙二醛质量摩尔浓度采用硫代巴比妥酸法测定[12]。此外,过氧化物酶活性的测定采用愈创木酚-双氧水显色法,氧自由基产生速率的测定采用对氨基苯磺酸-α-萘胺显色法[13]。
1.4 数据统计分析
场地全部钻孔(CK1-10、ZK1~ZK18)均有揭露,揭露层厚3.10~22.00m,平均厚度14.49m;层顶高程-19.92~-8.55m,层顶深度12.30m~23.40m。
所有数据用统计软件SPSS 19.0在0.05水平上进行单因素方差分析,用Excel 2007制图。
2 结果与分析
2.1 甲醛和弱光对常春藤的叶片解剖结构的影响
表1显示:ck-HN的叶片厚度最大,其次是T1-HN,而最小的是T2-HH,此外,T1,T2及ck的叶片厚度均为中华常春藤大于洋常春藤。ck-HN的栅栏组织厚度显著 (P<0.05)大于其他处理,T1-HN次之,T2-HN,T2-HH,T3-HN和T4-HH则显著(P<0.05)小于其他处理,且T1和ck的栅栏组织厚度均为中华常春藤大于洋常春藤。海绵组织厚度最大的是ck-HN,除T1-HN和T3-HN以外,显著 (P<0.05)大于其他处理,而T2-HH和ck-HH则显著(P<0.05)小于其他处理,且T2和ck的海绵组织厚度均为中华常春藤大于洋常春藤。这说明3种胁迫均会使常春藤叶片厚度和栅栏组织厚度显著(P<0.05)降低;此外,甲醛胁迫显著(P<0.05)增大了洋常春藤的叶片厚度和海绵组织厚度,栅栏组织厚度也有所增加,但差异不显著(P>0.05),而弱光和双重胁迫却使叶片厚度和栅栏组织厚度显著(P<0.05)降低。
从表1可看出:甲醛和弱光处理对常春藤气孔长度、宽度和密度均造成了一定的影响。除T1-HN外,ck-HN和ck-HH的气孔长度和宽度显著(P<0.05)大于其他处理,而T3-HH的气孔长度显著(P<0.05)小于其他处理,T3-HN和T3-HH的气孔宽度也显著(P<0.05)小于其他处理;T1-HN和ck-HN的气孔密度显著(P<0.05)大于其他处理;除T3-HN外,T3-HH的气孔密度则显著(P<0.05)小于其他处理。可见,中华常春藤的气孔长度和气孔宽度均大于洋常春藤,3种胁迫使常春藤气孔的长度、宽度和密度减小,其中双重胁迫减小的幅度最大。
2.2 甲醛和弱光对常春藤甲醛质量分数及根系活力的影响
试验处理4个月后,T1-HN,T1-HH,T3-HN和T3-HH的根系甲醛质量分数在150 μg·g-1以上,叶片的甲醛质量分数在120 μg·g-1以上。其中,根系中T3-HN的甲醛质量分数显著(P<0.05)低于T1-HH和T3-HH,叶片中T3-HH的甲醛质量分数显著(P<0.05)高于T1-HN和T3-HN(图1)。说明加入甲醛后,无论遮光与否,中华常春藤单位组织吸收和积累的甲醛量均低于洋常春藤。T2-HN,T2-HH,ck-HN和ck-HH的根系和叶片甲醛质量分数均在40 μg·g-1以下,其中,根系中T2的甲醛质量分数显著(P<0.05)低
于ck,叶片中T2-HN的甲醛质量分数显著(P<0.05)低于T2-HH,ck-HN和ck-HH。说明在遮光条件下,中华常春藤吸收并积累的甲醛量少于洋常春藤。

表1 甲醛和弱光对常春藤叶片解剖结构的影响Table 1 Effects of formaldehyde and weak light on the anatomy of ivy leaf
图1还显示:与ck相比,各处理的根系活力均显著(P<0.05)下降。其中,除ck以外,T1-HH显著(P<0.05)高于其余各处理,T2-HH的根系活力则最低,差异显著(P<0.05),而T1-HN,T2-HN,T3-HN和T3-HH之间均未达到差异显著(P>0.05)性水平。可见,在甲醛胁迫下,中华常春藤的根系活力弱于洋常春藤,而在弱光照胁迫下,中华常春藤的根系活力强于洋常春藤,但在甲醛和弱光双重胁迫下,两者的差异不显著(P>0.05),且仍能保持一个较高水平。

图1 甲醛和弱光对2种常春藤甲醛质量分数及根系活力的影响Figure 1 Effects of formaldehyde and weak light on formaldehyde content and root activity of ivy
2.3 甲醛和弱光对常春藤叶绿素及类胡萝卜素质量分数的影响
从图2可看出:T1-HH的叶绿素a质量分数最高,且除T2-HH和ck-HH外,显著(P<0.05)高于其他处理,而T2-HH,T3-HN和T3-HH则显著(P<0.05)低于其他处理。T1-HH,T2-HN和ck-HN的叶绿素b质量分数显著(P<0.05)高于其他处理,而除T1-HN外,T2-HH,T3-HN和T3-HH则显著(P<0.05)低于其他处理。除T2-HN和ck-HN外,T1-HH的叶绿素a+b质量分数显著(P<0.05)高于其他处理,而除T3-HN外,T3-HH则显著(P<0.05)低于其他处理。T3-HN和T3-HH的类胡萝卜素质量分数显著(P<0.05)高于其他处理,而其他处理间则差异不显著(P>0.05)。可见,单独甲醛处理一方面可显著(P<0.05)增加洋常春藤叶绿素b和叶绿素a+b的质量分数,另一方面使中华常春藤的叶绿素质量分数显著(P<0.05)低于洋常春藤;弱光下显著(P<0.05)降低了洋常春藤的叶绿素质量分数,而对中华常春藤的影响不大;但在甲醛和弱光双重胁迫下,2种常春藤的叶绿素质量分数显著(P<0.05)降低,类胡萝卜素质量分数显著(P<0.05)上升。
2.4 甲醛和弱光对常春藤超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的影响
除T1-HN和T3-HH外,T1-HH和T3-HN根系的SOD活性显著(P<0.05)高于其他处理,而除T3-HH外,ck-HN和ck-HH则显著(P<0.05)低于其他处理;T1-HN和T1-HH叶片的SOD活性显著(P<0.05)高于ck-HN和ck-HH,而与其他处理的差异不显著(P>0.05)。ck-HN和ck-HH的根系POD活性显著(P<0.05)高于其他处理,而除T2-HH外,T2-HN叶片POD活性显著(P<0.05)高于其他处理;此外,对照(ck)叶片POD活性显著(P<0.05)高于T3,T3又显著(P<0.05)高于T1(图3)。可见,无论甲醛还是弱光胁迫,均能提高常春藤叶片和根系的SOD活性,相对而言,甲醛处理提高的幅度更大;此外,甲醛处理使常春藤POD活性显著(P<0.05)降低,弱光处理却不同程度地提高常春藤叶片POD活性。可见,甲醛有利于提高洋常春藤SOD和POD活性,而弱光处理则有利于提高中华常春藤的这2种酶的活性。
2.5 甲醛和弱光对常春藤过氧化氢质量摩尔浓度及氧自由基产生速率的影响
从图4可看出:T2-HN根系的过氧化氢质量摩尔浓度显著(P<0.05)高于其他处理,而ck-HN和ck-HH则显著(P<0.05)低于其他处理;T3-HN和T3-HH叶片的过氧化氢质量摩尔浓度显著(P<0.05)高于其他处理,而T1-HN,T2-HH,ck-HN和ck-HH则显著(P<0.05)低于其他处理。图4还显示:根系氧自由基产生速率最高的是T3-HN,显著(P<0.05)高于T1-HN,T2-HH,ck-HN和ck-HH,而除ck-HN外,
ck-HH显著(P<0.05)低于其他处理;T1-HN和T3-HN叶片氧自由基产生速率相对较高,而T2-HN和ck-HN的产生速率则相对较低,两者差异显著(P<0.05)。可见,单独甲醛处理后,中华常春藤的过氧化氢质量摩尔浓度显著(P<0.05)高于洋常春藤,而单独弱光照处理的效果则与之相反。
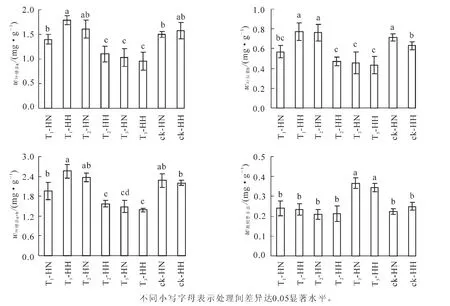
图2 甲醛和弱光对常春藤叶绿素及类胡萝卜素质量分数的影响Figure 2 Effects of formaldehyde and weak light on the content of chlorophyll and carotenoid in ivy
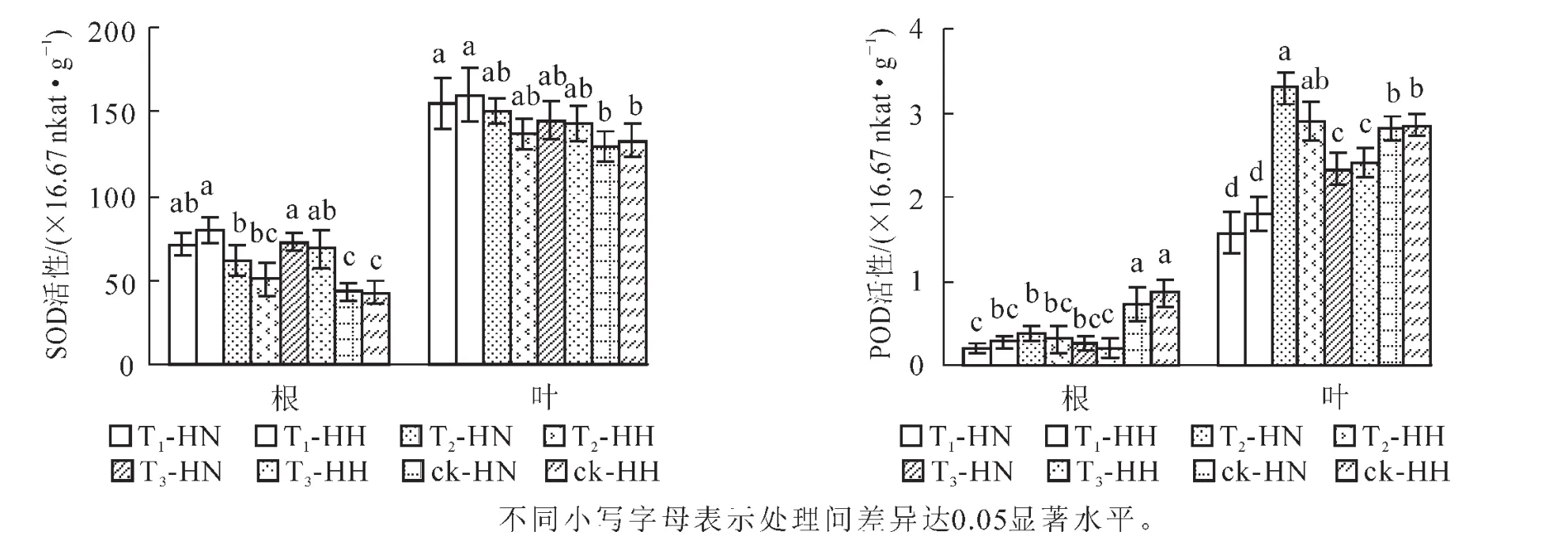
图3 甲醛和弱光对常春藤SOD和POD活性的影响Figure 3 Effects of formaldehyde and weak light on the activities of SOD and POD in ivy
2.6 甲醛和弱光对常春藤相对电导率及丙二醛(MDA)质量摩尔浓度的影响
从图5可看出:T1-HN,T2-HH和T3-HH根系的相对电导率显著(P<0.05)高于ck-HN和ck-HH;T1-HH,T2-HN,T3-HH根系的相对电导率也显著(P<0.05)高于ck-HH。T1-HH叶片的相对电导率最高,T3-HH次之,两者显著(P<0.05)高于其他处理。图5还显示:ck-HN和ck-HH根系的MDA质量摩尔浓度显著(P<0.05)低于其他处理,而T1-HN,T1-HH,T2-HH,T3-HN则显著(P<0.05)高于其他处理;T1-HN叶片MDA质量摩尔浓度显著(P<0.05)高于其他处理,而除T2-HN外,ck-HN和ck-HH则显著(P<0.05)低于其他处理。可见,甲醛和弱光均可使常春藤的相对电导率和MDA质量摩尔浓度增大;总体而
言,甲醛胁迫下中华常春藤根系和叶片的这2项指标均高于洋常春藤,在弱光下则相反,而在双重胁迫下相对电导率接近单独胁迫的高值或居中。

图4 甲醛和弱光对常春藤过氧化氢质量摩尔浓度及氧自由基产生速率的影响Figure 4 Effects of formaldehyde and weak light on hydrogen peroxide content and oxygen free radical production rate in ivy

图5 甲醛和弱光对常春藤相对电导率及丙二醛质量摩尔浓度的影响Figure 5 Effects of formaldehyde and weak light on relative electrical conductivity and MDA content in ivy
3 结论与讨论
植物表型可塑性是由于环境变化引起基因表达的变化从而产生不同的表型,是植物对环境变化的重要适应[14]。植物叶器官受环境影响较大,通过对中华常春藤和洋常春藤进行长达4个月的甲醛和弱光处理培养,2种常春藤的叶片解剖结构均发生了较大的变化,主要表现在甲醛和弱光处理使叶片厚度、栅栏组织厚度减小,其中弱光处理的减小幅度最大。气孔是植物与环境之间气体交换的通道,空气中的各种污染物主要通过气孔进入植物组织,气孔在叶肉组织与大气之间构成了一个可变的扩散阻力,调控气体的吸收,气孔开度缩小或关闭可增强植物对大气污染的抗性[15]。从本研究结果来看,甲醛和弱光处理均使常春藤的气孔长度、宽度和密度降低,其中弱光和双重处理下降达到差异显著(P<0.05)性水平;中华常春藤的气孔长度、宽度和密度在各处理下均大于洋常春藤,但结合植物体内的甲醛质量分数来看,甲醛处理后洋常春藤根系和叶片的甲醛质量分数高于中华常春藤。可见,尽管在甲醛和弱光下,常春藤叶片解剖结构发生了一系列的变化响应,但对逆境的抵抗能力更多还是通过生理生化调控来实现的。
甲醛和弱光胁迫均是影响植株生长发育和光合作用的逆境因素。甲醛胁迫可使植物的叶绿素质量分数降低[16],原因是甲醛胁迫下,抗氧化酶系统清除氧自由基能力降低,引起细胞膜脂过氧化,丙二醛不断积累,从而破坏了叶绿体的膜系统,叶绿素降解且质量分数大幅降低[10]。从高光环境到低光环境,植物所能获得的光量减少。为了更有效地捕获光能,植物会相应地增加叶内的叶绿素质量分数[17]。生长在
弱光环境下的植物,叶绿素质量分数增加使其能够充分吸收光合有效辐射[18],但光照太弱也不利于叶绿素的合成。从本研究来看,甲醛胁迫下中华常春藤的叶绿素a,叶绿素b和叶绿素a+b质量分数均下降,而洋常春藤则明显上升,说明甲醛对洋常春藤叶绿素合成有促进作用;另一方面,在弱光下中华常春藤的叶绿素a,叶绿素b和叶绿素a+b质量分数均上升,而洋常春藤则显著(P<0.05)下降,说明中华常春藤对弱光的适应性更强;此外,在甲醛和弱光双重胁迫下,2种常春藤的叶绿素a,叶绿素b和叶绿素a+b质量分数均显著(P<0.05)下降,类胡萝卜素质量分数则显著(P<0.05)上升,说明双重胁迫对2种常春藤均产生了较大的影响。
通过CAT,POD和SOD活性的动态变化研究发现,弱光下CAT,POD及SOD活性相对处于较低的状态,说明当活性氧产生速率较低时,保护酶活性也处于一个相对较低的状态[19]。植物体内积累了过量活性氧自由基可引发膜脂过氧化,MDA是膜脂过氧化的主要产物之一,其大量积累是活性氧伤害作用的表现。细胞膜通透性的大小可作为植物对不良环境胁迫的一个指标[20]。研究发现,弱光下2种常春藤根系和叶片中的SOD活性下降,而根系中的POD活性也下降,叶片中则上升;弱光下根系的过氧化氢质量摩尔浓度、氧自由基产生速率和相对电导率显著(P<0.05)上升,而叶片差异不大;此外,弱光还显著(P<0.05)增加了根系和叶片的MDA质量分数。甲醛胁迫可破坏植物细胞膜,使其透性增大,渗透物质外流。本研究中2种常春藤的细胞膜透性在甲醛胁迫下均增大,这与刘栋等[21]的研究结果相同。在甲醛胁迫下,2种常春藤根系和叶片的SOD活性、过氧化氢质量摩尔浓度、氧自由基产生速率和MDA质量分数上升,POD活性显著(P<0.05)降低,这与令狐昱慰等[10]的研究结果基本一致。同时,本研究结果还发现,甲醛和弱光双重胁迫使2种常春藤根系和叶片的SOD活性、氧自由基产生速率、过氧化氢和MDA质量分数上升,而POD活性显著(P<0.05)降低。
从本研究结果来看,中华常春藤对弱光的适应性强于洋常春藤,而洋常春藤对甲醛的抗性强于中华常春藤,且洋常春藤单位组织吸收的甲醛量大于中华常春藤。此外,甲醛和弱光双重胁迫下虽然对2种常春藤的生长生理均造成较大的伤害,但2种常春藤在叶片解剖和生理生化方面做出积极响应去适应这些逆境胁迫。
[1] BAZZAZ F A.Plants in Changing Environments:Linking Physiological,Population,and Community Ecology[M]. Cambridge:Cambridge University Press,1996.
[2] CALLAHAN H S,PIGLIUCCI M.Shade-induced plasticity and its ecological significance in wild populations of Arabidopsis thaliana[J].Ecology,2002,83(7):1965-1980.
[3] 陈雄,吴冬秀,王根轩,等.CO2浓度升高对干旱胁迫下小麦光合作用和抗氧化酶活性的影响[J].应用生态学报, 2000,11(6):881-884.
CHEN Xiong,WU Dongxiu,WANG Genxuan,et al.Effect of elevated CO2concentration on photosynthesis and antioxidative enzyme activities of wheat plant grown under drought condition[J].Chin J Appl Ecol,2000,11(6):881-884.
[4] 何维明,钟章成.攀援植物绞股蓝幼苗对光照强度的形态和生长反应[J].植物生态学报,2000,24(3):375-378.
HE Weiming,ZHONG Zhangcheng.Morphological and growth responses of the climbing plant,Gynostemma pentaphllum seedlings to varying light intensity[J].Acta Phytoecol Sin,2000,24(3):375-378.
[5] 朱天乐.室内空气污染控制[M].北京:化学工业出版社,2003:46-47.
[6] 刘艳丽,陈能场,周建民,等.观赏植物净化室内空气中甲醛的研究进展[J].工业催化,2008,16(9):6-11.
LIU Yanli,CHEN Nengchang,ZHOU Jianmin,et al.Researches in the removal of formaldehyde from indoor air by ornamental plant[J].Ind Catalys,2008,16(9):6-11.
[7] 曹永慧,周本智,陈双林.弱光下水分胁迫对不同产地披针叶茴香幼苗生理特性的影响[J].生态学报,2014,34(4):814-822.
CAO Yonghui,ZHOU Benzhi,CHEN Shuanglin.Effects of water stress on physiological characteristics of different illicium lanceolatum ecotypes under low light intensity[J].Acta Ecol Sin,2014,34(4):814-822.
[8] 孟雅宁,严立斌,范妍芹.低温弱光下甜(辣)椒3种酶活性的变化及其耐受性研究[J].河北农业科学,2014,18(6):21-24,85.
MENG Yaning,YAN Libin,FAN Yanqin.Research on changes of three enzymes activities of sweet(hot)pepper under low temperature and poor light and the tolerance[J].J Hebei Agric Sci,2014,18(6):21-24,85.
[9] 轩秀霞,肖素勤,游览,等.常春藤代谢气体甲醛中间产物及甲醛胁迫下叶片相关生理特性变化分析[J].生命科学研究,2013,17(2):125-135.
XUAN Xiuxia,XIAO Suqin,YOU Lan,et al.The analysis of the intermediates for formaldehyde metabolism and physiological changes under gaseous formaldehyde stress in Hedera helix[J].Life Sci Res,2013,17(2):125-135.
[10] 令狐昱慰,黎斌,李思锋,等.3种观赏植物对室内甲醛污染的净化及生长生理响应[J].西北植物学报,2011, 31(4):776-782.
LINGHU Yuwei,LI Bin,LI Sifeng,et al.Monitoring,purification and response of three indoor ornamental plants on formaldehyde pollution[J].Acta Bot Boreal-Occident Sin,2011,31(4):776-782.
[11] 张书林.间苯三酚比色法测定微量甲醛研究[J].环境工程,2005,23(4):77-79.
ZHANG Shulin.Study on the methods for determining trace formaldehyde by phloroglucinol[J].Environ Eng,2005, 23(4):77-79.
[12] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[13] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14] MACDONALD S E,CHINNAPPA C C,REID D M.Evolution of phenotypic plasticity in the Stellaria longipes complex:Comparisons among cytotypes and habitats[J].Evolution,1988,42(5):1036-1046.
[15] 邸葆,陈段芬,果秀敏,等.几种花卉叶片的组织结构对其抗甲醛能力的影响[J].北方园艺,2007(10):122-124.
DI Bao,CHEN Duanfen,GUO Xiumin,et al.Effect of leaf structure on the formaldehyde-resistance capacity in five ornamental plants[J].Northern Hortic,2007(10):122-124.
[16] 肖健,吴思政,聂东伶,等.甲醛胁迫对3种室内观赏植物的生理生化影响[J].湖南林业科技,2012,39(2):45-48.
XIAO Jian,WU Sizheng,NIE Dongling,et al.Effects of formaldehyde stress on physiology and biochemistry of three ornamental plants[J].J Hunan For Sci Technol,2012,39(2):45-48.
[17] 郭晋平,李海波,刘宁,等.华北落叶松和白杄幼苗对光照和竞争响应的差异比较[J].林业科学,2009,45(2): 53-59.
GUO Jinping,LI Haibo,LIU Ning,et al.Comparison of responses of Larix principis-rupprechtii and Picea meyeri seedling growth to light availability and planting density under controlled environment[J].Sci Silv Sin,2009,45(2): 53-59.
[18] 李潮海,栾丽敏,尹飞,等.弱光胁迫对不同基因型玉米生长发育和产量的影响[J].生态学报,2005,25(4):824-830.
LI Chaohai,LUAN Limin,YIN Fei,et al.Effects of light stress at different stages on the growth and yield of different maize genotypes(Zea mays L.)[J].Acta Ecol Sin,2005,25(4):824-830.
[19] 晁天彩,周守标,常琳琳,等.光照强度对大花旋蒴苣苔叶形态和生理指标的影响[J].生态学杂志,2013,32(5):1161-1167.
CHAO Tiancai,ZHOU Shoubiao,CHANG Linlin,et al.Effects of light intensity on the leaf morphology and physiological parameters of Boea clarkeana[J].Chin J Ecol,2013,32(5):1161-1167.
[20] CHU Ling,LIU Dengyi,WANG Youbao,et al.Separate and combined effects of Cu and Cd on seedling growth and active oxygen metabolism system of Trifolium repens L.[J].Front Biosci,2006,11(11):2861-2867.
[21] 刘栋,史宝胜,魏文欣.甲醛气体胁迫对3种观赏植物的形态及部分生理指标的影响[J].河北农业大学学报, 2011,34(2):66-70.
LIU Dong,SHI Baosheng,WEI Wenxin.Effect of formaldehyde gas stress on morphology and partial physiological indexes of three ornamental plants[J].J Agric Univ Hebei,2011,34(2):66-70.
Anatomical structure and physiological characteristics of ivy with formaldehyde and weak light stress
ZHANG Yongfu1,MO Liling1,NIU Yanfen1,XIA Tiyuan1,WANG Dingkang1,GENG Kaiyou2
(1.School of Agriculture,Kunming University,Kunming 650214,Yunnan,China;2.Office of Science Research, Kunming University,Kunming 650214,Yunnan,China)
To determine the effects of formaldehyde and weak light stress on anatomical and physiological characteristics of two species of ivy(Hedera helix and Hedera nepalensis)with their adaptability,potted seedlings were used as experimental materials.Sealed glass containers held three stress treatments of formaldehyde,weak light,and formaldehyde+weak light,and a control.After four months of treatment,the anatomical structure of leaves,the physiological and biochemical indexes of roots and leaves were measured.Results for H.helix showed that with formaldehyde and with weak light stress,palisade tissue thickness,length and width of stomata decreased significantly (P<0.05);whereas spongy tissue thickness increased with formaldehyde stress,and spongy tissue density increased with weak light.However,for H.nepalensis and stress,thickness of the leaf, palisade tissue,and spongy tissue;and the length,width,and density of stomata all decreased.For both ivies, root vigor with all stresses decreased significantly (P<0.05).With formaldehyde and formaldehyde+weak light stresses,formaldehyde content of H.helix was higher than H.nepalensis.Also,with formaldehyde stress, chlorophyll content in H.nepalensis decreased,but it increased with weak light which was contrary to H.helix.
botany;Hedera spp.;formaldehyde stress;weak light stress;anatomic structure;physiological response
S718.4
A
2095-0756(2016)06-1017-08
2015-12-17;
2016-01-25
云南省高校优势特色重点学科(生态学)建设项目资助;昆明学院引进人才科研项目(YJL11030)。
张永福,副教授,博士,从事植物抗性生理研究。E-mail:123017360@qq.com。通信作者:王定康,教授,博士,从事植物生理及繁殖生物学等研究。E-mail:wdk117@163.com
10.11833/j.issn.2095-0756.2016.06.013
In addition,with the formaldehyde+weak light stress treatment,chlorophyll content in both ivies decreased significantly(P<0.05),but carotenoid content increased significantly(P<0.05).In both ivies with the weak light treatment,superoxide dismutase(SOD)activity of roots and leaves decreased,and with formaldehyde and double stress the SOD activity in roots and leaves along with peroxidase(POD)activity in roots decreased significantly(P<0.05).Finally,for both ivies with all stresses,hydrogen peroxide,malondialdehyde(MDA),relative electrical conductivity,and the oxygen free radical generation rate increased.Thus,the adaptability of H. nepalensis to weak light was stronger than H.helix,but the resistance to formaldehyde was contary.[Ch,5 fig.1 tab.21 ref.]
