甘露糖对免疫性肝损伤小鼠的保护作用
2016-12-09谭建扬宋梦楠李晓斐
谭建扬,宋梦楠,丁 虹,李晓斐
(武汉大学药学院,湖北武汉 430072)
甘露糖对免疫性肝损伤小鼠的保护作用
谭建扬,宋梦楠,丁 虹,李晓斐
(武汉大学药学院,湖北武汉 430072)
目的:研究甘露糖对卡介苗与脂多糖(Bacillus Calmette-Guérin,BCG/lipopolysaccharides,LPS)诱导的小鼠免疫性肝损伤的保护作用及作用机制。方法:将小鼠随机分成正常组、模型组、甘露糖低剂量组(20 mg/kg)、甘露糖高剂量组(100 mg/kg),采取BCG联合LPS诱导小鼠肝损伤。取肝脏、脾脏、胸腺,测定脏器指数。用试剂盒的方法分别检测各组小鼠血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)活力,丙二醛(malonic dialdehyde,MDA)、一氧化氮(NO)、肿瘤坏死因子(tumor necrosis factor,TNF-α)、细胞白介素(interleukin-β,IL-β)含量及超氧化物歧化酶(superoxide dismutase,SOD)与过氧化氢酶(catalase,CAT)活力,并取肝组织病理切片观察。结果:与模型组相比,甘露糖可以显著降低脾脏、胸腺指数、血清ALT、AST活性以及显著提高TNF-α、IL-β、MDA、NO含量(p<0.05)和SOD、CAT活力(p<0.05)。其中甘露糖高剂量组(100 mg/kg)保护免疫性肝损伤的效果更好,趋近于正常组。结论:甘露糖对BCG/LPS诱导的小鼠免疫性肝损伤有很好的保护作用。
甘露糖,甘露糖受体,免疫性肝损伤,卡介苗,脂多糖,保肝
我国作为肝炎发生率高的国家,数据调查显示,全球约20亿人曾感染过HBV,其中3.5亿人为慢性HBV感染者[1],大部分患者的肝有纤维化或硬化的趋势,其中少部分甚至会转变为肝癌[2]。机体的异常免疫应答是肝细胞损伤的重要原因[3,4],且免疫复合物又是引起肝外损伤的主要因素,因此免疫反应在肝损伤的发生发展过程中发挥着关键作用。
甘露糖是目前仅有的一种用于临床上的糖质营养素[5]。它广泛的分布机体的神经、肝[6]、睾丸、视网膜和肠。甘露糖能被机体直接用于糖蛋白的合成,有调节免疫系统、增加伤口愈合、抗发炎等生理作用。此外也有相关文献报道,甘露糖可以抑制巨噬细胞的炎症,保护脂多糖诱导的大鼠急性肺损伤[7]。甘露糖受体属于C型凝集素超家族[8],它可以与特定的糖类分子相结合,从而挥发识别病原体、递呈抗原、保持内环境稳定的作用[9-10]。本研究采用的BCG/LPS联合诱导小鼠免疫性肝损伤模型,其在病理变化和病理生理机制上与人类肝炎相似[10,14],主要表现为巨噬细胞、枯否细胞大量聚集在肝脏并致敏[15]。致敏的巨噬细胞进一步被LPS激活而释放包括氧自由基、NO、白介素等细胞毒性介质,从而激活了凋亡通路、诱导氧化应激等生物效应导致肝细胞损伤[16-17]。基于以上考虑,本研究利用BCG/LPS致小鼠肝损伤模型[11-12],探讨了甘露糖对免疫性肝损伤的保护作用及可能作用机制。
1 材料与方法
1.1 材料与仪器
甘露糖 郑州郑亚化工产品有限公司,纯度99%;40只昆明种HM小鼠 体重(20±2) g,雌性,购自湖北省实验动物研究中心,动物合格证号:42000600010207;卡介苗 卫生部上海生物箭晶研究所;谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST),丙二醛(malonic dialdehyde,MDA)、一氧化氮(NO)、肿瘤坏死因子(tumor necrosis factor,TNF-α)、细胞白介素(interleukin-β,IL-β)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;脂多糖 美国Sigma公司。
UV-102-02FW紫外可见分光光度计 日本岛津公司;2032自动柱层析仪 瑞典LKB公司;XK/1216半自动生化分析仪 四川旭康医疗电器有限公司;HPIAS系列高清晰度彩色病理图文分析系统 华海医疗信息技术股份有限公司。

表2 小鼠肝、脾脏、胸腺指数(n=10)
1.2 实验方法
1.2.1 小鼠免疫性肝损伤模型的建立 将40只小鼠随机分成4个组(各组体重无显著差异),分别为正常组、BCG/LPS肝损伤模型组、甘露糖低剂量组(20 mg/kg)、甘露糖高剂量组(100 mg/kg),每组10只。造模第1 d[13],模型组、甘露糖高、低剂量组小鼠均通过尾静脉注射BCG2.5 mg/0.2 mL只致敏,正常组小鼠注射等量的生理盐水。3 h后,甘露糖高、低剂量组分别灌胃甘露糖20、100 mg/kg bw,正常组、模型组灌胃等量生理盐水,连续给药15 d,最后1次给甘露糖后,除正常组外,各组经尾静脉注射LPS 7.5 μg/0.2 mL/只,诱导小鼠肝损伤(甘露糖对小鼠体重无显著影响)。
1.2.2 肝脏、脾脏、胸腺指数的测定 将小鼠经尾注射LPS 16 h后,采用眼眶取血的方法采集血液。完成采血后立即处死小鼠,并解剖取出其肝脏、脾脏、胸腺于4 ℃生理盐水中洗净,待滤纸拭干后,于天平称重,记录,并按以下公式计算肝脏、脾脏、胸腺指数。
1.2.3 生化指标检测 将采集的血液进行分离,取其血清,按照试剂盒说明书分别测定血清中的ALT、AST活力。取肝脏右叶组织,剔除结缔组织,于4 ℃生理盐水中洗净,滤纸拭干后,按1∶9(W/V)的生理盐水比例制备肝匀浆[7],遵照试剂盒使用说明书的方法,分别测定肝组织中MDA、NO、TNF-α、IL-β的含量及SOD、CAT活力。
1.2.4 组织病理学检查 取肝脏左叶组织于10%中性福尔马林中固定。制备病理切片并用HE染色后,于光镜下对肝组织切片的组织病理学变化进行观察。

2 结果与分析
2.1 甘露糖对BCG/LPS致肝损伤小鼠体重的影响
小鼠随机分组时,模型组和正常组,甘露糖高、低剂量组与模型组之间体重均无显著性差异。连续给予甘露糖15 d后,与模型组比较,甘露糖低剂量组体重显著减低((p<0.01),甘露糖高剂量组体重无显著性差异,表明甘露糖高剂量可能有利于维持体重的正常。

表1 小鼠体重(n=10)
注:与正常组相比,#p<0.05,##p<0.01;与模型组相比,*p<0.05,**p<0.01;表2~表6。
2.2 甘露糖对BCG/LPS致肝损伤小鼠肝脏、脾脏、胸腺指数的影响
表2中实验数据显示,与正常组相比,免疫性肝损伤模型组的脾脏指数和胸腺指数均显著提高(p<0.05),说明造模成功。与模型组相比,甘露糖高、低剂量组均可抑制三者的升高,并显示出效果逐渐增强的趋势,特别是甘露糖高剂量组能够显著减低脾脏和胸腺指数(p<0.05)。
2.3 甘露糖对BCG/LPS致肝损伤小鼠血清中ALT、AST活性的影响
表3中实验数据显示,模型组的小鼠血清中ALT活性显著地高于正常对照组(p<0.05),AST活性极显著高于正常对照(p<0.01),说明造模成功。与模型组相比,甘露糖高剂量组ALT、AST活性下降均达显著水平(p<0.05),且数值接近正常组的水平;甘露糖低剂量组ALT活性也下降到显著水平(p<0.05),AST活性呈幅度下降。

表3 小鼠血清中ALT、AST的活性(n=10)
2.4 甘露糖对BCG/LPS致肝损伤小鼠血清中MDA、NO含量和SOD、CAT活性的影响
由表4、5可知,正常组与模型组的MDA、NO含量和SOD、CAT活性差异显著(p<0.01~0.05),进一步说明本实验的造模成功。高剂量甘露糖组MDA含量较模型组存在极显著差异(p<0.01)。同时,SOD、CAT活性呈现显著上升且趋近正常组水平,NO含量显著下降(p<0.05)。低剂量甘露糖组对BCG/LPS致肝损伤小鼠血清中的MDA含量和SOD、CAT活力均无改善现象。

表4 小鼠血清中MDA、NO的含量(n=10)
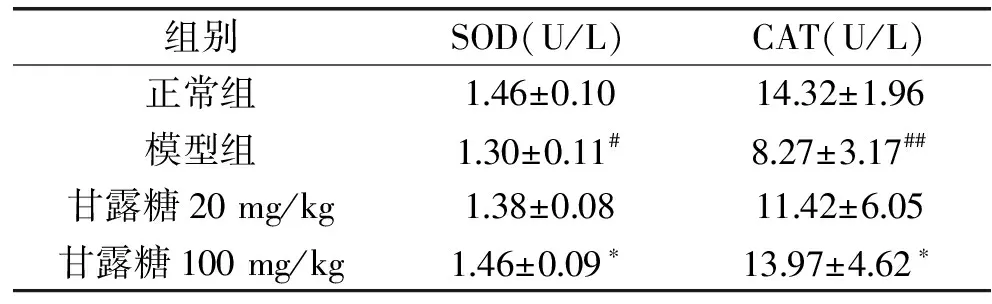
表5 小鼠血清中SOD、CAT的活力(n=10)
2.5 甘露糖对血清中TNF-α和IL-β含量的影响
表6中实验数据显示,与正常组相比,免疫性肝损伤模型组的TNF-α、IL-β的含量均极显著提高(p<0.01),说明造模成功。与模型组相比,甘露糖高低剂量组均可降低二者的含量,并随浓度的增加而增强,特别是甘露糖高剂量组能够显著减低TNF-α、IL-β的含量(p<0.05)。

表6 小鼠肝组织中TNF-α、IL-β的含量(n=10)
2.6 肝组织病理学检查
由图1可见,正常组小鼠的肝组织结构完整,肝小叶、肝索结构正常,间质无炎细胞浸润,细胞未见脂肪变性和玻璃样变;模型组肝细胞局部坏死明显,并有较多炎细胞浸润,脂肪变性和玻璃样变;甘露糖低剂量组存在少量炎性细胞浸润,无明显细胞坏死;甘露糖高剂量组,形态较为正常,仅极少量细胞有玻璃样变。随甘露糖剂量的增大,对肝脏的保护作用也随之增强,其中高剂量的甘露糖对肝脏具有较好的保护作用。

图1 甘露糖对BCG/LPS致肝损伤小鼠肝组织病理学变化的影响(100X)Fig.1 Effect of mannose on histopathology of liver of mouse injured by BGC+LPS
3 结论与讨论
据有关研究,LPS可以诱导巨噬细胞产生自由基,对肝细胞造成过氧化损伤,使得肝组织中的滑面内质网和CYP450酶系遭到破坏[18]。胞膜通透性改变,会引起原细胞内容物浓度的失衡,引发肝细胞损伤、坏死。ALT、AST是肝细胞浆内的两种可溶性酶,通过血清中ALT、AST含量的高低反映肝细胞损伤程度。机体细胞受氧自由基攻击的严重程度可以通过MDA的含量高低来间接反映,机体清除氧自由基保护细胞不受损伤的能力可以以SOD活力的高低来体现[19]。肝细胞也可以经特异性细胞因子及LPS协同诱导,持续产生大量的NO,介导多种病理生理效应。
另外阅读文献可知,肝损伤的模型中介导肝损伤的主要介质是TNF-α,它促使如NO、IL-1、IL-6等与肝坏死有关的介质生成,IL-1等又增强了TNF-α的肝损伤作用,所以即使少量存在TNF-α,宿主也会发生组织损伤[20]。甘露糖能抑制TNF-α和IL-βmRNA的合成和炎症因子蛋白的释放,且其抗炎效应可以通过甘露糖受体(mannose receptor,MR)实现[8]。由此我们可以推测甘露糖对免疫性肝损伤的保护可能与MR有关。
本研究结果表明,与模型组比较,甘露糖高剂量组(100 mg/kg)对小鼠血清ALT、AST有明显的降低作用,对肝细胞具有保护作用;也可以减少MDA和NO的含量并提高SOD、CAT的活力,说明甘露糖可直接清除体内过剩自由基和脂质过氧化物,或者增强SOD活力增强抗氧化作用,有效防止或减轻自由基导致的氧化损伤,增强免疫。通过肝脏指数与病理切片也证实了甘露糖对肝细胞的保护作用。我们也对TNF-α和IL-β的含量进行检测以此探究甘露糖保护免疫性肝损伤的机制,实验结果证明甘露糖高低剂量组的TNF-α和IL-β含量都明显低于模型组。
综上甘露糖对免疫性肝损伤小鼠具有较好的保护作用,其作用机制可能是甘露糖与MR结合后,MR参与受体介导的吞噬作用和内吞作用来抑制TNF-α、IL-β的释放,进而保护肝细胞,具体机制还需进一步探究。
[1]丁善龙,王杰,鲁凤民. 乙型肝炎研究及我国防治现状[J]. 传染病信息,2013,26(6):369-372.
[2]程启闰,方海明,李芳群,等. 贯叶连翘提取物对小鼠急性免疫性肝损伤的保护作用[J]. 安徽医科大学学报,2015,50(4):477-480.
[3]Herkel J,Schuchmann M,Tiegs G,et al. Immune-medicated liver injury[J]. J Hepatol,2005,42(6):920-923.
[4]Della Corte C,Sartorelli MR,Comparcola D,et al. Autoimmune liver diseases[J]. Minerva Pediatr,2012,64(6):595-606.
[5]魏欢平,李翠,罗罡,等. 铁皮石斛不同阶段多糖和甘露糖含量研究[J]. 安徽农学通报,2014,20(20):29-31.
[6]郭林娜,高恒宇,何苗,等. 甘露糖受体在肝细胞癌中的表达及意义[J]. 世界华人消化杂志,2016,24(1):37-43.
[7]徐旋里. 甘露糖对急性肺损伤的保护作用及其通过甘露糖受体抑制脂多糖诱导的巨噬细胞炎症[D]. 杭州:浙江大学,2008.
[8]张培,周建英,徐旋里. 甘露糖受体与临床相关性研究进展[J]. 国际病理科学与临床杂志,2013,33(4):361-364. DOI:
10.3969/j.issn.1673-2588.2013.04.017
[9]刘小玲,曾令兵. 甘露糖受体结构、功能、表达和应用研究的新进展[J]. 水产学杂志,2013,26(1)54-59.
[10]Wang GS,Liu GT. Role of nitric oxide in immunological liver damage in mice[J]. Biochem pharmacol,1995,49(9):1277-81.
[11]Zhang NN,Huang NY,Zhou XK,et al. Protective effects of IL-4 on Bacillus Calmette-Guerin and lipopolysaccharide induced immunological liver injury in mice[J]. Inflamm Res,2012,61(1):17-26.
[12]Jiang C,Jiao Y,Chen X,et al. Preliminary characterization and potential hepatoprotective effect of polysaccharides from Cipangopaludina chinensis[J].Food Chem Toxicol,2013,59():18-25.
[13]石燕玲,何慧,张胜. 灵芝肽对免疫性肝损伤小鼠的保护作用[J]. 食品科学,2008,29(6):415-418.
[14]王根生,刘耕陶. 一氧化氮在小鼠肝损伤中的作用[J]. 中华医学杂志,1996,76(3):203-6.
[15]Ferluga J,Allison AC. Role of mononuclear infiltrating cells in pathogenesis of hepatitis[J]. Lancet,1978,312(8090):610-611.
[16]Calvo JR,Reiter RJ,Garcia JJ. Characterization of the protective effects of metalonin and related indoles against alpha-naphthyl isothiocyanate-induced liver injury in rats[J]. J Cell Biochem,2001,80(4):461-470.
[17]李天一,汪丽佩,吴国琳. 黄芪多糖对免疫性肝损伤小鼠免疫调节的影响[J]. 中国中医急症 2014,23(1):25-27.
[18]Nicoletti F,Beltrami B,et al. Protection from concanavalin A(Con A)-induced T cell-dependent hepatic lesions and modulation of cytokine release in mice by sodium fusidate[J]. Clin Exp Immuol,1997,110(3):479-484.
[19]陈方军,李俊,王佳佳. 玉屏风多糖对小鼠化学性肝损伤的影响[J]. 安徽医科大学学报,2011,46(1):49-52.
[20]李晶媛,李树臣,杨维良. TNF-α诱导肝细胞凋亡机制的回顾与展望[J]. 世界华人消化杂志,2007,15(6):606-611.
Hepatoprotective effects of mannose on immunological liver injury in mice
TAN Jian-yang,SONG Meng-nan,DING Hong*,LI Xiao-fei*
(School of Pharmaceutical Science,Wuhan University,Wuhan 430072,China)
Objective:The hepatoprotective effects of mannose and possible mechanism were researched on BCG/LPS-induced immunological liver injury in mice. Method:Mice were divided into four groups,namely control,model and two mannose-treated groups. BCG and LPS were used to induce the immunity hepatic injury model of mice in the experiment. Blood,liver and organs were sampled for detection of biochemical and immunological index,and the pathological changes of liver. Results:The index of liver,spleen and thymus,ALT/AST activities in serum and NO/MDA/TNF-α/IL-βlever in serum from the mannose group significantly lower than model group’s. Mannose significantly reduces of SOD and CAT activity in liver(p<0.05). The dose of 100 mg/kg bw mannose hepatoprotective had the best effectand the index was close to blank group. Conclusion:Mannose has hepatoprotective effects against BCG/LPS-induced liver damage in mice.
mannose;mannose receptor;immunological liver damage;Bacillus Calmette-Guérin(BCG);lipopolysaccharides(LPS);hepatoprotective effect
2016-03-11
谭建扬(1994-),男,本科,研究方向:药理毒理学,E-mail:2013302290006@whu.edu.cn。
*通讯作者:丁虹(1964-),女,博士,教授,博士生导师,研究方向:神经药理学,E-mail:dinghong1106@whu.edu.cn。
TS201.4
A
1002-0306(2016)20-0000-00
10.13386/j.issn1002-0306.2016.20.000
李晓斐(1993-),女,硕士,研究方向:药理毒理学,E-mail:13080664601@163.com。
