实时荧光定量PCR检测畜禽肉制品中鸭源性成分
2016-12-09林彦星张彩虹阮周曦刘建利廖立珊杨俊兴吕建强花群义曹琛福
林彦星,张彩虹,阮周曦,刘建利,宗 卉,廖立珊,孙 洁,杨俊兴,吕建强,花群义,曹琛福
(深圳出入境检验检疫局,广东深圳 518045)
实时荧光定量PCR检测畜禽肉制品中鸭源性成分
林彦星,张彩虹,阮周曦,刘建利,宗 卉,廖立珊,孙 洁,杨俊兴,吕建强,花群义,曹琛福*
(深圳出入境检验检疫局,广东深圳 518045)
根据鸭mtDNA COX基因上的保守序列设计特异性引物和TaqMan探针,建立实时荧光定量PCR用于检测畜禽肉制品中的鸭源性成分。结果表明,建立的方法特异性强,与鹅、鸡、羊、牛等15种动物DNA无非特异性扩增;灵敏度高,可检测1.0 pg/μL鸭源DNA的存在;重复性好,同DNA浓度所测得Ct值的变异系数均小于3%;应用该法对模拟混合样品进行检测,结果与预期相符,且常见肉类DNA的存在并不影响该法对鸭源性成分检测的灵敏度。说明本试验建立的鸭源性成分实时荧光定量PCR法特异、敏感、稳定,可快速准确检测畜禽肉制品中含有的鸭源性成分。
实时荧光定量PCR;检测;鸭源性成分
“民以食为天,食以安为先”,食品安全是关乎人人的重大民生问题。肉制品中掺杂掺假是我国食品行业中存在的问题之一,一些不法商贩或企业为获取高额利润,铤而走险以廉价的鸭肉冒充羊肉、牛肉进行生产经营,欺骗消费者。由于鸭肉的纹理相对于猪肉比较像牛羊肉,且在加工过程中往往会加入羊肉粉、香精等添加剂以掩盖其造假行为,使掺假产品具有更大的欺骗性和隐蔽性,这种肉类掺杂掺假行为违反我国《食品安全法》的有关要求,严重危害了公民的生命权和健康权,严重扰乱了市场经济秩序和社会秩序。因此,有必要建立敏感高效的方法来检测肉畜禽肉制品中的鸭源性成分。
PCR是目前动物源性成分鉴别的主流技术,因为不同物种的基因组不同,依据物种的特异序列,可以用引物经过PCR扩增特异的产物来鉴别物种源性[1]。我国已经建立了牛、羊、猪、马、驴、兔、狗等动物源性成分的普通PCR/实时荧光定量PCR鉴定方法和标准,但还未制定实时荧光定量PCR检测鸭源性成分的标准。与普通PCR相比,实时荧光定量PCR在封闭的体系中进行扩增和实时检测,无需电泳就可以对结果进行分析,避免了传统PCR产物的污染和EB(溴化乙锭)带来的危害,自动化程度高,检测周期短,且扩增目的片段较小,尤其适用于经过深加工的食品,在动物源性成分鉴别检测中的具有广阔的应用前景[2-10]。
线粒体DNA( mitochondrial DNA,mtDNA) 是唯一存在于细胞器中且相对独立的基因组[11],具有高度的物种特异性,在细胞中的拷贝数多[12],可有效降低食品加工造成的DNA损失[13],是近年来动物源性成分鉴定中用的较多的目标基因。本项目通过比较分析鸭与其他畜禽类mtDNA中多个编码区(coding sequence,CDS)的同源性,结合引物和探针的设计要求,最终选用细胞色素C氧化酶III(cytochrome c oxidase subunit III,COX3)作为靶基因;目前国内外未见应用荧光定量PCR扩增该基因片段进行鸭源性成分鉴定的报道。论文通过设计并筛选特异性引物和探针,对反应体系和反应条件进行优化,以及特异性、灵敏性和重复性试验等,建立了鸭源性成分实时荧光定量PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备 高通量自动化样品处理工作站(FASTH21),瑞士CONSUL AR公司产品;小型恒温混匀仪、掌上离心机、台式高速离心机(Centrifuge 5415 R),德国Eppendorf公司产品;微量分光光度计Nanodrop 2000C,美国Thermo公司产品;荧光定量PCR仪(7500 Fast Real-time PCR System),美国ABI公司产品。
1.1.2 主要试剂 血液组织细胞基因组提取试剂盒(离心柱型)、深加工食品DNA提取试剂盒(离心柱型),天根生化科技(北京)有限公司产品;Probe qPCR Mix,东洋纺(上海)生物科技有限公司产品;引物与荧光探针均由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 实时荧光定量PCR引物与TaqMan探针设计 根据NCBI GenBank已发表的鸭(Anas platyrhynchos)线粒体基因序列(NC-009684.1),用Primer Express3.0及DNASTAR PrimerSelect软件设计用于扩增鸭COX3基因部分序列的特异性引物和探针。上游引物DP1序列为5′-CTTACTCACAACCTCAGGGCTAG-3′,下游引物DP2序列为5′-TGTAGGTGTGTGGTGGCCTT-3′,探针序列DQ为5′-(FAM) CTCATCTATCCTGCTAGCCGCCG(BHQ1)-3′,扩增片段长度151 bp。并将设计的引物探针序列与鹅、鸡、鸽、鹌鹑、猪、牛、马、羊等多种常见畜禽COX3上相对应的基因片段进行比对。
1.2.2 模板DNA的提取 称取待检样品200 g,使用高通量自动化样品处理工作站对样品进行均质处理。取50 mg样品均质于1.5 mL离心管中,加入600 μL~800 μL裂解液,65℃作用30 min,期间不时振荡混匀;12 000 r/min离心5 min;转移上清于洁净离心管中,加入400 μL三氯甲烷-异丙醇(24∶1),混匀;12 000 r/min离心5 min,取上清液;加0.8倍体积预冷的异丙醇,沉淀;12 000 r/min离心5 min,弃上清液;750 mL/L乙醇洗涤1次,晾干;加入50 μL灭菌双蒸水溶解沉淀,制成DNA溶液,保存于-20℃备用。也可用基因组提取试剂盒提取DNA。
1.2.3 实时荧光定量PCR反应体系与条件 根据反应体系母液的特性及其推荐的适用于7500 Fast荧光PCR仪的体系参数,设定反应条件为95℃ 20 s;95℃ 3 s,60℃ 30 s,40个循环。反应总体积为20 μL,其中Probe qPCR Mix 10 μL,50×ROX reference dye 0.04 μL,鸭肉模板DNA 0.8 μL,采用不同的引物浓度(5 pmol~20 pmol)和探针浓度DQ(2 pmol~10 pmol)配比,最后用双蒸水补至20 μL,通过试验筛选出最佳的引物和探针浓度。
1.2.4 特异性试验 分别用鹅、鸡、火鸡、鸽、鹌鹑、鹧鸪、鸵鸟、驴、马、绵羊、山羊、牛、猪、狗、鱼等纯肉提取的DNA作为模板进行实时荧光定量PCR反应,以验证引物与探针对于鸭源性成分检测的特异性;以鸭肉DNA作为阳性对照,并以双蒸水为模板设置空白对照。另外,用普通PCR方法[14]对鸭肉DNA进行扩增,扩增产物用琼脂糖凝胶电泳鉴定。
1.2.5 灵敏度试验 用微量分光光度计检测鸭肉DNA浓度,然后以羊肉DNA做稀释液,10×系列稀释鸭肉DNA,进行实时荧光定量PCR反应,观察该方法的灵敏度及羊肉成分的存在对灵敏度的影响,用羊肉DNA为模板作为阴性对照。
1.2.6 重复性试验 批内重复性试验:将上述敏感性试验中100~10-4稀释的共5个不同浓度DNA作为模板进行实时荧光定量PCR检测,每个浓度做3个重复;批间重复性试验:将5个不同浓度的DNA模板在同一反应条件下进行3次独立的实时荧光定量PCR检测,根据Ct值的差异计算批内和批间变异系数(CV),评估所建立检测方法的重复性和稳定性。
1.2.7 模拟混合样品中鸭源性成分的检测 在牛肉、羊肉、猪肉、鹅肉中分别按50%、20%、10%、5%、1%的比例加入鸭肉,按1.2.2所述方法提取DNA,采用本试验建立的实时荧光定量PCR方法对20份模拟混合样品进行检测,并分别设置牛肉、羊肉、猪肉、鹅肉4份阴性对照和1份空白对照。
2 结果
2.1 引物探针序列比对结果
利用DNAMan软件将设计的引物探针序列与常见畜禽COX3基因片段进行比对,发现上游引物、下游引物以及探针与各对照物种间分别存在4个、3个和7个以上碱基的差异(表1),差异值介于21.21%~39.39%,
2.1 实时荧光定量PCR反应体系的优化
通过对实时荧光定量PCR的引物、探针浓度进行优化,最终确定20 μL反应体系中,引物DP1、DP2各1 μL(10 pmol),探针DQ 0.5 μL(5 pmol)。反应条件为95℃ 20 s;95℃ 3 s,60℃ 30 s,40个循环。荧光PCR结果鸭肉DNA出现典型的S型扩增曲线,空白对照无扩增。
2.2 特异性试验结果
以鸭肉DNA作为阳性对照,以鹅、鸡、火鸡、鸽、鹌鹑、鹧鸪、鸵鸟、驴、马、绵羊、山羊、牛、猪、狗、鱼肉等另外15种动物DNA为检测模板进行引物探针的特异性试验,结果表明,仅鸭的DNA扩增出典型的S型曲线,其他物种模板及空白对照均无阈值信号产生(图1),表明该检测方法特异性良好。而普通PCR(SN/T 3731.5-2013)也从所提取的鸭肉DNA中扩增出约226 bp的DNA片段(图2),验证了该荧光PCR的特异性。
2.3 灵敏度试验结果
微量分光光度计测得鸭肉DNA浓度为37.1 ng/μL,以羊肉DNA为稀释液做10×系列稀释(100~10-6),鸭肉DNA含量从37.1 ng/μL递减到0.000 037 1 ng/μL;实时荧光定量PCR检测结果显示100~10-5稀释的鸭肉DNA模板Ct值分别为17.534 9、21.496、25.120 4、28.420 1、31.602 6、35.672 1。其中,10-4稀释对应的鸭肉DNA浓度为3.71 pg/μL,扩增曲线明显,Ct值为31.602 6,说明该方法的检测灵敏度可达到pg级,且羊肉DNA的存在并不影响该方法对鸭源性成分检测的灵敏度(图3)。

表1 鸭源性成分检测引物探针序列与其他物种相应序列的比较

1.鸭肉DNA;2~16.分别是鹅、鸡、火鸡、鸽、鹌鹑、鹧鸪、鸵鸟、驴、马、绵羊、山羊、牛、猪、狗、鱼DNA;17.空白对照
1.Duck DNA; 2-16.DNA of goose,chicken,turkey,pigeon,quail,francolin,ostrich,ass,horse,sheep,goat,cattle,pig,dog,fish respectively;17.Blank control
图1 荧光PCR特异性检测结果
Fig.1 The results of specificity test by real-time PCR
由于10-5稀释对应的鸭肉DNA含量极微小(0.371 pg/μL),Ct值为35.672 1,但未出现典型的扩增曲线;将鸭肉DNA含量稀释至1 pg/μL时,Ct值小于35。综合试验情况,将Ct值35作为该方法的检测阈值,在实验判定有效的情况下,如有FAM荧光检出,且Ct值≤35.0,则判定样品中含有鸭源性成分;如未检测到有Ct值或Ct值>35.0,则不含鸭源性成分或每微升含量低于pg级。
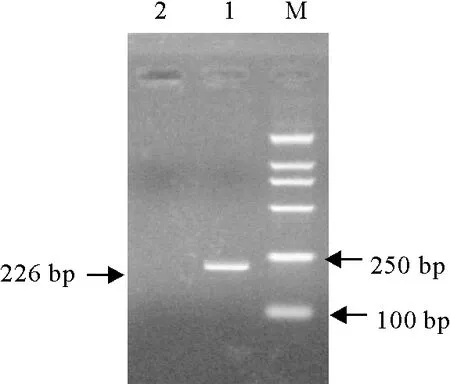
M.DNA 标准 DL 2 000;1.鸭DNA PCR产物;2.空白对照
M.DNA Marker DL 2 000; 1.PCR products of duck DNA; 2.Blank control
图2 普通PCR扩增结果
Fig.2 The results of PCR amplification

1~7.鸭肉DNA,DNA含量分别是37.1、3.71、0.371、0.037 1、0.003 71、0.000 371、0.000 037 1 ng/μL;8.阴性对照(羊DNA);9.空白对照
1-7.Duck DNA contents were 37.1,3.71,0.371,0.037 1,0.003 71,0.000 371,0.000 037 1 ng/μL respectively;8.Negative control (sheep DNA); 9.Blank control
图3 实时荧光定量PCR敏感性试验
Fig.3 Sensitivity test of real-time PCR
2.4 重复性试验结果
取100~10-4稀释的共5个浓度的鸭肉DNA分别做3个批内重复试验(图4)和3个批间重复试验(图5)。将试验结果进行统计分析,批内变异系数(CV)0.62%~1.64%,批间变异系数(CV)0.24%~2.34%;而将批内试验和批间试验加起来共6个重复中,同DNA浓度所测得Ct值变异系数(CV)0.86%~2.73%,均小于3%(表2),说明该方法具有很好的重复性和稳定性。

1~3.鸭肉DNA 37.1 ng/μL;4~6.鸭肉DNA 3.71 ng/μL;7~9.鸭肉DNA 0.371 ng/μL;10~12.鸭肉DNA 0.037 1 ng/μL;13~15.鸭肉DNA 0.003 71 ng/μL;16.阴性对照(羊肉DNA);17.空白对照
1-3.Duck DNA content were 37.1 ng/μL,4-6.Duck DNA 3.71 ng/μL,7-9.Duck DNA 0.371 ng/μL,10-12.Duck DNA 0.037 1 ng/μL,13-15.Duck DNA 0.003 71 ng/μL;16.Negative control (sheep DNA); 17.Blank control
图4 实时荧光定量PCR批内重复试验
Fig.4 Reproducibility of intra-assay of real-time PCR

1~5.鸭肉DNA,含量分别是37.1、3.71、0.371、0.037 1、0.003 71 ng/μL;6.阴性对照(羊肉DNA);7.空白对照
1-5.Duck DNA contents were 37.1,3.71,0.371,0.037 1,0.003 71 ng/μL respectively;6.Negative control (sheep DNA); 7.Blank control
图5 实时荧光定量PCR批间重复试验
Fig.5 Reproducibility of inter-assay of real-time PCR
2.5 模拟混合样品中鸭源性成分检测结果
检测结果显示,在按50%、20%、10%、5%、1%的比例掺入鸭肉的牛肉、羊肉、猪肉、鹅肉中均获得有效的扩增曲线,准确的检出鸭源性成分,且随着掺入量的减少,Ct值均相应的升高;阴性对照及空白对照均未检出,结果与预期完全相符。
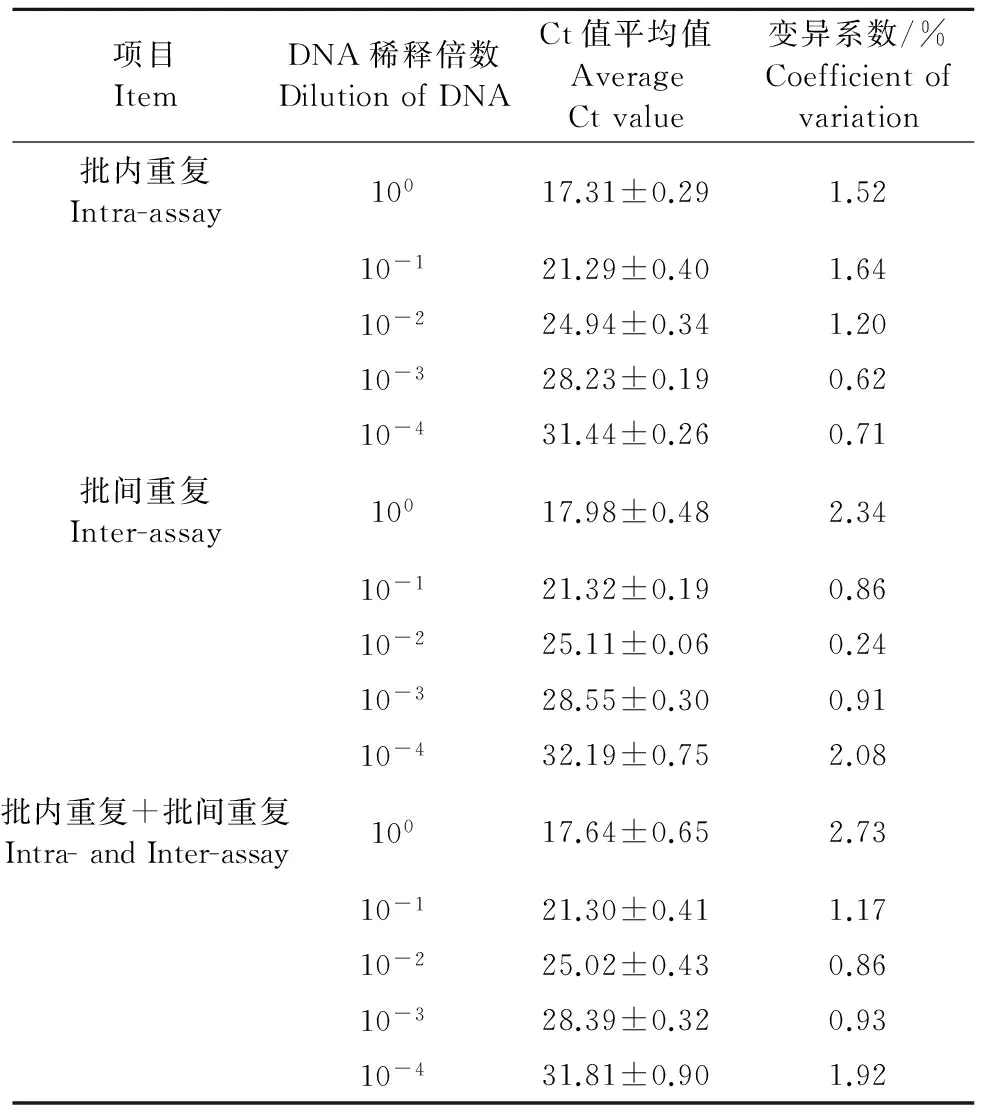
表2 5份不同DNA浓度的鸭DNA模板的批内和批间重复性试验
3 讨论
线粒体基因组分子结构简单,无组织特异性,在所有组织细胞中,均含有大量的线粒体。通过检索NCBI GenBank已发表的鸭、鹅、鸡、火鸡、鸽、鹌鹑、鹧鸪、鸵鸟、驴、马、猫、绵羊、山羊、牛、狗、兔、猪细胞色素C氧化酶Ⅲ(COX3)基因序列,可知上述大部分动物COX3基因大小为784 bp(火鸡为787 bp,牛781 bp),用软件DNAMAN将鸭COX3基因片段分别与上述其他动物进行比较,在禽类间的一致性为80.56%~89.67%,与哺乳动物类的一致性介于70.15%~74.74%之间。本试验根据鸭线粒体COX3基因设计多套用于扩增其特异性片段的引物和探针,扩增片段长度83 bp~165 bp,最终筛选出其中特异性最强一对引物探针,扩增片段长度为151 bp。目的片段较短,适于对畜禽肉制品中的鸭源性成分进行检测,这是因为食品生产加工过程中由于加工工艺等的不同,会受到加工工艺流程等方面的影响,肉类DNA片段会变小,因此利用PCR技术进行动物源性成分鉴定时,目的片段要求尽可能较短[15]。
在实时荧光定量PCR的研究中,判定是否阳性的Ct值并没有统一标准,需根据不同的样品、目的及引物探针的特异性来综合分析并制定检测阈值。本试验制定的方法将Ct值35作为该方法的阳性判定值,鸭源性成分的检测限介于10-4~10-5之间,即掺入的鸭肉DNA含量达1 pg/uL时就可以检出。由于本试验制定的检测鸭源性成分的实时荧光定量PCR灵敏度极高,畜禽肉制品中检出含有鸭源性成分并不能简单判定掺假,还应综合分析,因为一方面掺假的目的是获取更大的利润,掺入鸭肉的比例太低则无利可图;另一方面正常的食品生产加工、运输中不同原料或产品间均存在着交叉污染的可能。本试验所建立的鸭源性成分实时荧光定量PCR快速、简便,具有很好的特异性、灵敏度和重复性,为畜禽肉制品中鸭源性成分检测提供了更为高效、便捷的检测方法,适用于食品安全检测、口岸出入境动物产品的检测等方面,应用范围广泛,适用性强。
[1] 李丽娟,袁晓龙.源性成分鉴别检测技术研究进展[J].动物医学进展,2015,36(5):107-110.
[2] 徐 琼,张奕南,顾文佳,等.TaqMan实时荧光定量PCR法定量检测生肉中猪源性成分的建立[J].食品科技,2016,41(2):309-313.
[3] 张晶鑫,高玉时,樊艳凤,等.利用PCR技术鉴别畜禽肉中鸭源性成分研究[J].安徽农业科学,2015,43(34):202-203,322.
[4] 侯东军,韩合敬,郝智慧,等.双重荧光PCR法快速检测饲料中牛羊源成分[J].黑龙江畜牧兽医,2016(2):247-250.
[5] 赵 新,王 永,兰青阔,等.荧光定量PCR方法鉴别肉制品中羊源性成分[J].食品工业科技,2015,36(1):299-302,308.
[6] 陈 轩,廖秀云,陶 旻,等.Taqman探针荧光PCR检测鲨鱼源性成分[J].食品与生物技术学报,2015,34 (10):1083-1088.
[7] 范丽丽,李 培,傅春玲,等.食品中鸡源性成分实时荧光定量PCR检测方法的建立[J].食品科学,2014,35(2):248-251.
[8] 王 玮,吕青骎,朱卢玺,等.食品中马源性成分的实时荧光定量PCR检测[J].食品与生物技术学报,2014,34(9):961-964.
[9] 熊 蕊,郭凤柳,刘晓慧,等.肉制品中犬源性成分PCR检测方法的建立[J].动物医学进展,2014,35(8):9-12.
[10] 岳 苑.实时荧光定量PCR法检测清真食品中马、驴源性成分[J].湖北农业科学,2014,53(22):5518-5522.
[11] 张素素,孙 嘉.线粒体DNA拷贝数的研究新进展[J].医学综述,2014,20(24):4417-4419.
[12] Yoshinobu K.Antioxidative roles of sezamin,a functional lignan in sesame seed and it’s effect on lipid and alcohol -metabolism in the liver:a DNA microarray study[J].Bio Factors,2004,(21):191-196.
[13] Zhang J,Huang H,Cai Z,et al.Species identification in salted products of red snappers by semi-nested PCR-RFLP based on the mitochondrial 12S rRNA gene sequence[J].Food Control,2006,17(7):557-563.
[14] SN/T 3731.5-2013 食品及饲料中常见禽类品种的鉴定方法(第5部分):鸭成分检测PCR法[S].
[15] Martín I,García T,Fajardo V,et al.SYBR-Green real-time PCR approach for the detection and quantification of pig DNA in feedstuffs[J].Meat Sci,2009,82(2):252-259.
A Real-time Fluorescent PCR for Detection of Duck-derived Ingredients in Meat Products of Livestock and Poultry
LIN Yan-xing,ZHANG Cai-hong,RUAN Zhou-xi,LIU Jian-li,ZONG Hui,LIAO Li-shan, SUN Jie,YANG Jun-xing,LV Jian-qiang,HUA Qun-yi,CAO Chen-fu
(ShenzhenEntry-exitInspectionandQuarantineBureau,Shenzhen,Guangdong,518045,China)
To develop a real-time fluorescent PCR assay for detection of duck-derived ingredients in meat products of livestock and poultry,the specific PCR primers andTaqman probe were designed based on the conserved sequence of cytochrome c oxidase subunit III gene of duck mitochondrial DNA.The results show that,the assay had high specificity and sensitivity,only amplifies the target gene fragment of duck and the detection limit is 1.0 pg/μL.And this assay had good reproducibility,the coefficient of variation of Ct values is less than 3%.Application of the assay to detect simulation mixed samples,the result is in line with expectations,and the presence of common meat DNA did not affect the sensitivity of detection of duck-derived ingredients.In summary,this real-time fluorescent PCR assay is specific,sensitive and stable,It can quickly and accurately detect the duck-derived ingredients in meat.
real-time fluorescent PCR; detection; duck-derived ingredients
2016-04-18
林彦星(1980-),男,广东潮州人,兽医师,硕士,主要从事动物及动物产品检验检疫工作。*通讯作者
S851.4
A
1007-5038(2016)11-0048-06
