血清降钙素原定量检测在血流感染患者中的临床应用价值研究
2016-12-09翁绳凤王秀明杨京灵
翁绳凤,吴 华,宋 洋,王秀明,王 艳,杨京灵
(北京老年医院检验科 100095)
·临床研究·
血清降钙素原定量检测在血流感染患者中的临床应用价值研究
翁绳凤,吴 华,宋 洋,王秀明,王 艳,杨京灵
(北京老年医院检验科 100095)
目的 探讨血清降钙素原(PCT)定量检测在血流感染患者中的临床应用价值。方法 采用回顾性研究对该院220例老年住院患者同时送检的血培养和PCT检测结果进行分析。比较血清PCT水平与血培养结果的关系及其在革兰阴性细菌、革兰阳性细菌和假丝酵母菌之间的差异。结果 血培养阳性率为20.45%,在血培养阳性标本中PCT阳性率为64.44%;在血培养阴性标本中PCT阴性率为44.00%。血培养阳性患者PCT中位数为(8.00±17.39)μg/L,血培养阴性患者PCT为(4.46±11.05)μg/L,差异有统计学意义(P=0.007)。革兰阴性菌组PCT为(11.25±23.37)μg/L,假丝酵母菌组PCT为(11.21±13.59)μg/L,均高于革兰阳性菌组PCT水平(5.42±14.81)μg/L,差异有统计学意义(P=0.011)。结论 定量检测PCT可辅助快速排除和诊断血流感染,与血培养联合检测可提高诊断和鉴别诊断的准确性。
降钙素原; 血流感染; 血培养
血流感染是指致病菌或条件致病菌侵入血液循环中而引起的急性全身炎性反应。其病死率高,因此诊断血流感染成为医学界关注的热点。血培养一直被认为是诊断血流感染的“金标准”[1-2],但其耗时长,阳性率低,尤其老年人临床表现较隐蔽,无特异性,且感觉迟钝,机体反应差,体温变化不规则,甚至体温不升,常不被重视而影响早期诊断。近年来,降钙素原(PCT)水平成为鉴别细菌性与病毒性感染的重要新指标[3-4],它也因此被作为诊断血流感染的重要标志物。本研究主要探讨血清PCT定量检测和血培养在老年血流感染患者中的临床应用价值。
1 资料与方法
1.1 一般资料 本研究选取2012~2013在本院同时进行血培养及PCT检测的老年住院患者220例,所有患者血培养送检时间和PCT送检时间相差不超过24 h。若同一患者一周内有2次及以上送检,只统计第1次血培养和PCT检测结果。若同一患者送检间隔超过一周,则记录每次血培养和PCT结果。
1.2 仪器与试剂 采用美国BD公司生产的Bactect9050全自动血培养仪及配套血培养瓶进行血培养。采用该公司生产的Phoenix全自动微生物鉴定药敏分析仪及相应配套试剂进行病原微生物鉴定。采用广州万孚生物技术股份有限公司生产的PCT定量检测试剂盒(免疫荧光层析法)进行PCT定量检测。按说明书操作,若PCT大于或等于0.5 μg/L,即为PCT阳性,并按要求进行定标和质控试验。
1.3 方法
1.3.1 标本采集 按全国临床检验操作规程,无菌操作条件下采集患者静脉血3~5 mL于真空采血管,3 500 r/min离心3 min,分离血清,作为PCT检测标本。按要求无菌抽血(包括1个需氧培养瓶和1个厌氧培养瓶)。每个培养瓶取血量8~10 mL。
1.3.2 血培养 血培养瓶送至实验室,经编号登记后放入Bactect9050血培养仪中。仪器温度设置35.5 ℃,阴性报警时限设定为7 d。仪器发出阳性报警时,立即用无菌注射器抽取培养液做革兰染色、镜检并接种于血平板、麦康凯平板或厌氧血平板上于35 ℃培养。待菌落形成后用Phoenix微生物全自动鉴定仪及API生化鉴定系统对病原菌进行鉴定。

2 结 果
2.1 基本信息 2012~2013年送检PCT检测共923例,阳性率42.58%(393/923);送检血培养1 256例,阳性率19.28%(239/1 256);同时送检PCT和血培养共220例。在220例老年住院患者中,男138例,女82例;平均年龄(75.33±13.11)岁。
2.2 PCT与血培养结果比较 血培养阳性率20.45%(45/220),PCT阳性率57.73%(127/220)。在血培养阳性标本中PCT阳性率为64.44%(29/45);在血培养阴性标本中PCT阴性率为44.00%(77/175)。表明175例血培养阴性患者中有56.00% PCT阳性。PCT阴性预测值NPT和阳性预测值PPT分别为82.80%(77/93)和22.83%(29/98)。见表1。
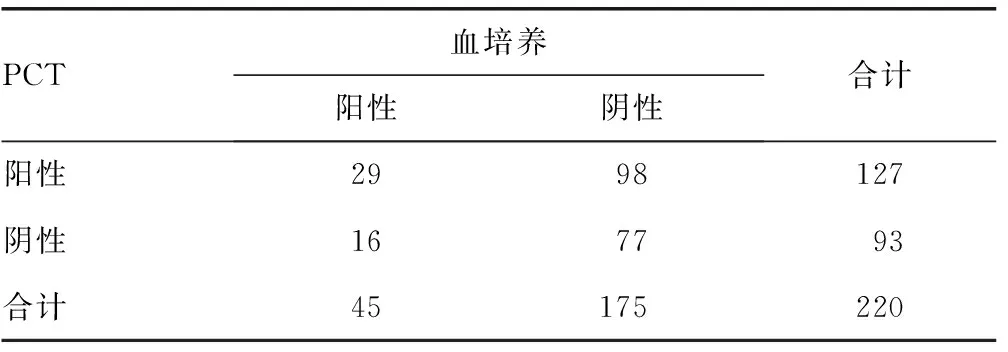
表1 PCT与血培养结果比较(n)
2.3 主要病原菌PCT检测结果 血培养阳性患者PCT中位数为(8.00±17.39)μg/L,血培养阴性患者PCT中位数为(4.46±11.05)μg/L,差异有统计学意义(P=0.007)。革兰阴性菌组PCT为(11.25±23.37)μg/L,假丝酵母菌组PCT为(11.21±13.59 )μg/L,均高于革兰阳性菌组(5.42±14.81)μg/L,差异有统计学意义(P=0.011)。革兰阴性菌组与假丝酵母菌组PCT水平比较,差异无统计学意义(P>0.05)。见表2。
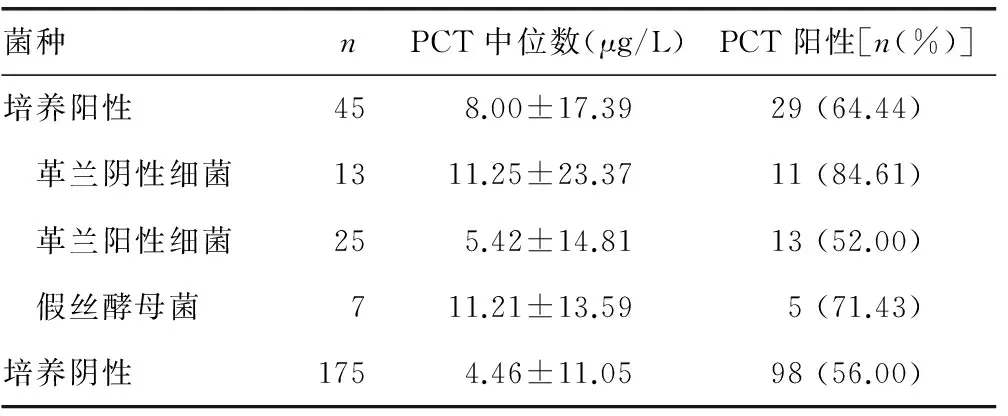
表2 主要病原菌PCT检测结果
3 讨 论
PCT是降钙素的前体,在健康人的外周血中水平较低[5],但当细菌或病毒感染时,血清中PCT会显著升高[6]。因此,PCT成为早期诊断血流感染的重要检测指标。本研究中,血培养阳性率为20.45%,低于国内相关报道[7-8]。原因可能为:(1)采血需在抗菌药物使用前或血药水平低谷期,但老年人大多有基础疾病且合并感染,在采血前不能保证未使用抗菌药物。(2)采血量不足将降低细菌检出率,而老年人多见贫血,通常只送检1套。本研究中,45例血培养阳性患者PCT阳性率64.44%(64.44%患者PCT水平高于临界值0.5 μg/L),略低于学者相关研究结果[7,9],提示临床若怀疑血流感染应尽早做血培养和PCT检测,有助早期诊断和及早使用抗菌药物,改善患者预后。但仍有35.00%左右患者血培养阳性PCT不升高,可能由药物因素所致。国内文献曾报道,高水平头孢他啶可使大鼠产生较少的PCT[10]。血培养阴性患者中有56.00%患者PCT阳性,且个别血培养阴性患者PCT出现极端高值现象。原因可能为:(1)患者局部感染引起PCT的升高。(2)PCT水平升高存在非特异性因素影响,如系统性炎性反应综合征、创伤、神经内分泌肿瘤等。在分析PCT阳性结果时应排除上述干扰因素。同时,血培养阴性受血培养次数、采血量和采血时间等因素影响,阴性结果并不能完全排除血流感染。
本研究中,血培养革兰阳性菌分离率大于阴性菌,阳性菌中凝固酶阴性葡萄球菌占多数(18/25),与罗军等[9]研究结果不一致,可能与研究人群不同及例数少有关。革兰阴性菌感染PCT大于阳性菌感染,差异有统计学意义(P<0.05),可能是革兰阴性菌细胞壁主要由脂多糖生成,因此产生大量内毒素,而内毒素刺激PCT产生[11]。18例凝固酶阴性葡萄球菌阳性者中PCT阴性5例,经临床核实均为污染菌。因此,做血培养的同时应检测PCT,既能评估患者是否存在感染及其感染程度,又能有助于鉴别凝固酶阴性葡萄球菌是否为血流感染的污染菌。刘洋等[12]对此进行了详细研究,认为PCT可有效鉴别诊断凝固酶阴性葡萄球菌引起的血流感染和血培养污染。
PCT阴性预测值NPT和阳性预测值PPT分别为82.80%(77/93)和22.83% (29/98)。PCT阴性预测能力较强,PCT<0.5 μg/L时对排除血流感染具有较好参考价值。阳性预测值较低,低于国内其他报道[13]。可能的原因包括:(1)老年人是特殊群体,多种病症共存,影响检测结果。(2)患者曾使用大剂量抗菌药物,使细菌生长受抑制,导致血培养阴性或者炎性反应开始3~4 h PCT升高但细菌水平不足,导致血培养阴性。(3)专家共识中提到的其他非感染因素,如外科手术、创伤、自身免疫性疾病等[14]。
另外,真菌感染与革兰阴性菌感染PCT水平相近,高于阳性菌感染,差异有统计学意义(P<0.05),提示PCT升高时不仅要考虑细菌感染,也不能忽视真菌感染的可能性。PCT是否可作为危重患者的监测指标[15],本次研究未涉及相关资料,有待于进一步深入探讨。
综上所述,单纯血培养或PCT都不能快速有效地判定血流感染,两者联合检测可提高诊断和鉴别的准确性,能更好指导临床合理采用抗菌药物。此外炎性反应和感染控制需要连续监测PCT水平。
[1]Kim KE,Han JY.Evaluation of the clinical performance of an automated procalcitonin assay for the quantitative detection of blood stream infection[J].Korean J Lab Med,2010,30(2):153-159.
[2]张有江,王欢,罗艳萍,等.定量降钙素原测定在血流感染诊断中的应用[J].军医进修学院学报,2010,31(12):1219-1221.
[3]Gilbert DN.Use of plasma procalcitonin levels as an adjunct to clinical microbiology[J].J Clin Microb,2010,48(7):2325-2329.
[4]Becker KL,Snider R,Nylen ES.procalcitonin assay in systemic inflammation,infection,and sepsis:clinical utility and limitations[J].Crit Care Med,2008,36(3):941-952.
[5]Christ-Grain M,Muller B.Procalcitonin in bacterial infections-hype,hope,more or less[J] Swiss Med Wkly,2005,135(31/32):451-460.
[6]Liu F,Wang Q,Zeng FY,et al.Clinical diagnostic value of procalcitonin detection in local infection and sepsis[J].J South Med Univ,2010,30(30):614-619.
[7]王凯飞,沈定霞,刘朝军,等.血清降钙素原定量检测与血培养结果的比较[J].中华检验医学杂志,2012,35(3):243-246.
[8]马莉,孙光伟,王厚照.血清降钙素原联合血培养连续检测对菌血症的诊断价值[J].临床误诊误治,2011,24(10):78-80.
[9]罗军,蒋雪梅,李红霞,等.血清降钙素原与血培养联合检测对血流感染的诊断价值[J].国际检验医学杂志,2014,35(8):1052-1053.
[10]张智洁,刘勇,孙继梅,等.头孢他啶影响大鼠降钙素原产生机制的初步研究[J].中华医院感染学杂志,2007,17(2):129-133.
[11]顾敏,包正军.革兰阳性与阴性菌感染血清降钙素原水平比较[J].中国感染控制杂志,2011,10(6):449-451.
[12]刘洋,万腊根,余阳,等.血清降钙素原对凝固酶阴性葡萄球菌血流感染鉴别诊断的价值[J].中国感染与化疗杂志,2013,13(3):185-189.
[13]蒋伟,李少增,周峥.定量检测降钙素原在患者感染诊断及其预后判断中的临床价值[J].中国感染控制杂志,2012,11(3):189-191.
[14]降钙素原急诊临床应用专家共识组.降钙素原(PCT)急诊临床应用的专家共识--标准与指南[J].中华急诊医学杂志,2012,21(9):944-948.
[15]安云霞,孔存全,朱敏,等.败血症老年患者血清降钙素原水平及临床意义[J].中国实用医刊,2013,40(19):9-10.
10.3969/j.issn.1673-4130.2016.22.038
A
1673-4130(2016)22-3191-03
2016-04-11
2016-06-18)
