骨质疏松模型小鼠不同骨密度条件下的基因表达谱分析
2016-12-05陈柏龄崔昊文肉孜卡热依米提
陈柏龄,崔昊文,林 焘,肉孜卡热·依米提,吕 中
基础研究
骨质疏松模型小鼠不同骨密度条件下的基因表达谱分析
陈柏龄,崔昊文,林 焘,肉孜卡热·依米提,吕 中
目的探讨不同骨密度(bone mineral density,BMD)骨质疏松模型小鼠基因表达谱的差异,分析骨质疏松基因表达谱系的特征。方法采用30只C57BL/6J去势雌性小鼠建立骨质疏松模型,以微计算机断层扫描(Micro-CT)技术测量其BMD。根据BMD选取10只小鼠并分为2组:BMD最高的5只小鼠分入H组(high BMD组),BMD最低的5只小鼠分入L组(low BMD组)。应用基因芯片技术检测两组骨质疏松小鼠基因的表达,通过Gene Ontology(GO)数据库对差异表达基因进行基因信息学分析。结果共筛选出差异表达基因684条,包含功能明确的基因610条,其中299条表达上调、311条表达下调。结论炎症以及免疫反应、细胞黏附、胶原代谢及骨质矿化等相关基因群的差异表达,可能对骨质疏松小鼠BMD的改变发挥重要作用。
骨质疏松;骨密度;基因表达谱;疾病模型,动物;小鼠
骨质疏松症是以骨量低下、骨微结构损坏为主要特征,致使骨脆性增加而易于发生骨折的一种全身性骨病[1]。骨质疏松症的发生、发展是一个复杂过程,其演进过程涉及大量的基因突变、缺失、扩增及失活等异常表达信息[2-3]。基因芯片技术可以获得大量的生物学信息,为在基因水平诊断、预防和治疗骨质疏松症提供可能。目前大部分骨质疏松相关的基因芯片研究将重点放在骨质疏松患者、动物模型与正常人、动物基因表达谱差异的探讨上[4-6]。而对于非遗传因素相似的骨质疏松患者或动物模型,其骨质疏松严重程度事实上也可存在巨大差别,但还未见与其相关的表达谱芯片的研究报道。本研究利用小鼠全基因组芯片,探讨不同骨密度(bone mineral density,BMD)骨质疏松小鼠基因表达谱的变化,并对差异表达基因进行生物信息学分析,为揭示骨质疏松症的基因调控机制提供参考。
1 材料与方法
1.1主要实验仪器与试剂
主要实验仪器:Latheta LCT-200(Hitachi-Aloka公司,日本),ND1000紫外分光光度计(NanoDrop公司,美国)。
主要试剂:Mouse Gene Expression v2 4x44K Microarray试剂盒(G4846A,Agilent公司,美国),Gene Expression Hybridization试 剂 盒(5188-5242,Agilent公司,美国),RNasey Mini试剂盒(74106,Qiagen公司,美国);Trizol(15596-018,Invitrogen公司,美国);C57BL/6小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)完全培养基(MUBMX-90011)、C57BL/6小鼠BMSCs成骨诱导分化培养基(MUBMX-90021)购自中国苏州赛业生物科技有限公司。
1.2骨质疏松模型小鼠的建立
C57BL/6J近交系雌性小鼠30只,8周龄左右,SPF级,由中山大学动物实验中心提供(实验动物合格证号:11400700134037、11400700139179)。适应性饲养1周后,小鼠被随机分为模型组(Ovx组,25只)和假手术组(Sham组,5只)。1%戊巴比妥钠麻醉后,对Ovx组采用背部脊柱旁切口双侧卵巢切除术,于子宫颈部结扎后切除卵巢,依次缝合肌层及皮层,碘伏消毒;对Sham组采用相同切口,于卵巢周围切除相同体积脂肪组织,保留卵巢,缝合伤口。置于SPF级动物房饲养8周后,以微计算机断层扫描(micro-computer tomography,Micro-CT)技术检测其腰椎骨BMD。
1.3Micro-CT测量BMD
术后8周颈髓离断处死小鼠。取小鼠胸椎下段至骶椎,置于40 g/L多聚甲醛溶液中固定48 h,其余部位则用于提取小鼠BMSCs。用Latheta LCT-200对制备好的腰椎标本进行Micro-CT扫描,条件为源电压55 kV、源电流131 μA、曝光时间300 ms,分辨率为10 μ m。使用VGStudio MAX V2.2三维重建处理软件,对脊柱腰椎的Micro-CT扫描图片进行三维图像重建,选取各组小鼠腰椎体4个部位重组图像中的相同位置进行BMD定量分析。计算平均值后,依据BMD的大小对Ovx组小鼠排序,选取其中BMD最高和最低的骨质疏松模型小鼠各5只,分别作为H组(high BMD组)和L组(low BMD组)。
1.4BMSCs体外培养
于多聚甲醛溶液固定小鼠胸椎下段至骶椎后,将小鼠身体其余部分以75%乙醇浸泡5 min,无菌条件下取小鼠双侧股骨、胫骨,无菌剪钝性剥离肌肉,用1 mL注射器吸取PBS液反复冲洗小鼠骨髓腔,冲出骨髓经过离心,将细胞重悬于C57BL/6小鼠BMSCs完全培养基,于37℃、5% CO2、饱和湿度的细胞培养箱中培养。48 h后半量换液,72 h后全量换液,以后每2天换液1次,当小鼠BMSCs生长密度达到80%左右时对其进行消化计数,按1∶2比例传代。待小鼠BMD测定完成后,对选出的10只小鼠(L组和H组)和5只Sham组小鼠对应的BMSCs进行RNA提取和检测。
1.5RNA提取、纯化、质检
将L组和H组的小鼠BMSCs传至第三代,使用Trizol法分别提取两组小鼠总RNA。RNA的质量通过ND-1000紫外分光光度计进行评估,标准变性凝胶电泳评估RNA完整性。紫外分析及电泳检测显示获得高质量的纯净RNA,使用RNasey Mini试剂盒纯化总RNA。
1.6标记和芯片杂交
将样品RNA反转录为cDNA,使用Gene Expression Hybridization试剂盒对其进行Cy3-UTP荧光标记。采用小鼠4x44K基因表达谱芯片v2和杂交探针分别进行94℃水浴变性后,加入混合探针,置42℃杂交箱中避光杂交16~18 h。按顺序用1×SSC+0.2%SDS、0.1×SSC+0.2% SDS、0.1×SSC洗涤,室温晾干,避光保存于干燥器中。
1.7数据分析
使用Agilent Feature Extraction软件(v11.0.1.1)获得芯片图并读值,得到原始数据。使用GeneSpring GX v12.1软件对原始数据进行Quantile标准化,而后对经过筛选的高质量探针进一步分析。根据Benjamini Hochberg FDR方法得到修正的P值(即FDR),进行差异基因筛选。基因显著性差异表达的判定标准:Fold Change≥2.0,FDR≤0.05,两组样品间具有统计学意义的差异表达基因通过散点图表示(图3)。使用标准富集计算方法进行Gene Ontology(GO)分析。
2 结果
2.1小鼠BMD检测结果
Sham组小鼠BMD明显高于Ovx组,两组比较,差异有统计学意义[(443±22)vs(332± 24)mg/cm2,P<0.05];L组和H组小鼠BMD分别为(298±10)和(365±3)mg/cm2,Sham组、L组和H组各组间BMD差异均有统计学意义(均P<0.05),见图1。

图1 Sham组、L组和H组骨质疏松小鼠骨密度 *P<0.05
2.2RNA提取结果
琼脂糖凝胶电泳结果显示,2组样品总RNA的18 s和28 s条带清晰明亮,无明显的拖尾或弥散,紫外分光光度计浓度测定结果显示,A260/ A280比值符合芯片实验要求(表1、图2)。
2.3基因表达谱结果分析
2.3.1芯片杂交结果 芯片扫描结果显示芯片信号强度均一、清晰,背景值均匀,结果可靠。绘制各组信号值的散点分布图(图3),位置高于最上方绿线和低于最下方绿线的点分别由上调和下调的表达量Fold Change≥2.0基因信号产生,此部分基因即为差异表达基因,而大部分基因位于Fold Change lines以内,不符合显著性差异表达的判定标准。
2.3.2差异基因表达 按照设定的基因显著性差异表达判定标准:Fold Change≥2.0,FDR≤0.05,经筛选分析发现,L组与H组的差异表达基因共有684条。其中未命名的基因44条,已命名的640条基因中,上调基因318条、下调基因322条。差异基因中功能未明确的基因74条,已明确功能的610条基因之中,上调基因299条、下调基因311条。
2.3.3差异基因GO分析结果 在我们发现的差异基因中,未命名的44条基因主要为功能未明确的基因或相同基因的不同转录本。针对已命名的640条基因进行GO功能分类分析,在L组小鼠BMSCs中上调表达的基因主要与炎症及免疫反应(IRG1、IRF7、GATA3、LAG3、ZBP1、CXCL9、CXCL10、GZMB、TNIP3、TNFAIP3)等相关;下调表达的基因主要与细胞黏附(HAPLN1、NCAM2、CTNNAL1、PCDH9、PCDH18、LAMA3、CLDN1),胶原代谢(IGF1、FGFR2、PTN、ASPN、PRELP、OGN、MMP20、MMP24、COL11A1)及骨质矿化(OMD)等活动有关。
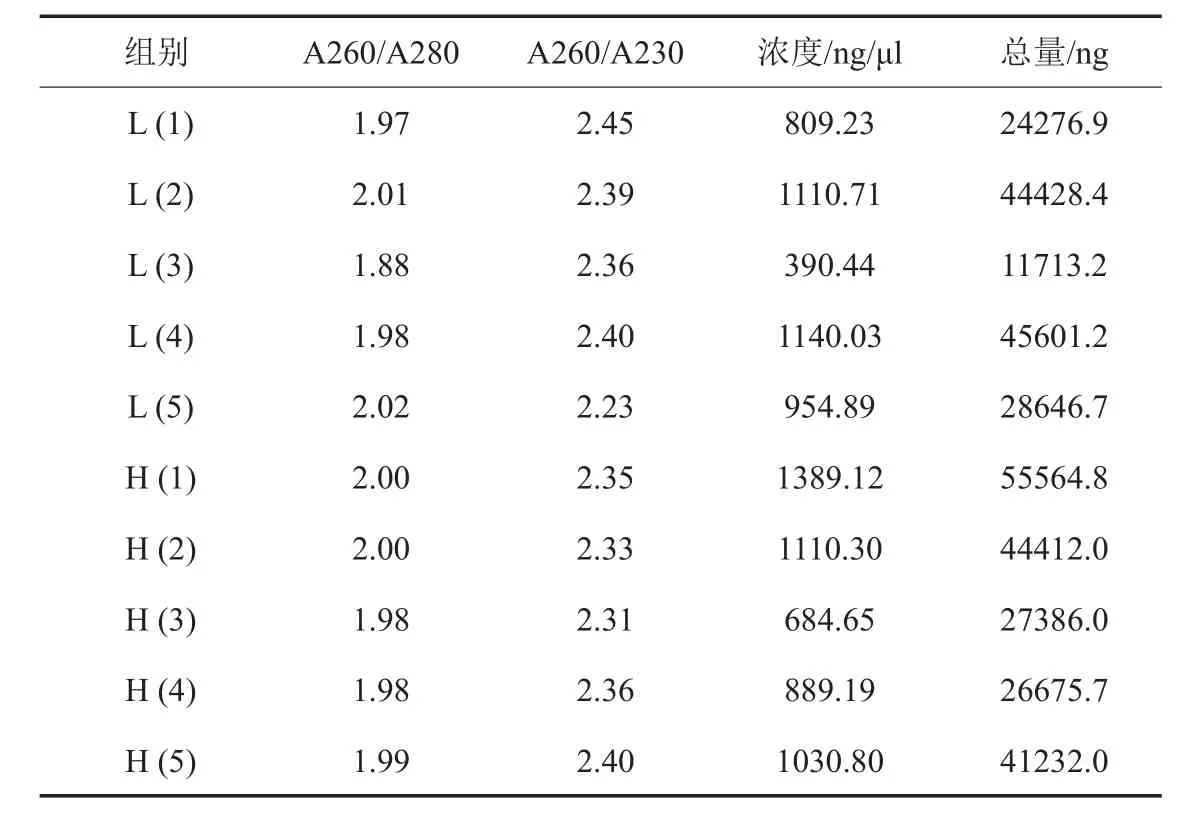
表1 L组和H组骨质疏松小鼠样品RNA基本信息

图2 L组和H组骨质疏松小鼠样品总RNA电泳图

图3 不同骨密度条件下骨质疏松小鼠基因表达散点图
3 讨论
全基因组表达谱芯片作为一种高通量、快速、平行的基因表达信息分析技术,能同时进行疾病多基因的高密度检测,已用于多种疾病相关基因的筛选。现阶段很多国内外学者利用这一技术,在全基因组水平,进行了大样本量的关联分析[2,7]。作为一种由遗传因素和环境效应共同决定的多基因疾病,骨质疏松症在人群中表现出显著的遗传异质性[8]。而BMD仍是当前诊断骨质疏松症、预测骨质疏松性骨折风险、监测自然病程以及评价药物干预疗效的最佳定量指标[9]。在临床工作中我们发现,具备相似生存环境、生活习惯和既往病史等的骨质疏松患者,其BMD可以存在巨大差别,特别是停经时长相近、非遗传因素相似的中老年女性患者,有些BMD正常或仅表现为骨量减少,有些则出现严重的骨质疏松。在本研究中,我们建立了骨质疏松模型小鼠,筛选相同条件下BMD差别最大的10只小鼠(BMD最高和最低小鼠各5只),提取其BMSCs并探索相关基因表达谱系的变化,然后对差异表达基因进行生物信息学分析,以探讨在排除雌激素干扰的情况下,骨质疏松相关基因的调控机制。
我们发现,不同BMD的两组骨质疏松小鼠共有610个已明确功能的差异表达基因,其中299条基因上调表达、311条基因下调表达。经GO分析后发现,在L组小鼠BMSCs中上调表达的基因主要与炎症以及免疫反应等相关;下调表达的基因主要与细胞黏附、胶原代谢及骨质矿化等活动有关。
多种细胞黏附相关基因(HAPLN1、NCAM2、CTNNAL1、PCDH9、PCDH18、LAMA3、CLDN1)在L组小鼠BMSCs表达明显减低。骨质疏松发生的重要机制之一是成骨细胞数量及功能的降低,骨代谢过程中骨形成与骨吸收失衡,骨吸收处于优势,导致骨量减少[10]。黏附作用是BMSCs发挥其增殖和成骨分化作用的前提。在多种细胞转化因子引导下,BMSCs于骨组织表面黏附,并在生长因子的作用下增殖分化为成骨细胞,分泌钙基质,最终矿化成骨[11]。据此推测,这可能是排除雌激素干扰下,骨质疏松小鼠BMD明显减低的重要调控机制。
胶原代谢相关的基因(IGF1、FGFR2、PTN、ASPN、 PRELP、OGN、 MMP20、MMP24、COL11A1)及骨质矿化相关的基因(OMD)在L组小鼠BMSCs表达呈明显下调。胶原在人体骨有机基质中占90%,骨的稳定性、可塑性等基本特征归因于胶原,其赋予骨高抗张强度;更重要的是,胶原还提供矿盐结晶的基质,而矿盐结晶则赋予骨高抗压硬度。对于骨胶原纤维含量低的骨板,其骨盐含量也低,表现出低BMD[12-13]。
多种炎症以及免疫相关的基因(IRG1、IRF7、GATA3、LAG3、ZBP1、CXCL9、CXCL10、GZMB、TNIP3、TNFAIP3)在L组小鼠BMSCs出现明显上调表达。而炎症、自身免疫性疾病与骨质疏松症的关系,研究者们已早有认识。此类疾病均伴有全身或局部的骨量改变,而T淋巴细胞及其产物是BMSCs增殖、成骨和破骨分化的关键调节因素[14-15];也有学者提出“骨免疫学(osteoimmunology)”的概念,认为在骨质疏松发生发展过程中,免疫系统和免疫因素发挥重要的调节作用[16-17]。本研究显示,这些炎症以及免疫相关的基因可能对无雌激素影响下骨质疏松小鼠BMD的变化起到重要作用。
综合以上结果,我们分析得出,骨质疏松模型小鼠表现出不同的BMD,可能是由于炎症以及免疫反应、细胞黏附、胶原代谢及骨质矿化等过程相关基因群的异常表达所致。
[1]Kanis JA.The diagnosis of osteoporosis[J].J Bone Miner Res,1994,9(8):1137-1141.
[2]Richards JB,Rivadeneira F,Inouye M,et al.Bone mineral density,osteoporosis,and osteoporotic fractures:a genomewide association study[J].Lancet,2008,371(9623):1505-1512.
[3]Ralston SH,Uitterlinden AG.Genetics of osteoporosis[J]. Endocr Rev,2010,31(5):629-662.
[4]Xiao Y,Fu H,Prasadam I,et al.Gene expression profiling of bone marrow stromal cells from juvenile,adult,aged and osteoporotic rats:with an emphasis on osteoporosis[J].Bone, 2007,40(3):700-715.
[5]Balla B,Kósa JP,Kiss J,et al.Different gene expression patternsinthebonetissueofagingpostmenopausal osteoporotic and non-osteoporotic women[J].Calcif Tissue Int,2008,82(1):12-26.
[6]Kósa JP,Balla B,Speer G,et al.Effect of menopause on gene expression pattern in bone tissue of nonosteoporotic women[J].Menopause,2009,16(2):367-377.
[7]严卫丽.复杂疾病基因组关联研究进展:遗传统计分析[J].遗传,2008,30(5):543-549.
[8]Richards JB,Zheng HF,Spector TD.Genetics of osteoporosis fromgenome-wideassociationstudies:advancesand challenges[J].Nat Rev Genet,2012,13(8):576-588.
[9]NIH Consensus development panel on osteoporosis prevention,diagnosis,and therapy,march 7-29,2000:highlights of the conference[J].South Med J,2001,94(6):569-573.
[10]Raisz LG.Pathogenesis of osteoporosis:concepts,conflicts, and prospects[J].J Clin Invest,2005,115(12):3318-3325.
[11]Brunner M,Jurdic P,Tuckerman JP,et al.New insights into adhesion signaling in bone formation[J].Int Rev Cell Mol Biol,2013,305:1-68.
[12]Fonseca H,Moreira-Gonçalves D,Coriolano HJ,et al.Bone quality:the determinants of bone strength and fragility[J]. Sports Med,2014,44(1):37-53.
[13]Alford AI,Kozloff KM,Hankenson KD.Extracellular matrix networks in bone remodeling[J].Int J Biochem Cell Biol, 2015,65:20-31.
[14]Rifas L,Arackal S,Weitzmann MN.Inflammatory T cells rapidly induce differentiation of human bone marrow stromal cells into mature osteoblasts[J].J Cell Biochem,2003,88(4): 650-659.
[15]Weitzmann MN.T-cells and B-cells in osteoporosis[J].Curr Opin Endocrinol Diabetes Obes,2014,21(6):461-467.
[16]Walsh MC,Kim N,Kadono Y,et al.Osteoimmunology:interplay between the immune system and bone metabolism[J]. Annu Rev Immunol,2006,24:33-63.
[17]Takayanagi H.Osteoimmunology:shared mechanisms and crosstalk between the immune and bone systems[J].Nat Rev Immunol,2007,7(4):292-304.
(本文编辑:白朝晖)
Analysis of gene expression profiles in mice with osteoporosis under the conditions of different bone mineral density
CHEN Bailing,CUI Haowen,LIN Tao,Rouzikare·Yimiti,LV Zhong.Department of Spinal Surgery,the First Affiliated Hospital of Sun Yat-sen University,Guangzhou,Guandong 510080,China
Objective To investigate the differences of the gene expression profiles in mice with osteoporosis under the conditions of different bone mineral density(BMD),and to analyze the characteristics of the osteoporotic gene expression profiles.Methods Osteoporotic model was established by applying 30 ovariectomized C57BL/6J female mice,which BMD were measured through micro computed tomography (Micro-CT)subsequently.According to BMD,10 mice were selected and divided into two groups,5 mice with the highest BMD were in H group and 5 mice with the lowest BMD were in L group.Gene chips were used to investigate the gene expression of osteoporotic mice in two groups,and the differential expression genes were analyzed through Gene Ontology(GO)database.Results A total of 684 genes expressed in osteoporotic mice with different BMD were screened out,comprising 610 known genes,among which,up-and down-regulatedgenes were 299 and 311,respectively.Conclusion Many abnormal expression gene groups,which involved in inflammatory and immune response,cell adhesion,collagen metabolism and bone mineralization,might play important roles in the changes of BMD in osteoporotic mice.
Osteoporosis;Bone density;Gene expression profiles;Disease models,animal;Mice
R681.4,R394.36
A
1674-666X(2016)05-309-06
10.3969/j.issn.1674-666X.2016.05.009
国家自然科学基金(31570976)
510080广州,中山大学附属第一医院脊柱外科
E-mail:chenbl2012@163.com
(2016-08-19;
2016-09-22)
