荷花品种不同部位DNA提取的比较研究
2016-12-04兴义民族师范学院生物与化学学院贵州兴义562400西南大学生命科学学院重庆40075贵州省民族药用生物资源研究与开发重点实验室贵州兴义562400
, , , , , , (.兴义民族师范学院生物与化学学院, 贵州 兴义 562400; 2.西南大学生命科学学院, 重庆 40075;3.贵州省民族药用生物资源研究与开发重点实验室, 贵州 兴义 562400)
荷花品种不同部位DNA提取的比较研究
桂腾琴1,2,3,伍伟1,卢鹏1,王颖娟1,张万芹1,马彩瑜1,陈鹏1
(1.兴义民族师范学院生物与化学学院, 贵州 兴义 562400; 2.西南大学生命科学学院, 重庆 400715;3.贵州省民族药用生物资源研究与开发重点实验室, 贵州 兴义 562400)
采用改良的3×CTAB法提取荷花品种笛女、国庆红、红苔莲的叶片、叶柄和花不同部位的DNA,并对提取的DNA进行琼脂糖凝胶电泳检测、纯度检测和ISSR分析。结果表明,除叶柄中提取的DNA效果不理想外,其余从叶片、花中提取的DNA纯度高、得率高,OD260/280比值在1.80左右,OD260/230比值在2.01左右。以红苔莲的花为试材,对改良的3×CTAB法提取基因组DNA的参数进行正交试验,选出提取DNA的最优组合。通过荷花基因组DNA的ISSR分析,完全满足实验要求。
荷花; 基因组DNA; 不同部位; 改良的3×CTAB
荷花(NelumbonuciferaGaertn.)是睡莲科(Nymphaeaceae)莲属(Nelumbo)[1]的植物,也是被子植物中起源最早的古老植物之一,素有“活化石”之称。原产于中国和印度,是我国十大传统名花之一。
DNA分子标记研究的前提和基础就是制备高质量的基因组DNA[2]。荷花组织中含有大量的次生代谢产物、多糖和多酚,这些物质可能会干扰DNA的提取[3-4]。从富含次生代谢产物、多糖和多酚的荷花材料中提取高质量的基因组DNA更加困难[5-6]。目前,绝大多数学者以幼嫩的叶片为实验材料[7-8]提取基因组DNA,对植物材料不同部位DNA提取的比较研究报道较少。另外,对改良的3×CTAB法提取基因组DNA的参数进行正交试验也很少报道。
1 材料与方法
1.1 材 料
荷花品种笛女,国庆红,红苔莲的叶片、叶柄、花,均采自安龙招堤荷花池,采摘后用清水冲洗吸干后置于硅胶中干燥。
1.2 主要试剂
改良的3×CTAB法主要试剂。
STE核分离液:700 mmol/L NaCl;100 mmol/L Tris-HCl(pH=8.0);50 mmol/L EDTA (pH=8.0);2% PVP (W/V);2%β-巯基乙醇 (V/V)。
3×CTAB 核裂解液:100 mmol/L Tris-HCl(pH=8.0);50 mmol/L EDTA (pH=8.0);1.4 mol/L NaCl;3% CTAB (W/V);2% PVP (W/V)。
“PCN”溶液:0.067 5 g PVP,45μL 10% CTAB+4% NaCl。
1.3 DNA提取
1.3.1 改良的3×CTAB法具体步骤
参照桂腾琴[9]的提取方法略有改动。
1) 分别称取硅胶干燥笛女、国庆红,红苔莲的叶片、叶柄、花各0.2 g于灭过菌的预冷的研钵里,加入少量的PVP和2%β-巯基乙醇,用液氮研磨样品成粉末状立即加入600μL STE 核分离缓冲液,迅速研磨成糊状匀浆,小心转入1.5 mL离心管中,上下颠倒混匀。
2) 4℃下5 000 r/min离心10 min,取出弃上清。若上清很粘稠,用STE核分离液反复清洗后离心。
3) 在沉淀中加入65 ℃预热的3×CTAB核裂解液600μL和10μLβ-巯基乙醇,将材料轻轻混匀。65 ℃水浴60 min,每隔几分钟轻轻摇动离心管1次。
4) 取出冷却至室温,加入等体积氯仿/异戊醇(体积比24∶1)和“PCN”溶液(0.067 5 g PVP,45μL 10% CTAB+4% NaCl)摇匀,室温静置5 min后10 000 r/min 离心10 min。
5) 把上清液转入新的离心管,重复抽提2~3次,每次抽提时都加入“PCN”溶液去多糖。
6) 取上清,加入RNaseA 至终浓度为10μg/mL,37 ℃水浴保温30 min。取出后加入1/5体积 5 mol/L NaCl和2倍体积预冷的乙醇,颠倒摇匀,-20 ℃静置30 min沉淀DNA。
7) 挑出DNA集结成白色絮状,用70%的乙醇清洗2次,室温风干后溶于50μL TE中,放在-20 ℃备用。
1.3.2 DNA提取的正交试验
以荷花品种红苔莲的花瓣(硅胶干燥)为试材,进一步研究改良的3×CTAB法提取DNA过程中第1)步磨样前加入PVP和β-巯基乙醇量多少,第3)步水浴时间、第4)步离心转数等参数对提取DNA的影响,选用L9(34)正交表,因素-水平及正交试验设计见表1。
表1 DNA提取参数正交试验设计
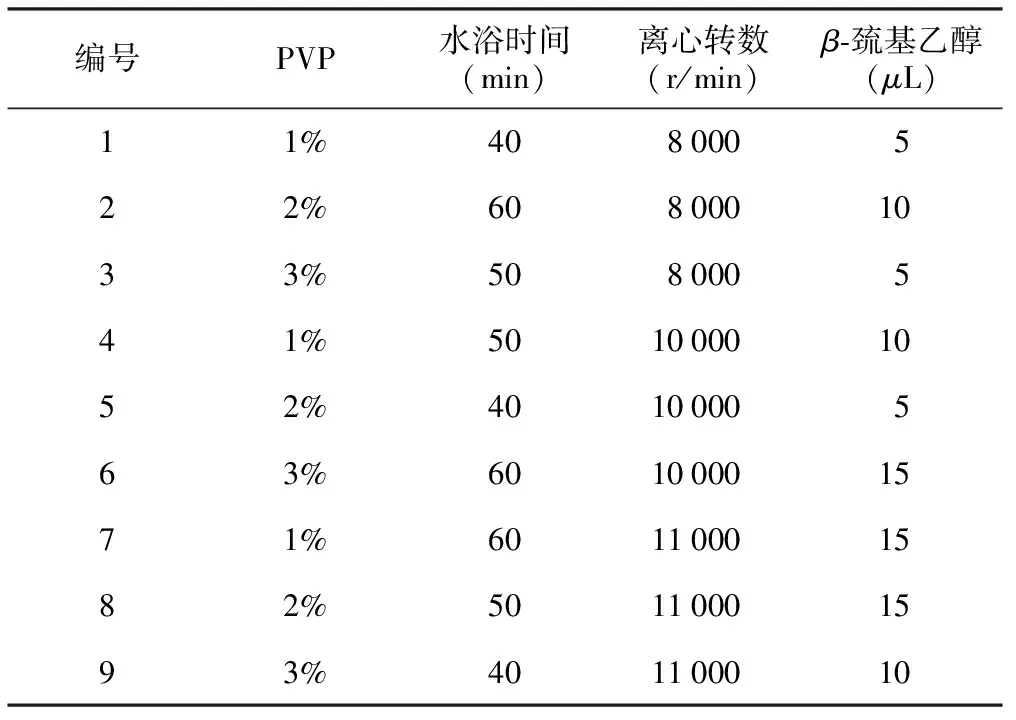
编号PVP水浴时间(min)离心转数(r/min)β⁃巯基乙醇(μL)11%408000522%6080001033%508000541%50100001052%4010000563%60100001571%60110001582%50110001593%401100010
1.4 DNA的检测方法
1.4.1 比色检测
DNA的纯度和浓度用紫外分光光度计检测,并根据公式计算DNA产率[10]。
1.4.2 电泳检测
取DNA原液10μL和2μL上样缓冲液,用1%的琼脂糖凝胶电泳检测,在Bio-RAD凝胶成像系统中观察照相和分析。
1.4.3 PCR检测
用改良的3× CTAB 法的最佳组合提取16个荷花栽培品种的DNA为模板进行ISSR-PCR扩增,扩增用引物为UBC 811,扩增体系参照桂腾琴[11]略有改动,即25μL反应体系中含0.2 mmol/L dNTPs,0.32μmol/L引物,10×buffer 2.5μL,2.0 mmol/L Mg2+,40 ng模板DNA,1 UTaqDNA聚合酶,用灭菌纯净水补至总体积为25μL。扩增程序为:94 ℃预变性5 min;94 ℃ 30 s,50.6 ℃ 30 s,72 ℃ 90 s,35 个循环;72 ℃延伸7 min。用1.4%的琼脂糖凝胶电泳检测PCR扩增产物,经染色和电泳后,照相并分析。

注:1、2、3分别为笛女、国庆红、红苔莲花的DNA;4、5、6分别为笛女、国庆红、红苔莲叶片的DNA;7、8、9分别为笛女、国庆红、红苔莲叶柄的DNA。图1 3个荷花品种不同部位DNA的琼脂糖凝胶电泳图谱

注:1~9分别代表表1的9种组合提取DNA。图2 正交试验提取DNA的琼脂糖凝胶电泳图谱
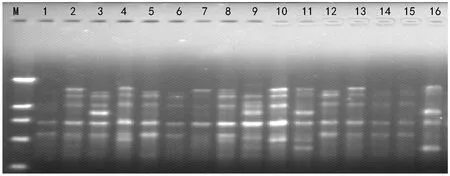
图3 引物UBC 811对部分荷花品种扩增的ISSR带型
2 结果与分析
2.1 荷花品种不同部位DNA纯度和产率的测定
表2 荷花品种不同部位提取DNA的检测结果
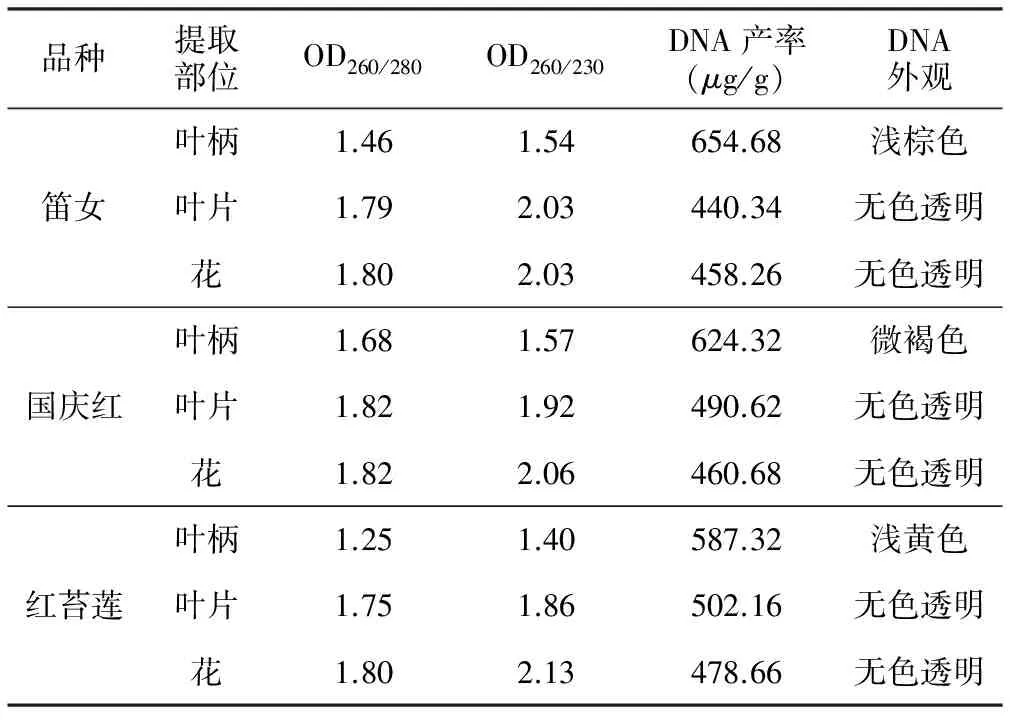
品种提取部位OD260/280OD260/230DNA产率(μg/g)DNA外观叶柄1.461.54654.68浅棕色笛女叶片1.792.03440.34无色透明花1.802.03458.26无色透明叶柄1.681.57624.32微褐色国庆红叶片1.821.92490.62无色透明花1.822.06460.68无色透明叶柄1.251.40587.32浅黄色红苔莲叶片1.751.86502.16无色透明花1.802.13478.66无色透明
从表2可以看出,3个品种的叶片、叶柄、花都能获得其基因组DNA,但是叶片和花基因组DNA,其OD260/280比值为1.75~1.82,平均1.80左右,表明提取的DNA纯度较高,无蛋白质、RNA、酚类及小分子等污染;而叶柄中提取的DNA,OD260/280比值为1.46左右(表2),OD260/230比值为1.40~1.57,平均为1.50,表明RNA及酚类去除不干净。总之,从叶片和花中提取DNA,比较纯。就DNA的产率而言,“叶柄中提取的DNAgt;叶片的DNAgt;花的DNA”(表2)。
2.2 DNA的电泳检测
3个荷花品种不同部位提取DNA的琼脂糖凝胶如图1所示,1~6点样孔处干净无荧光,去除蛋白质、多糖彻底,DNA主带清晰无降解。点样孔7,8,9分别是笛女、国庆红和红苔莲的叶柄DNA,点样孔处发亮,说明蛋白质、多糖去除不彻底,DNA有降解,RNA去除不彻底。
2.3 正交试验凝胶电泳检测结果
图2所示,正交实验中第8种组合提取DNA条带完整,点样孔处无杂质,效果最好,第5种组合效果最差。即改良的3×CTAB法提取基因组DNA时,第1)步磨样前加入PVP含量为2%、β-巯基乙醇15μL、第3)步水浴时间为50 min、第4)步离心转数11 000转,获得DNA纯度高,条带完整。
2.4 ISSR-PCR扩增结果检测
图3所示,用改良的3×CTAB法的最佳组合提取的荷花品种DNA为模板进行ISSR-PCR扩增,条带清晰,多态性条带丰富,说明此方法提取的DNA完全符合ISSR-PCR扩增需要。
3 讨 论
有研究表明,叶柄、老叶、根等组织器官中的酚、萜等次生代谢产物及多糖、蛋白质等对DNA的提取造成了困难[12],且这些物质随组织器官的增长而增加[10]。因此,实验室在提取荷花叶柄DNA、梨、桃等成熟叶片DNA时,提取DNA效果不理想。
荷花品种在没有开花之前,叶片及外形极其相似,因此,幼嫩叶片的采集给品种的鉴定带来了困难。幼叶的采集常常受到采集时间和季节的约束。野外采集样品时为保持材料的新鲜度经常用液氮迅速冷冻,但液氮的携带不方便,所以在野外采集或采样时间较长时,可将采集到的材料置于变色硅胶中干燥,可有效防止植物细胞死亡过程中次生物质的释放和DNA的降解[13-14]。
在改良的3×CTAB法提取DNA的过程中,对PVP、β-巯基乙醇、水浴时间、离心转数等参数进行了正交优化实验,结果第1)步磨样前加入PVP含量为2%、β-巯基乙醇15μL、第3)步水浴时间为50 min、第4)步离心转数11 000转,获得DNA纯度高,条带完整。在磨样前,加入2% PVP和β-巯基乙醇15μL能有效防止磨样和水浴过程中酚类氧化成醌[15]。陈静[16]、刘红艳[17]等用改良CATB法提取DNA时,在CTAB提取液中加入PVP 40,100 mmol/Lβ-巯基乙醇和10 mmol/L Na2S2O5,能获得高质量DNA。这些组合是提取中的关键步骤,能有效除去多糖和多酚等物质。而组合5,PVP含量为2%、β-巯基乙醇5μL时,提取的DNA为褐色,植物组织氧化严重,提取DNA的量少。
植物基因组DNA提取质量的好坏与样品的采集部位、保存方法[18]和提取方法[19-21]等有关。因此,在DNA提取过程中要综合考虑各种因素,才能获得高质量、比较纯的基因组DNA,满足后续实验要求。
[1]张行言.中国荷花新品种图志Ⅰ[M].北京:中国林业出版社,2011.
[2]刘塔斯,林丽关,龚力民,等.分子标记中植物DNA提取方法的研究进展[J].中南药学,2005,3(6):370-373.
[3]李金璐,王硕,于婧,等.一种改良CTAB法提取植物DNA[J].植物学报,2013,48:72-78.
[4]Amaini J,Kazemi R,Abbasi AR,et al.A simple and rapid leaf genomic DNA extraction method for polymerase chain reaction analysis[J].Iranian Journal of Biotechnology,2011,9:69-71.
[5]Muhammad I,Zhang TT,Wang Y,et al.Modification of CTAB protocol for maize genomic DNA extraction[J].Research journal of Biotechnology,2013,8:41-45.
[6]Sahu SK,Thangaraj M,Kathiresan K.DNA extraction protocol for plant with high levels of secondary Metabolites and Polysac-charides without using liquid nitrogen and phenol[J].ISRN Molecular Biology,2012,6(4),205049.
[7]房经贵,章镇,刘大均,等.一种从贮藏较久番茄叶中提取适于PCR扩增的DNA的方法[J].植物生理学通讯,2000,2(1):47-50.
[8]祝军,王涛,赵玉军,等.应用AFLP分子标记鉴定苹果品种[J].园艺学报,2000,27(2):102-106.
[9]桂腾琴.果梅ISSR标记与遗传多样性分析[D].重庆:西南大学,2008:14-15.
[10]佟兆国,王富荣,章镇,等.一种从果树成熟叶片提取DNA的方法[J].果树学报,2008,25(1):122-125.
[11]桂腾琴,孙敏,陆春莲,等.梨ISSR-PCR反应体系的正交优化研究[J].西南师范大学学报(自然科学版),2014,39(12):37-43.
[12]彭建营,束怀瑞,彭士琪.一种适合枣和酸枣基因组DNA的提取方法[J].河北农业大学学报,2000,10(4):46-49.
[13]朱田田,杜弢,晋玲,等.不同保存方法对中麻黄基因组DNA提取效果的影响[J].山西农业科学,2013,41(1):23-25,29.
[14]张国防,陈存及,邢建宏.樟树干叶DNA提取方法的研究[J].江西农业大学学报,2006,28(1):111-114.
[15]宋艳波,吴国良,牛洪斌.改良CTAB法在核桃叶片基因组DNA提取中的应用研究[J].山西农业大学学报(自然科学版),2011,31(2):109-112.
[16]陈静,王文江.适于AFLP分析的核桃叶DNA提取方法[J].河北农业大学学报,2004,27(6):44-47.
[17]刘红艳.卡特兰的DNA提取方法研究[D].北京:中国林业科学研究院,2014,07.
[18]高柄淼,王朝,何萍,等.野外保存对益智叶片基因组DNA的影响[J].贵州农业科学,2005,43(7):19-22.
[19]罗强,恒春娜,段世华.山茶属(CamelliaL.)植物叶片基因组DNA不同提取方法的比较[J].井冈山大学学报(自然科学版),2014,35(4):40-43.
[20]丁浩,郑唐春,梁德洋,等.一种简易高效提取多种植物纯净DNA的方法[J].植物研究,2015(3):457-461.
[21]陈林杨,宋敏舒,查红光,等.一种改良的植物基因组DNA通用提取方法[J].植物分类与资源学报,2014(3):457-461.
(本栏目责任编辑:周介雄)
Comparative Study on Extraction of DNA from Different Parts ofNelumbonuciferaGaertn.
GUITengqin1 ,2,3,WUWei1,LUPeng1,WANGYingjuan1,ZHANGWanqin1,MACaiyu1,CHENPeng1
(1.School of Biology and Chermistry,Xingyi Normal University for Nationalities,Xingyi Guizhou 562400,China;2.College of Life Science,Southwest University,Chongqing 400715,China;3.Research and Development of Biological Resources,Key Laboratory of National Medicine,Xingyi Guizhou 562400,China)
Genomic DNA ofNelumbonuciferaGaertn.was extracted from different parts of three cultivars ofNelumbonuciferaGaertn.,Dinv,Guoqinghong,and Hongtailian. Yield and purity of total genomic DNA was detected by agarose gel electrophoresis and UV-spectrophotomoter.Results showed that,extraction effect of DNA from the petiole was not ideal,the purity of DNA extracted from the leaves and flowers were high.OD260/280was 1.80 or so.OD260/230was 2.01 or so.Taking the flowers of cultivars Hhongtailian as material,orthogonal experiment was carried out on the parameters of genome DNA extracted by the modified 3×CTAB method,and the optimal combination of DNA extraction was selected.When tested through the DNA-ISSR analysis,experiment requirement was met perfectly.
NelumbonuciferaGaertn.; genomic DNA; different parts; the modified CTAB method
2016-02-10
贵州省科技厅联合基金项目(编号:黔科合LH字[2014]7413号);2015年国家级大学生创新创业训练计划项目(No.201510666015)。
桂腾琴(1977—),女(回族),贵州安龙人;副教授,理学硕士,主要从事植物生物技术的研究。
10.16590/j.cnki.1001-4705.2016.07.041
S 682.32
A
1001-4705(2016)07-0041-04
