利用重组自交系群体定位玉米种子活力相关生理性状的QTL
2016-12-04河南科技大学农学院河南洛阳471003河南农业大学农学院郑州45000
, , , , , , (1.河南科技大学农学院, 河南 洛阳 471003; .河南农业大学农学院, 郑州 45000)
·研究报告·
利用重组自交系群体定位玉米种子活力相关生理性状的QTL
韩赞平1,2,陈彦惠2,张亚奇2,张良坤2,任真真2,苏慧慧2,赵西拥2
(1.河南科技大学农学院, 河南 洛阳 471003; 2.河南农业大学农学院, 郑州 450002)
种子是农作物生产的物质基础,种子质量直接影响农业生产的成效。种子活力是衡量种子质量和应用价值最重要的指标之一,活力高的种子发芽迅速整齐、幼苗均匀、生长健壮,同时可以节约播种量,减少劳力投入,降低生产成本,提高农业生产效益。QTL定位和克隆是解析玉米农艺性状遗传基础的重要手段。本研究以基于豫537 A×沈137构建的一个RILs群体的212个家系为材料,利用SNP分子标记技术构建的高密度的分子遗传连锁图谱,采用复合区间作图法定位了超氧化物歧化酶活性、过氧化物酶活性、过氧化氢酶活性、丙二醛含量等玉米种子活力相关生理指标的QTL,共检测到11个QTLs,分别分布在第1、2、4、6、7、8条等6条染色体上,单个QTL的贡献率介于5.52%~12.10%之间,这些QTL的确定有助于开展分子标记辅助选择种子活力相关性状。
玉米; 种子活力; 数量性状位点定位; 重组自交系; 生理性状
表1 亲本及RIL群体家系4个生理性状表型的平均表现
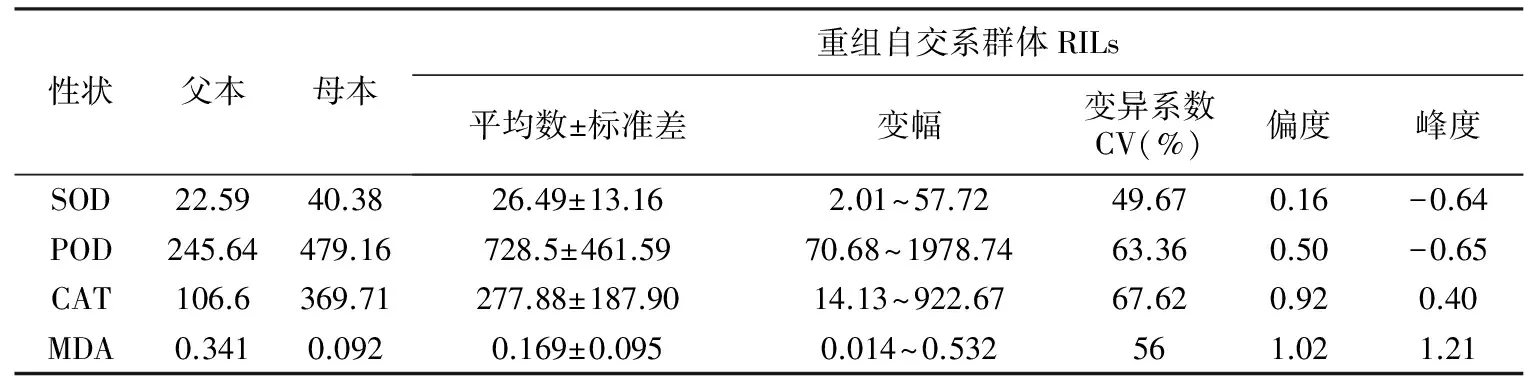
性状父本母本重组自交系群体RILs平均数±标准差变幅变异系数CV(%)偏度峰度SOD22.5940.3826.49±13.162.01~57.7249.670.16-0.64POD245.64479.16728.5±461.5970.68~1978.7463.360.50-0.65CAT106.6369.71277.88±187.9014.13~922.6767.620.920.40MDA0.3410.0920.169±0.0950.014~0.532561.021.21
种子活力是在种子发育过程中形成的,贮藏物质的积累是种子活力形成的基础。伴随着种子成熟,体内的蛋白质、淀粉等物质逐渐积累,种子的发芽率及活力也逐渐提高,至生理成熟期达到高峰[1],之后即进入活力降低、逐渐衰老的过程,种子活力的下降是通过系列的生理生化变化而表现出来的,首先体现在细胞膜保护系统酶活性丧失、蛋白变性,进而生理代谢失调。植物在长期进化过程中形成了完善和复杂的抗氧化保护系统来清除活性氧,提高对氧化胁迫的抗性[2]。目前,对于种子中过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和丙二醛(MDA)的表型研究比较广泛和深入,它们的活性和种子发芽率呈现极高的相关性[3-4]。随着分子标记技术日新月异的发展和QTL研究的不断深入,在作物数量遗传方面,有从研究形态性状QTLs转向生理生化性状、酶以及代谢产物的QTLs的趋势。与形态性状相比较,生理性状与基因表达的关系比农艺性状更为密切,在酶结构基因和控制其酶活性以及相应的产物或底物含量的QTLs之间找到共同位点的可能性也更大,从而更好地揭示QTL的功能[5-8]。因此,借助分子生物学的技术手段,开展对种子活力相关生理性状QTL的分析研究,具有重要的应用价值。
本研究基于豫537 A×沈137构建的一套重组自交系群体,通过测定萌发种子中SOD、POD、CAT和脱氢酶的活性,并对调控各个生理性状的QTL进行了检测和加性效应分析,为进一步深入研究生理性状的分子遗传基础以及实现分子标记辅助选择、培育具有优良生理特性和高活力的玉米种质提供参考。
1 材料与方法
1.1 材 料
本研究所用材料为基于豫537 A×沈137获得的一套包含212个家系的重组自交系群体。其中,豫537 A是由河南农业大学用豫综 5号C2改良群体,采用轮回选择的方法,连续自交6代选育而成的玉米自交系;沈137是沈阳农业科学院利用国外杂交种 6 JK-111选育而成的玉米自交系。
1.2 方 法
精选生理状态一致的亲本和重组自交系群体各个家系种子各30粒,先用5%的次氯酸钠溶液对种子消毒5 min,用无菌水清洗8遍,之后用无菌水浸泡12 h,然后置于12.5 cm口径内铺3层滤纸的培养皿中,每皿加入35 mL无菌水,写上标号,置于人工气候室[温度为(28±1)℃,相对湿度为65%,光照强度4 000 lx]进行种子萌发,3次重复,每日固定时间定量补水,第3天取样。 称取1 g萌发种子,用镊子剥去种皮,放入少量石英砂,加6 mL 0.05 mol/L(pH=7.8)的磷酸缓冲液,冰浴中研磨,在4 ℃,12 000 r/min条件下离心30 min,取上清液。采用NBT(氮蓝四唑)法测定SOD活性;以愈创木酚法测定POD活性;利用可见光分光光度法测定过氧化氢酶活性;以硫代巴比妥酸法测定丙二醛含量。各个指标的测定方法参照宋松泉等[9]的方法。
1.3 数据统计分析方法
利用SPSS 17.0统计分析软件计算亲本和重组自交系群体家系的平均数以及其它描述性统计、相关以及方差分析。
1.4 QTL分析和命名
利用该RIL群体业已构建的包括1 139个SNP标记的遗传图谱[10],采用WinQTL cart 2.5软件以复合区间作图法[11]检测SOD活性、POD活性、CAT活性和丙二醛含量的主效QTL,以Plt;0.05和LODgt;2.5为阀值来判断QTL的存在。QTL命名按照“q+性状的英文简写+所在染色体+QTL编号”的规则进行。如qSOD1-1表示位于1染色体上SOD的QTL。
2 结果与分析
2.1 所测4个生理性状在亲本和RIL群体中的平均表现
亲本及RIL群体的212个家系所测定的4个生理性状的平均值如表1。由表1可以看出,2个亲本的4个生理性状存在明显差异。同母本豫537 A相比,父本沈137的SOD、 POD、 CAT的表型值低,而MDA含量高。RIL群体中,所测定的4个生理性状都表现出超亲分离,SOD、 POD、 CAT和 MDA的变异系数依次为49.67%、63.36%、67.62%和56%,变化幅度大。从它们的偏度和峰度表现,可以判断4个性状的表型呈正态分布,表现出数量性状遗传的特点,满足QTL定位的基本要求。
表4 所测4个生理性状的QTL检测结果
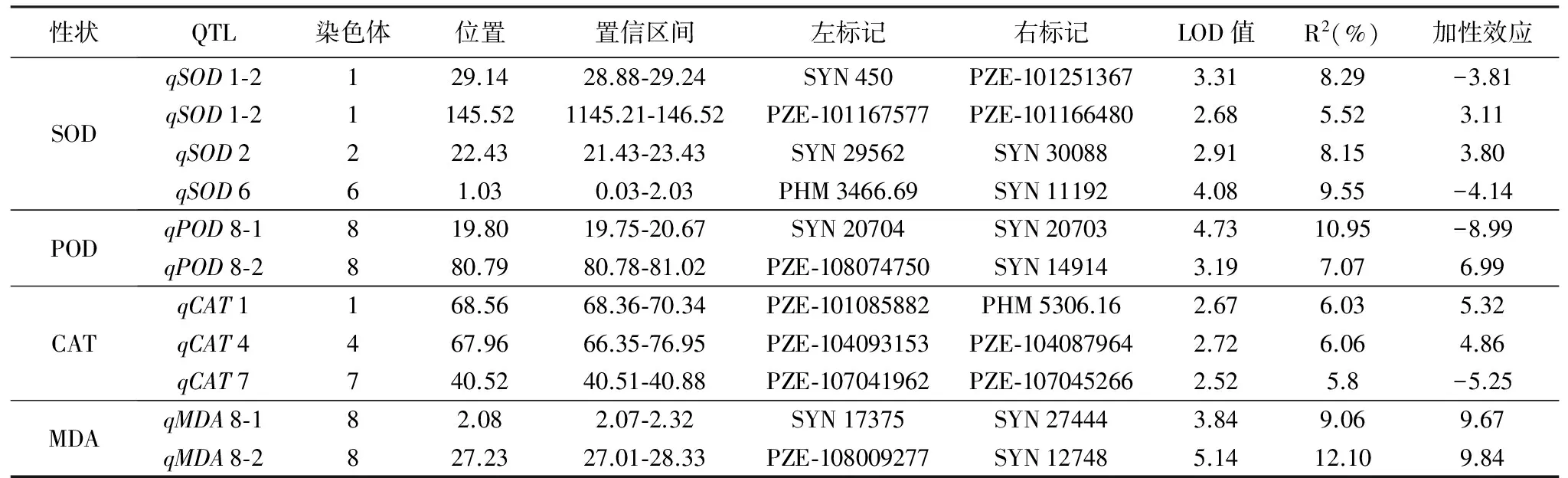
性状QTL染色体位置置信区间左标记右标记LOD值R2(%)加性效应SODqSOD1⁃2129.1428.88⁃29.24SYN450PZE⁃1012513673.318.29-3.81qSOD1⁃21145.521145.21⁃146.52PZE⁃101167577PZE⁃1011664802.685.523.11qSOD2222.4321.43⁃23.43SYN29562SYN300882.918.153.80qSOD661.030.03⁃2.03PHM3466.69SYN111924.089.55-4.14PODqPOD8⁃1819.8019.75⁃20.67SYN20704SYN207034.7310.95-8.99qPOD8⁃2880.7980.78⁃81.02PZE⁃108074750SYN149143.197.076.99CATqCAT1168.5668.36⁃70.34PZE⁃101085882PHM5306.162.676.035.32qCAT4467.9666.35⁃76.95PZE⁃104093153PZE⁃1040879642.726.064.86qCAT7740.5240.51⁃40.88PZE⁃107041962PZE⁃1070452662.525.8-5.25MDAqMDA8⁃182.082.07⁃2.32SYN17375SYN274443.849.069.67qMDA8⁃2827.2327.01⁃28.33PZE⁃108009277SYN127485.1412.109.84
2.2 所测4个生理性状表型的相关性分析
对RIL群体家系4个生理性状表型进行的相关性分析结果如表2。由表2可以看出,所测定的4个生理性状之间相关性均没有达到极显著水平(α=0.01)。SOD与CAT呈显著的负相关(r=-0.190*),POD与MDA呈显著的正相关(r=0.188*),其它的均为相关但未达到显著水平。说明所测4个相关生理指标存在着一定的内在联系,对高活力玉米品种的选育有一定的参考意义。
表2 RIL群体家系4个生理性状表型的相关性分析
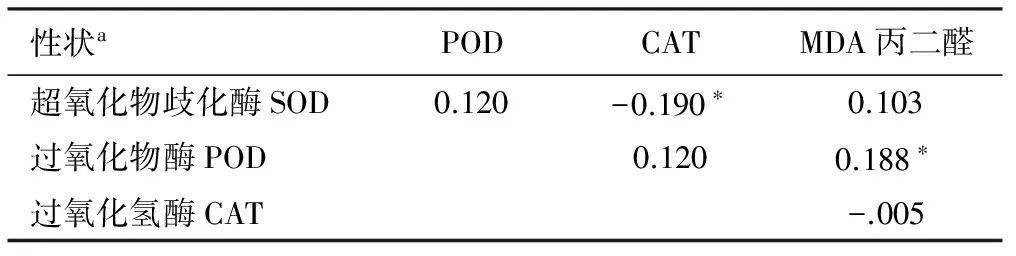
性状aPODCATMDA丙二醛超氧化物歧化酶SOD0.120-0.190∗0.103过氧化物酶POD0.1200.188∗过氧化氢酶CAT-.005
注:“*”表示α=0.05的显著水平,“**”表示α=0.01的显著水平。
2.3 所测4个生理性状表型的方差分析
对所测定的RIL群体家系4个生理性状表型数据进行方差分析,结果如表3。由表3可以看出,所测定的4个生理性状在各家系间差异极显著(plt;0.001),重复之间差异不显著,说明重组自交系各个家系遗传差异显著。
表3 RIL群体家系4个生理性状表型的方差分析

性状家系重复F值pSOD487.94∗∗99.926.26;0.001POD597772.14∗∗169911.6315.85;0.001CAT90417.52∗∗730.147.59;0.001MDA0.00789∗∗0.001212.97;0.001
2.4 所测4个生理性状QTL效应分析
对正常环境条件下亲本和重组自交系群体各个家系萌发的种子,以测得SOD活性、POD活性、CAT活性和 MDA含量等4个生理性状的表型值为指标,对其进行了加性QTL分析,结果列于表4,共检测到11个QTLs,其中4个调控SOD活性、2个调控POD活性、3个调控CAT活性和2个调控MDA含量(表4),分别分布在第1、2、4、6、7、8条等6条染色体上,单个QTL的贡献率为5.52%~12.10%。
检测到的4个控制SOD活性的QTLs中,2个位于第1染色体上,另外2个分别位于第2和第6染色体上,单个QTL的贡献率为5.52%~9.55%。位于第1染色体上2个QTL的贡献率分别为8.29%和5.52%,qSOD1-2增效等位基因分别来自于豫537 A,qSOD1-2增效等位基因来自于沈137。位于第2染色体上1个QTL的贡献率为8.15%,加性效应为3.80,增效等位基因来自豫537 A,位于第6染色体上PHM 3466.69-SYN 11192之间的1个QTL的贡献率最高,为9.55%,增效等位基因来自于沈137。
检测到的2个控制POD活性的QTLs均位于第8染色体上,分别介于SYN 20704-SYN 20703和PZE-108074750-SYN 14914之间,贡献率依次为10.95%和7.07%,加性效应分别为-8.99和6.99,增效等位基因分别来自沈137和豫537 A,qPOD8-1可能是调控POD活性的主效QTL。
检测到3个控制CAT活性的QTLs,分别分布于第1、4、7染色体上,单个QTL的贡献率为5.8%~6.06%。位于第1染色体上PZE-101085882-PHM 5306.16之间的1个QTL的贡献率为6.03%,加性效应为5.32,qCAT1增效等位基因分来自于豫537 A。位于第4染色体上PZE-104093153-PZE-104087964之间的qCAT4的贡献率为6.06%,加性效应为4.86,增效等位基因来自豫537 A,位于第7染色体上PZE-107041962-PZE-107045266之间的qCAT4的贡献率为5.8%,增效等位基因来自于沈137。
检测到2个控制MDA含量的QTLs,即qMDA8-1和qMDA8-2,均位于第8染色体上,分别介于PZE-104144719-PUTV 163 a-60354034-2731和PZE-104106375-PZE-104106033之间,贡献率依次为9.06%和12.10%,加性效应分别为9.67和9.84, 增效等位基因来自豫537 A,qMDA8-2可能是调控MDA含量的主效QTL。
3 讨 论
对于生理生化性状的QTL定位研究,水稻[6,12]、小麦[8]已有报道,玉米上鲜有报道。本研究利用一套包含212个家系的重组自交系群体,测定了SOD活性、POD活性、CAT活性和 MDA含量等4个生理性状的表型,分析了它们的平均表现(表1)、表型相关性和差异显著性(表2、表3),对其进行了QTL分析,共检测到11个QTLs,分别为控制SOD活性的4个QTLs、控制POD活性的2个QTLs、控制CAT活性的3个QTLs和控制MDA含量的2个QTLs,分布在第1、2、4、6、7、8等6条染色体上,单个QTL的贡献率为5.52%~12.10%(表4)。
定位群体表型数据的可靠性一定程度上会影响QTL定位结果的准确性[13-14],对于酶活性等生理生化性状的测定,要面对实验样品量大、各个性状或者指标测定步骤繁杂、人工操作及环境影响因素多的问题。在本实验中,从选择生理状态同质的种子、种子处理、取样、研磨以至数据读取,均为专人操作,确保了实验的重复性以及测定是操作的统一性和可靠性,同时最大程度避免了由于生理状态的差异导致在后期出现的分离现象。
本研究所测定的生理性状,SOD是一种专门清除体内超氧阴离子自由基的金属酶,有保护细胞膜不受自由基损伤的生理功能。POD是一种广泛存在于植物体内,与呼吸作用、光合作用及生长素的氧化等生物活动密切相关的活性较高的酶。在植物生长发育过程中活性不断发生变化,能使组织中所含的某些碳水化合物转化成木质素,增加木质化程度,因而一般在老化组织中活性较高,幼嫩组织中则活性较弱。CAT主要催化H2O2分解为H2O与O2,阻碍H2O2与O2在铁螯合物作用下发生生成非常有害的-OH的反应。MDA是自由基作用于生物体发生脂质过氧化反应后的氧化终产物,它的累积能够引起蛋白质、核酸等生命大分子物质的交联聚合,产生细胞毒性。本研究表明,SOD活性与CAT活性呈显著负相关(r=-0.190*)、POD活性与MDA含量的表型呈显著正相关(r=0.188*),其它彼此之间相关,不论相关性质如何,都相关不显著。同其他研究者所表明的SOD、POD、CAT和 MDA之间的相关关系随着材料、时期、处理的不同而呈现出不同的结果相一致[15-16]。
本试验共检测到11个QTLs参与调控所测SOD、POD、CAT和MDA含量,没有检测到协同的QTL位点,表型相关显著的SOD与CAT、POD与MDA含量均在相同的染色体上检测到分布的QTL,但没有分布于相同或者临近标记区间的,说明SOD活性与CAT活性以及POD活性与MDA含量有着部分相同的遗传机制,不同生理生化表型的遗传机制是不同的。从生化的角度来说,每个生理生化表型不仅受到多基因的调控,而且受到代谢途径中不同调节因子的影响,最终造成了定位群体中生理生化表型的差异表现,生理生化性状遗传的复杂性可见一斑。
玉米的QTL定位研究已进行了很多,但主要集中在植株形态、产量和品质性状上[17-21],强化玉米生理生物特性的遗传机理研究,尤其是将生理生化表型与相关的植株形态、产量、生理性状及基因的表达信息有机结合在一起,必将更加有利于全面认识玉米复杂性状的遗传基础和作用机制。
[1]孙群,王建华,孙宝启.种子活力的生理和遗传机理研究进展[J].中国农业科学,2007,40(1):48-53.
[2]Cadenas E.Biochemistry of oxygen toxicity [J].Annual review of biochemistry,1989,58(1):79-110.
[3]Tang ZJ,Song M.Physiological and biochemical analysis of artificially aged Chinese cabbage [BrassicacampestrisL.ssp.Pekinensis(Lour.)Olsson][J].Acta Horticulturae Sinica,1999,26(5):319-322.
[4]Cui K,Peng S,Xing Y,et al.Molecular dissection of seedling-vigor and associated physiological traits in rice[J].Theoretical and Applied genetics,2002,105(5):745-753.
[5]Prioul JL,Pelleschi S,Séne M,et al.From QTLs for enzyme activity to candidate genes in maize[J].Journal of Experimental Botany,1999,50(337):1 281-1 288.
[6]沈波.水稻的生理遗传研究[D].中国农业科学院,2005.
[7]卫宪云.小麦的遗传作图和衰老相关生理性状的QTL分析[D].山东农业大学,2006.
[8]Jiang P,Wan Z,Wang Z,et al.Dynamic QTL analysis for activity of antioxidant enzymes and malondialdehyde content in wheat seed during germination[J].Euphytica,2013,190(1):75-85.
[9]宋松泉,程红焱,龙春林,等.种子生物学研究指南[M].北京:科学出版社,2005.
[10]韩赞平.玉米种子活力相关性状QTL定位及相关基因的克隆[D].河南农业大学,2014.
[11]Zeng ZB.Precision mapping of quantitative trait loci[J].Genetics,1994,136:1 457-1 468.
[12]汪斌.水稻耐盐性和叶绿素含量的遗传剖析[D].福建农林大学,2002.
[13]Ashfield T,Bocian A,Held D,et al.Genetic and physical localization of the soybean Rpg 1-b disease resistance gene reveals a complex locus containing several tightly linked families of NBS-LRR genes [J].Molecular Plant-Microbe Interactions,2003,16(9):817-826.
[14]黎裕,王天宇,石云素,等.玉米抗旱性的OTL分析研究进展和发展趋势[J].干旱地区农业研究,2004,24(1):32-39.
[15]路萍,张利,王萌,等.涝胁迫对不同丹参品系苗期保护酶活性及脂质过氧化作用的影响[J].浙江大学学报(农业与生命科学版),2013,39(1):56-61.
[16]赵昶灵,王树会.剪叶对云南烤烟漂浮苗抗氧化酶活性和根系形态建成的效应[J].云南农业大学学报,2014,29(1):84-92.
[17]Mickelson SM,Stuber CS,Senior L,et al.Quantitative trait loci controlling leaf and tassel traits in a B 73×Mo 17 population of maize[J].Crop Science,2002,42(6):1 902-1 909.
[18]于永涛,张吉民,石云素,等.利用不同群体对玉米株高和叶片夹角的QTL分析[J].玉米科学,2006,14(2):88-92.
[19]郑祖平,黄玉碧,田孟良.不同供氮水平下玉米株型相关性状的QTLs定位和上位性效应分析[J].玉米科学,2007,15(2):14-18.
[20]汤继华,严建兵,马西青,等.利用“永久F2”群体剖析玉米产量及其相关性状的遗传机制[J].作物学报,2007,33(8):1 299-1 303.
[21]库丽霞.玉米株型相关性状分子遗传机理研究[D].河南农业大学,2010.
The QTL Mapping of Related Physiological Characteristics of Maize Seed Vigor by Recombinant Inbred Lines Population
HANZanping1,2,CHENYanhui2,ZHANGYaqi2,ZHANGLiangkun2,RENZhenzhen2,SUHuihui2,ZHAOXiyong2
(1.College of Agriculture,He’nan University of Science and Technology,Luoyang He’nan 471003,China;2.College of Agriculture,He’nan Agricultural University,Zhengzhou 450002,China)
Seed is the basis of the crop production and its quality affects the efficiency of agricultural production directly.Seed vigor is the most important indicator of seed quality and application value.High vigor is a complex seed property that determines its potential for rapid uniform emergence,What’s more,it can save rate,reduce the labor input and the production cost and improve agricultural output efficiency greatly.QTL mapping and cloning is an important means to analyse the genetic basis of agronomic traits in maize.In the present study,based a set of recombinant inbred line (RIL) population which were obtained from Yu 537 A×Shen 137 and contain 212 family lines as materials,a high-density molecular linkage map was constructed by using single nucleotide polymorphism (SNP) molecular marker technology.Through composite interval mapping method,the QTL of seed vigor related physiological traits were detected,including activity of superoxide dismutase,peroxidase activity,catalase activity,malondialdehyde.In total,eleven QTLs were detected and located on chromosomes 1,2,4,6,7 and 8,with the explanation of phenotypic variation from 5.22% to 12.10% of a single QTL.These results provided valuable information for marker assisted selection of seed vigor.related trait in crop breeding.
maize; seed vigor; QTL mapping; recombinant inbred lines; physiological traits
2016-03-17
国家自然基金项目计划(编号:U 1504315);河南科技大学青年基金(编号:2015 QN 031);河南科技大学科研启动基金(编号:13480067)。
韩赞平(1975—),男,河南孟津人;博士,讲师,主要从事玉米遗传改良研究。
10.16590/j.cnki.1001-4705.2016.07.001
S 513
A
1001-4705(2016)07-0001-05
