吉林省西洋参栽培群体种子表型多样性研究
2016-12-04中国农业科学院特产研究所吉林长春30潍坊工程职业学院应用化学与生物工程学院山东潍坊6500
, , , (.中国农业科学院特产研究所, 吉林 长春 30;.潍坊工程职业学院应用化学与生物工程学院, 山东 潍坊 6500)
吉林省西洋参栽培群体种子表型多样性研究
张浩1,邵财1,郑颖2,王英平1
(1.中国农业科学院特产研究所, 吉林 长春 130112;2.潍坊工程职业学院应用化学与生物工程学院, 山东 潍坊 262500)
采用方差分析、多重比较等多种分析方法对吉林省西洋参栽培区13个群体种子单株种子数、千粒重、种子长、种子宽、种子厚5个表型性状进行研究,以系统揭示西洋参栽培群体种子表型性状的变异程度和变异规律。结果表明:西洋参种子单株种子数、种子宽在群体间和群体内均达到显著或极显著差异,而千粒重、种子长及种子厚仅在群体内存在极显著差异,说明西洋参种子性状在2个层次上都具有丰富的多样性。5个种子性状平均变异系数为0.161 9,变异幅度为0.088 2~0.314 9,其中单株种子数最大,为0.314 9,种子长最小,为0.088 2,各群体平均变异系数最大的是延吉2,最小的是汪清。各性状的平均表型分化系数(Vst)为9.8%,即群体间的变异(8.31%)远低于群体内的变异(49.49%)。群体内的变异是吉林省西洋参栽培群体的主要变异来源。
西洋参; 多样性; 表型性状
西洋参(PanaxquinquefoliumL.)又名花旗参,原产加拿大和美国,为五加科西洋参的干燥根,是名贵的中药材。具补气养阴,清热生津的功效。用于气虚阴亏,内热,咳喘痰血,虚热烦倦,消渴,口燥咽干[1]。20世纪80年代我国引种成功,随着长期栽培及生产实践,中国已成为西洋参第一大消费国,世界第二大生产国和世界三大主产地之一[2]。
植物表型性状反映了基因型对环境变化的适应,在长期的选择压力下发生不可逆变化,经稳定遗传后产生新表型,因此表型变异在适应和进化上具有重要意义[3]。表型性状具有稳定、不易受环境影响的特点,可以简便快速地揭示群体的遗传变异程度。种子性状的变异是表型变异的重要组成部分,影响到种子的传播和萌发,决定物种的扩散能力和种群的分布格局。种实表型性状变异与地理纬度、海拔高度和气候相关[4-7]。种子表型变异具有较高的稳定性,通过了解种子表型的变异规律,可获得该植物群体变异趋势的一般规律,并且可以为种子鉴别、种子检验、种子划区以及播种育苗等工作提供参考。目前,对西洋参种子表型多样性变异的研究尚未见报道。为此,本研究对西洋参主产区吉林省的13个栽培群体种子性状变异进行分析,以期初步了解和掌握西洋参主产区种子的变异规律和变异趋势,为今后开展西洋参种质资源收集、保存、多样性及育种研究工作提供理论依据。
1 材料和方法
1.1 实验材料
在勘查的基础上,于2014年11月完成所有西洋参种子表型性状的采集工作。取样地点分别为吉林省集安1(JA 1)、集安2(JA 2)、集安3(JA 3)、抚松(FS 1)、抚松2(FS 2)、靖宇(JY)、安图(AT)、延吉1(YJ 1)、延吉2(YJ 2)、和龙(HL)、汪清(WQ)、长白1(CB 1)、长白2(CB 2)8个地点13个栽培群体,每个个体采集30~100粒种子。
1.2 表型测定
测定内容包括种子的长、宽、厚、千粒重,用游标卡尺测定每粒种子的长、宽和厚。随机取500粒种子称其重量,换算成千粒重,重复3次,取平均值。上述长、宽、厚测量精度均为0.01 cm,重量测量精度为0.01 g。
1.3 统计分析
各性状采用巢式设计方差分析[8-11],线性模型为:
Yijk=μ+τi+δj(i)+εk(ij)
表1 西洋参群体间群体内表型性状的方差分析结果
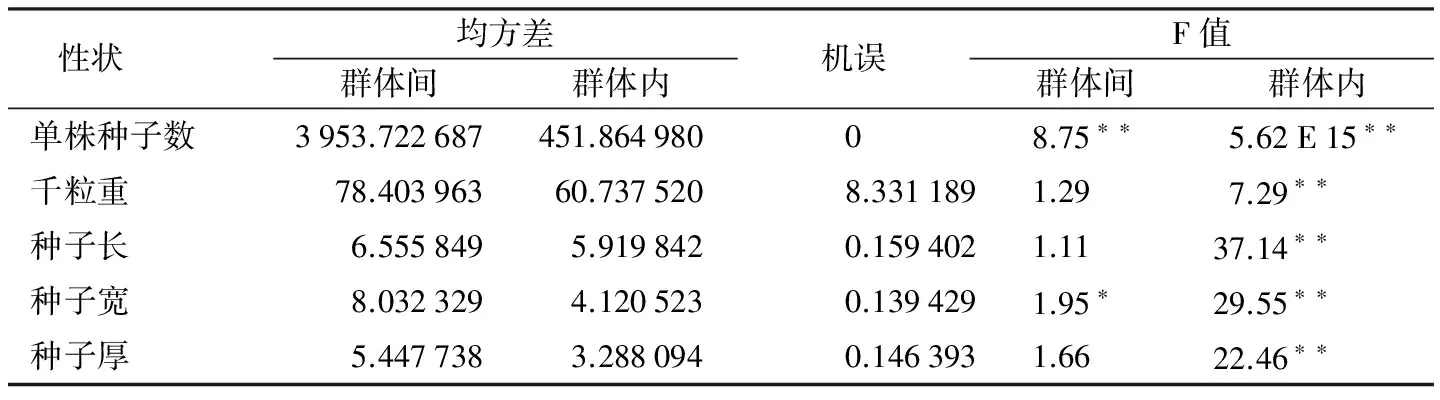
性状 均方差群体间群体内机误F值群体间群体内单株种子数3953.722687451.86498008.75∗∗5.62E15∗∗千粒重78.40396360.7375208.3311891.297.29∗∗种子长6.5558495.9198420.1594021.1137.14∗∗种子宽8.0323294.1205230.1394291.95∗29.55∗∗种子厚5.4477383.2880940.1463931.6622.46∗∗
注:“*”表示差异显著(plt;0.05),“**”表示差异极显著(plt;0.01)。
表2 西洋参13个栽培群体表型性状的平均值和标准差

群体单株种子粒数千粒重种子长种子宽种子厚WQ37±7.202e36.08±5.755ab5.842±0.466a4.897±0.397a2.741±0.36abYJ135.41±9.273e35.51±10.29ab5.835±0.601a4.828±0.536ab2.886±0.399aYJ235.71±20.544e35.79±3.172ab5.868±0.483a4.75±0.435ab2.864±0.433aFS147.36±19.58cde34.29±5.063ab5.976±0.465a4.706±0.489ab2.662±0.443abFS249.87±23.137cd35.85±6.14ab5.936±0.579a4.929±0.467a2.688±0.379abAT36.23±9.949e35.46±3.292ab5.953±0.557a4.727±0.417ab2.908±0.821aJY36.72±11.247e33.17±5.903b5.68±0.558a4.591±0.471b2.57±0.372bHL41.36±16.488de33.83±2.829b5.669±0.435a4.578±0.384b2.732±0.351abCB164.86±15.87ab36.70±5.995ab5.815±0.521a4.785±0.476ab2.728±0.516abCB269.93±15.52a38.35±5.792ab5.886±0.439a4.889±0.397a2.767±0.393abJA153.35±11.883bcd36.91±6.762ab6.004±0.507a4.798±0.506ab2.784±0.417abJA255.86±14.156bc39.20±4.361a5.958±0.476a4.967±0.484a2.841±0.409aJA357.05±14.97bc35.61±6.022ab5.814±0.636a4.794±0.501ab2.659±0.381ab
注:同列不同小写字母表示群体间差异达显著水平(plt;0.05)。
其中,Yijk为第i个群体第j个家系第k个观测值,μ为总平均值,τi为群体间效应值,δj(i)为群体内家系效应值,εk(ij)为随机误差。
群体间表型分化系数(Vst)可以反映群体间的表型分化值,即群体间变异占遗传总变异的百分比。

变异系数(CV)表示表型性状的离散程度。
CV=S/x
式中,S为标准差,x为平均值。
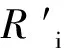
式中,Ri为群体内的极差,Ro为性状总极差。
其它统计运算按照常规方法并利用Excel 2003和SAS 8.0软件进行。
2 结果与分析
2.1 西洋参栽培群体间和群体内的形态变异特征
西洋参种子5个表型性状中单株种子数在群体间差异极显著(plt;0.01),种子宽在群体间差异显著(plt;0.05),千粒重、种子长、种子厚在群体间差异不显著;而5个表型性状在群体内都存在极显著差异(plt;0.01)(表1),表明西洋参种子在群体内存在广泛的变异。各性状平均值和多重比较结果(表2)表明,不同群体的西洋参种子单株粒数存在极显著差异,其中长白(CB)群体最大,为69.93粒,延吉(YJ)群体最小,为35.41粒。不同群体种子宽存在显著差异,其中集安(JA)群体最大,为4.967 cm,和龙(HL)群体最小,为4.578 cm。
2.2 西洋参种子形态变异特征
由表3可知,5个种子性状平均变异系数为0.161 9,变异幅度0.088 2~0.314 9。各性状变异系数由大到小依次为:单株种子数(0.314 9)gt;种子厚(0.157 8)gt;千粒重(0.153 0)gt;种子宽(0.095 8)gt;种子长(0.088 2),表明单株种子数在群体间变化最大,种子长最小。
同一表型性状在不同群体内的变异也不同,13个群体所有性状的平均变异系数从小到大的排序为:WQ(0.129 3)lt;CB 2(0.134 1)lt;JA 2(0.137 2)lt;JA 1(0.149 1)lt;HL(0.154 3)lt;CB 1(0.157 2)lt;JA 3(0.157 7)lt;JY(0.166 0)lt;AT(0.166 3)lt;YJ 1(0.180 8)lt;FS 1(0.181 8)lt;FS 2(0.193 7)lt;YJ 2(0.197 8)。变异系数最大的群体为YJ 2,变异系数最小的群体为WQ,表明YJ 2群体的多样性较高,群体WQ的多样性较低。
2.3 西洋参各群体表型性状的相对极差
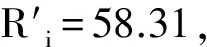
表3 西洋参13个群体种子性状的平均变异系数

群体单株种子粒数千粒重种子长种子宽种子厚性状平均值WQ0.19460.15950.07980.08110.13130.1293YJ10.26190.28980.10300.11100.13830.1808YJ20.57530.08860.08230.09160.15120.1978FS10.41340.14770.07780.10390.16640.1818FS20.46390.17130.09750.09470.14100.1937AT0.27460.09280.09360.08820.28230.1663JY0.30630.17800.09820.10260.14470.1660HL0.39860.08360.07670.08390.12850.1543CB10.24470.16340.08960.09950.18910.1572CB20.22190.15100.07460.08120.14200.1341JA10.22270.18320.08440.10550.14980.1491JA20.25340.11130.07990.09740.14400.1372JA30.26240.16910.10940.10450.14330.1577群体平均值0.31490.15300.08820.09580.15780.1619


群体单株种子粒数千粒重种子长种子宽种子厚性状平均值WQ31.4655.7734.8338.3876.8847.46YJ138.2070.2543.6771.3152.1255.11YJ270.7920.1170.1834.6659.4151.03FS187.6455.6145.6543.1657.3557.88FS289.8942.1057.1236.7957.0456.59AT42.7030.5367.6840.7753.5147.04JY39.3359.8570.1845.9536.4450.35HL53.9324.1737.3435.0636.7537.45CB166.2950.7244.5958.0390.1061.95CB264.0466.5449.3443.4357.8156.23JA156.1897.6443.0184.9977.3471.83JA261.8042.0842.2261.0953.0452.05JA353.9365.1182.8551.1350.2860.66群体平均值58.1752.3452.9749.6058.3154.28
表5 表型性状的方差分量及群体间表型分化系数
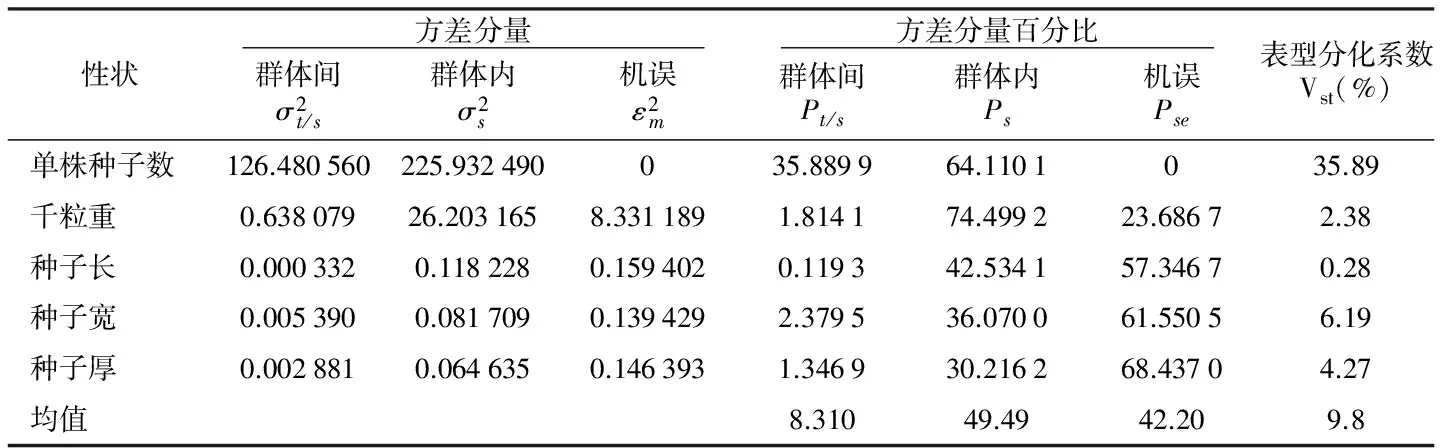
性状 方差分量 方差分量百分比 群体间σ2t/s群体内σ2s机误ε2m群体间Pt/s群体内Ps机误Pse表型分化系数Vst(%)单株种子数126.480560225.932490035.889964.1101035.89千粒重0.63807926.2031658.3311891.814174.499223.68672.38种子长0.0003320.1182280.1594020.119342.534157.34670.28种子宽0.0053900.0817090.1394292.379536.070061.55056.19种子厚0.0028810.0646350.1463931.346930.216268.43704.27均值8.31049.4942.209.8
2.4 西洋参各群体间的表型分化及各形态特征变异来源
由表5可以看出,各性状群体遗传组成存在较大差异,群体间和群体内的方差分量百分比分别为0.119 3%~35.89%和30.216 2%~74.499 2%。各性状的表型分化系数Vst存在较大差异,表型性状的表型分化系数(Vst),变异幅度为0.28%~35.89%,最大的是单株种子数,Vst=35.89%,最小的是种子长,Vst=0.28%,其均值为9.8%,群体内变异为49.49%,群体间变异为8.31%,说明群体内的变异远高于群体间的变异。
3 结论与讨论
3.1 西洋参表型性状遗传变异
对我国西洋参主产区吉林省13个栽培群体5个表型性状的分析结果表明,西洋参栽培群体在群体间和群体内都存在丰富的变异。5个种子性状在群体内都存在极显著差异,而群体间在单株种子数、种子宽上存在着广泛差异。表型性状变异系数变幅为0.088 2~0.314 9,其中单株种子数的变异系数最大,其次,种子厚、千粒重、种子宽、种子长的变异系数均较小,说明这4者具有较稳定的遗传特征。前人研究认为,种子大小在居群间可以发生较大的差异,如小桐子种子(Vst=14.27%)、青钱柳种子(Vst=20.54%),这种差异来自地理阻隔和差异显著的自然条件的长期作用[6,12-13]。西洋参种子单株种子数在种子的所有性状中变异最大,这表明其性状稳定性较差并受到一定环境压力的影响,可能由于局域环境条件如小气候、土壤特征对单株种子数影响很大。
3.2 西洋参群体间的遗传分化
巢式方差分析可以揭示居群内和居群间的变异,而且可以划分居群内和居群间变异组分。吉林西洋参栽培群体的表型分化系数平均值为9.8%,群体内变异较高,达49.49%,群体间变异较低,为8.31%,群体内变异大于群体间变异,群体内个体间变异是吉林西洋参栽培群体表型变异的主要部分。其中,单株种子数表型分化系数较大(Vst=35.89%),说明这个性状相对于其他性状在群体间有较高的表型分化程度;而种子长的表型分化系数最小(Vst=0.28%),群体间较为稳定。尽管群体内的变异远大于群体间的变异,但群体间的变异意义却远大于群体内,因为存在于群体间的变异反映了地理、生殖隔离上的变异,群体间的多样性变异是种内多样性的重要组成部分,分布在群体间的变异真正反映了群体在不同环境中的适应状况,其大小在某种程度上说明了该生物对不同环境适应的广泛程度,值越大,适应的环境越广[14]。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010:212.
[2]Punja ZK.American ginseng:research developments,opportunities,and challenges[J].J Ginseng Res,2011,35:368-370.
[3]Pigliucci M,Murren C J,Schlichting C D.Phenotypic plasticity and evolution by genetic assimilation[J].Journal of Experimental Biology,2006,209(12):2 362-2 367.
[4]刁松锋,邵文豪,姜景民,等.基于种实性状的无患子天然群体表型多样性研究[J].生态学报,2014,34(6):1 451-1 460.
[5]康永祥,赵宝鑫,贠玉洁,等.毛梾天然群体种实表型多样性研究[J].西北农林科技大学学报,2011,39(9):107-117.
[6]佘诚棋,杨万霞,方升佐,等.青钱柳天然群体种子性状表型多样性[J].应用生态学报,2009,20(10):2 351-2 356.
[7]苏世平,李毅,种培芳,等.河西走廊不同红砂天然群体种子表型性状相关性研究[J].草业学报,2013,22(1):87-94.
[8]葛颂.同工酶与林木群体遗传变异研究[J].南京林业大学学报,1998(1):68-72.
[9]田胜平,汪阳东,陈益存,等.山苍子天然种群叶片和种实性状的表型多样性[J].生态学杂志,2012,31(7):1 665-1 672.
[10]王娅丽,李毅.祁连山青海云杉天然群体的种实性状表型多样性[J].植物生态学报,2008,32(2):355-362.
[11]李伟,林富荣,郑勇奇,等.皂荚南方天然群体种实表型多样性[J].植物生态学报,2013,37(1):61-69.
[12]Greipsson S,Davy A J.Seed mass and germination behaviour in populations of the dune building grassLeymusarenarius[J].Annals of Botany,1995,76:493-501.
[13]管俊娇,虞泓,何露,等.小桐子居群种子表型变异研究[J].西南农业学报,2011,24(3):108-109.
[14]李斌,顾万春,卢宝明.白皮松天然居群种实性状表型多样性研究[J].生物多样性,2002,10(2):181-188.
Phenotypic Diversity of Seed in Cultivated Populations ofPanaxquinquefoliusL.
ZHANGHao1,SHAOCai1,ZHENGYing2,WANGYingping1
2016-06-25
吉林省科技创新与科技成果转化计划(编号:20140311023 YY);中国农业科学院科学与技术创新工程(编号:CAAS-ASTIP-2014-ISAPS)。
张 浩(1983—),男,硕士,助理研究员,研究方向:药用植物资源与育种。
王英平(1967—),男,博士,研究员,博士研究生导师,E-mail:yingpingw@126.com。
10.16590/j.cnki.1001-4705.2016.11.072
Q 944
A
1001-4705(2016)11-0072-04
