不同耐湿性长豇豆开花结荚期和苗期叶片全蛋白电泳分析
2016-12-04江汉大学生命科学学院湖北武汉430056
, , (江汉大学 生命科学学院, 湖北 武汉 430056)
不同耐湿性长豇豆开花结荚期和苗期叶片全蛋白电泳分析
胡志辉,杜振海,陈禅友
(江汉大学 生命科学学院, 湖北 武汉 430056)
采用改进的低温液氮样品制备技术,运用SDS-PAGE方法对24个不同耐湿性基因型豇豆在开花结荚期和苗期做叶片全蛋白电泳图谱分析。根据两个时期各参试品种的亚基信息分别进行聚类分析,获得了2个系统聚类树。结果表明:在开花结荚期受湿涝害后,24个不同耐湿性的长豇豆品种叶片蛋白质亚基分布存在着明显差异。其聚类成4个品种群,中等耐湿的16个品种在0.40距离处首先聚为一类,对湿涝极敏感的美国地豆独成一簇且在最大距离0.81处才与其余23个品种最终聚为一类。在开花结荚期和苗期两个时期间,长豇豆品种叶片蛋白质亚基分布差异很大,而同一时期内差异较小,12个品种的聚类树明显依两个时期聚为不同的簇,在0.39距离处苗期所有品种聚为一簇,而在0.63距离处开花结荚期所有品种聚为另一簇,两簇在0.75距离时聚为一类。说明长豇豆植株蛋白质表达的时序性差异大于基因型差异,因此不同时期鉴定可能会得出不一致的结论。苗期叶片蛋白质类型丰富,是植物生长发育最活跃而复杂的时期,故选择苗期鉴定具有鉴定方便和信息丰富等优势。
豇豆基因型; 苗期; 结荚期; 耐湿性; 叶片全蛋白; SDS-PAGE
total leaf proteins; SDS-PAGE
在世界许多地方,如中国、日本、印度、巴基斯坦、澳大利亚等国家及湿润地区和半干旱地区,湿涝危害严重威胁着农作物的生产,影响高产与稳产,成为广泛关注的严重问题。迄今,国内外学者已就不结球白菜、芝麻、大豆、黄瓜、玉米等作物湿害的症状、鉴定方法及湿害的机理、耐湿性资源的筛选及耐湿的遗传改良等方面问题做了大量的研究[1-6]。
表1 供试品种信息和叶片全蛋白显带数
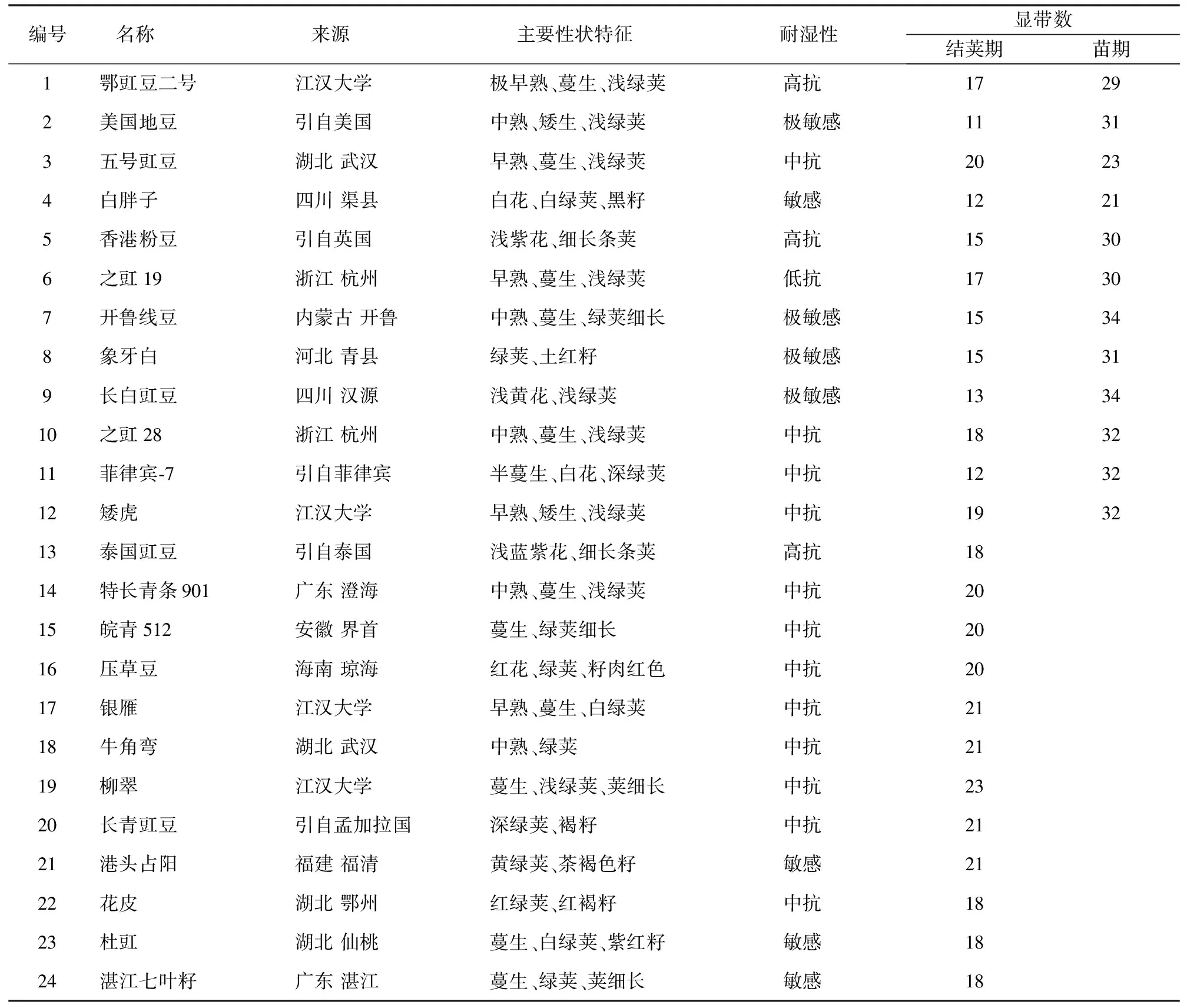
编号名称 来源 主要性状特征 耐湿性 显带数结荚期苗期1鄂豇豆二号江汉大学极早熟、蔓生、浅绿荚高抗17292美国地豆引自美国中熟、矮生、浅绿荚极敏感11313五号豇豆湖北武汉早熟、蔓生、浅绿荚中抗20234白胖子四川渠县白花、白绿荚、黑籽敏感12215香港粉豆引自英国浅紫花、细长条荚高抗15306之豇19浙江杭州早熟、蔓生、浅绿荚低抗17307开鲁线豆内蒙古开鲁中熟、蔓生、绿荚细长极敏感15348象牙白河北青县绿荚、土红籽极敏感15319长白豇豆四川汉源浅黄花、浅绿荚极敏感133410之豇28浙江杭州中熟、蔓生、浅绿荚中抗183211菲律宾⁃7引自菲律宾半蔓生、白花、深绿荚中抗123212矮虎江汉大学早熟、矮生、浅绿荚中抗193213泰国豇豆引自泰国浅蓝紫花、细长条荚高抗1814特长青条901广东澄海中熟、蔓生、浅绿荚中抗2015皖青512安徽界首蔓生、绿荚细长中抗2016压草豆海南琼海红花、绿荚、籽肉红色中抗2017银雁江汉大学早熟、蔓生、白绿荚中抗2118牛角弯湖北武汉中熟、绿荚中抗2119柳翠江汉大学蔓生、浅绿荚、荚细长中抗2320长青豇豆引自孟加拉国深绿荚、褐籽中抗2121港头占阳福建福清黄绿荚、茶褐色籽敏感2122花皮湖北鄂州红绿荚、红褐籽中抗1823杜豇湖北仙桃蔓生、白绿荚、紫红籽敏感1824湛江七叶籽广东湛江蔓生、绿荚、荚细长敏感18
豇豆(VignaunguiculataLinn.) 为豆科(Leguminosae)豇豆属(Vigna)植物,可攀缘生长,是耐热耐旱的一年生作物[7]。我国南方地区夏季降雨量较大,长豇豆生长季节,常出现远远超过其生理需水量的情况,极易造成湿害,最终导致其产量和品质的下降。前人从形态学和生理学等角度进行过豇豆品种耐湿特征的描述[8-10],Sangakkara等[11]研究了土壤水分和钾肥对绿豆和豇豆幼苗生长的影响;Timsina等[12-13]研究了淹水处理下豇豆品种的植株水分关系与生长,以及早熟性与淹水程度的互作效应。Ogbonnaya等[14]则通过水培、盆栽和田间试验,证明不同基因型耐旱性有差异,基因型方差占表型总方差的比例高,因而对豇豆耐旱性基因型筛选是可行的。陈禅友等[15]对60份豇豆品种耐盐性能进行了评判,长豇豆品种耐湿性的鉴定和筛选尚缺乏研究,对具遗传差异耐湿性的豇豆基因型受胁迫后其遗传表达物——蛋白质的变化等也缺乏研究,影响品种利用工作,有必要研究不同基因型的耐湿性。聚丙烯酰胺凝胶电泳方法常用来分析鉴别植物遗传表达物的差异。豇豆叶片全蛋白在正常或湿涝胁迫后表达产物的变化可能反映出不同豇豆品种的遗传基因功能组差异,暗示着品种耐湿能力的差别。本研究观测了田间自然鉴定结果并开展室内苗期实验,对豇豆开花结荚期和苗期叶片全蛋白电泳图谱的亚基分布和位点进行分析,比较不同耐湿性豇豆基因型和不同时期在蛋白质表达上的差异,以揭示豇豆耐湿性遗传多样性,并为耐湿豇豆资源判别和新品种选育提供依据和理论指导。
1 材料和方法
1.1 植物材料
实验以24个长豇豆品种(见表1)为材料。
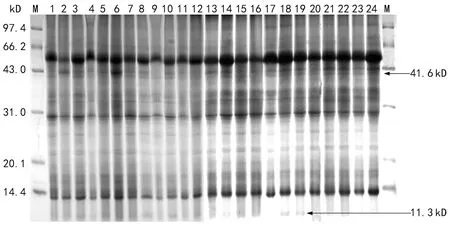
注:M为Marker,序号1~24表示编号1~24的豇豆品种(见表1)。图1 24个不同耐湿性基因型豇豆开花结荚期叶片全蛋白电泳图谱
1.2 试剂配制
实验试剂尽量选用高标准的国产或进口化学药品,按照常规方法配置。标准蛋白质(Marker)来自中国科学院上海生物化学研究所。
1.3 取 样
1) 开花结荚期田间取样。调查地点在武汉市什湖农场,该地块排水性较差,土质为粘壤土(粉质粘土),地经过翻耕后盖上薄膜。用地面积为700 m2,共播种56个品种,每个品种约10 m2。开长约50 cm,深约15 cm的播种行,根据种子量和试验田的具体情况进行播种。畦植2行,每隔20 cm播1窝,每窝3~4粒种子。2015年5月7日播种,6月17日武汉市普降暴雨到大暴雨,试验地平均降雨量为115 mm,造成严重积水,形成了对长豇豆品种的湿害,此时正值开花结荚期。分别于6月29日和7月6日分2次调查各品种30株豇豆的湿害受害情况。植株的湿涝害的抗性水平分为5级,高抗:无病植株;中抗:0.1%~25%叶片发病的植株;低抗:25%~50%叶片发病的植株;敏感:50%~75%叶片发病的植株;极敏感:75%以上叶片发病的植株。从中选用24个不同耐湿性基因型(表1)作为试验材料。并在7月6日田间采摘其植株中、上部叶片放入冰壶,快速带回实验室及时处理取样。
2) 苗期实验室取样。于2015年7月7日在实验室播种其中12个豇豆品种(表1中编号为1-12的品种),取21天苗龄的幼苗第一个三出复叶的叶片制样。
1.4 样品制备
按Masako等[16]和何瑞峰等[17]的方法并加以改进。取各品种不同时期的新鲜叶片300 mg,重复3次,加鲜样重的15%即45 mg PVP(PVP摄入量为鲜样重的15%时效果最好[18])及少许石英砂于液氮中碾成粉末。加入3 mL10%(w/v)三氯乙酸(用丙酮配制,其丙酮中含0.07%β-巯基乙醇),用磁力搅拌器震荡混匀后悬浮其中,-20 ℃ 沉淀1 h,于4 ℃,13 000 r/min条件下离心15 min弃上清液。加入3 mL冷丙酮(其中含0.07%β-巯基乙醇),用磁力搅拌器震荡混匀后悬浮其中,-20 ℃沉淀2 h或过夜,期间每隔一定时间振荡1次,换液1~2次,以达到充分去色素的目的。 同上离心弃上清液,加入80%冷丙酮(其中含0.07%β-巯基乙醇),用磁力搅拌器震荡混匀后悬浮其中-20 ℃沉淀1 h。 同上离心弃上清液,取沉淀用真空干燥机真空干燥12 h制成干粉(使样品充分干燥散去丙酮),-20 ℃保存备用。
1.5 电泳方法
制胶—点样—电泳—胶版固定—染色—脱色—凝胶成像等均参照生物化学技术[19]和豇豆种子蛋白质分析技术方法[20-21]。
1.6 实验数据处理
采用南京大学捷达凝胶成像系统辅助人工读带,以“1”和“0”系统记录谱带,有带的赋值为1,无带的赋值为0,建立数据库,以DPS软件系统按照Jaccard 相似系数法的UPGMA方法进行品种聚类分析,依24个品种开花结荚期和12个品种2个时期(开花结荚期、苗期)分别建立系统聚类树。
2 结果与分析
2.1 不同耐湿性基因型长豇豆叶片全蛋白电泳图谱分析
实验选用的24个长豇豆品种具有耐湿代表性,叶片全蛋白提取上采用了改进的低温液氮研磨和丙酮沉降技术,蛋白质图谱经过反复实验具有稳定的重复性。图谱显带比较清晰,较为全面准确地反映了供试材料的遗传表达物差异。
2.1.1 24个品种开花结荚期叶片全蛋白电泳结果分析
从24个豇豆品种开花结荚期叶片全蛋白质图谱(图1)中共检测出26条亚基带,其中17条多态性带,多态性率为65.38%,9条共有谱带,分别为79.2,64.2,29.6,28.9,25.7,22.1,17.6,16.6,13.8 kD。总体上,亚基分布范围为97.4~11.3 kD,亚基出现频率变化幅度为0.04~1。品种平均显带数为17.6条,其中柳翠最多,为23条,美国地豆最少,为11条(图1)。

注:M为Marker,序号1~12表示编号1~12的豇豆品种开花结荚期,序号13~24表示编号1~12的豇豆品种苗期(见表1)。图2 12个不同耐湿性基因型豇豆开花结荚期和苗期叶片全蛋白电泳图谱
表2 12个不同耐湿性基因型豇豆开花结荚期和苗期叶片全蛋白亚基分布情况
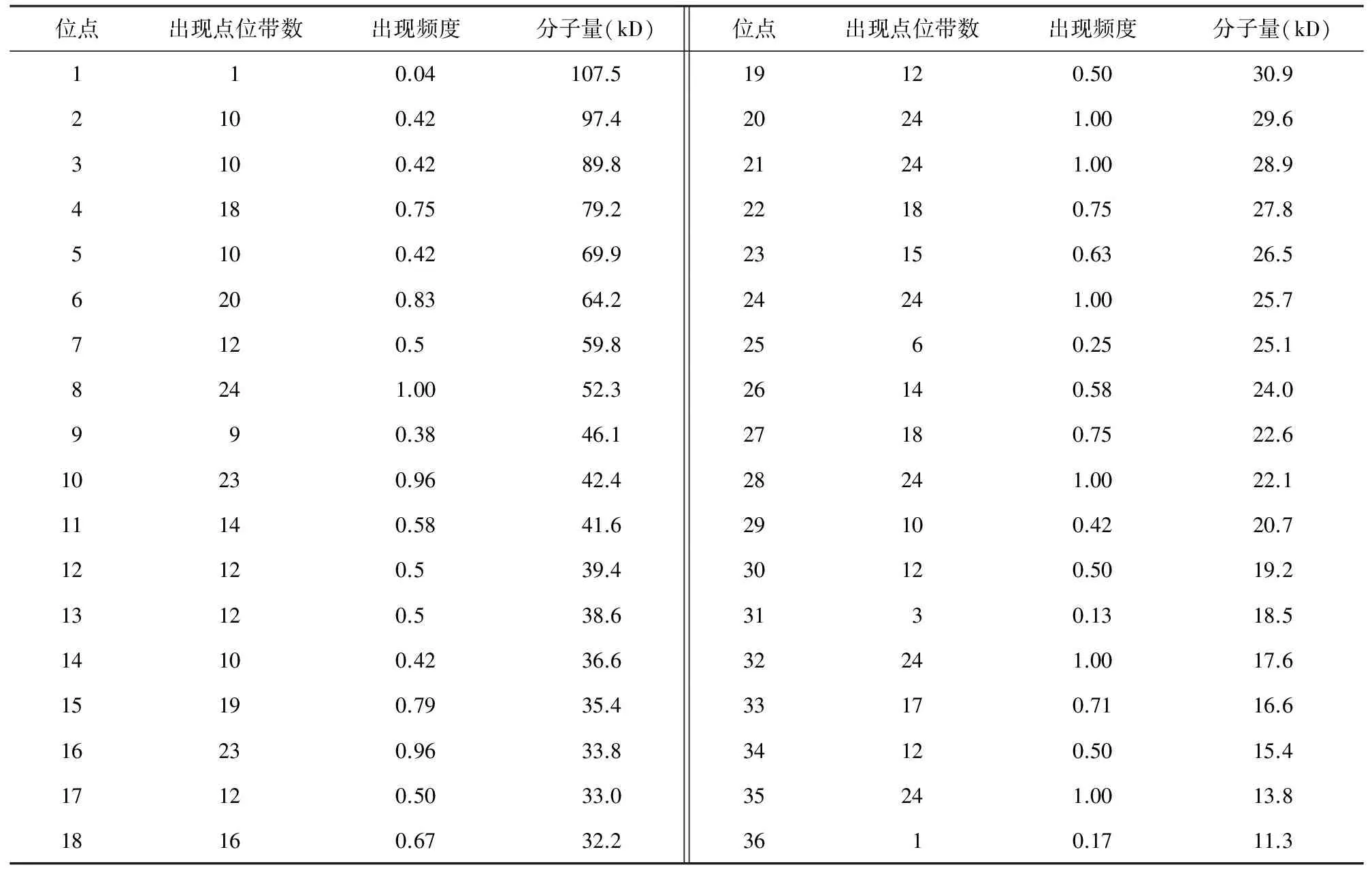
位点出现点位带数出现频度分子量(kD)位点出现点位带数出现频度分子量(kD)110.04107.519120.5030.92100.4297.420241.0029.63100.4289.821241.0028.94180.7579.222180.7527.85100.4269.923150.6326.56200.8364.224241.0025.77120.559.82560.2525.18241.0052.326140.5824.0990.3846.127180.7522.610230.9642.428241.0022.111140.5841.629100.4220.712120.539.430120.5019.213120.538.63130.1318.514100.4236.632241.0017.615190.7935.433170.7116.616230.9633.834120.5015.417120.5033.035241.0013.818160.6732.23610.1711.3
2.1.2 12个品种苗期和开花结荚期叶片全蛋白电泳结果分析
从12个豇豆品种苗期和开花结荚期的叶片全蛋白质图谱(图2)中共检测出36条蛋白质亚基带,其中16条多态性带,多态性率为44.44%,20条共有谱带,分别为79.2,59.8,52.3,42.4,39.4,33.8,33.0,32.2,30.9,29.6,28.9,27.8,26.5,25.7,22.6,22.1,19.2,18.5,15.5,13.8 kD,总体上,亚基分布范围是107.5~11.3 kD,亚基出现频率变化幅度为0.04~1。品种平均显带28.9条,亚基数最多的开鲁线豆为34条,最少的美国地豆为21条(表1 )。
比较开花结荚期和苗期电泳图谱差异(图2),苗期的12个豇豆品种叶片全蛋白质图谱中检测出32条蛋白质亚基带,12条多态性带,多态性率为37.5%,16条共有谱带,其蛋白质亚基相对分子量和出现频率见表2,亚基分布范围是107.5~13.8 kD,亚基出现频率变化幅度为0.04~1。而同样的12个品种在结荚期的叶片全蛋白质图谱中只检测出26条蛋白质亚基带,反而有14条多态性带,多态性率为53.84%,9条共有谱带,其蛋白质亚基相对分子量和出现频率也列于表2,亚基分布范围是97.4~11.3 kD,亚基出现频率变化幅度为0.04~1。可见苗期的亚基条带数量明显较开花结荚期多,其品种间的共有性也较开花结荚期大,多态性较小,其分布范围偏于高分子量,而开花结荚期偏于低分子量。这说明苗期植株蛋白质表达物更丰富,同时可能与开花结荚期受湿害胁迫增加了不同基因型表达物的差异有关。可见不同时期和方法进行基因型鉴定可能会得出不同的结论,因此在鉴定长豇豆品种耐湿性时,选择适当的时期和胁迫处理方法十分重要。
2.2 聚类分析
1) 根据24个参试品种开花结荚期叶片全蛋白图谱各亚基的分布情况,运用Jaccard 相似系数法的UPMGA进行聚类分析,建立聚类树(图3)。可以将供试的24个长豇豆品种分为Ⅰ、Ⅱ、Ⅲ、Ⅳ 4个品种群,较耐湿的16个品种在0.40距离处首先聚为一类,对湿涝极敏感的美国地豆独成一簇且在最大距离0.81处才与其余23个品种最终聚为一类。
2) 根据12个参试品种开花结荚期和苗期的叶片全蛋白的各亚基分布情况,运用Jaccard相似系数的类平均数(UPMGA)方法进行聚类分析,建立聚类树(图4)。将供试的12个豇豆品种依两个时期分为不同簇,在0.39距离时苗期所有品种聚为一簇(S簇),而在0.63距离时开花结荚期所有品种聚为另一簇(F簇),两簇在0.75距离时聚为一类。充分体现出长豇豆植株蛋白质表达的时序性差异大于基因型差异,同样说明鉴定豇豆品种耐湿性时,时期的确立很重要。

注:序号1~24同表1品种编号。图3 根据开花结荚期叶片全蛋白亚基分布绘制的24个品种UPGMA聚类图
从图3、图4可以看出,苗期矮虎和美国地豆等在0.24距离时被聚为一簇(S1),而在开花结荚期矮虎与泰国豇豆和五号豇豆等在0.43距离时被聚为一簇(F1),美国地豆在0.63距离时独立聚为一簇(F3)。结合前文提到的田间调查结果,从开花结荚期Ⅰ、Ⅱ、Ⅲ、Ⅳ 4个品种群来分析,品种群Ⅰ所包含的Ⅰ1和Ⅰ22个品种亚群中的品种基本上都是对湿涝有较强抗性的品种,品种群Ⅳ由对湿涝害极敏感的美国地豆独立组成。矮虎和美国地豆苗期被聚为一簇(图4),可能是因为二者都有矮生习性(表1)等共性;在开花结荚期分散在不同品种群(图3),特别是美国地豆单独成为一簇,这可能是其对湿涝害极敏感的表现,其蛋白质亚基分布与其它所有品种相比缺少41.6 kD的蛋白质亚基。

注:序号1~12代表品种编号(表1);F表示开花期;S表示苗期。图4 12个品种长豇豆叶片全蛋白亚基在开花结荚期和苗期分布聚类图
但抗性相同的品种也不一定全聚在一起,因为聚类原理是根据亚基分布相似性来聚类的,所以不同抗性的品种可能有很多共有的亚基,而特异的亚基所占比例偏少。如矮虎所在的Ⅰ1品种亚群主要是对湿涝害有中等抗性的品种,但其所在的簇中泰国豇豆是高抗品种。而2个高抗品种鄂豇豆二号、香港粉豆和3个极敏感品种开鲁线豆、长白豇豆、象牙白在0.42和0.50距离时分聚在品种群II和品种群III中,其中鄂豇豆二号和开鲁线豆、长白豇豆在0.42距离时聚在品种群Ⅱ中,香港粉豆和象牙白在0.50距离时聚在品种群Ⅲ中。就蛋白质亚基分布情况来看,品种群Ⅱ中3品种共有13个蛋白质亚基,所以根据聚类原理,它们聚在一起了,但鄂豇豆二号具有的46.1 kD蛋白质亚基,两极敏感品种没有。品种群Ⅲ中香港粉豆,象牙白共有13个蛋白质亚基,但香港粉豆具有的32.2 kD和22.6 kD亚基,象牙白没有。在开花结荚期,耐湿品种鄂豇豆二号、香港粉豆和泰国豇豆,它们之间共有13个蛋白质亚基,鄂豇豆二号特有46.1 kD亚基,香港粉豆特有79.2 kD亚基,泰国豇豆特有33.0 kD亚基。极敏感品种美国地豆、开鲁线豆、长白豇豆和象牙白,它们之间共有8个蛋白质亚基。其中,象牙白特有11.3 kD亚基。
3 讨 论
由于开花结荚期与苗期发育阶段的差异,以及开花结荚期受到外部不良环境条件刺激,它们叶片表达的蛋白质种类存在明显差异,这与其生理活动需求密切相关,尽管开花结荚期有新的蛋白质条带如42.0,34.5,11.3 kD亚基等,但其蛋白质数量明显下降,例如,共有带由苗期的20条减少到开花结荚期的9条,品种平均显带带数由苗期的28.9条下降到结荚期17.6条(表1),因而苗期是植物生长发育最活跃而复杂的时期。开花结荚期不同品种叶片全蛋白无论从种类还是数量上都发生了较大的改变,这可能与品种遗传背景和抵抗外界环境中湿涝害胁迫都有关系。除去所有品种都共有的9个蛋白质亚基,高抗品种与极敏感品种的差异主要体现在79.2,46.1,41.6,33.0,22.1 kD和11.3 kD 6个蛋白质亚基的有无上,推测其可能与长豇豆耐湿涝害有关。
[1]Alam I,Lee DG,Kim KH,et al.Proteome analysis of soybean roots under waterlogging stress at an early vegetative stage[J].Journal of Biosciences,2010,35(1):49-62.
[2]Qi XH,Xu XW,Lin XJ,et al.Identification of differentially expressed genes in cucumber (CucumissativusL.) root under waterlogging stress by digital gene expression profile[J].Genomics,2012,99:160-168.
[3]潘华,周红英,孙建,等.苗期湿害胁迫下不同基因型芝麻的反应差异研究[J].江西农业学报,2015,27(1):24-27.
[4]郭欣欣,朱玉英,侯瑞贤,等.淹水胁迫对不结球白菜幼苗光和特性的影响[J].植物科学学报,2015,33(2):210-217.
[5]Bansal R,Srivastava JP.Antioxidative defense system in pigeonpea roots under waterlogging stress[J].Acta Physiologiae Plantarum,2012,34(2):515-522.
[6]Feng Yu,Xuesong Han,Cunjuan Geng et al.Comparative proteomic analysis revealing the complex network associated with waterlogging stress in maize (ZeamaysL.)seedling root cells[J].Proteomics,2015,15(1):135-147.
[7]党江波,李彩,李晔,等.豇豆螺旋茎段维管组织观察及其成因分析[J].植物科学学报,2011,29(6):743-748.
[8]Sanoussi AF,Loko LY,Ahissou H et al.Diversity and agronomic performances of the cowpea (VignaunguiculataWalp.) landraces in Southern Benin[J].International research journal of agricultural science and soil science,2013,3(4):121-133.
[9]陈一舞,林黎奋,高吉寅.豇豆属内栽培种分类的再研究[J].中国农业科学,1992,25(6):22-29.
[10]李耀华,陈禅友,于衍正,等.豇豆品种资源的聚类分析[J].武汉植物学研究,1997,15(3):255-261.
[11]Sangakkara UR,Frehner M,Nösberger J.Influence of Soil Moisture and Fertilizer Potassium on the Vegetative Growth of Mungbean (VignaradiataL.Wilczek) and Cowpea (VignaunguiculataL.Walp)[J].Journal of Agronomy and Crop Science,2001,186(2):73-81.
[12]Timsina J,Garrity DP,Pandey RK.Plant water relations and growth of cowpea cultivars subjected to varying degrees of waterlogging[J].Field Crops Research,1994,39(1):49-57.
[13]Timsina J,Garrity DP,Pandey RK.The interaction of cowpea maturity with degree of waterlogging in the post-rice environment[J].Field crops Research,1994,39(1):39-48.
[14]Ogbonnaye CI,Sarr B,Brou C et al.Selection of cowpea genotypes in hydroponics,pots,and field for drought tolerance[J].Crop Science,2003,43(3):1114-1120.
[15]李依,潘磊,吴华,等.60份豇豆品种资源的耐盐能力评判[J].植物遗传资源学报,2016,17(1):66-73.
[16]Masako I,Takeo K,Tsukasa M.Rice allergenic proteins,14-16 kDa albumin and α-globulin,remain insoluble in rice grains recovered from rice miso(rice-containing fermented soybean paste)[J].Bioscience,Biotechnology,and Biochemistry,2005,69(6):1 137-1 144.
[17]何瑞峰,丁毅,于金洪.水稻温敏叶绿素突变体叶片蛋白的双向电泳分析[J].作物学报,2001,27:875-879.
[18]Wang XC,Wang DY,Wang D et al.Systematic comparison of technical details in CBB methods and development of a sensitive GAP stain for comparative proteomic analysis[J].Electrophoresis,2012,33(2):296-306.
[19]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:178-185.
[20]Kumar DA,Anshuman S,Prakash SJ et al.Assessment of genetic diversity in maize(ZeamaysL.) inbred lines on the basis of soluble seed proteins using SDS-PAGE[J].Electronic Journal of Plant Breeding,2015,6(1):264-268.
[21]Prachi G,Rohtas S,Malhotra S et al.Cowpea [Vignaunguiculata(L.)walp.] seed proteins:Heterogeneity in total proteins and protein fractions[J].Legume Research-An International Journal,2014,37(1):62-67.
Comparison of Total Leaf Protein Profiles of Different Waterlogging Tolerance of Asparagus Bean in Flowering,Podding and Seedling Period as Revealed by SDS-PAGE Electrophoresis
HUZhihui,DUZhenhai,CHENChanyou
(College of Life Sciences,Jianghan University,Wuhan Hubei 430056,China)
The total leaf protein profiles in asparagus bean were revealed by SDS-PAGE electrophoresis for 24 different waterlogging tolerance genotypes at the flowering period in the field and 12 cultivars seedlings cultured in laboratory,respectively.Reproducible electrophoretic profiles of each accession were accompanied by using an improved sampling technology-the method of freezing liquid nitrogen extraction.The subunits distributions for each accession were compared to analyze the genetic relationships among cultivars in two growth stages (flowering and seedling),two dendrograms were constructed by UPGMA cluster analyses using DPS software,respectively.The result indicated that cultivars with different resistant performance in flowering and podding period to the waterlogging damage in the field had obvious different protein profiles.Results also showed that identifications of waterlogging tolerance in asparagus bean genotypes at different growth stages might lead to different conclusions.Seedling stage is the most active and complex in plant growth,and which protein types are very rich.So seedling stage appraisal was more convenient and reliable.
asparagus bean genotypes; seedling; flowering period; waterlogging tolerance;
2016-05-19
农业部“948”项目(编号:2011-G 1-17);省部级科技平台(编号:鄂科技通2011-101);武汉市科技计划项目(编号:201250499145-12)。
胡志辉(1973—),男,湖北武汉人;高级实验师,主要从事植物生理生化实验教学和研究工作;E-mail:huzhihui@jhun.edu.cn。
10.16590/j.cnki.1001-4705.2016.11.040
S 643.4
A
1001-4705(2016)11-0040-06
