利用野生甘蓝抗性遗传资源获得高抗菌核病甘蓝型油菜的抗性与分子标记初步分析
2016-12-04四川大学生命科学学院成都610064
, , , (四川大学生命科学学院, 成都 610064)
利用野生甘蓝抗性遗传资源获得高抗菌核病甘蓝型油菜的抗性与分子标记初步分析
王浩杰,牛显飞,宋验红,王茂林
(四川大学生命科学学院, 成都 610064)
菌核病是甘蓝型油菜最严重的病害之一,自身抗性低,而甘蓝野生资源中存在高抗遗传资源。以部分抗性的甘蓝型油菜中双9号和高抗性的甘蓝野生资源为亲本杂交得到F1(ACC),F1连续用中双9号回交6代,得到育性基本恢复正常植株自交,培育成了高抗菌核病材料,命名为F 6。染色体计数显示,F 6有38条染色体,和甘蓝型油菜(AACC,2 n=38)一致。菌核病抗性鉴定实验结果说明F 6对菌核病的抗性高于中双9号而弱于甘蓝。通过在亲本和子代间比较229个分布于甘蓝型油菜19个遗传连锁群的SSR分子标记以及16个与甘蓝抗菌核病特异性位点有关的SSR分子标记,发现甘蓝抗菌核病主要特异性区段9号连锁群已渗入甘蓝型油菜基因组中。
甘蓝; 甘蓝型油菜; 菌核病; SSR标记
甘蓝型油菜(BrassicanapusL.)(AACC,2 n=38)是由芸薹(BrassicarapaL.)(AA,2 n=20)与甘蓝(Brassicaoleracea)(CC,2 n=18)通过自然种间杂交后双二倍化进化而来的一个复合种,是仅次于大豆的世界第二油料作物[1]。核盘菌(Sclerotiniasclerotiorum)是一种非宿主特异性的寄生真菌,可以感染400多种植物并且造成感染部位的腐烂,其中宿主包括一些重要的农作物,例如油菜、大豆等[2]。菌核病可造成巨大的产量和经济损失[3],甘蓝型油菜一直以来受到核盘菌的严重危害,在中国每年核盘菌导致油菜减产达10%到80%[4]。因为甘蓝型油菜对核盘菌高度敏感,目前只有少数部分抗性品种,如中双9号,但是没有完全抗性或高抗性的品种[5]。尽管目前市场上有几种杀真菌剂可以用来预防和治愈菌核病,但这种药物的有效性高度依赖于使用的时间、植物的生长时期和环境,并且化学药物会造成环境污染以及高成本[6-7]。因此,培育自身对菌核病具有高抗性的新型甘蓝型油菜是一种环保、高效、低成本的对抗核盘菌为害的方法。
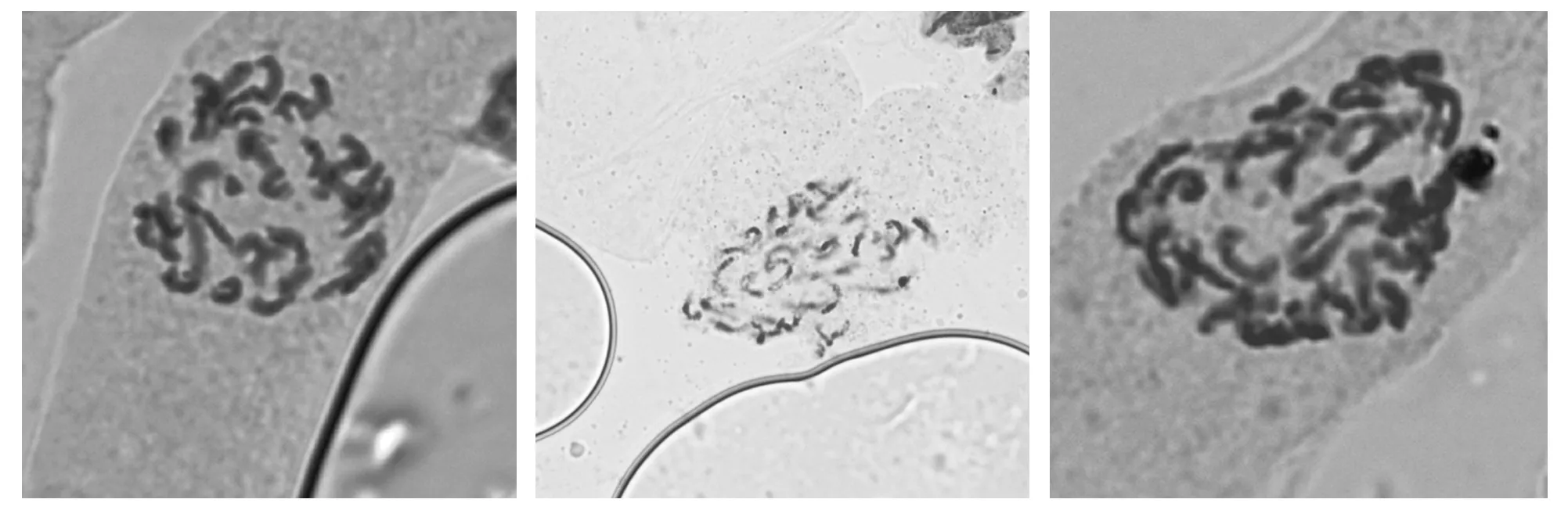
图1 F 6中期染色体
虽然甘蓝型油菜中没有高抗品种,但油菜的近缘物种甘蓝中存在高抗性的资源[4],可以通过甘蓝型油菜与甘蓝杂交从而将后者的高抗性基因转移到甘蓝型油菜中[8]。本实验以部分抗性的甘蓝型油菜中双九号和一种高抗性野生甘蓝为亲本,通过远缘杂交培育出具有更高抗性的甘蓝型油菜育种新资源。
1 材料和方法
1.1 材 料
1.1.1 植物材料
以具有菌核病部分抗性的甘蓝型油菜中双9号(简称ZS 09)为母本和高抗性野生甘蓝Olera 2(从瑞典Uppsala 遗传中心引进,简称O)为父本杂交获得少许子代F1,F1表现雄性不育,再以F1植株为母本用ZS 09为回交父本连续回交6代,得到1株有花粉的植株,可自交结实,自交获得遗传性状稳定的品系,命名为F 6。2年田间自然观测及人工接种鉴定均表现为高抗菌核病。
1.1.2 核盘菌
核盘菌购买自北京豫鼎鑫捷科技有限公司,PDA培养基22 ℃接种4~5 d,待培养基表面布满白色菌丝后,用9 mm打孔器打孔,获取PDA菌丝块。
1.2 方 法
1.2.1 提取DNA
提取DNA用的是天根Plant Genomic DNA Kit试剂盒,按照说明书进行操作,提取的DNA保存在4 ℃冰箱。
1.2.2 染色体计数
参照兰泽蘧等[9]的方法:发芽的油菜根部达到15 cm左右后剪下,0.2%秋水仙素处理4 h后用蒸馏水冲洗干净,卡诺氏固定液4 ℃固定24 h再用蒸馏水冲洗干净,分别在95%、85%的乙醇中放置30 min,转到70%乙醇4 ℃保存。 将保存的材料洗涤后转入1 mol/L HCl中,60 ℃解离10 min左右,蒸馏水冲洗干净,用卡宝品红染液染色10~15 min,压片后放在显微镜下观察并拍照。
1.2.3 SSR分析
实验所用的SSR(simple sequence repeat,微卫星DNA)标记中有229个是由Piquemal等[10]所开发,这些引物均匀地分布在甘蓝型油菜的19个连锁群上;另有16个是从Mei et al[11]中筛选的甘蓝抗菌核病特异性位点SSR标记。实验步骤参照史慧娟等[12]的方法:PCR加样体系和反应体系不变,扩增产物用10%非变性PAGE凝胶电泳分离,0.2% AgNO3染色,显色后照相并保存。
1.2.4 叶片菌核病抗性鉴定
实验参照王汉中等[5]的方法进行设计,待样品植株成长到10叶期左右,采摘新鲜叶片放入垫有湿毛巾和滤纸的白瓷盘,每组5片叶,叶柄用湿纱布包裹。核盘菌PDA菌丝块倒置接种于叶片表面。接种后用透明保鲜膜密封,保持空气湿度大于80%,于22 ℃下接种4 d后记录菌斑面积,计算公式为:面积 = (长轴 × 短轴)π/4。
1.2.5 数据的统计分析
使用软件SPSS 21.0和Excel来进行离体叶片菌斑面积数据的方差分析(ANOVA)与t检验。
2 结果与分析
2.1 F 6染色体数目分析
通过压片法可以清晰地观察中期染色体(图1)。经统计,F 6个体拥有38条染色体,与甘蓝型油菜(AACC,2 n=38)染色体数目一致,表明F 6确实是一种甘蓝型油菜。

注:从左到右:ZS 09、Olera 2、F 6。图2 接种核盘菌96 h后的叶片
2.2 离体叶片菌核病抗性鉴定实验
在ZS 09、O及F 6叶片上接种核盘菌96 h后,三者叶片上呈现不同大小的菌斑(图2)。菌斑面积大小如表1,结果显示ZS 09的菌斑面积最大,F 6次之,甘蓝最小,表明甘蓝对菌核病的抗性最强,F 6次之,ZS 09抗性最低。该实验证明了F 6是比ZS 09菌核病抗性更高的油菜资源。
2.3 亲本和子代SSR分子标记分析
229个位于甘蓝型油菜连锁群上的SSR标记在ZS 09、O、F 6基因组中分别有181、148、168个标记扩增出条带(图3)。其中,F 6扩增出与ZS 09相同条带的标记有67个,与O相同的标记38个,与ZS 09、O都不相同的特异性标记有52个。与亲本Olera 2扩增出相同条带而ZS 09没有的38个SSR分子标记分布在甘蓝型油菜的18个遗传连锁群上(N 8号连锁群无),其中主要的连锁群为N 1、N 13、N 14,证明了F 6的确含有甘蓝Olera 2部分遗传物质且较为均匀稳定地分布在F 6的基因组中。
16个甘蓝抗菌核病特异性位点SSR标记结果显示(图4),有10个SSR标记在Olera 2和F 6中扩增出来的条带一致,占62.5%,其中有1个标记位于甘蓝1号连锁群,2个位于6号连锁群,7个位于9号连锁群。该结果说明F 6遗传了约三分之二甘蓝抗菌核病特异性位点。
3 讨 论
由于起源和驯化的时间短加上育种方法效率不高,导致甘蓝型油菜品种少,遗传学基础薄弱。相反,其亲本之一的甘蓝包含许多遗传资源,并且拥有许多优异的品质,例如对核盘菌的高抗性[13]。常用的油菜育种方法有2种:一种是用甘蓝型油菜与其亲缘物种杂交来培育新品种[14];另一种则是模仿自然状态下甘蓝型油菜的产生,即用芸薹与甘蓝杂交,通过胚胎挽救和染色体加倍的方法得到异源四倍体油菜[15]。本实验以具有部分抗性的甘蓝型油菜中双9号和具有高抗性的甘蓝为亲本,进行杂交将甘蓝中的抗性遗传物质遗传给子代F1,子代F1与ZS 09连续回交6代克服了雄性不育得到一株有花粉的植株,并通过自交来稳定和累加自身遗传性状。F 6的染色体数目为整倍体并和甘蓝型油菜(2 n=38)一致,这是F 6自交可育性的基础并证明了F 6是一种甘蓝型油菜。229个甘蓝型油菜遗传连锁群SSR分子标记实验中,F 6有52个亲本不具有的条带,可能是因为在育种过程部分染色体结构发生变异,甘蓝型油菜和甘蓝基因组部分同源导致染色体互换。菌核病抗性鉴定实验证明了F 6的抗性显著性高于中双9号,但低于甘蓝,这是由于核盘菌抗抗性位点是数量性状位点(QTL),分布在多条染色体上,未能全部遗传到F 6基因组中,SSR标记方法证明F 6只继承了约2/3的抗性位点,另外本研究中标记的这些位点并不能包含甘蓝全部的抗性基因,这促使着我们接下来要找出更多的抗性位点,提高这些位点从甘蓝转移到甘蓝型油菜中的成功率。需要注意的是抗性鉴定实验是在实验室操作的,需进行田间抗性鉴定实验进一步检验F 6在自然状态下的抗性大小。本次研究目的是培育菌核病高抗性甘蓝型油菜,重点是其菌核病抗性,而和田间产量相关的其他油菜品质如油菜籽重量、含油量高低、开花时间、抗(耐)性等等则需要未来进一步探索。
表1 离体叶片接种核盘菌96 h后菌斑面积

样品名称 菌斑面积(cm2) ZS09 2.52±0.41 O 1.03±0.20∗∗ F6 1.88±0.22∗
注:“**”代表p=0.01水平上对ZS 09的显著性差异,“*”代表p=0.05水平上对ZS 09的显著性差异。

注:M为DL 500 DNA Maker;F为F 6;O为Olera 2;RA-E 04、SWUC 731、RA2-F 11、SWUC 679、SWUC 81、SWUC 177、SWUC 205、SWUC 59、SWUC 455、NA 1-C 08、SWUC 227为SSR标记名称。图4 甘蓝抗菌核病特异性位点SSR标记部分扩增图谱
[1]Basunanda P,M Radoev,W Ecke et al.Comparative mapping of quantitative trait loci involved in heterosis for seedling and yield traits in oilseed rape (BrassicanapusL.)[J].Theor Appl Genet,2010,120(2):271-281.
[2]Boland G,Hall R.Index of plant hosts of Sclerotinia sclerotiorum[J].Can J Plant Pathol,1994,16(2):93-108.
[3]Koch S,Dunker S,Kleinhenz B,et al.A crop loss-related forecasting model for Sclerotinia stem rot in winter oilseed rape[J].Phytopathology,2007,97(9):1186-94.
[4]Mei J,L Qian,J O Disi,et al.Identification of resistant sources against Sclerotinia sclerotiorum inBrassicaspecies with emphasis onB.oleracea[J].Euphytica,2011,177(3):393-399.
[5]王汉中,刘贵华,郑元本,等.抗菌核病双低油菜新品种中双9号选育及其重要防御酶活性变化规律的研究[J].中国农业科学,2004,37(1):23-28.
[6]Turkington TK,R Morrall.Use of petal infestation to forecast Sclerotinia stem rot of canola:the influence of inoculum variation over the flowering period and canopy density[J].Phytopathology,1993,83(6):682-689.
[7]Del R L,Bradley CA,Henson Ra,et al.Impact of Sclerotinia stem rot on yield of canola[J].Plant Dis,2007,91(2):191-194.
[8]Jiaqin,Mei;Yao,Liu,Dayong,Wei,et al.Transfer of sclerotinia resistance from wild relative of Brassica oleracea intoBrassicanapususing a hexaploidy step[J].Theor Appl Genet,2015,128(4):639-44.
[9]兰泽蘧,罗鹏.介绍一种遗传学教学实验材料-油菜[J].遗传,1991,13(2):28-30.
[10]J Piquemal,E Cinquin,F Couton,et al.Construction of an oilseed rape (BrassicanapusL.) genetic map with SSR markers[J].Theor Appl Genet,2005,111(8):1 514-1 523.
[11]Jiaqin Mei,Yijuan Ding,Kun Lu,et al.Identification of genomic regions involved in resistance against Sclerotinia sclerotiorum from wildBrassicaoleracea[J].Theor Appl Genet,2013,126(2):549-556.
[12]史慧娟,赵昭,阳治国,等.甘蓝型油菜均隆油5号特征指纹图谱构建和杂种纯度鉴定[J].种子,2014,33(8):16-20.
[13]Yijuan Ding,Jiaqin Mei,Qinfei Li,et al.Improvement of Sclerotinia sclerotiorum resistancein Brassica napus by usingB.oleracea[J].Genet Resour Crop Evol,2013,60(5):1615-1619.
[14]陈树忠,殷家明,唐章林,等.甘蓝型油菜与羽衣甘蓝远缘杂交初步研究[J].西南农业大学学报,2000,22(3):208-210.
[15]Cheng Cui,Xianhong Ge,Mayank Gautam,et al.Cytoplasmic and genomic effects on meiotic pairing inBrassicahybrids and allotetraploids from pair crosses of three cultivated diploids[J].Genetics,2012,191(3):725-738.
BreedingSclerotiniasclerotiorumResistantBrassicanapusL.by Using WildBrassicaoleraceawith the Analysis of Resistance and Molecular Marks
WANGHaojie,NIUXianfei,SONGYanhong,WANGMaolin
(College of Life Science,Sichuan University,Chengdu 610064,China)
Sclerotiniastem rot is one of most serious diseases inBrassicanapusL.because of its low resistance,but high resistant varieties are found in wildBrassicaoleracea.Hybridizing partially resistantBrassicanapusL.Zhongshuang No.9 and highly resistantBrassicaoleraceaOlera 2 to obtain F1(ACC).F 6 was generated by continuously backcrossing Zhongshuang No.9 to F16 times followed by selfing.The chromosomal number of F1was 38,it was according withBrassicanapusL.Resistance assessment indicating that the resistance of F1was higher than Zhongshuang No.9 but lower than Olera 2.Lastly,through comparing the amplified maps of 229 pairs of SSR marks distributed on the genetic linkage groups ofBrassicanapusL.as well as 16 pairs of SSR mark represented peculiar resistant loci ofBrassicaoleraceagainstSclerotiniasclerotiorumbetween parents and progeny,we found that the No.9 linkage group of Olera 2 had permeated into the the genome of F 6.
Brassicaoleracea;BrassicanapusL.;SclerotiniaSclerotiorum; SSR maker
2016-05-13
国家科技支撑计划( 编号: 2013 FBAD 01 B 03);国家“863” 计划( 编号:2011 AA 10 A 10401) ;四川省“十二五” 油菜育种攻关项目( 编号:2011 yz gg 05) 。
王浩杰(1991—),男,安徽六安人;硕士研究生,研究方向:植物遗传;E-mail: wanghoajie@sina.cn。
王茂林,男,教授,博士生导师,主要从事植物分子生物学研究和油菜遗传育种研究;E-mail: mlwang@scu.edu.cn。
10.16590/j.cnki.1001-4705.2016.11.009
S 565.4
A
1001-4705(2016)11-0009-04
