2型糖尿病患者脑部小血管病变的MRI评价
2016-12-03肖正光朱才松邵康为袁立新闵庆华陆文杰
肖正光,杨 军,朱才松,邵康为,袁立新,闵庆华,顾 峰,陆文杰
(上海市同仁医院 上海交通大学医学院附属同仁医院影像科,上海 200336)
2型糖尿病患者脑部小血管病变的MRI评价
肖正光,杨军,朱才松,邵康为,袁立新,闵庆华,顾峰,陆文杰
(上海市同仁医院 上海交通大学医学院附属同仁医院影像科,上海200336)
目的:本研究应用多种磁共振技术,对2型糖尿病人的脑部小血管损害表现进行无创评估,以期对临床糖尿病的诊治及评估给予一定的帮助。材料和方法:收集2013年1—12月我院神经内科住院患者437例,排除18例,分为糖尿病组和无糖尿病组,应用3.0T磁共振扫描仪,行颅脑轴位T1WI、T2WI、FLAIR、DWI、SWI、矢状面T2加权像序列扫描,分别记录各个病例急性梗塞的发生例数及分布类型、脑内微出血灶、腔隙性梗塞灶的发生数目,脑白质疏松程度。结果:糖尿病组小血管闭塞型梗塞发生率68.2%(30/44)大于无糖尿病组43.2%(35/81),差异有统计学意义(χ2=7.49,P<0.05)。糖尿病组既往卒中发生率、腔隙灶发生严重程度、脑白质疏松程度均较无糖尿病组严重(P<0.05),但脑内微出血的发生程度两组无差异(P>0.05)。结论:2型糖尿病患者急性梗塞以小病灶为主,其腔隙灶发生严重程度、脑白质疏松程度均较无糖尿病组严重。
糖尿病,2型;糖尿病血管病变;脑血管障碍;磁共振成像
高血糖状态是糖尿病引起神经系统损害的共同基础[1],可引起一系列脑部的影像学改变,脑微小血管病变被认为是糖尿病造成脑部损伤的病理基础,本文利用MRI多种成像方式,无创性地对2型糖尿病人的脑部表现进行评估,以期对临床糖尿病脑部损伤的诊治及疗效评价、远期评估给予一定的帮助。
1 材料和方法
1.1研究对象
收集2013年1—12月我院神经内科以头晕、肢体不利等症状收治入院,临床疑似缺血性脑卒中患者;排除标准:脑部肿瘤患者,本次卒中是由外科或血管介入操作引起;合并严重的心、肝、肺、肾功能不全或恶性肿瘤。最终入组患者437例,其中5例脑部术后,3例脑肿瘤,7例脑部外伤,3例严重心功能不全予以排除。根据临床病史,分为2型糖尿病组和无糖尿病组。
1.2研究方法
1.2.1检查方法
入选患者皆在入院3天内进行3.0T的头颅磁共振检查。本研究使用德国西门子公司 skyro Magnetom 3.0T超导型磁共振扫描仪,20通道高分辨率颅脑线圈。所得原始数据传输到Syngo Multi Modality Workplace工作站,分别观察有无急性梗塞灶、梗塞灶分布情况、脑室周围白质和皮质下白质病变、脑内微出血的数目和腔隙性脑梗塞的数目。
1.2.2扫描参数
①SWI序列:单次回波,TE 20ms,TR 27ms,翻转角15°,FOV 24 cm×24 cm,矩阵256×227,激励次数2,扫描层厚2.0mm。②T1WI序列参数:TE 9.0ms,TR 1 500ms,TI 760ms,FOV 24 cm×24 cm,矩阵320~224,激励次数1,层厚5mm,间隔1.2mm。③T2WI序列参数:TE 117ms,TR 5000ms,FOV 24 cm× 24 cm,矩阵320×320,激励次数1,层厚5.0mm,间隔1.2mm。④T2FLAIR序列参数:TE 85ms,TR 5000ms,TI 1 802.6ms,FOV 24 cm×24 cm,矩阵256×157,激励次数2,层厚5.0mm,间隔1.2mm。⑤DWI序列,TE 85ms,TR 3200ms,Flip角90°,FOV 24cm×24cm,矩阵192×192,激励次数2,层厚5.0mm,间隔1.2mm。
1.2.3影像学评价
所得图像由两名影像科医师采用双盲法进行独自评价分析,事先不知道患者相关临床资料。两者评价结果一致作为最终结果记录,如两者评价结果不一致,则由两者共同进行评价,通过协商最终取得一致意见作为最终结果记录。
急性脑梗塞分类:表现为DWI高信号,T1WI等或稍低信号,T2WI及FLAIR等或稍高信号,1型为大动脉粥样硬化型,临床上存在同一供血区短暂性脑缺血反复发作,出现失语、运动功能障碍等症状,颅脑MRI检查发现有大于15mm的梗塞灶,大脑皮层可受累。2型小动脉闭塞型梗塞:判定标准为,临床上具有典型或非典型的脑梗塞的症状,颅脑MRI检查中发现的梗塞灶的最大直径<15mm。
脑白质疏松:在FLAIR序列上评价,参照Fazekas等[5]的0~3逐级加重方法,对于皮质下白质病变和脑室周围白质病变进行单独评价,皮质下白质疏松(Deep white matter hyperintense signals,DWMH):0级:正常白质;1级:皮层下散在点状白质高信号;2级:白质内高信号呈融合趋势:3级:白质内见大片融合高信号。脑室周围白质疏松(Periventricular hyperintense,PVH):0级:正常白质;l级:脑室前后角呈帽状或脑室旁呈线样白质高信号:2级:如光滑的晕圈一样脑室周白质信号异常:3级:脑室周围白质病变不规则,并向皮层下白质延伸[6]。全脑白质积分参照Fazekas量表(0~6分)将脑室旁和深部白质病变两部分的分数相加计算总分。
腔隙性梗塞灶:严重程度按照病灶数目多少进行分级:0级为无腔隙灶,1级病灶数目1~3,2级病灶数目4~10,3级病灶数目>10[7]。
脑内微出血:主要应用SWI序列对脑内微出血灶(Cerebral microbleeds,CMBs)进行观察,对确定病灶计数,按照CMBs病灶数目[8]进行分级,0级为正常,1级病灶数1~2个,2级病灶3~10,3级病灶>10个。
1.3统计方法
所有数据均经SPSS 13.0统计软件包进行分析处理;计量资料以均数±标准差(±s)或中位数(四分位数间距)表示,计数资料以百分数表示,比较采用单因素方差分析和χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1研究样本
最终入组419例中,糖尿病组145例,男73例,女72例,年龄41~93岁,平均(72.4±11.5)岁,其中高血压患者112例(77.2%),无糖尿病组274例,男151例,女123例,年龄32~91岁,平均(70.8±13.1)岁,其中高血压199例(72.6%),两组的性别构成、年龄以及高血压患者比例差异无统计学意义(P>0.05)。
2.2糖尿病组和无糖尿病组相关资料比较
两组急性梗塞发生及类型比较。无糖尿病组急性梗塞发生率为29.6%(81/274),糖尿病组为30.3% (44/145)。梗塞病例中,糖尿病组小血管闭塞型68.2%(30/44),无糖尿病组为43.2%(35/81);大血管闭塞型糖尿病组为31.8%(14/44),无糖尿病组为56.8%(46/81),两组梗塞的类型差异显著(χ2=7.49,P<0.05)。
两组卒中史的比较:糖尿病组既往卒中的发生率(48/145)明显高于无糖尿病组(24/274),两者差异有统计学意义(χ2=39.5,P<0.05)(表1)。
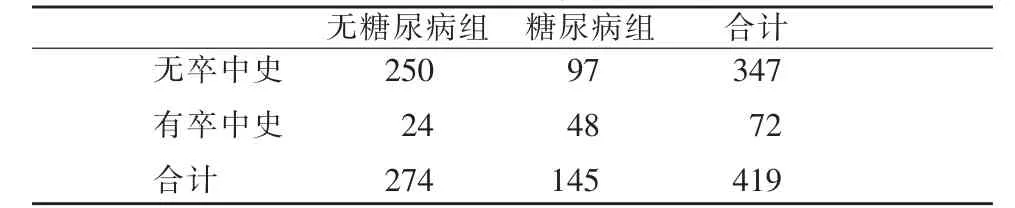
表1 两组既往卒中史比较
两组脑微出血严重程度的比较,差异无统计学意义(P>0.05,表2)。

表2 两组脑内微出血程度比较
两组腔隙性梗塞灶严重程度 (数目多少)的比较,发现糖尿病组脑内腔隙灶的严重程度亦明显高于无糖尿病组,尤其是重度腔隙灶的比例糖尿病组为17.9%(26/145),明显高于无糖尿病组9.5%(26/274),差异具有统计学意义P<0.05(见表3)。

表3 两组脑内腔隙灶严重程度比较
在对两组皮层下白质积分及脑室周边积分进行比较,发现糖尿病组的皮质下白质疏松及脑室周边白质疏松程度较无糖尿病组严重,两侧差异有统计学意义(P<0.05)(见表4,5)。将两组皮层下白质积分和脑室周边积分相加所得全脑白质积分进行比较,亦发现糖尿病组的全脑白质疏松程度较无糖尿病组严重,两者差异具有统计学意义(P<0.05)(见表6)。

表4 两组皮层下白质积分比较

表5 两组脑室周边白质积分比较

表6 两组脑白质积分比较
3 讨论
Mile和Root首先报道糖尿病会对认知功能产生不良影响[9],糖尿病脑血管病以脑动脉粥样硬化所致缺血性脑病最为常见,如短暂性脑缺血发作、腔隙性脑梗死、多发性脑梗死、脑血栓形成等,糖尿病者脑血管病发生率较非糖尿病者明显增高[10],女性尤甚。Framingham研究结果45~74岁糖尿病脑梗死发生率较非糖尿病者男性高2.5倍,女性高3.7倍。而且,糖尿病者各年龄段缺血性脑卒中的发生率均高于非糖尿病者。因此本研究首先对糖尿病伴发急性梗塞的表现进行分析,糖尿病组梗塞的发病率为44/145(30.3%),无糖尿病组急性梗塞发病率为81/ 274(29.6%),两者并无明显差别,这和文献报道并不相符,造成这个结果的可能原因为抽样误差所致,我们的病例均为神经内科住院病例,本身都具有一定的神经功能症状才会入院,这就造成了群体的梗
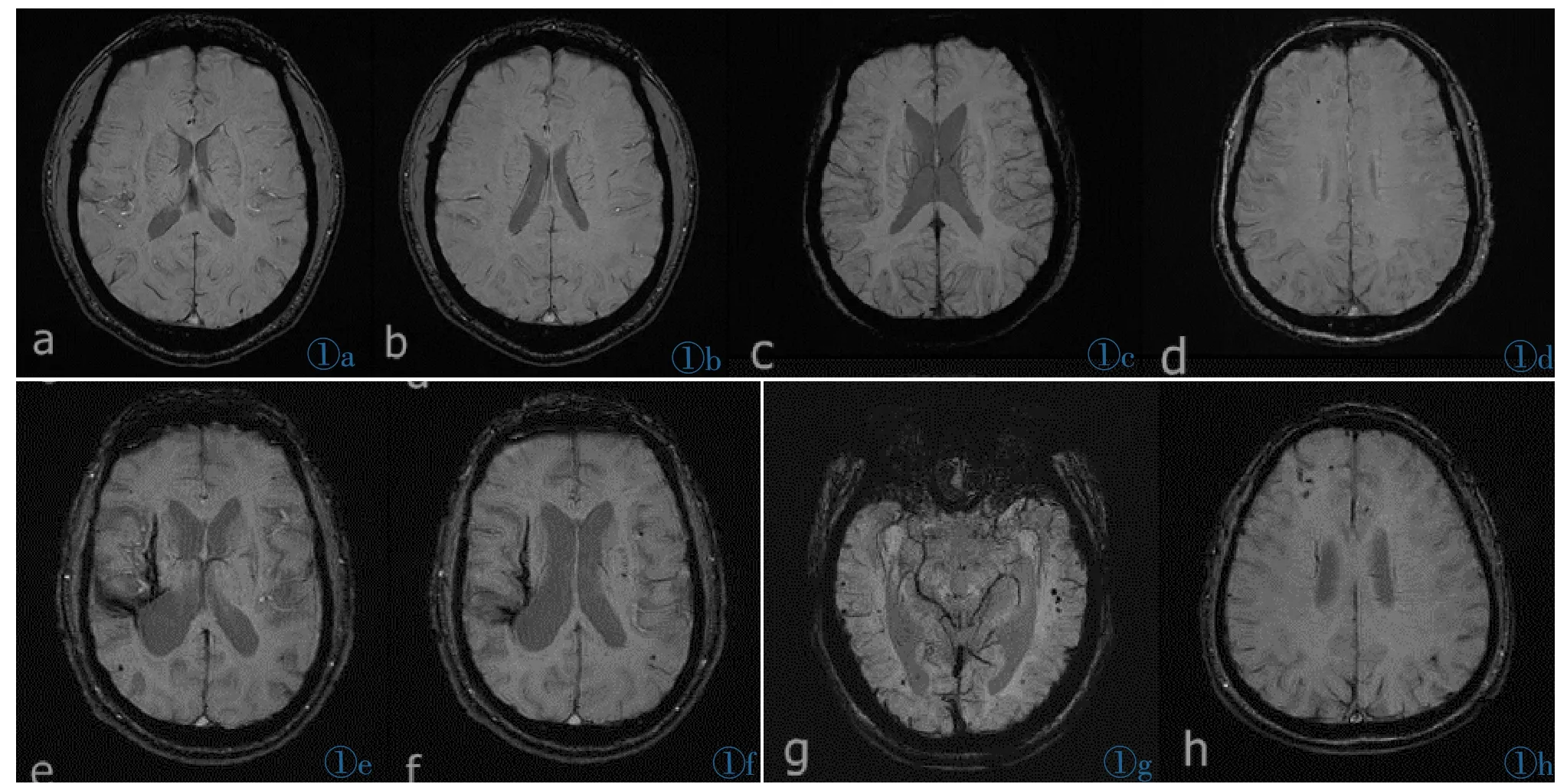
图1脑内微出血灶严重程度,在SWI序列上,以微出血灶的数目多少进行分级,图1a,1b为同一病例,无微出血灶(0级);图1c,1d为1级(1~2);图1e,1f为2级(3~10);图1g,1h为3级病灶数目>10个,定义为3级。
Figure 1.The severity of cerebral microbleeding based on the number of lesions for grading.Figure 1a,1b for the same case,no micro hemorrhage(level 0);Figure 1c,1d for level 1(1~2);Figure 1e,1f level 2(3~10);Figure 1g,1h number of lesions>10,defined as level 3.塞发生率较高。
图2梗塞类型分类。图2a~2d为同一病例,男性,78岁,2型糖尿病11年,右侧肢体肌力下降,口齿不清,表现为大片梗塞灶,累及皮层,判定为1型大血管粥样硬化型梗塞。图2e~2h为另一病例,女性,81岁,2型糖尿病6年,肢体乏力,MRI检查可见左侧额叶点状梗塞灶,归为2型小血管闭塞型。
Figure 2.Infarction type classification.Figure 2a~2d for the same cases,male,78 years old,type 2 diabetes for 11 years,right limb muscle strength decline,slurred speech,characterized by large area of infarction,involving the cortex,classified as type 1 large vascular atherosclerotic infarction.Figure 2e~2h for another case,female,81,six years in type 2 diabetes,the body fatigue,MRI showed a dot infarct lesion on the left frontal lobe,classified as type 2 small vascular occlusion type.


图3脑白质疏松程度判定,在FLAIR序列上,图3a,3b为同一病例,皮质下见点状高信号,脑室旁细线样高信号,两者均为1级信号;图3c,3d脑室旁高信号影范围较广(2级信号),皮质下白质区小片高信号(2级信号);图3e,3f病例脑室旁及皮质下白质病变融合成片(3级信号)。
Figure 3.To determine the degree of cerebral white matter on FLAIR sequence.Figure 3a,3b for the same case,there is dot high signal under the cortex and linear high signal next to the ventricle,both for level 1;Figure 3c,3d show broader high signal shadow beside the ventricle(level 2)and small piece of high signal in subcortical white matter area(level 2);Figure 3e,3f show that periventricular and subcortical white matter lesions are confluent(level 3).
由此,我们将两组既往卒中史进行了比较,研究中糖尿病组高血压的发生率为77.2%,无糖尿病组为72.6%,两组并无明显差异,但对两组的既往卒中史的发生率进行比较,发现糖尿病组中既往卒中发生率48/145(33.1%),明显高于无糖尿病组该类患者比例24/274(8.8%),两者的差异具有统计学意义(P<0.05)。这提示我们慢性高血糖状态对脑血管的损伤是长久的过程,在较长的过程对脑部卒中的发生产生较为明显的影响,这也证实了糖尿病群体卒中的发生率明显升高,糖尿病是卒中独立危险因素之一[11]。进一步比较发现,糖尿病组梗塞病灶更多表现为多灶性、散在分布30/44(68.2%),发病部位多位于白质区或脑内深穿支的供血区,如壳核、内囊、丘脑及脑桥基底等,皮层较少累及,这就反映出这些病灶更多是由于小动脉闭塞引起,无糖尿病组该类表现为35/81(43.2%);这可能是由于糖尿病引起微血管内皮功能损伤更加容易影响小动脉,导致血管小血管内微血栓形成而致管腔闭塞,组织缺血梗塞。而非糖尿病组的梗塞更多表现为,梗塞病灶范围较大,常常累及皮质区域46/81(56.8%),这就提示为较大血管病变所导致。糖尿病群体中,高血压发生率甚高(20%~60%),众所周知,高血压是脑卒中产生的重要因素,我们研究中两组高血压的发病率相近,但是梗塞的表现产生了分化的趋势,我们猜测这归结于糖尿病这一因素的存在,使得脑微血管改变比无糖尿病组更加明显所致。
我们又对两组的微小出血灶及腔隙灶的发生情况进行了对比,发现糖尿病组的腔隙灶的发生率84.1%(122/145)亦明显高于无糖尿病组78.1%(214/ 274),但是两组微小出血灶严重程度并无明显差异。腔隙性梗塞灶属于微小血管病变,腔隙性脑梗塞的存在,提示微血管受损。高血糖的存在,及其伴随的代谢综合征直接或间接地导致血管内皮功能异常,作用于毛细血管组织、导致内皮炎症反应发生、引起血脑屏障通透性改变,并影响了局部的新陈代谢和血流调节,可能是2型糖尿病患者发生微小血管和大血管病变的重要发病机制之一,这就可以解释糖尿病组的腔隙性梗塞灶发生率高于无糖尿病组。但是,脑内微出血灶同腔隙性脑梗塞一样也属于脑微血管病变,以往的研究也表明随着腔隙性脑梗塞严重程度的增加(数目的增多),发现脑内微出血比率越高,为何在糖尿病组中,腔隙灶的发生率明显增高,而并未出现微出血灶发生率同步增高呢?我们猜测这可能是由于糖尿病患者的血液易呈高粘、高滞、高凝倾向,红细胞聚集性增强,红细胞变形能力减弱,血小板凝聚功能增强,从而引起全血粘度增高,血液出现不同程度的凝固现象,易在微血管中发生血栓及栓塞,而凝血功能的亢进,则抑制了脑血管的破裂和出血。
小血管病变是脑白质疏松LA(又称白质疏松)发生与进展的重要危险因素[12-13],其与老年人认知功能减退、情绪、步态异常、排尿障碍有关,并且与脑卒中复发和预后相关[14-15]。既往研究将颅脑MRI上确定的脑白质疏松在老年人群等特定人群中作为脑部小血管损害的影像学标记物,因此我们将糖尿病组脑白质病变程度同无糖尿病组白质程度进行比较,糖尿病组中脑白质病变积分4级以上为38.6% (56/145),而非糖尿病组4级以上占比为25.2%(69/ 274),发现糖尿病组明显较无糖尿组病变程度严重,这强烈提示2型糖尿病的相关因素与脑白质病变严重程度存在一定的关联,糖尿病的控制情况可能与脑白质病变的进展相关。Masana和Manschot等[10]研究指出2型糖尿病患者发生LA的可能性较高,进展速度比无糖尿病患者进展速度更快。但是既往研究结果也有相反结论,Lazarus等研究认为PVH在糖尿病组与非糖尿病组无明显差异。在Bresser[16]研究中,也没有发现糖尿病同脑白质病变严重程度明显相关。造成这样结果的原因可能为,既往研究对象都是脑梗塞患者或腔隙性梗塞患者,而非集中针对糖尿病患者进行研究,糖尿病患者占的比重太少,没有显示出这一群体的特征。
2型糖尿病人群相对无糖尿病人群更容易发生脑卒中,尤其是缺血性脑卒中,更多表现为小血管损害所导致的小范围、多病灶改变,脑内腔隙灶发生的严重程度更高,但是脑内微出血灶并没有明显增多改变。同时,糖尿病同脑部白质病变的严重程度相关。
[1]Last D,Alsop DC,Abduljalil AM,et al.Global and regional effects of type 2 diabetes on brain tissue volumes and cerebral vasoreactivity[J].Diabetes Care,2007,30(5):1193-1199.
[2]Umemura T,Kawamura T,Umegaki H,etal.Endothelial and inflammatory markers in relation to progression of ischaemic cerebral small-vessel disease and cognitive impairment:a 6-year longitudinal study in patients with type 2 diabetes mellitus[J].J Neurol Neurosurg Psychiatry,2011,82(11):1186-1194.
[3]van Harten B,Oosterman JM,Potter van Loon BJ,et al.Brain lesions on MRI in elderly patients with type 2 diabetes mellitus [J].Eur Neurol,2007,57(2):70-74.
[4]Debette S,Markus HS.The clinical importance of white matter hyperintensities on brain magnetic resonance imaging:systematic review and meta-analysis[J].BMJ,2010,26(341):c3666.
[5]Fazekas F,Chawluk JB,Alavi A,et al.MR signal abnormalities at 1.5T in Alzheimer’s dementia and normal aging[J].AJR,1987, 149(2):351-356.
[6]Marti-Fabregas J,Valencia C,Pujol J,et al.Fibrinogen and the amount of leukoaraiosis in patients with symptomatic small-vessel disease[J].Eur Neurol,2002,48(4):185-190.
[7]Roob G,Lechner A,Schmidt R,et al.Frequency and location of microbleeds in patients with primary intracerebral hemorrhage[J]. Stroke,2000,31(11):2665-2669.
[8]Reichenbach JR,Venkatesan R,Schillinger DJ,et al.Small vessels in the human brain:MR venography with deoxyhemoglobin as an intrinsic contrast agent[J].Radiology,1997,204(1):272-277.
[9]de la Monte SM,Wands JR.Alzheimer’s disease is type 3 diabetes—evidence reviewed[J].J Diabetes Sci Technol,2008,2(6): 1101-1113.
[10]Manschot SM,Brands AM,van der Grond J,et al.Brain magnetic resonance imaging correlates of impaired cognition in patients with type 2 diabetes[J].Diabetes,2006,55(4):1106-1113.
[11]高娜,赵铁耘,李秀钧,等.糖尿病是卒中的独立危险因素[J].中国卒中杂志,2007,2(7):594-596.
[12]Fazekas F,Kleinert R,Offenbacher H,et al.Pathologic correlates of incidental MRl white matter signal hyperintensities[J].Neurology,1993,43(9):1683-1689.
[13]Wong TY,Klein R,Sharrett AR,et al.Cerebral white matter lesions,retinopathy,and incident clinical stroke[J].JAMA,2002, 288(1):67-74.
[14]Ay H,Arsava EM,Rosand J,et al.Severity of leukoaraiosis and susceptibility to infarct growth in acute stroke[J].Stroke, 2008,39(5):1409-1413.
[15]Thein SS,Hamidon BB,Teh HS,et al.Leukoaraiosis as a predictor for mortalityandmorbidityafter anacuteischaemic stroke[J].Singapore Med J,2007,48(5):396-399.
[16]de Bresser J,Tiehuis AM,van den Berg E,et al.Progression of cerebral atrophy and white matter hyperintensities in patients with type 2 diabetes[J].Diabetes Care,2010,33(6):1309-1314.
MRI features of cerebral small vessel disease in patients with type 2 diabetes mellitus
XIAO Zheng-guang,YANG Jun,ZHU Cai-song,SHAO Kang-wei,YUAN Li-xin,MIN Qing-hua,GU Feng,LU Wen-jie (Department of Radiology,Tongren Hospital,Shanghai JiaoTong University School of Medicine,Shanghai 200336,China)
Objective:To evaluate the manifestation of cerebral small vessel damage of type 2 diabetes using noninvasive techniques of MR imaging,and to provide useful information for clinical diagnosis,therapy,and long term evaluation of diabetes.M aterials and Methods:Four hundred and thirty-seven neurology inpatients were recruited in our study between January 2013 and December 2013,eighteen cases were excluded.Diabetes group and non-diabetes group were observed.All patients underwent brain MRI with T1WI,T2WI,FLAIR,DWI,SWI and T2WI sequences in 3.0T scanner.The incidence rate and distribution pattern of acute infarction,cerebral micro hemorrhage,the number of lacunar infarction and the degree of leukoaraiosis were recorded.Results:The incidence rate of infarction caused by small vessel occlusion was higher in diabetes group than in non-diabetes group(68.2%vs 43.2%).There was statistical difference between diabetes group and non-diabetes group(χ2=7.49,P<0.05).Compared with non-diabetes,diabetes group showed up more serious degree in previous cerebral apoplexy,lacunar infarction and leukoaraiosis.There was no statistical difference in the occurrence rate of cerebral microhemorrhage between the two groups(P>0.05).Conclusion:Small lesions was mainly presented in acute infarction happened in patients with type 2 diabetes.The severity of lacunar infarction and leukoaraiosis occurred in diabetes group was severer than that in non-diabetes group.
Diabetes mellitus,type 2;Diabetic angiopathies;Cerebrovascular disorders;Magnetic resonance imaging
R643;R445.2
A
1008-1062(2016)05-0318-05
2015-10-21;
2015-12-31
肖正光(1979-),男,上海人,主治医师。E-mail:18121226559@189.cn
杨军,上海市同仁医院 上海交通大学医学院附属同仁医院影像科,200336。E-mail:y.jun66@aliyun.com
上海市重点专科建设科研基金资助(No.05II025)。
