灰树花胞外多糖的分离纯化及免疫调节作用
2016-12-01韩丽荣王莉蕊王春玲
韩丽荣,程 代,孟 梦,王莉蕊,王春玲
(天津科技大学食品工程与生物技术学院,天津 300457)
灰树花胞外多糖的分离纯化及免疫调节作用
韩丽荣,程 代,孟 梦,王莉蕊,王春玲
(天津科技大学食品工程与生物技术学院,天津 300457)
通过对灰树花(Grifola frondosa)深层发酵的胞外多糖(EXGFP)进行分离纯化,研究其性质和免疫活性.灰树花胞外粗多糖经醇沉、酶-sevag脱蛋白和Sephadex G-100色谱柱分离得到纯化组分EXGFP-A.通过Sepharose 4B凝胶柱法和HPLC法鉴定EXGFP-A的纯度,结果表明EXGFP-A是均一多糖组分,纯度为92.68%,.理化性质实验结果表明,EXGFP-A是一种非淀粉类、不含糖醛酸及多酚类物质,含有α -D-葡萄糖苷键和吡喃糖环的中性多糖.MTT实验表明,当 EXGFP-A质量浓度为 80,µg/mL、作用 48,h时,小鼠巨噬细胞 RAW264.7细胞增殖指数达到最大值,为137.5%,.吞噬活性实验结果证实EXGFP-A能够提高RAW264.7细胞对中性红的吞噬能力,扫描电子显微镜结果发现RAW264.7细胞经过EXGFP-A处理后,细胞表现出了明显的活化特征.
灰树花;胞外多糖;分离纯化;小鼠巨噬细胞RAW264.7;免疫活性
灰树花(Grifola frondosa)是一种珍贵的药食两用型真菌[1],具有多种生物活性,如抗病毒[2]、免疫调节[3]、抗辐射[4]、抗肿瘤[5]、抗氧化[6]、调节血糖[7]及降血脂作用,从而具有良好的应用前景.已有研究证实了灰树花多糖的抗肿瘤活性[8],因此,对于其结构分析以及其他活性的研究成为了当前的研究热点.随着对灰树花深入的研究,其化学成分也逐渐被分离出来,主要有多糖、蛋白质、肽类和脂类等,其中主要的活性成分为灰树花多糖[9].
近年来,灰树花作为一种珍贵真菌被开发研究,大量的研究已经证实了其具有多种生物活性.国内外对于灰树花的研究主要集中在灰树花子实体多糖的功能学评价[10].杨阳等[11]通过小鼠脾淋巴细胞转化增殖实验,证实了灰树花多糖组分的免疫活性.王宝琴等[12]研究结果证明,高纯度碱提灰树花 β-葡聚糖能显著提高小鼠的细胞吞噬功能及特异性免疫和非特异性免疫功能.但有关灰树花的发酵培养、多糖结构和体外免疫活性的研究相对较少.
本实验通过对灰树花进行深层发酵培养,所得发酵液经提取得到灰树花胞外粗多糖,分离纯化后得到均一的多糖组分,采用红外光谱分析等方法对其进行基本的结构分析,利用 MTT实验、中性红实验以及扫描电镜对其进行体外免疫活性的研究.以上研究将会为灰树花胞外多糖的开发利用提供一定的理论依据.
1 材料与方法
1.1实验材料
灰树花(Grifola frondosa)由天津科技大学菌种保藏中心提供,编号为39025.
RAW264.7细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所.
1.2灰树花胞外多糖的提取及分离纯化
对灰树花进行深层发酵培养,所得发酵液通过醇沉法得到胞外粗多糖(EXGFP).经过除蛋白、脱色、超滤分级和 Sephadex G-100色谱柱(26,mm× 800,mm)分离,最终得到灰树花胞外多糖 EXGFPA.具体操作如下:
醇沉法:将灰树花发酵液减压浓缩后,加入 95%,的乙醇,使乙醇终体积分数为 75%,,4,℃过夜提取后,离心收集沉淀,经无水乙醇、丙酮、乙醚等依次洗涤,冷冻干燥得到灰树花胞外粗多糖.
除蛋白:采用酶-sevag法,向5%,的EXGFP溶液中添加3%,的木瓜蛋白酶,调节pH为6~7,60,℃酶解2,h后,加入sevag溶液,混匀后静置,取上层的多糖溶液层.向上层溶液中重复添加 sevag溶液,直至将蛋白完全除去.
脱色、超滤分级及分离:选择 AB-8大孔吸附树脂进行脱色,将得到的多糖溶液以体积分数 5%,缓慢沿壁加入装好的柱子中,并保持适当的流量,直到流出的溶液为无色溶液为止.将脱色处理后的多糖溶液经过0.45,µm的滤膜进行预处理后超滤分离.冷冻干燥后,采用 Sephadex G-100色谱柱(26,mm× 800,mm)分离,最终得到灰树花胞外多糖EXGFP-A.
1.3EXGFP-A纯度鉴定
采用 Sepharose 4B凝胶柱法和 HPLC法,对EXGFP-A进行纯度鉴定.将5,mg/mL的EXGFP-A溶液上样至 Sephadex G-75的色谱柱(16,mm× 600,mm)中,洗脱液为三蒸水,流量为0.2,mL/min,每10,min收集1管.采用苯酚-硫酸法测定各管多糖含量,以洗脱管数为横坐标,吸光度为纵坐标,绘制EXGFP-A的洗脱曲线.
采用 0.22,µm 的微孔滤膜对 10,mg/mL的EXGFP-A 溶液进行过滤后,备用.液相色谱条件:岛津 CT0-20A高效液相色谱仪,Shodex OHPak SB-804HQ(8.0,mm×300,mm)凝胶色谱柱;流动相为超纯水,流量为 0.8,mL/min;示差检测器检测,色谱柱和检测器温度为 30,℃.相对分子质量校正曲线所用标准品为Dextran系列,标准曲线y=-0.039,89x3+ 1.174x2-12.06x+47.704,R2=0.999.
1.4EXGFP-A理化性质测定
1.4.1显色实验
淀粉检测:将EXGFP-A精确配制成1%,的多糖溶液,取1,mL加入2%,的碘-碘化钾溶液3,mL,混匀后静置,观察有无颜色变化.
多酚类物质检测:将 EXGFP-A精确配制成5,mg/mL 的多糖溶液,加入 1%,的 FeCl3溶液 1~2滴,摇匀后静置,观察有无颜色变化.
糖醛酸检测:将 EXGFP-A 精确配制成0.1,mg/mL 的多糖溶液,取 1,mL加入 6,mL浓H2SO4溶液,85,℃水浴 20,min,室温静置,加入0.15%,的咔唑乙醇溶液200,µL,85,℃水浴20,min,室温静置,观察有无紫红色络合物产生.
1.4.2EXGFP-A的紫外扫描
将 EXGFP-A准确配制成 1,mg/mL 的多糖溶液,以蒸馏水为空白参照,分别进行紫外全波长扫描,扫描范围是190~400,nm.
1.4.3EXGFP-A的红外光谱
1,mg EXGFP-A样品以KBr压片,在室温条件下测定多糖样品的红外光谱[13].
1.5EXGFP-A免疫活性实验
1.5.1EXGFP-A对RAW264.7细胞增殖活性的影响
采用MTT法[14]测定EXGFP-A作用RAW264.7细胞一定时间后,使用酶标仪测定 570,nm处各孔的吸光度.细胞增殖率=A加药/A对照×100%,.
1.5.2EXGFP-A对RAW264.7细胞吞噬活性的影响
本实验采用中性红吞噬法测定 EXGFP-A处理RAW264.7细胞一定时间后,使用酶标仪测定540,nm处的吸光度.
1.5.3EXGFP-A对RAW264.7细胞形态的影响
取处于对数生长期的RAW264.7细胞进行计数,调整细胞悬液密度为5×104,mL-1,以每孔2,mL加入放有盖玻片的6孔细胞培养板中,37,℃、5%, CO2培养4~6,h使细胞充分贴壁.弃去培养液,加入质量浓度分别为0、40、80、160,µg/mL的EXGFP-A,37,℃、5%, CO2细胞培养箱中继续培养48,h.
细胞培养结束后,用 PBS缓冲液洗去残留培养液,然后以 2.5%,戊二醛溶液固定细胞 2,h,以不同体积分数(10%,、30%,、50%,、70%,、90%,、100%,)的乙醇依次对细胞进行脱水处理,取出盖玻片,剪成适量大小粘于样品台,待喷金后进行电镜扫描,观察经EXGFP-A作用前后RAW264.7细胞的形态变化.
2 结果与讨论
2.1灰树花多糖的分离纯化
经减压浓缩、乙醇醇沉、脱脂、酶-sevag法除蛋白、AB-8大孔吸附树脂脱色、超滤除杂、Sephadex G-100色谱柱分离以及冷冻干燥,最终得到灰树花多糖EXGFP-A,得率为2.84,g/L.
2.2EXGFP-A的纯度鉴定
EXGFP-A的纯度鉴定结果如图1所示.
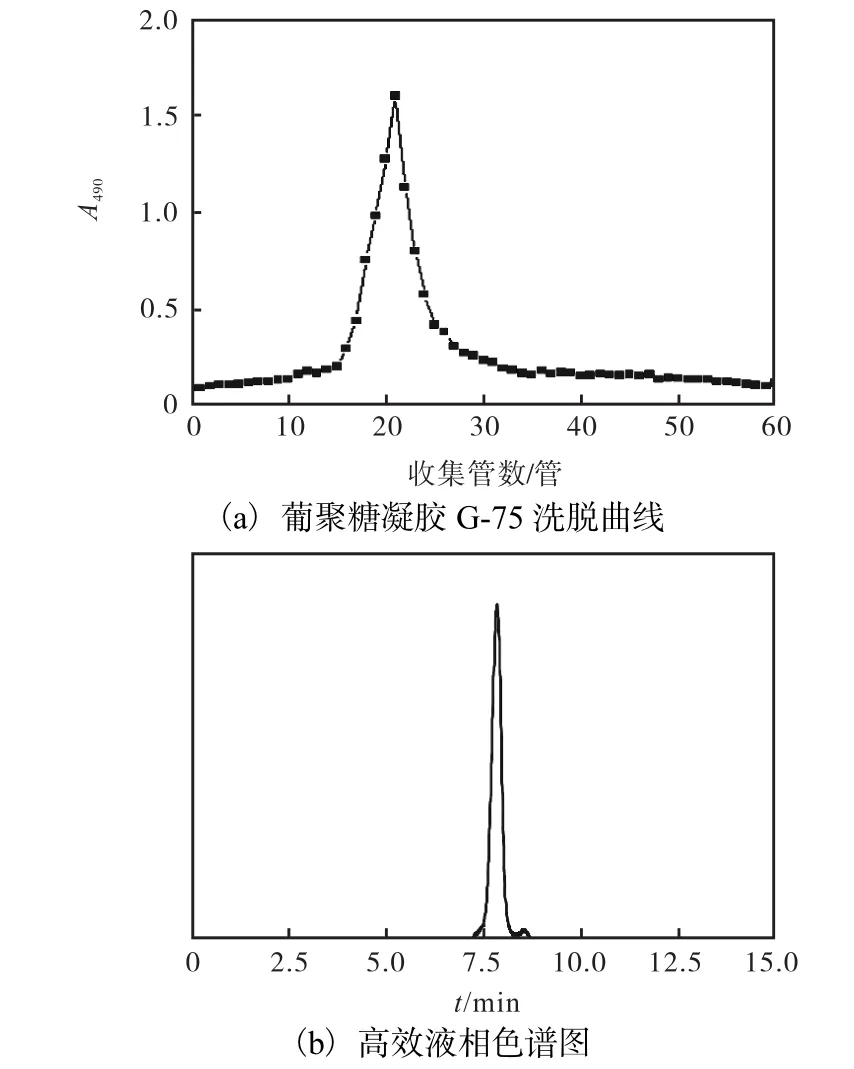
图1 EXGFP-A葡聚糖凝胶 G-75洗脱曲线和高效液相色谱图Fig.1 Sephadex G-75 flew curve and HPLC of EXGFP-A
从Sephadex G-75洗脱曲线可以看出,EXGFP-A的洗脱峰为单一对称峰型,说明EXGFP-A是宏观均一的多糖组分.高效液相色谱图中出现较单一对称主峰,表明该组分是均一多糖,经测定纯度为92.68%,,相对分子质量为1.355×106.
2.3EXGFP-A的理化性质测定
EXGFP-A显色实验结果见表1.EXGFP-A为白色粉末状,溶于水但不溶于有机试剂,是一种非淀粉类、不含多酚类物质及糖醛酸的中性多糖.

表1 EXGFP-A显色实验Tab.1 Color experiments of EXGFP-A
紫外全波长扫描显示(图 2),EXGFP-A在260,nm和 280,nm处无明显吸收峰,说明 EXGFP-A组分中基本不含核酸以及蛋白质,而在 196,nm处有多糖的特征吸收峰,说明 EXGFP-A组分是多糖类物质.
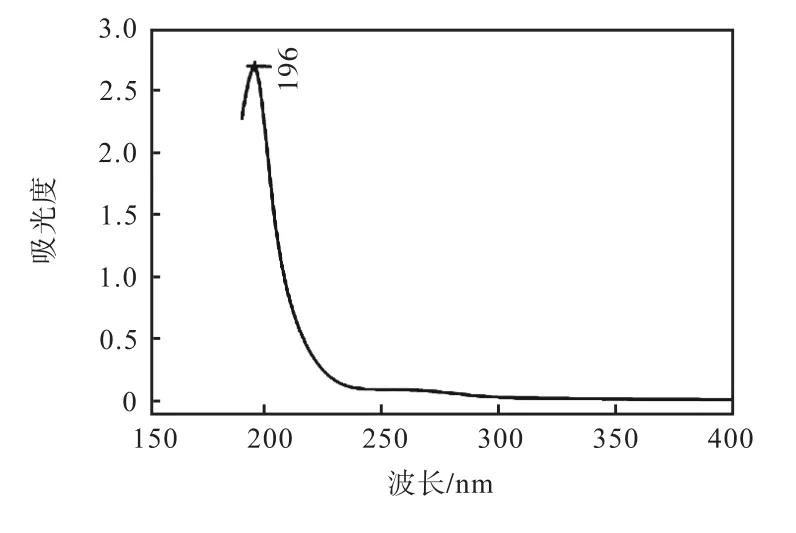
图2 EXGFP-A紫外扫描图谱Fig.2 UV scanning of EXGFP-A
EXGFP-A的红外光谱分析结果如图3所示.在3,600~3,200,cm-1处是 O—H伸缩振动;2,934,cm-1为C—H伸缩振动;1,652,cm-1、1,400~1,200,cm-1是C—H的变角振动,以上特征吸收峰证明 EXGFP-A是糖类物质.在 1,700~1,775,cm-1处无明显吸收峰,表明样品中不含羧基,即 EXGFP-A是中性多糖. 1,870~1,540,cm-1处是 C=O伸缩振动.1,069,cm-1处的吸收峰表明EXGFP-A中存在3-6-内醚桥,即样品中含有3-6-内醚-半乳糖,而852,cm-1处的吸收峰表明 EXGFP-A的单糖组成为α -D-葡萄吡喃糖,即EXGFP-A属于吡喃型多糖.此外,807,cm-1处的特征峰则说明在多糖分子中存在甘露糖苷键,619,cm-1处的吸收峰表明多糖中含有葡萄糖残基.
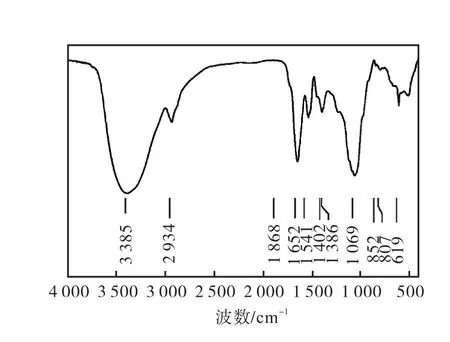
图3 EXGFP-A红外分析图谱Fig.3 FT-IR spectroscopic analysis of EXGFP-A
2.4EXGFP-A的免疫活性研究
2.4.1EXGFP-A对RAW264.7细胞增殖活性的影响
巨噬细胞作为一种重要的免疫细胞广泛分布于机体中,通过呈递抗原、吞噬侵入体内的有害物质、分泌细胞因子等途径发挥防御和调节功能,参与机体的特异性、非特异性免疫反应[15],在宿主防御方面扮演着重要作用.当处于休眠状态的巨噬细胞受到一些免疫增强剂激活后,会表现出更强的杀菌、增殖、吞噬及胞饮能力[16].
本实验采用噻唑蓝比色法,即 MTT法测定EXGFP-A对 RAW264.7细胞增殖活性的影响,以脂多糖(LPS)处理组作为阳性对照,*和**分别表示与空白组相比P<0.05和P<0.01,结果如图4所示.
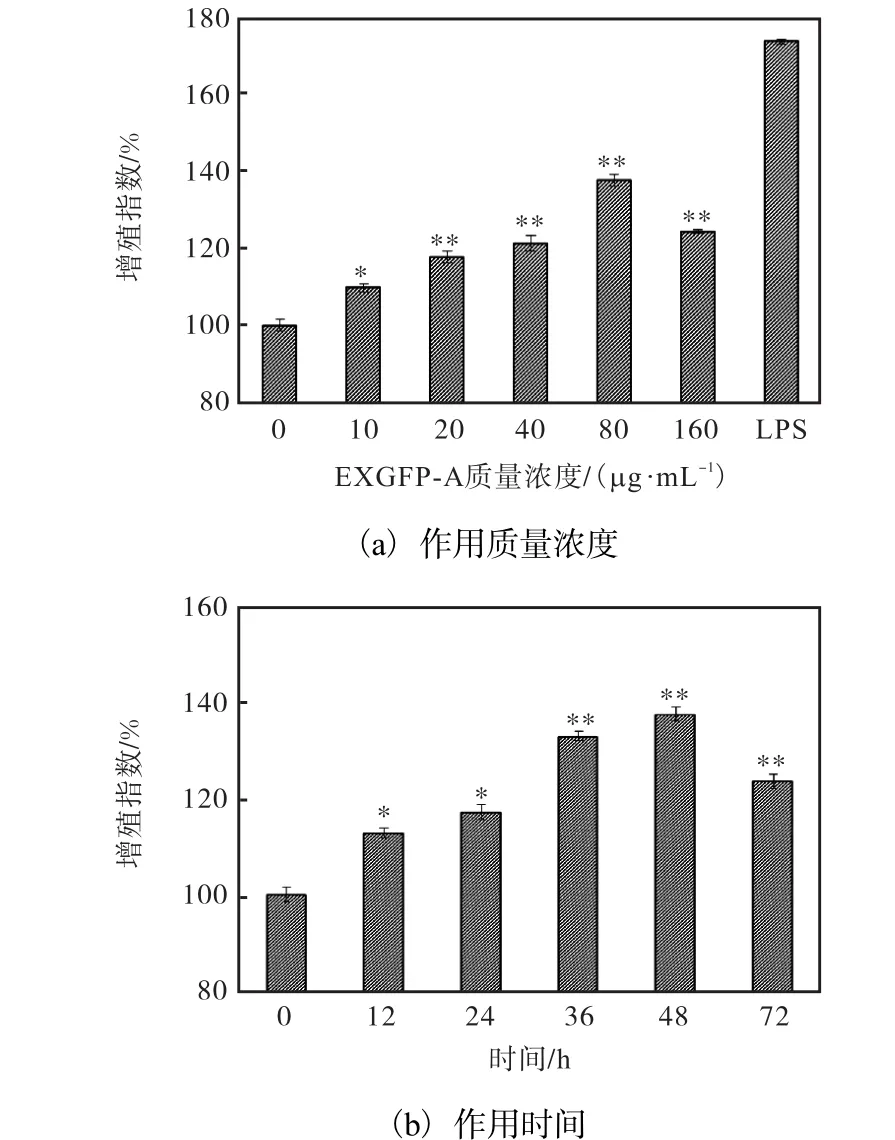
图4 EXGFP-A作用质量浓度和作用时间对RAW264.7细胞增殖活性的影响Fig.4 Effects of EXGFP-A concentration and culturing time on cell proliferation of RAW264.7 cells
不同质量浓度的EXGFP-A与细胞共同培养后,细胞的增殖能力均有所增加.在共同培养 48,h后,EXGFP-A作用质量浓度为80,µg/mL时,RAW264.7细胞的增殖指数最大,为 137.5%,.当以 80,µg/mL EXGFP-A在不同培养时间作用于 RAW264.7细胞后,结果如图4(b)所示.当EXGFP-A作用时间达到48,h时,增殖效果达到最大.
以上结果表明,EXGFP-A能够增强 RAW264.7细胞的增殖活性.EXGFP-A作用于RAW264.7细胞的最佳质量浓度为80,µg/mL,最佳作用时间为48,h.
2.4.2EXGFP-A对RAW264.7细胞吞噬活性的影响
吞噬作用是巨噬细胞对入侵病原微生物的直接反应,是免疫系统维持自身内环境稳定的重要手段,是非特异性免疫的关键环节,也是机体产生免疫应答的基础和免疫功能活化的指标.
通过中性红吞噬实验测定 EXGFP-A作用后RAW264.7细胞的吞噬能力,以脂多糖(LPS)处理组作为阳性对照,*和**分别表示与空白组相比 P<0.05和P<0.01,结果如图5所示.当EXGFP-A作用质量浓度为 80,µg/mL时,RAW264.7细胞吞噬活性最高.中性红吞噬实验初步说明EXGFP-A能够刺激RAW264.7细胞使其处于活化状态,能通过提高巨噬细胞的吞噬能力来发挥多糖的免疫活性,执行各种免疫防御功能.
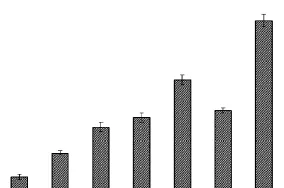
图5 EXGFP-A作用质量浓度对RAW264.7细胞吞噬活性的影响Fig.5 Effects of EXGFP-A concentration on the pinocytic activity of RAW264.7 cells
2.4.3细胞形态学观察
RAW264.7细胞经EXGFP-A处理后,利用扫描电子显微镜观察 EXGFP-A作用前后所引起的细胞外观形态变化,结果如图 6所示.当用 80,µg/mL EXGFP-A分别作用于细胞24,h、48,h和72,h后,与对照组细胞相比,经药物作用后的细胞体积明显增大,表面凸起明显,贴壁面积明显增大,褶皱增加,并有部分伪足出现.以上结果表明,当用 80,µg/mLEXGFP-A作用于细胞 48,h时,细胞活化特征最为明显.
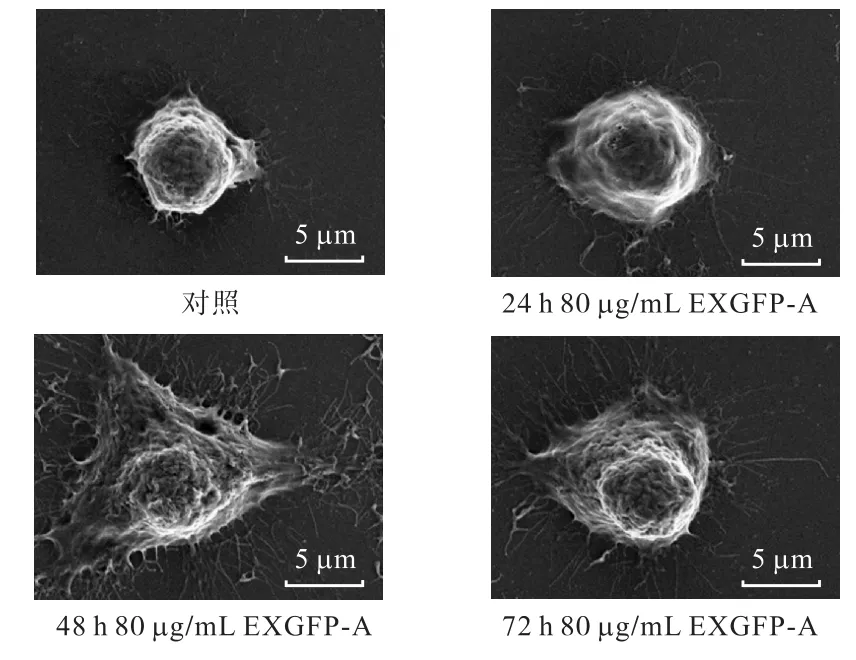
图6 EXGFP-A作用RAW264.7细胞的扫描电镜图Fig.6 SEM images of RAW264.7 cells treated with EXGFP-A
3 结 论
灰树花胞外多糖 EXGFP-A是一种主要含有葡萄糖的吡喃型中性多糖,并对 RAW264.7的细胞增殖和吞噬活性具有明显的促进作用.EXGFP-A能够促进细胞的形态变化,使细胞呈现出激活状态,说明EXGFP-A可以激活RAW264.7细胞,增强机体的免疫活性,证实了灰树花胞外多糖EXGFP-A具有体外免疫活性.但是,多糖所引起的免疫效应可归因于细胞内多条信号转导通路的相互作用,因此,可从分子、受体水平通过免疫印迹等方法深入研究多糖激活细胞的作用机制,为灰树花胞外多糖的开发利用提供理论依据.
[1] Mayell M. Maitake extracts and their therapeutic potential[J]. Alternative Medicine Review A Journal of Clinical Therapeutic,2001,6(1):48-60.
[2] Gu C Q,Li J W,Chao F H,et al. Inhibition of hepatitis B virus by D-fraction from Grifola frondosa:Synergistic effect of combination with interferon-α in HepG22.2.15[J]. Antiviral Research,2006,72(2):162-165.
[3] Yang B K,Gu Y H,Jeong Y T,et al. Chemical characteristics and immuno-modulating activities of exobiopolymers produced by Grifola frondosa during submerged fermentation process[J]. International Journal of Biological Macromolecules,2007,41(3):227-233.
[4] 汪维云. 灰树花多糖的抗辐射作用研究[J]. 安徽农业大学学报,2003,30(2):210-212.
[5] Kodama N,Komuta K,Nanba H. Can maitake MD fraction aid cancer patients?[J]. Alternative Medicine Review A Journal of Clinical Therapeutic,2002,7(3):236-239.
[6] 周昌艳,唐庆九,王军,等. 灰树花提取物清除氧自由基的研究[J]. 菌物研究,2006,4(3):31-34.
[7] Kubo K,Aoki H,Nanba H. Anti-diabetic activity present in the fruit body of Grifola frondosa(Maitake)[J]. Biological & Pharmaceutical Bulletin,1994,17(8):1106-1110.
[8] Mosmann T. Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods,1983,65(1/2):55-63.
[9] 郭淑臻. 灰树花多糖的制备工艺及其降血糖作用的研究[D]. 合肥:合肥工业大学,2014.
[10] 刘佳,王蝉,刘培,等. 黄药子甲醇提取物对 LPS诱导的小鼠腹腔巨噬细胞释放 NO及 iNOS表达的影响[J]. 贵阳中医学院学报,2008,30(2):79-80.
[11] 杨阳,刘承初,贾薇,等. 灰树花多糖的超滤分离及免疫活性研究[J]. 食品科学,2008,29(9):277-280.
[12] 王宝琴,徐泽平,杨传伦. 高纯度碱提灰树花发酵菌丝体β-葡聚糖的免疫活性研究[J]. 西北农林科技大学学报:自然科学版,2011,39(7):141-146.
[13] 张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1999:115-149.
[14] 彭颖,李宗军. 菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及信号通路[J]. 食品科学,2012,33(15):318-322.
[15] 范延丽. 花桑寄生多糖的分离、纯化及抗肿瘤活性的研究[D]. 福州:福建师范大学,2008.
[16] Fishman M,Gunther G. Induction of tumor cell resistance to macrophage-mediated lysis by preexposure to non-activated macrophages[J]. Cellular Immunology,1986,99(1):241-256.
责任编辑:郎婧
The Isolation,Purification and Immunomodulatory Activity of Extracellular Polysaccharide from Grifola frondosa
HAN Lirong,CHENG Dai,MENG Meng,WANG Lirui,WANG Chunling
(College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
An extracellular polysaccharide(EXGFP)was obtained by submerged culture of Grifola frondosa,and its property and immunomodulatory activity were investigated.The final purified fraction,EXGFP-A,was obtained by using alcohol for precipitation,enzymes-sevag for deproteinization and Sephadex G-100,gel column for further isolation and purification.The purity of EXGFP-A was tested with Sepharose 4B gel column and HPLC.The results show that EXGFP-A is a homogeneous polysaccharide,and its purity is about 92.68%,.Tests of its physicochemical properties indicate that EXGFP-A is a non-starch neutral polysaccharide,excludes uronic acid and polyphenols,and contains α-D-glucoside bond and pyranose ring.The result of MTT assay shows that the cell proliferation index reached a maximum of 137.5%, when EXGFP-A was at a concentration of 80,µg/mL and the treatment time was 48,h.The neutral red phagocytosis experiment indicates that the phagocytic activity of RAW264.7,cells was significantly enhanced by EXGFP-A.According to scanning electron microscope,the activation of RAW264.7,cells could also be promoted by adding EXGFP-A.
Grifola frondosa;extracellular polysaccharide;purification;mouse macrophage RAW264.7;immunomodulatory activity
R979.5
A
1672-6510(2016)04-0025-05
10.13364/j.issn.1672-6510.20150117
2015-09-08;
2015-12-03
国家科技支撑计划资助项目(2012BAD33B04);天津市应用基础与前沿技术研究计划资助项目(13JCZDJC29800)
韩丽荣(1990—),女,内蒙古人,硕士研究生;通信作者:王春玲,教授,wangchunling@tust.edu.cn.
