应用RNAi技术探讨CAP10基因在新型隐球菌感染小鼠中对Th1-Th2型免疫的影响
2016-12-01吴赞艺林梨平欧启水林东红徐建萍
吴赞艺,林 旎,林梨平,欧启水,林东红,陈 敏,徐建萍
应用RNAi技术探讨CAP10基因在新型隐球菌感染小鼠中对Th1-Th2型免疫的影响
吴赞艺1,林 旎2,林梨平2,欧启水1,林东红2,陈 敏2,徐建萍2
目的 设计siRNA表达质粒干扰CAP10基因的合成,将siRNA干扰前与干扰后的新型隐球菌菌液经呼吸道感染小鼠分别建立动物模型,行组织病理学检查与细胞因子检测,探讨CAP10基因对Th1/Th2 免疫应答的影响。方法 建立小鼠吸入感染隐球菌模型,在感染后第7 d(急性期),PAS染色观察小鼠肺组织病理变化,并采用酶联免疫吸附试验定量检测小鼠血液中的Th1(IFN-γ、TNF-α)、Th2细胞因子(IL-10)水平。结果 急性期小鼠血液内IFN-γ、TNF-α及IL-10浓度测定分别为:对照组(uninfected组)(19.24±1.31)pg/mL,(36.94±2.04)pg/mL及(18.32±3.00)pg/mL,新型隐球菌未干扰组(WT组)(14.34±1.26)pg/mL,(25.37±1.37)pg/mL及(72.96±8.83)pg/mL,新型隐球菌干扰组(siRNA-CAP10组)(14.63±0.95)pg/mL,(26.22±1.55)pg/mL及(38.73±4.61)pg/mL。与对照组相比,WT组和siRNA-CAP10组Th1因子IFN-γ及TNF-α水平明显降低(P<0.01),Th2细胞因子IL-10水平明显增高。WT组与siRNA-CAP10组相比,IFN-γ及TNF-α水平未见明显增高而IL-10水平明显增高(P<0.01)。IFN-γ/IL-10及TNF-α/IL-10的比率分别为:对照组1.08±0.21,2.07±0.34,WT组0.20±0.03,0.35±0.05,siRNA-CAP10组0.38±0.04,0.69±0.09。WT组和siRNA-CAP10组IFN-γ/IL-10及TNF-α/IL-10的比率较对照组明显减少(P<0.01);WT组IFN-γ/IL-10及TNF-α/IL-10的比率亦明显低于siRNA-CAP10组(P<0.01)。结论 在新型隐球菌感染小鼠中,CAP10基因的表达与抗真菌的免疫反应有关,其下调有利于控制新型隐球菌播散,有利于Th1/Th2比率趋于平衡,在调节炎症反应方面有重要作用,有望成为新的分子治疗靶点。
新型隐球菌;CAP10基因;siRNA;Th1 Th2 细胞因子
新型隐球菌是临床上重要的病原性真菌,具有显著的嗜神经性,能导致严重的隐球菌性脑膜炎,症状重、预后差、死亡率高。其发生、发展、转归除了宿主免疫状态的影响,还取决于多种毒力因子,如多糖荚膜、漆酶、脲酶、黑色素等的表达差异,其中高分子量的多聚糖荚膜是最经典的毒力因子,然而关于荚膜毒力因子与Th1/Th2 免疫应答的关系,以及在隐球菌病的病理生理过程中的作用尚不明朗[1-2]。
CAP10基因是荚膜形成的关键基因,有研究表明,野生型的新型隐球菌中敲除CAP10基因可以导致荚膜丢失,且在动物模型中无致病性,但重新与CAP10基因互补后菌株形成荚膜,并在动物模型中具有毒性[3]。本研究选取CAP10基因作为研究靶点,设计siRNA表达质粒干扰CAP10基因的合成,转染至新型隐球菌菌株(BLS71),筛选稳定转染的阳性克隆,再将siRNA干扰前与干扰后的新型隐球菌制成菌悬液经呼吸道感染小鼠建立动物模型,行组织病理学检查与细胞因子检测,探讨CAP10基因干扰前后的病理生理变化以及对Th1/Th2 免疫应答的影响[4]。
1 材料与方法
1.1 质粒与菌株 psilencer 4.1-CMV neo 购于Invitrogen公司,新型隐球菌菌株(BLS71)购于中国医学真菌保藏管理中心隐球菌专业实验室,大肠埃希菌E.coliDH5α 感受态购于Tiagen 公司。
1.2 siRNA表达载体的构建、连接与转化 根据GenBank数据库提供的cap10 基因核苷酸序列用 Ambion 公司 siRNA 在线设计软件设计长度为21 bp的靶向序列,并带上HindⅢ、BamHⅠ酶切黏性末端,总长55 bp。序列为:正义链 5′-GATCCGGGCTTTGATGAATGGTACTTCAA-GAGAGTACCATTCATCAAAGCCCTTA-3′;反义链 5′-AGCTTAAGGGCTTTGATGAATGGTACTCTCTTGAAGT-ACCATTCATCAAAGCCCG-3′。制备50 μL体系,将两条单链由95 ℃起至45 ℃,每递减5 ℃温育5 min,使单链退火形成双链,4 ℃短期保存备用。用内切酶HindⅢ和BamHⅠ对质粒 psilencer 4.1-CMV neo进行双酶切,琼脂糖凝胶电泳分析酶切产物,并回收线性化产物。取线性载体片段4 μL,单链退火产物6 μL,T4连接酶 1 μL,10×ligase buffer 2 μL,ddH2O 7 μL,16 ℃连接20 h,转化至感受态受体菌 DH5α。挑取菌落,DNA测序验证。
1.3 重组质粒转染和阳性克隆的筛选 用LiAc醋酸锂酵母转化试剂盒对新型隐球菌进行重组质粒转染。酵母完全培养基(YPD)筛选转入重组质粒的新型隐球菌细胞,每2~3 d更换1次新鲜筛选培养液,10 d后,用含50 μg/mL G418 的YPD维持培养,第14 d收获转染的新型隐球菌。
1.4 动物模型的建立
1.4.1 实验动物 SPF级雌性C57BL/6小鼠购于福建莱科实验动物中心,一共48只,体重在 16~22 g,随机分为3组,每组16只,分别为新型隐球菌未干扰组即BLS71标准株(WT组),新型隐球菌干扰组(siRNA-CAP10组),对照组为新型隐球菌未感染组(uninfected组),感染后第7 d处死。
1.4.2 菌悬液制备 干扰组与非干扰组分别以PBS清洗,1 200 r/min离心5 min,重复3次,再用无菌双蒸水重悬,计数板计数,调定终浓度为5×106CFU/mL,配好的菌悬液当天使用。
1.4.3 小鼠感染新型隐球菌模型 为模拟自然感染过程,小鼠经水合氯醛麻醉后,迅速以移液器移出20 μL菌悬液经小鼠单侧鼻孔接种感染。对照组小鼠接种等量PBS溶液。
1.5 小鼠取血及肺部组织病理学检查 接种7 d后,断头法处死各组小鼠,立即倒置取小鼠全身血液约1~2 mL,而后取出双肺,迅速浸泡入福尔马林溶液中固定24 h,随后置入TS 12C 自动脱水机中处理,60 ℃石蜡中包埋,滑动切片机上切薄片2张,常规PAS染色,光学显微镜下观察肺组织病理变化、炎症细胞趋化状态、新型隐球菌生长与吞噬细胞相互作用情况。
1.6 ELISA法对小鼠血液Th1、Th2细胞因子进行定量分析 采用 ELISA 双抗体夹心法进行测定,ELISA试剂盒购于厦门泰京生物技术有限公司,检测过程按试剂说明书严格操作。结果判读:以空白孔调零,在450 nm 处酶标仪测定各孔吸光度(OD值),画出标准曲线,并计算出相应标本Th1细胞因子IFN-γ、TNF-α及Th2细胞因子IL-10的含量。
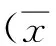
2 结 果
2.1 重组质粒测序鉴定 重组质粒经自动基因测序仪测序(Invitrogen 公司),结果与设计序列完全相符,所含目的基因序列准确无误,重组质粒构建成功。
2.2 转染细胞的筛选 取10 μL转染菌悬液加入10 mL不含G418的完全培养基中,30 ℃ 120 r/min震荡培养36 h。4 000 r/min离心5 min,弃去上清,加入5 mL含100 μg/mL的G418的完全培养液,每2~3 d更换1次新鲜筛选培养液。未能稳定转染的细胞在8~10 d可全部死亡,转入neo抗性基因的隐球菌细胞可持续存活并增殖传代,由此获得稳定的阳性克隆。用含半量筛选浓度50 μg/mL的G418完全培养基维持培养。取少量菌液,在YPD培养基上分离培养获得单菌落。
2.3 小鼠肺组织病理学检查结果 肺部大体标本可见,对照组(uninfected组,1A)肺部大小形态正常,新型隐球菌未干扰组(WT组,1B)可见肺部明显膨大水肿,新型隐球菌干扰组(siRNA-CAP10组,1C)水肿程度低于WT组。
肺组织病理切片可见,感染后第7 d,新型隐球菌未干扰组(WT组,2C、2D)可见大量炎性细胞浸润,隐球菌大量分布于全肺,部分坏死灶,肉芽肿开始形成;新型隐球菌干扰组(siRNA-CAP10组,2E、2F)可见散在分布的隐球菌,炎性细胞浸润程度较轻,未见明显的坏死灶。2A、2B为正常对照。

图1 鼠肺石蜡包埋大体标本Fig.1 Paraffin embedding gross specimen of mouse lung
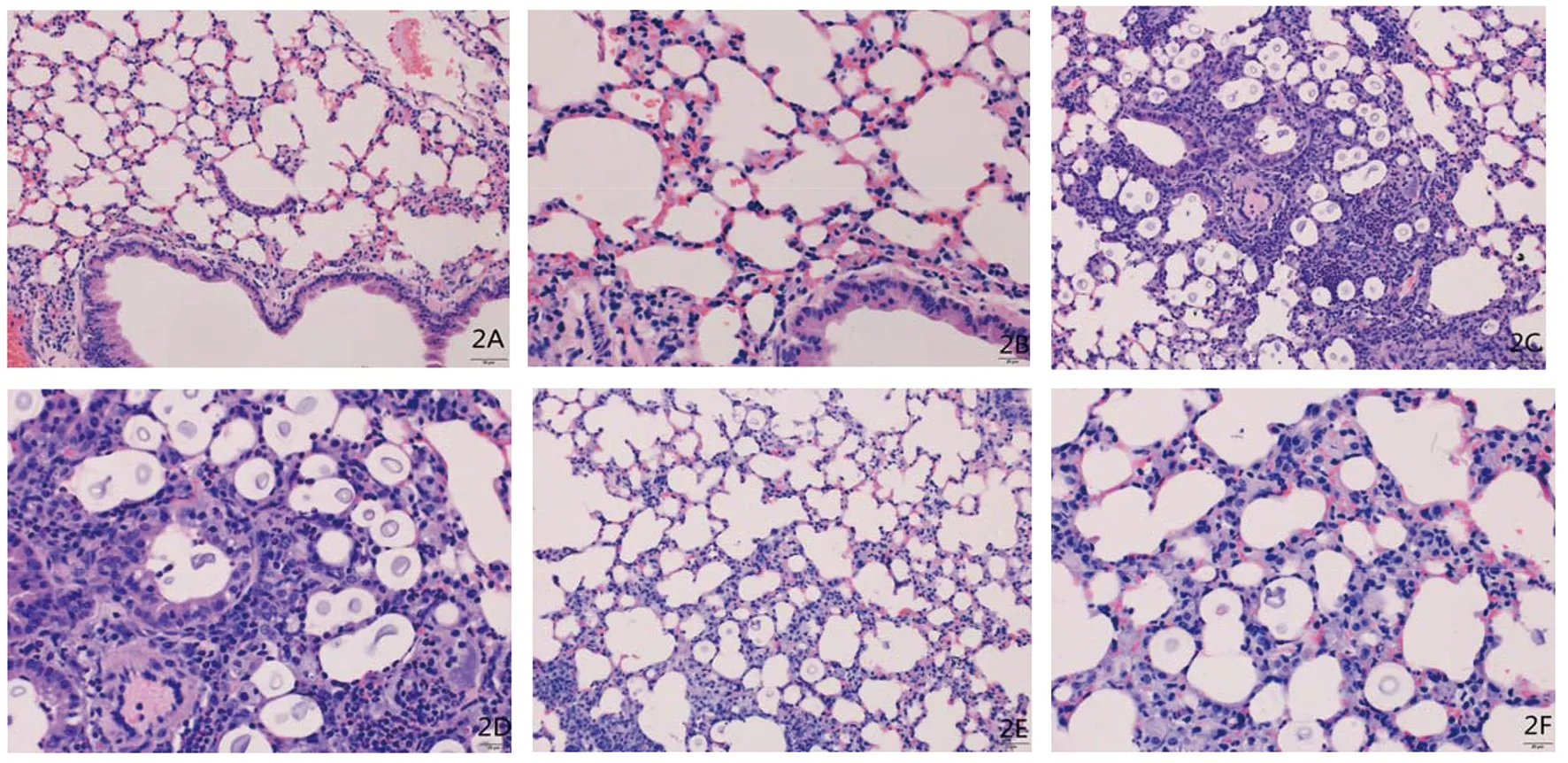
图2 正常鼠肺(2A、2B)、隐球菌感染后肺组织病理变化(2C、2D、2E、2F)Fig.2 Histopathological analysis of uninfected and infected lung tissue
2.4 Th1、Th2细胞因子定量分析结果 急性期小鼠血液内IFN-γ、TNF-α及IL-10浓度测定分别为:对照组(uninfected组)(19.24±1.31) pg/mL,(36.94±2.04) pg/mL及(18.32±3.00) pg/mL,新型隐球菌未干扰组(WT组)(14.34±1.26) pg/mL,(25.37±1.37) pg/mL及(72.96±8.83) pg/mL,新型隐球菌干扰组(siRNA-CAP10组)(14.63±0.95)pg/mL,(26.22±1.55) pg/mL及(38.73±4.61) pg/mL。
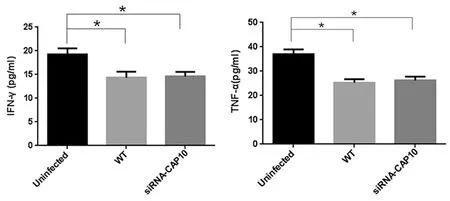
图3 Th1细胞因子IFN-γ、TNF-α表达量Fig.3 Expression of Th1 cytokines (IFN-γ, TNF-α) of each group
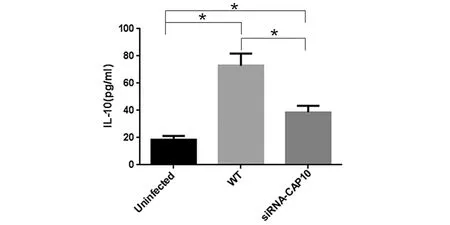
图4 Th2细胞因子IL-10表达量Fig.4 Expression of Th2 cytokines (IL-10) of each group
与对照组相比,WT组和siRNA-CAP10组Th1因子IFN-γ及TNF-α水平明显降低(P<0.01),Th2细胞因子IL-10水平明显增高(P<0.01)。WT组与siRNA-CAP10组相比,IFN-γ及TNF-α水平未见明显增高,差异无统计学意义;而IL-10水平明显增高,差异具有统计学意义(P<0.01)(见图3、4)。
2.5 Th1-Th2免疫应答方式比较 以Th1与Th2细胞因子的比率(Th1/Th2)来反应免疫应答方式。IFN-γ/IL-10及TNF-α/IL-10的比率分别为:对照组1.08±0.21,2.07±0.34,WT组0.20±0.03,0.35±0.05,siRNA-CAP10组0.38±0.04,0.69±0.09。WT组和siRNA-CAP10组IFN-γ/IL-10及TNF-α/IL-10的比率较对照组明显减少(P<0.01);WT组IFN-γ/IL-10及TNF-α/IL-10的比率亦明显低于siRNA-CAP10组(P<0.01)。
3 讨 论
新型隐球菌多糖荚膜是第1个明确认为与致病力有关的隐球菌毒力因子,为致病性隐球菌的标志之一。新型隐球菌的荚膜在多个水平调节宿主的免疫反应,抗宿主的保护效应机制包括:改变抗原呈递过程使抗体无应答性、细胞因子分泌失调、抗吞噬作用、补体缺失、白细胞迁移抑制等。CAP10基因是荚膜形成的关键基因,Okabayashi K等在对荚膜厚度的测量值和CAP10基因的表达量的比较中,提示了荚膜厚度与CAP10基因表达存在着相关关系[5]。本研究选取CAP10基因作为研究靶点,设计siRNA表达质粒干扰CAP10基因的合成,从而干扰荚膜形成,探讨CAP10基因表达下调对新型隐球菌感染病理生理过程的影响。为了尽可能的贴近自然感染途径,采用单侧鼻孔吸入的方式感染C57BL/6小鼠建立动物模型,感染菌量1×105CFU/鼠。由于感染新型隐球菌后小鼠的死亡时间一般为2~4周,为减少感染过程中小鼠不可控死亡造成的影响,本研究选取7 d,即感染的急性期作为观察时间点。
感染后第7 d肺组织病理切片显示,新型隐球菌未干扰组(WT组)可见大量炎性细胞浸润,隐球菌大量分布于全肺,部分坏死灶,肉芽肿开始形成;新型隐球菌干扰组(siRNA-CAP10组)可见散在分布的隐球菌,炎性细胞浸润程度较轻,未见明显的坏死灶;提示CAP10基因与炎症反应有关,下调其表达可使炎症反应减轻。新型隐球菌感染后免疫主要依赖于宿主的细胞免疫,及其激活的相应细胞因子IL-10、IFN-γ、TNF-α等。有文献报道[6-8]向易感小鼠接种致病性隐球菌菌株后,其Th1反应削弱而Th2细胞因子产生增多,表明以Th2为主的免疫应答模式是新型隐球菌逃脱宿主清除的主要方式。本研究Th1-Th2细胞因子检查见:较对照组,WT组和siRNA-CAP10组Th1细胞因子IFN-γ及TNF-α水平明显降低(P<0.01),而Th2细胞因子IL-10水平明显增高(P<0.01),提示CAP10基因与Th1-Th2型细胞因子分泌有关,Th1应答的扩大可以增加杀伤细胞的毒性作用,是保护性免疫,而Th2应答的扩大可导致免疫清除能力下降,引起疾病播散,实验结果符合预期。WT组与siRNA-CAP10组相比,Th2细胞因子IL-10水平明显增高(P<0.01),而Th1型因子IFN-γ及TNF-α水平未见明显增高则可能提示CAP10基因的表达下调主要影响Th2型免疫,其表达量与Th2型细胞因子分泌成正相关。此外,细菌、病毒等微生物感染可导致机体Th1/Th2平衡失调即Th1/Th2漂移现象,因此本研究还比较了Th1-Th2免疫应答方式在3组间的区别,较对照组,WT组和siRNA-CAP10组IFN-γ/IL-10及TNF-α/IL-10的比率明显低于对照组(P<0.01);WT组IFN-γ/IL-10及TNF-α/IL-10的比率亦明显低于siRNA-CAP10组(P<0.01);提示机体受到新型隐球菌攻击时,Th1亚群功能降低而Th2亚群功能升高,出现Th1/Th2漂移。在WT组Th1/Th2漂移十分显著,这有可能使得隐球菌感染后不能被吞噬细胞有效清除,菌体反而可借助“木马机制”进一步扩散甚至感染中枢神经系统;较WT组,siRNA-CAP10组Th1/Th2比率明显升高,提示经siRNA干扰后CAP10表达下调,Th1/Th2平衡有向Th1型保护性免疫转换的趋势,可能有利于菌株被快速清除[9-11]。
本研究阐明了新型隐球菌感染小鼠后急性期免疫应答方式与CAP10基因的关系,CAP10基因的表达量变化能影响Th2型细胞因子的分泌,其下调有利于Th1-Th2比率趋向于平衡状态,有利于控制新型隐球菌播散,可影响新型隐球菌的预后、转归,有望成为新的分子治疗靶点,为临床调整Th1-Th2失衡提供新的线索。
[1] Zaragoza O, Rodrigues ML, De Jesus M, et al. The capsule of the fungal pathogenCryptococcusneoformans[J]. Adv Appl Microbiol, 2009, 68: 133-216. DOI: 10.1016/S0065-2164(09)01204-0
[2]Teresa R, O’Meara J, Alspaugh A. TheCryptococcusneoformanscapsule: a sword and a shield[J]. Clin Microbiol Rev, 2012, 25(3): 387-408. DOI: 10.1128/CMR.00001-12
[3] Zaragoza O, Telzak A. The polysaccharide capsule of the pathogenic fungusCryptococcusneoformansenlarges by distal growth and is rearranged during budding[J]. Mol Microbiol, 2006, 59(1): 67-83. DOI: 10.1111/j.1365-2958.2005.04928.x
[4]Voelz K, May RC. Cryptococcal interactions with the host immune system[J]. Eukaryot Cell, 2010, 9(6): 835-846. DOI: 10.1128/EC.00039-10
[5] Okabayashi K, Kano R, Watanabe S, et al. Expression of capsule-associated genes ofCryptococcusneoformans[J]. Mycopathologia, 2005, 160: 1-7.
[6]Wozniak KL, Kolls JK, Wormley FL Jr. Depletion of neutrophils in a protective model of pulmonary cryptococcosis results in increased IL-17A production by gammadelta T cells[J]. BMC Immunol, 2012, 13: 65. DOI: 10.1186/1471-2172-13-65
[7]Jarvis JN, Casazza JP, Stone HH, et al. The phenotype of theCryptococcus-specific CD4+memory T-cell response is associated with disease severity and outcome in HIV-associated cryptococcal meningitis[J]. J Infect Dis, 2013, 207(12): 1817-1828. DOI: 10.1093/infdis/jit099
[8]Wozniak KL, Ravi S, Macias S, et al. Insights into the mechanisms of protective immunity againstCryptococcusneoformansinfection using a mouse model of pulmonary cryptococcosis[J]. PLoS One, 2009, 4(9): e6854. DOI: 10.1371/journal.pone.0006854
[9]Wozniak KL, Hardison SE, Kolls JK, et al. Role of IL-17A on resolution of pulmonaryC.neoformansinfection[J]. PLoS One, 2011, 6: e17204. DOI: 10.1371/journal.pone.0017204
[10] Qiu Y, Davis MJ, Dayrit JK, et al. Immune modulation mediated by cryptococcal laccase promotes pulmonary growth and brain dissemination of virulentCryptococcusneoformansin mice[J]. PLoS One, 2012, 7(10): e47853. DOI: 10.1371/journal.pone.0047853
[11] Alanio A, Desnos-Ollivier M, Dromer F. Dynamics ofCryptococcusneoformans-macrophage interactions reveal that fungal background influences outcome during cryptococcal meningoencephalitis in humans[J]. mBio, 2011, 2(4): e00158-00111. DOI: 10.1128/mBio.00158-11
RNAi technology application for evaluating effect of CAP10 gene in Th1-Th2 immune of mice infection withCryptococcusneoformans
WU Zan-yi1, LIN Ni2, LIN Li-ping2, OU Qi-shui1, LIN Dong-hong2, CHEN Min2, XU Jian-ping2
(1.TheFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou350001,China;2.FujianMedicalUniversity,Fuzhou350001,China)
In this study, we designed a siRNA-plasmid to lower the expression of CAP10 gene. A mouse model ofCryptococcusneoformansinfection was established by inhalation ofCryptococcusneoformansthrough one nostril. On day 7 after inoculation (acute phase), the infected lung were observed by histopathological analysis. Th1-Th2 cytokines (IFN-γ, TNF-α and IL-10) were detected by ELISA. In acute phase, the levels of these cytokines were (19.24±1.31)pg/mL, (36.94±2.04)pg/mL, (18.32±3.00) pg/mL in control, (14.34±1.26)pg/mL, (25.37±1.37)pg/mL, (72.96±8.83)pg/mL in Wild-Type(WT), (14.63±0.95)pg/mL, (26.22±1.55)pg/mL, (38.73±4.61)pg/mL in siRNA-CAP10 respectively. The level of IFN-γ and TNF-α were significantly lower in WT and siRNA-CAP10 groups than those in control mice, while the level of IL-10 was significantly higher in WT and siRNA-CAP10 groups than in control mice (P<0.01). Compared to siRNA-CAP10 groups, the level of IL-10 were significantly higher in WT (P<0.01), while the level of IFN-γ and TNF-α were not statistically significant difference. Using the ratio of Th1/Th2 to evaluate the status of immune response, the ratios of IFN-γ/IL-10 and TNF-α/IL-10 were 1.08±0.21, 2.07±0.34 in control, 0.20±0.03, 0.35±0.05 in WT, and 0.38±0.04, 0.69±0.09 in
Cryptococcusneoformans; CAP10 gene; siRNA; Th1 Th2 cytokines
Lin Ni, Email: ssytnx@126.com
10.3969/j.issn.1002-2694.2016.10.009
福建省自然科学基金项目(No.2013J01317);福建医科大学苗圃基金(No.2014mp019)
林 旎,Email:ssytnx@126.com
1.福建医科大学附属第一医院,福州 350004;
2.福建医科大学,福州 350004
R379.5
A
1002-2694(2016)10-0618-05-0893-05
2016-02-01;
2016-06-20
siRNA-CAP10. The level of IFN-γ/IL-10 and TNF-α/IL-10 were significantly lower in WT and siRNA-CAP10 groups than in control mice, and the level of IFN-γ/IL-10 and TNF-α/IL-10 were significantly lower in WT than in siRNA-CAP10 mice (P<0.01). Results showed CAP10 gene expression related to antifungal immune response inCryptococcusneoformansinfection in mice. The down-regulation of CAP10 gene may control the spread ofCryptococcusneoformansand turned the ratio of Th1/Th2 back to balance. CAP10 gene played a very important role in regulating inflammatory response, which may became new molecular targets for treatment.
Supported by the Fujian Province Natural Science Fund (No. 2013J01317), and the MP Science Fund of the Fujian Medical University (No. 2014mp019)
