两种方法检测人凝血因子IX的细菌内毒素
2016-11-30张晓杰臧恒昌
尹 敏,张晓杰,臧恒昌
药学
两种方法检测人凝血因子IX的细菌内毒素
尹敏,张晓杰,臧恒昌*
人凝血因子Ⅸ;动态浊度法;家兔检查法;细菌内毒素
人凝血因子Ⅸ(human coagulation factorⅨ,FⅨ)临床应用于控制与预防B型血友病(先天性九因子缺乏症,又称圣诞节症)的出血[1],包括接受外科手术时的出血控制与预防出血等。人凝血因子Ⅸ作为一种在研的静脉注射制剂,药典未收载其质量标准,热原含量检测为制品研发质量控制中必要的一项生物学安全指标[2-4]。热原检查方法有家兔法和细菌内毒素法,其中家兔法为活体动物实验,能直观反应所有类型热原物质对机体的致热情况,操作繁琐,无法定量,制品生产过程的热原控制较困难;细菌内毒素法仅能测定供试品中细菌内毒素的含量,可定量,快速测定[5]。本文参照国外药典及中国药典2015年版三部中热原检查法、细菌内毒素检查法中的动态浊度法,初步建立了家兔法和动态浊度法检测人凝血因子Ⅸ中热原的检测方法[6-12]。
1 材料与方法
1.1仪器与试剂BET-48G细菌内毒素测定仪,ZH-BLENDER型漩涡混合器 (天津药典标准仪器厂),WRY-2008热原测温仪(上海辽卓科贸有限公司)。细菌内毒素标准品 (中国食品药品检定研究院,批号:150601-201478,规格:80 EU/支),细菌内毒素检查用水及动态浊度法鲎试剂(湛江安度斯生物有限公司批号1408050,规格0.6 ml/支),人凝血因子Ⅸ (批号:2015S01、2015S02、2015S03,规格:50IU FⅨ/ml)山东泰邦生物制品有限公司研发中心提供。
1.2实验动物新西兰白兔,普通级,体重1.7~3.0 kg,雌雄皆可,家兔按《中国药典》2015版通则中热原检查法进行预选。饲养条件:温度17~25℃,湿度40%~70%。
1.3实验方法
1.3.1细菌内毒素标准曲线制备将细菌内毒素工作品用1 ml细菌内毒素检查用水复溶,置漩涡混合器上混合15 min,然后逐级稀释(每步稀释不超过10倍)至最终细菌内毒素浓度为2.0、0.5、0.125、0.03125 EU/ml四个标准品溶液,各取0.2ml分别倒入预先加有0.1 ml动态浊度法鲎试剂反应管内,混匀,37℃BET-48G细菌内毒素测定仪自动检测,其中每个浓度重复3管,同时做阴性对照(NC)2管。以平均反应时间的对数(lgT)为纵坐标,内毒素浓度的对数(lgC)为横坐标,绘制标准曲线。阴性对照的反应时间大于标准曲线最低浓度的反应时间,细菌内毒素标准曲线成立。细菌内毒素标准曲线及可靠性分析结果见表1。
1.3.2样品最大稀释倍数确认取复溶后的供试品1瓶,含人凝血因子Ⅸ为50 IU/ml(c)。人凝血因子Ⅸ细菌内毒素本公司内控标准为<0.03 EU/IU(L),标准曲线最低浓度为0.03125 EU/ml(λ1),供试品的最大稀释倍数为(MVD)=cL/λ1为24倍。
1.3.3干扰试验根据标准曲线内毒素浓度的设置,选择0.25 EU/ml作为靠近曲线中点的内毒素浓度(λm)的样品,用细菌内毒素检查用水将其分别稀释3、6、12、24、48倍,作为供试品溶液(A液),同时制备含上述供试品浓度并含内毒素浓度为λm(0.25 EU/ml)的溶液(B液)。2.1项下的方式测定,按标准曲线回归方程分别计算出供试品溶液和含标准内毒素的供试品溶液的内毒素含量,并计算该实验条件下的回收率,回收率在50%~200%实验成立。
1.3.4样品溶液验证试验另取三批样品,依照以上方法检查,根据标准曲线计算人凝血因子Ⅸ中的细菌内毒素(EU/ml)。
1.3.5家兔检查法按照《中国药典》2015年版三部热原检查法[13],选取符合热原检查实验要求的家兔9只,随机分成三组,每组3只,分别注射含50 IU/ml的FⅨ溶液,另取符合热原检查实验要求的家兔9只,随机分成三组,每组3只,分别注射含50 IU/ml的FⅨ同时含细菌内毒素10 EU/ml的溶液,注射后测定3 h内家兔体温变化。
2 结果
2.1细菌内毒素检查法(又称动态浊度法)
2.1.1标准曲线试验中,用细菌内毒素检查用水将细菌内毒素工作品分别稀释至 2、0.5、0.125、0.03125 EU/mL进行检测。利用BET-48G细菌内毒素测定仪软件的双对数线性拟合得出,标准曲线方程为LgT=0.47037-0.03703 LgC(T为反应时间,C为溶液中细菌内毒素的浓度),相关系数r=-0.9976(绝对值应>0.980),反应时间在590~1800 s,而阴性对照试验的反应时间>3600 s,在范围0.03125~2.0 EU/ml内,线性良好。见表1,图1、2。

表1 标准系列吸光度(OD=0.02)
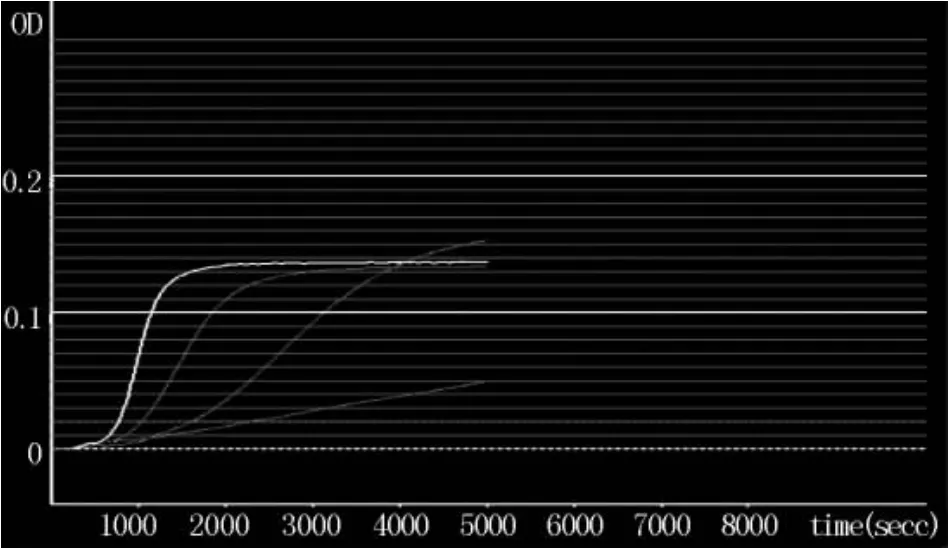
图1 标准系列吸光度(OD值)随时间变化
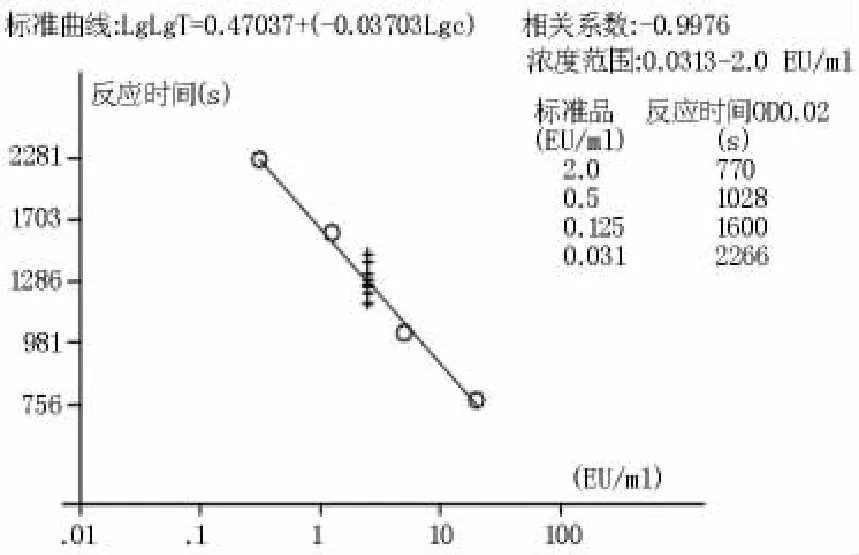
图2 标准曲线
2.1.2动态浊度法检定人凝血因子Ⅸ中细菌内毒素及干扰实验结果试验结果得到三批人凝血因子Ⅸ内毒素浓度,2015S01最大为1.401 EU/ml,小于本企业的内控标准1.5 EU/ml。三次试验干扰试验(回收率)100.56~117.52%,证明该方法准确可靠,在24的稀释倍数下干扰小。见图3。
2.2动态浊度法和家兔检查法检测人凝血因子Ⅸ中细菌内毒素结果3批次样品在本公司内控标准中都符合规定,其中2015S01动态浊度法细菌内毒素含量为1.404 EU/ml,家兔法升温最高为 (0.08± 0.08)℃,两种方法有一定的相关性。见表2。
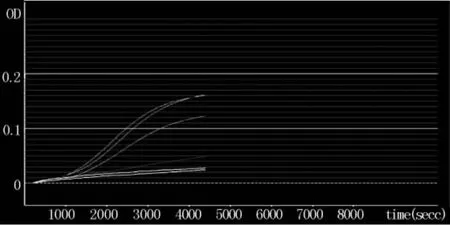
图3 三批试样吸光度(OD值)随时间变化
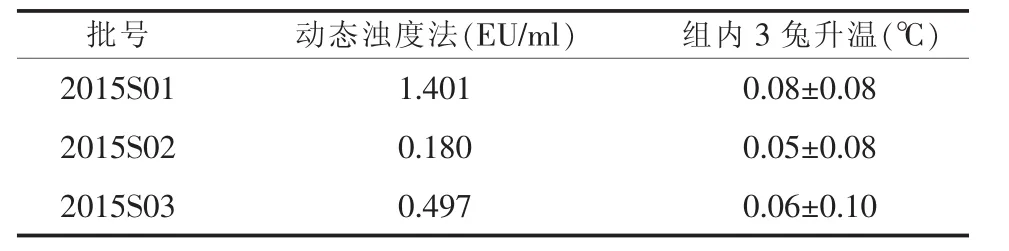
表2 动态浊度法与家兔法检测凝血因子Ⅸ中的细菌内毒素结果
3 讨 论
家兔对热原的反应与人基本相似,能够检测所有类型的热原物质,并能较好反映外源性热原引起哺乳动物复杂的升温过程。因此家兔法热原检查为检测热原质的法定方法,但是,在生产过程控制中,该法因检验周期长,动物个体差异等原因不太适用。鲎试剂动态浊度法是采用专用仪器(细菌内毒素测定仪)在适当波长范围内检测鲎试剂与内毒素反应过程中的浊度变化而测定内毒素含量的方法,内毒素与鲎试剂的C因子反应,被激活的凝固酶切断凝固原蛋白中的精氨酸肽链,形成凝固蛋白,在产生凝胶的过程中发生浊度变化,用内毒素测定仪检测反应混合物的浊度到达某一预先设定的吸光度所需要的反应时间。内毒素浓度和形成凝胶时间负相关,即内毒素浓度越高形成凝胶时间越短。细菌内毒素与鲎试剂的反应是由一系列酶促放大作用产生的,其干扰因素可能有供试品的酸碱度、金属离子浓度、非特异性鲎试剂激活物、对仪器检测光源的吸收干扰等[14]。本实验干扰试验结果表明:用动态浊度法定量测定人凝血因子Ⅸ稀释液中细菌内毒素,其回收率均在50%~200%,表明此条件下不存在干扰因素,且3批样品均在规定的限度0.03 EU/IU(1.5 EU/ml)以下,判为合格。
同凝胶法相比,动态浊度法由于标准曲线的建立,最大限度的消除了标准品对实验结果的影响,实验结果不受标准品准确性的影响,同时计算回收率更科学,对样品干扰行为的描述更加准确;与家兔法热原检查相比,操作简便,灵明度高,可定量,避免了由于动物个体差异造成的异常结果。本实验中,内毒素限值确定时采用的标准较严格,为按家兔法注射剂量计算得出限值的1/3,若内毒素结果>0.03 EU/IU,应采取家兔法进行复核,并引起足够重视。
[1]颜景斌.人凝血因子Ⅸ突变型研究现状[J].遗传,2005,27(5):833-838.
[2]赵艳华,马平,卜凤荣.凝血因子分子生物学研究进展[J].生物技术通讯,1999,10(2):158.
[3]Yamamoto M,Ochiai H,Fujiwara S,et al.Evaluation of the applicability of the bacterialendotoxin test to antibiotic products[J].Biologicals,2000,28(3):155-167.
[4]杨军,应莲芳,蒋琳,等.凝胶法和动态浊度法检测注射用重组人睫状神经营养因子中细菌内毒素含量[J].微生物学免疫学进展,2013,41(4):37-41.
[5]张璘,张继鹏,赵一欢,等.静注人免疫球蛋白细菌内毒素定量检测方法的探讨[J].微生物学免疫学进展,2013,41(2):23-27.
[6]王莉,高华,蔡彤,等.鲎试剂的研究及应用进展[J].药物分析杂志,2007,27(6):938-942.
[7]BP 2011.Vol V[S].2011:AppednixⅨ C-A 356.
[8]USP 35-NF 30.VolⅠ[S].2012:Biological Test<85>90.
[9]JP 2011[S].2011:General Test-4.01 Bacterial Endatoxin Test,92.
[10]EP.7.0[S].2011:Appendix-2.6.14 Bacterial endatoxin,171.
[11]Indian Pharmacopeia 2010.VolⅠ[S].2010:General Chapter-2.2.3 Bacterial Endatoxin Test,8.
[12]PhInt(Fourth edition).Vol 2[S].2006:Methods of Analysis-3.4 Test for Bacterial Endotoxins,1245.
[13]国家药典委员会.中华人民共和国药典[S].2015年版.三部.北京:中国医药科技出版社.
[14]The United States Pharmacopoeia Committee.The United States Pharmacopoeia[R].23ed.Rockville MD:United States Pharmacopoeia Convention,lne,1995:1696.
[2016-05-12收稿,2016-06-10修回]
[本文编辑:刘一洋]
R965.1
B
10.14172/j.issn1671-4008.2016.11.021
270000山东济南,山东大学药学院(尹敏,臧恒昌);271000山东泰安,山东泰邦生物制品有限公司(张晓杰)
臧恒昌,Email:zanghcw@126.com
