Pb在类芦组织和亚细胞中的分布规律和毒害效应
2016-11-29黄玫英罗洁文黄彩凤周垂帆
黄玫英,罗洁文,黄彩凤,周垂帆*
(1.福建农林大学林学院,福建 福州 350002;2.海峡两岸红壤区水土保持协同创新中心,福建 福州 350002)
Pb在类芦组织和亚细胞中的分布规律和毒害效应
黄玫英1,2,罗洁文1,2,黄彩凤1,2,周垂帆1,2*
(1.福建农林大学林学院,福建 福州 350002;2.海峡两岸红壤区水土保持协同创新中心,福建 福州 350002)
通过研究类芦体内Pb在组织和亚细胞水平的毒害效应和分布规律,分析类芦对Pb的耐性机制,为了解类芦对重金属的富集能力、耐性机制及逆境生理提供理论依据。采用营养液培养的方法,以Pb为目标污染物,胁迫后测定类芦体内(分为根和叶)Pb在各亚细胞组分的含量,并分别通过扫描电子显微镜(SEM)和能谱透射电子显微镜(TEM-EDS)观察Pb在组织和亚细胞的分布以及对其损伤情况。结果显示:从组织水平来看,Pb胁迫下组织结构由排列整齐变为不规则,局部出现较大破损而形成一些碎片,并出现晶体堵塞导管的现象;从亚细胞水平来看,类芦根叶细胞均损伤,出现细胞壁模糊、线粒体减少、叶绿体肿胀等现象,在根部Pb主要分布于细胞壁(12.28 mg·kg-1)和以液泡为主的可溶组分(38.82 mg·kg-1),而叶片中以可溶组分占比例最大(32.56%),且EDS元素分析也显示细胞内含有大量Pb。这些结果表明,类芦对Pb有一定的吸收富集能力,并可通过改变Pb在其组织和亚细胞水平的分布来降低毒害作用,因此类芦对重金属Pb有较强的耐性。
Pb;类芦;组织结构;亚细胞;SEM;TEM-EDS
Pb具有熔点低、易加工、耐腐蚀等特点,已经被人类使用了数千年。采矿、电镀以及一些含Pb的涂料、纸张、汽油等生产和使用向环境中排放了大量的Pb。由于Pb并不是动植物生长发育所必需的元素,而是一种有毒的重金属元素,其毒害作用具有潜伏性和长期性,进入土壤之后,可影响土壤的生化活性,致使植物叶绿素含量降低,呼吸作用受到抑制[1],膜透性发生改变以及DNA损伤[2],也会导致代谢过程中一些抗氧化酶如SOD、CAT、POD等的活性降低[3]。不少研究表明,低浓度的Pb对植物生长有促进作用,但是一般不超过100 mg·L-1[4],且Pb对植物的毒害作用随着Pb浓度、植物种类和部位以及植物生长发育阶段等的不同而有差异,如白雪姬(Tradescantia sillamontana)地上部和根部Pb累积最大量可超过1000 mg· kg-1,Pb胁迫下出现根部颜色变暗、叶片变薄下垂和幼茎生长迟缓等现象[5];雷竹(Phyllostachys praecox)在Pb含量1200 mg·kg-1土培条件下,叶、茎、根最大Pb富集量分别达到63、101、595 mg·kg-1,高浓度的Pb使雷竹部分细胞壁变形、叶绿体膜消失或部分断裂,片层结构模糊不清[6]。
植物修复是近些年发展起来的一项用于修复土壤重金属污染的生态技术,其机理主要是通过植物对重金属的吸收、积累和转化,减轻土壤重金属污染,因具有经济、简单和高效等优点而备受人们的关注。类芦(Neyraudia reynaudiana)是一种广泛分布于长江以南的草本植物,该植物极耐干旱、瘠薄,且根系发达、茎分蘖力强、生物量大、容易自然更新,对各种恶劣生境条件都有较强的适应性,是中国南方水土保持防风固沙的理想草种。近年来许多研究者发现,类芦在重金属矿废弃地上也可较好生长,并保有较高的生物量,对Pb有较强的耐性,并可以改善土壤理化性质。杨期和等[7]在粤东铅锌尾矿区对3种优势植物根际土壤微生物的活性研究中发现,类芦根际土壤Pb含量高达7 795.51 mg·kg-1;罗有发等[8]研究类芦在酸性矿山废水(AMD)污染土壤的生态修复效应及潜力中发现,类芦不仅生长良好,还提高了AMD污染土壤有效养分(全磷、全氮、有效磷、有效氮、有机质、速效钾)的含量。正是由于具备这些优势,使得类芦适合作为中国南方土壤重金属污染的修复植物。但近年来,国内外学者对类芦开展的研究多集中在水土流失治理、根系固土作用以及在受污染区域中生长的优势度等方面,而关于重金属在类芦组织和亚细胞水平上的毒害效应和分布规律并不清楚。
鉴于上述,本研究选取南方水土保持先锋植物类芦为试验材料,通过营养液培养实验,采用扫描电子显微镜(SEM)法和能谱透射电子显微镜(TEM-EDS)法以及差速离心法,研究Pb在类芦组织和亚细胞中的分布规律以及毒害效应,旨在探明类芦对重金属Pb的富集能力和解毒机制,为Pb污染土壤的植物修复治理提供基础数据。
1 材料与方法
1.1 试验材料及预培养
类芦种子于2015年4月购自云南昆明某种子公司,5月底种植于福建农林大学温室。同年8月底选择生长均一的类芦幼株,去除幼株腐烂的根和叶,将根系依次用自来水和去离子水洗净,移植在泡沫板上并置于500 mL超纯水中培养3~4 d,依次用1/4、1/2和完全Hoagland培养液在塑料盆中培养。预培养试验全程于人工气候箱中完成,培养期间昼/夜温度为25℃/22℃,光照时间16h,培养时间为3~5d。
1.2 试验方法
1.2.1 Pb胁迫类芦试验
取预培养后长到一定程度且大小一致的类芦,依次用自来水和去离子水冲洗干净,放入含有不同浓度Pb(以Pb(NO3)2的形式加入)的胁迫溶液中,设置浓度为0、200 μmol·L-1(以纯铅计)。每个处理重复15棵类芦,定植于有泡沫固定板的塑料盆中,将类芦置于人工气候箱培养,培养期间昼/夜温度为25℃/22℃,光照时间16 h,每3~4 d换一次胁迫液,并清洗塑料瓶,避免根系因缺氧腐烂。
1.2.2 SEM分析样品的制备和观察
类芦SEM分析样品的制备和观察参照朱宇恩等[9]的方法,并加以改进:取Pb胁迫21 d的类芦,依次用蒸溜水和去离子水将根系和叶片表面冲洗干净,分别切取新生根的根尖1 cm,完整的叶片中部(避开叶脉)5 mm2,然后用磷酸缓冲液反复清洗干净,迅速置于2.5%戊二酸固定液中固定2~24 h,抽气使材料下沉,在此期间加入适量Na2S(1%)溶液,使植物组织中的重金属凝结,再用0.1 mol·L-1的磷酸缓冲液冲洗3次,经50%、70%、80%、90%、95%、100%酒精逐级脱水,时间为每次15 min。再经冷冻干燥后切片镀金,采用S4800型扫描电镜,在5.0 kV的加速电压条件下完成观察、拍照。
1.2.3 TEM-EDS样品的制备和观察
TEM-EDS样品的制备和观察参照刘延盛等[10]和Basile等[11]的方法,具体步骤为:在Pb胁迫21 d后,依次用蒸溜水和去离子水将根系和叶片表面冲洗干净,从类芦顶端往下数第三片真叶,用锋利刀片取完整叶片中段2~3 cm,将切好的材料迅速投入2.5%的戊二醛固定液(用pH7.4的磷酸缓冲溶液配制),在4℃黑暗条件下固定6 h。随后,用0.1 mol·L-1磷酸缓冲溶液(pH7.4)洗涤4次,每次20 min。将洗涤过的材料转移至2%的锇酸(磷酸缓冲溶液配制)浸泡过夜10~12 h。在50%、70%、85%、90%、95%酒精中逐级脱水,每次各15 min,最后在100%酒精中脱水3次,每次各15 min。酒精与包埋剂3∶1比例渗透处理,每次2~3 h,之后纯包埋剂过夜(包埋胶囊包埋)。放入70℃烘箱处理12 h后,使用超薄切片机切片,分别经醋酸双氧铀染色20 min、柠檬酸铅染色15 min。
组织结构的改变及重金属分布特征观察采用配备X-射线能谱仪的透射电镜,在20 keV加速和25°离源角条件下完成。测量计数时间为60 s,测出的数值分别表示每种元素的峰值减去其背景值后的每秒脉冲数(CPS),重复检测每一细胞的微区至少8个测试点。
1.2.4 样品亚细胞组分Pb2+含量的测定
定期对类芦取样,分别在第3、7、14、21 d各取3株类芦,将根用去离子水冲洗干净并擦干,分为根部和地上部,放置于-80℃冰箱保存。
采用差速离心法分离不同的亚细胞组分,参考周小勇等[12]的方法,具体步骤为:准确称取鲜样0.2 g,加入20 mL提取液[0.25 mol·L-1蔗糖+50 mmol·L-1Tris-HCl缓冲液(pH 7.5)+1 mmol·L-1二硫赤藓糖醇],液氮研磨匀浆。匀浆液在冷冻离心机300 r·min-1下离心1 min,沉淀为细胞壁组分(F1);将上清液在2000 r·min-1下离心15 min,沉淀为细胞核和叶绿体组分(F2);上清液在10 000 r·min-1下离心20 min,沉淀为线粒体组分(F3);上清液为含核糖体的可溶组分(F4)。全部操作在4℃下进行。
各亚细胞组分Pb2+含量参考包曙光等[13]的硝酸-高氯酸湿法测定,并加以改进:将已分离的细胞组分置于50 mL三角瓶中,加混酸(HNO3∶HClO4=5∶1)10 mL,在电炉上加热,温度为150~200℃,加热约30 min溶液沸腾,持续加热溶液直至样品近干未干且溶液澄清时为消解完全,取下冷却至室温后用1%的稀硝酸定容至10 mL容量瓶中,用原子吸收法测定Pb2+含量。
1.3 数据处理
数据为3次重复样品测定结果的平均值(含标准差)。运用Excel 2007和SPSS 18进行数据统计分析,采用单因素方差分析(One-way ANOVA)和多重比较,用SNK法对处理间数据进行差异显著性分析,以P<0.05表示处理间数据差异显著。
2 结果与分析
2.1 Pb胁迫下类芦组织结构的SEM分析
通过SEM对类芦根系横切面进行观察,对照处理(图1A)的类芦根组织形状规则、排列整齐,根系表皮、内皮层和中柱清晰易分辨,切面的组织结构表面平整且无多余的杂质;Pb胁迫处理的类芦(图1B)根部组织结构形状不规则、排列无序,且薄壁细胞径向明显增大,相邻细胞间、上下细胞间连接壁破裂,在皮层细胞出现较多的颗粒状晶体,且有导管堵塞的现象。
类芦叶片组织结构相对于根系的变化要明显,对照处理(图2A)的类芦叶片表面光滑、连续;木质部内部的环纹清晰,排列有序且无破损;韧皮部细胞结构饱满,轮廓分明,薄壁细胞连续形成光滑。在Pb胁迫下(图2B),类芦的叶片表皮发生明显的变化,表皮细胞皱缩,局部有部分半球状或球状的突起,局部出现较大破损而形成一些碎片;木质部内的环纹变得模糊,部分环纹出现断裂或略微的膨胀;皮层出现了大量的颗粒状晶体,部分导管已出现堵塞。
2.2 类芦吸收Pb2+在亚细胞中累积部位的TEM-EDS分析
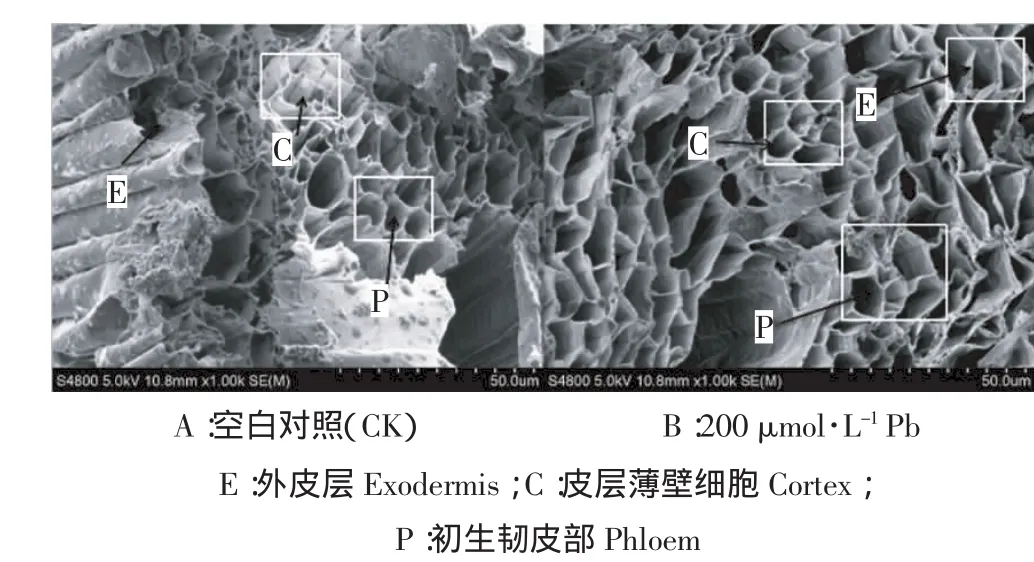
图1 不同处理下的类芦根系组织扫描电镜图Figure 1 The root tissues of Neyraudia reynaudiana in the different control treatment
通过TEM观察发现,正常类芦根系细胞的细胞器没有明显的损伤(图3),细胞质膜以及细胞壁表面清晰、光滑且连续。Pb胁迫下类芦根细胞(图4)的细胞膜、细胞壁附近可见到许多沉积的深色颗粒物,特别是在细胞间隙,表现出Pb2+逐渐渗入细胞结构而沉积的过程,进一步对样品放大观察发现,在Pb2+的作用下,根细胞发生了略微的质壁分离(图4d),局部的细胞质膜变得粗糙;线粒体的数量相对于对照组出现了明显的减少,一些受损的线粒体只残存一个或者极少数的脊突或几乎成为空泡;随着Pb2+的逐渐渗入,细胞质中大小液泡内也沉积了许多深色颗粒物(图4c)。通过EDS分析发现(图5),根细胞中Pb峰值与C、O、Si的相当,显著高于其他营养元素(Mg、Ca、K等),且吸附Pb的点位丰富,证实了大量沉淀于细胞壁、细胞间隙和液泡中的深色颗粒物主要成分为Pb。

图2 不同处理下的类芦叶片组织扫描电镜图Figure 2 The leave tissues of Neyraudia reynaudiana in the different control treatment

图3 Pb浓度为0 μmol·L-1处理下的类芦根细胞透射电镜图Figure 3 Ultrastructure of root cells of Neyraudia reynaudiana inthe control treatment(exposed to 0 μmol·L-1Pb for 21 days)

图4 Pb浓度为200 μmol·L-1处理下类芦根细胞透射电镜图Figure 4 Ultrastructure of root cells of Neyraudia reynaudiana in the control treatment(exposed to 200 μmol·L-1Pb for 21 days)

图5 Pb浓度为200 μmol·L-1处理下的类芦根细胞能谱分析图Figure 5 The EDS analyses of root cells of Neyraudia reynaudiana in the control treatment(exposed to 200 μmol·L-1Pb for 21 days)
TEM观察类芦叶细胞显示,正常类芦(图6)叶细胞完整,叶绿体片层结构清晰并呈现椭圆形,类囊体基粒和片层整齐;线粒体明显,呈现椭圆形;细胞核双层膜结构清楚,核仁致密完整,与核质界限分明。图7显示,Pb胁迫对类芦叶片的亚细胞结构产生了一定损伤:部分细胞的细胞膜和细胞壁被破坏(图7a),细胞内的膜系统空泡化严重(图7c),膜层出现游离现象,膜结构还逐渐模糊;在细胞间隙、细胞膜与细胞壁之间存在许多沉积的深色颗粒,可能是由于大量Pb2+在此沉积的结果;叶绿体的基粒片层结构紊乱以及消失,类囊体肿胀,一部分叶绿体外膜解体,叶绿体呈现略微的肿胀。通过EDS(图8)进一步分析发现,类芦叶片组织的Pb峰值与C、O峰值相当,且在2.55、10.51 keV吸附位点丰富,其他营养元素(Mg、Ca、Fe、K等)的峰值也较根细胞有所下降。这同样证实了大量地沉淀于类芦细胞壁以及叶绿体等细胞器的深色颗粒物的主要成分是Pb。

图6 Pb浓度为0 μmol·L-1处理下的叶细胞透射电镜图Figure 6 Ultrastructure of leave cells of Neyraudia reynaudiana in the control treatment(exposed to 0 μmol·L-1Pb for 21 days)

图7 Pb浓度为200 μmol·L-1处理下的叶细胞透射电镜图Figure 7 Ultrastructure of leave cells of Neyraudia reynaudiana in the control treatment(exposed to 200 μmol·L-1Pb for 21 days)

图8 Pb浓度为200 μmol·L-1处理下的类芦叶细胞能谱分析图Figure 8 The EDS analyses of leave cells of Neyraudia reynaudiana in the control treatment(exposed to 200 μmol·L-1Pb for 21 days)
2.3 Pb2+在类芦体内的亚细胞分布
通过差速离心分离法,将类芦叶片和根细胞分别分离出四部分,Pb2+在类芦亚细胞的分布如表1。从总含量上看,根系中的Pb2+含量远高于叶片,且随着胁迫时间的延长类芦体内Pb总量逐渐增加,但在不同部分的含量有一定差异。类芦根细胞在Pb浓度为200 μmol·L-1的胁迫初期,Pb2+主要分布在细胞壁组分(F1)及细胞核和叶绿体组分(F2),所占百分率分别为59.18%、22.30%,其次为线粒体组分(F3)以及可溶组分(F4);至胁迫结束,对照各组分未测出Pb2+,在Pb浓度为200 μmol·L-1的胁处理下,Pb2+从F1迁移到细胞原生质体,各组分Pb2+含量呈现F4>F1>F2>F3的规律,在F4中Pb2+含量最高(38.82 mg·kg-1),占总量的57.77%,此时含核糖体的F4是Pb2+在类芦根细胞的主要分布位点。而在类芦叶片中,胁迫初期,Pb2+也主要分布在F1,随着胁迫时间的延长,Pb2+在类芦体内逐渐从F1迁移到F2,至胁迫结束,各组分的含量呈现F4>F3>F1>F2的规律,Pb2+在F4含量较高,占32.56%,此时F4是Pb2+在类芦叶细胞的主要分布位点。

表1 不同时间和浓度处理下Pb2+在类芦各亚细胞的含量(mg·kg-1)Table 1 The concentration of Pb2+in leave and root cells of Neyraudia reynaudiana(mg·kg-1)
3 讨论
3.1 Pb2+对组织和亚细胞结构的毒害效应
Pb是一种对植物有极大毒害的元素,但是植物对Pb的敏感性及不同植物的毒害响应过程依赖于植物的基因型和生理特性。在SEM观察下发现,Pb对类芦不同的组织结构和组织区域均有不同的影响。在组织水平上,Pb胁迫后的类芦根和叶的组织结构均发生了形状不规则和形成晶体的现象,特别是皮层细胞,但中柱却无明显变化。这可能是因为植物为了减少重金属的毒害,将重金属离子限制在功能相对不重要的组织结构中。彭鸣等[14]通过X射线显微分析发现,玉米幼苗的木质部薄壁细胞对Pb2+的主动吸收积累以及皮层和表皮层细胞的沉积,减少了其进入中柱的量,保证了玉米正常的养分传输。Pb2+进入类芦体内后合成含Pb的晶体并在皮层及薄壁组织沉淀,有效地阻止了Pb2+向中柱内迁移,而中柱是植物运输养分和水分的重要组织[15],这在不同程度上降低了Pb2+对类芦的毒害作用。陈世宝等[16]在研究磷对降低土壤中铅生物有效性的X衍射及电镜分析发现,Pb以不同的磷酸盐化合物的形式沉淀,有效地阻止了Pb2+向中国芥菜中柱内的迁移,降低了污染土壤中Pb的蓄积毒性。因此,类芦为了保证生长代谢所需营养物质的运输,将大量的Pb2+以晶体形式沉淀,并将其限制在内柱外的组织结构中,但同时也导致了部分过多累积晶体的组织结构严重损伤。
TEM-EDS观察和分析证实细胞壁有大量Pb2+沉积,并且质膜已变得粗糙或模糊。这可能是由于Pb2+与膜蛋白相结合并使其部分变性,从而使以蛋白为主要成分的膜结构改变,导致部分功能丧失[17],这也是细胞壁对重金属离子固持作用有一定限度的原因。进入原生质体的重金属离子会对植物线粒体、叶绿体和细胞核等产生不同的毒害效应,如李佩华等[18]在铅、镉胁迫对马铃薯细胞超微结构的影响研究中发现,线粒体轻微膨胀呈椭圆形,嵴部分消失,结构解体;徐勤松等[19]通过电镜观察发现,Pb胁迫下凤眼莲(Eichhor-nia Crassipes Solms)体细胞中的细胞核染色质凝集,质体解体。但对植物来说,受危害后影响最大的是叶细胞中的叶绿体,其对重金属胁迫非常敏感,叶绿体的超微结构包括类囊体的完整性和有序性对光合作用的正常进行十分重要,而光合作用是植物生长发育重要的能量来源。本实验在SEM下观察到叶绿体的类囊体肿胀、外膜解体,这些表征都说明了Pb2+已经损伤了类芦的叶绿体。重金属离子对叶绿素的破坏将直接影响光合电子传递链的正常功能[20],也说明此时植物叶绿体在逐渐丧失光合功能,将逐步影响植物的整个生长发育过程。
3.2 Pb2+在类芦亚细胞水平的分布规律及其耐受机制
植物对Pb的耐受和解毒机制有多种,亚细胞的分布与累积方式决定了植物对Pb的耐性及解毒能力的大小,其中细胞壁被认为是植物保护原生质体免受金属离子毒害的第一道屏障。本研究通过原子吸收法和TEM观察法得到一致的结果,大量的Pb沉淀在类芦的细胞壁上,还有一大部分Pb被限制在液泡中。Pb主要分布在类芦细胞壁的原因可能在于:①由于Pb2+带正电,很容易在带负电的细胞壁处被大量吸附而沉积;②植物细胞壁含有蛋白质和多糖(纤维素、半纤维素、木质素等)以及大量配位基团(羟基、羧基、醛基、氨基酸等),容易吸附Pb2+。这一结果同王裕玲[21]的铅胁迫对双穗雀稗生理特性及铅积累的研究一致,Pb2+主要被储存于细胞壁。重金属离子被根毛吸收进入植物体内,转移到茎部或叶片中,将直接影响植物光合作用和其他重要的生理代谢过程,所以植物根部细胞壁的阻碍作用对避免重金属的毒害有重要意义。Lyubenova等[22]经研究证实,植物根细胞壁内带负电的果胶可以吸附固定大量的Pb;Krzeslowska[23]发现在Pb、Cd、Cu等重金属胁迫下,植物细胞壁果胶甲酯酶活性提高,低甲酯化果胶含量显著增加,果胶在空间上重新排布,从而提高了细胞壁吸收和累积重金属的容量。综合上述,类芦根细胞壁在减小Pb毒害效应中起到关键的作用,可能是其耐Pb机制之一。
然而,细胞壁的这种截留作用具有一定的局限性,这一方面可能是由于根细胞壁结合的重金属量达到饱和,另一方面由于毒性作用的加剧,使类芦细胞的正常代谢造成了伤害,如导致根细胞壁、原生质膜的透性增加、诱导氧化应激,从而对根细胞壁的截留功能产生严重的破坏,使得大量Pb2+会透过质膜进入原生质体。液泡因富含有机酸、蛋白质和生物碱等物质,可将Pb2+螯合成有机配体,转化为毒性较小的结合形态,缓解Pb对植物的毒害效应,所以成为植物保护原生质体免受金属离子毒害的第二道屏障。本研究也发现其他两个组分(F2、F3)的含量并不高,可能是透过细胞壁的Pb被局限在液泡这个活性较低的区域内,阻止了过多的Pb进入植物原生质体。罗有发等[8]通过X射线分析发现,胁迫后的豌豆幼苗液泡比细胞质多积累60%的Pb,在根中更是高达80%。液泡膜上的H+-ATP酶和Ca2+-ATP酶可以有效地转运金属离子[24],被认为是分隔重金属的重要机构。已有许多学者研究发现,Pb在液泡内的螯合作用可有效减小其毒性,如在Pb胁迫下的烟草[25],PCs与Pb所形成的络合物主要累积在叶肉细胞的液泡中,Yang等[26]发现在耐Pb品种水稻根系组织细胞质中的草酸担负着与Pb络合、减轻Pb毒害的作用。综合上述,说明类芦液泡内部的解毒机制及其区室化作用在类芦对Pb的富集、耐性和解毒方面起着重要的作用,但其内部有效的解毒机制还有待进一步的研究。
类芦通过细胞壁固持和液泡区室化这两个重要的屏障,减少了大量的Pb进入原生质体,许多学者在研究其他超富集植物(如Sedum alfredii、Potentilla griffithii var.velutina等)时也同样发现重金属离子主要富集在植物细胞壁和液泡中,其次分布在原生质体内[10,27],但是不同植物种类和重金属浓度胁迫下的耐受力和相应内部机制存在一定的差异。因类芦对Pb的富集能力、耐受性及拥有较大的生物量等特点,特别是在中国南方的矿区,类芦能对当地恶劣环境有极强的适应能力[7-8,28],使其成为中国南方矿区退化生态系统的植被恢复、重金属污染土壤治理的一种潜能植物。
4 结论
类芦将进入其体内的Pb2+合成晶体,并限制在中柱以外的组织中,有效地降低了Pb对组织结构的毒害作用,保证了正常的营养物质和水分运输。类芦的不同器官对Pb2+吸收能力存在一定差异,表现在地下部吸收Pb2+的能力大于地上部。根细胞内Pb2+主要分布在细胞壁和以液泡为主的可溶组分,而叶细胞内Pb2+在可溶组分占有量较大。
[1]周芙蓉.侧柏和国槐对干旱和铅胁迫的耐性及对铅污染土壤的修复[D].杨凌:西北农林科技大学,2014:3-4.
ZHOU Fu-rong.Tolerance of platycladus orientalis and Sophora japonica to drought,land stress and restoration of lead-contaminated soil[D].Yangling:Northwest Agriculture and Forestry University,2014:3-4.
[2]Sharma P,Dubey R S.Lead toxicity in plants[J].Brazilian Journal of Plant Physiology,2005,17(1):35-52.
[3]杨明琰,梁语燕,曾德榜,等.铅胁迫对黑麦草Pb富集特性及生理代谢的影响[J].西北农林科技大学学报(自然科学版),2014,42(12):97-101.
YANG Ming-yan,LIANG Yu-yan,ZENG De-bang,et al.Effects of lead stress on accumulation capacity and physiological metabolism of ryegrass[J].Journal of Northwest Agriculture and Forestry University(Natural Science Edition),2014,42(12):97-101.
[4]Patra J,Lenka M,Panda B B.Tolerance and co-tolerance of the grass Chloris barbata Sw.to mercury,cadmium and zinc[J].New Phytologist, 1994,128(1):165-171.
[5]魏朝丹,周兰英,李嫦平.利用观赏植物白雪姬修复铅污染的潜力研究[J].环境科学学报,2011,31(10):2290-2297.
WEI Chao-dan,ZHOU Lan-ying,LI Chang-ping.Investigation on the reparative potential of Pb pollution by ornamental plant Tradescantia sillamontana[J].Acta Scientiae Circumstantiae,2011,31(10):2290-2297.
[6]李松,柳丹,吴家森,等.雷竹对铅胁迫的生理响应及其修复效率研究[J].水土保持学报,2014,28(2):175-179.
LI Song,LIU Dan,WU Jia-sen,et al.Effects of lead stress on physiological response and phytoremediation efficiency of Phyllostachys praecox [J].Journal of Soil and Water Conservation,2014,28(2):175-179.
[7]杨期和,刘惠娜,李清华,等.粤东铅锌尾矿区3种优势植物根际土壤微生物的活性研究[J].中国农学通报,2012,28(30):56-64.
YANG Qi-he,LIU Hui-na,LI Qing-hua,et al.Study on the microbial activity of rhizosphere soil for three dominant plant in Pb-Zn wasteland in Eastern Guangdong Province[J].Chinese Agricultural Science Bulletin,2012,28(30):56-64.
[8]罗有发,吴永贵,付天岭,等.类芦植被对AMD污染土壤的生态修复效应及潜力[J].水土保持学报,2016,30(1):285-292.
LUO You-fa,WU Yong-gui,FU Tian-ling,et al.Ecological restoration effect and potential of Neyraudia reynaudiana vegetation on AMD polluted soil[J].Journal of Soil and Water Conservation,2016,30(1):285-292.
[9]朱宇恩,赵烨,徐东昱,等.旱柳(Salix matsudana Koidz)体内Cu迁移特征的水培模拟研究[J].环境科学学报,2011,31(12):2740-2747.
ZHU Yu-en,ZHAO Ye,XU Dong-yu,et al.Investigation on the characteristics of copper migration in different tissues of Salix matsudana Koidz based on hydroponic experiment[J].Acta Scientiae Circumstantiae,2011,31(12):2740-2747.
[10]刘延盛,鲁家米,周晓阳.Pb在豌豆幼苗细胞中的超微结构分布与毒性研究[J].应用与环境生物学报,2007,13(5):647-651.
LIU Yan-sheng,LU Jia-mi,ZHOU Xiao-yang.Cellular damages and accumulation of Pb polluted Pisum sativum L.:Implication for phytoremediation[J].Chinese Journal Applied and Environmental Biology, 2007,13(5):647-651.
[11]Basile A,Giordano S,Cafiero G,et al.Tissue and cell localization of experimentally supplied lead in Funaria hygrometrica Hedw.using X-ray SEM and TEM microanalysis[J].Journal of Bryology,1994,18(1):69-81.
[12]周小勇,仇荣亮,胡鹏杰,等.镉和铅对长柔毛委陵菜体内锌的亚细胞分布和化学形态的影响[J].环镜科学,2008,29(7):2028-2036.
ZHOU Xiao-yong,QIU Rong-liang,HU Peng-jie,et al.Effects of cadmium and lead on subcellular distribution and chemical form of zinc in Potentilla griffithii var.velutina[J].Environmental Science,2008,29(7):2028-2036.
[13]包曙光,刘海学,齐娜,等.铅胁迫对向日葵幼苗矿质元素吸收和积累的影响[J].水土保持学报,2013,27(1):107-110.
BAO Shu-guang,LIU Hai-xue,QI Na,et al.Effects of absorption and accumulation of mineral elements in sunflower seedlings under lead stress[J].Journal of Soil and Water Conservation,2013,27(1):107-110.
[14]彭鸣,王焕校,吴玉树.镉、铅在玉米幼苗中的积累和迁移:X射线显微分析[J].环境科学学报,1989,9(1):61-67.
PENG Ming,WANG Huan-xiao,WU Yu-shu.The accumulation and migration:X ray microanalysis ofcadmium and lead in the corn seedling[J].Acta Scientiae Circumstantiae,1989,9(1):61-67.
[15]Peterson C A,Enstone D E,Taylor J H.Pine root structure and its potential significance for root function[J].Plant and Soil,1999,217:205-213.
[16]陈世宝,朱永官,马义兵.磷对降低土壤中铅的生物有效性的X-衍射及电镜分析[J].环境科学学报,2006,26(6):924-929.
CHEN Shi-bao,ZHU Yong-guan,MA Yi-bing.Studies on the mechanisms of lead immobilization by phosphorus in soil by XRD,SEM and TEM[J].Acta Scientiae Circumstantiae,2006,26(6):924-929.
[17]Sharma R K,Agrawal M.Biological effects of heavy metals:An overview [J].Environmental Biology,2005,26(Suppl 2):301-313.
[18]李佩华.铅、镉胁迫对马铃薯叶绿素含量及细胞超微结构的影响[J].湖北农业科学,2015,54(16):3974-3978.
LI Pei-hua.Effects of Pb and Cd chlorophyll content and cell utrastructure of potato[J].Hubei Agricultural Sciences,2015,54(16):3974-3978.
[19]徐勤松,施国新,王学,等.铅(Pb)在凤眼莲(Eichhornia Crassipes Solms)体细胞中分布的电镜观察[J].南京师大学报(自然科学版), 2006,29(3):81-85.
XU Qin-song,SHI Guo-xin,WANG Xue,et al.Subcellular localization of Pb in cells of Eichhornia crassipes Solms by electron microscopy[J]. Journal of Nanjing Normal University(Natural Science),2006,29(3):81-85.
[20]Trebst A.Energy conservation in photosynthetic electron transport of chloroplasts[J].Annual Review of Plant Biology,1974,61(7):423-458.
[21]王裕玲.铅胁迫对双穗雀稗生理特性及铅积累的影响[J].西南农业学报,2015,28(3):1062-1066.
WANG Yu-ling.Effects of Pb stress on physiological characteristics of Paspalum distichum and its Pb uptake[J].Southwest China Journal of Agricultural Sciences,2015,28(3):1062-1066.
[22]Lyubenova L,Pongrac P,Vogel-Miku K,et al.Localization and quantification of Pb and nutrients in Typha latifolia by micro-PIXE[J].Met-allomics:Integrated Biometal Science,2012,4:333-341.
[23]Krzeslowska M.The cell wall in plant cell response to trace metals:Polysaccharide remodeling and its role indefense strategy[J].Acta Physiologiae Plantarum,2011,33(1):35-51.
[24]Yang X,Feng Y,He Z,et al.Molecular mechanisms of heavy metal hyperaccumulation and phytoremediation[J].Journal of Trace Elements in Medicine and Biology,2005,18(4):339-353.
[25]Crist R H,Martin J R,Crist D R.Heavy metal uptake by lignin:Comparison of biotic ligand models with an ion exchange process[J].Environmental Science and Technology,2002,36(7):1485-1490.
[26]Yang Y Y,Jung J Y,Song W Y,et al.Identification of rice varieties with high tolerance or sensitivity to lead and characterization of the mechanism of tolerance[J].Plant Physiology,2000,124(3):1019-1026.
[27]LI Ting-qiang,YANG Xiao-e,YANG Jin-yan,et al.Zn accumulation and subcellular distribution in the Zn hyper accumulator Sedum alfredii Hance[J].Pedosphere,2006,16(5):616-623.
[28]龙健,黄昌勇,滕应,等.天台铅锌矿区香根草(Vetiveria zizanioides)等几种草本植物的重金属耐性[J].应用与环境生物学报, 2003,9(3):226-229.
LONG Jian,HUANG Chang-yong,TENG Ying,et al.Tolerance to heavy metals of Vetiveria zizanioides some herbages in Tiantai leadzincmine[J].ChineseJournal Applied and Environmental Biology,2003, 9(3):226-229.
The distribution and toxic effects of Pb at the levels of the tissue and sub-cellular in Neyraudia reynaudiana
HUANG Mei-ying1,2,LUO Jie-wen1,2,HUANG Cai-feng1,2,ZHOU Chui-fan1,2*
(1.College of Forestry,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2.Co-innovation Center for Soil and Water Conservation in Red Soil Region of the Cross-straits,Fuzhou 350002,China)
In order to examine the phytoremediation potential of Neyraudia reynaudiana,the study explored the toxic effects and distribution of lead(Pb)at the levels of the tissue and sub-cellular in this species and analyzed the supplementing the growth medium with Pb as a target pollutant.After cultivation was concluded,the uptake of sub-cellular Pb was determined,and the distribution of Pb as well as the Pbinduced damage was respectively assessed through scanning electron microscope(SEM)and transmission electron microscope with energy dispersive X-ray spectroscopy(TEM-EDS).Pb caused the tissues to become irregular and fragmented by injuries;additionally,a portion of the catheters were filled with crystals.At the sub-cellular level,many phenomena demonstrated that leaf and root cells were harmed;for example,cell walls became vague,mitochondria were less numerous,and chloroplasts were swollen.Pb was mainly distributed in the cell wall(12.28 mg·kg-1)and the vacuole(38.82 mg·kg-1)of root cells,and it accounted for 32.56%of the total biomass in the leaves.In addition,the EDS analysis found a significant amount of Pb in cells.These results suggest that N.reynaudiana has a strong ability to both absorb and tolerate Pb.Moreover,the species may alter the distribution of Pb at both the tissue and the sub-cellular levels to reduce toxicity.Therefore,N.reynaudiana is well suited for phytoremediation in Southern China and elsewhere.
Pb;Neyraudia reynaudiana;tissue;sub-cellular;scanning electron microscope(SEM);transmission electron microscope with energy dispersive x-ray spectroscopy(TEM-EDS)
X171.5
A
1672-2043(2016)11-2077-09
10.11654/jaes.2016-0627
2016-05-06
国家科技支撑计划项目(2014BAD15B02);农业高校产学合作科技重大项目(2013N5002);福建省高校杰出青年科研人才培育计划项目(2015);福建省自然科学基金项目(2013J01073)
黄玫英(1994—),女,本科生,福建上杭人,主要从事生态修复研究。E-mail:hmy597@163.com
*通信作者:周垂帆E-mail:zhouchuifan@163.com
黄玫英,罗洁文,黄彩凤,等.Pb在类芦组织和亚细胞中的分布规律和毒害效应[J].农业环境科学学报,2016,35(11):2077-2085.
HUANG Mei-ying,LUO Jie-wen,HUANG Cai-feng,et al.The distribution and toxic effects of Pb at the levels of the tissue and sub-cellular in Neyraudia reynaudiana[J].Journal of Agro-Environment Science,2016,35(11):2077-2085.
