肝脏血管周上皮样细胞瘤的CT和MRI表现
2016-11-29赵秀丽ZHAOXiuli胡儒华HURuhua王平怀WANGPinghuai陈志晔CHENZhiye
赵秀丽 ZHAO Xiuli胡儒华 HU Ruhua王平怀 WANG Pinghuai陈志晔 CHEN Zhiye
作者单位
1. 山东省青州市人民医院影像科 山东青州262519 2. 解放军总医院影像科 北京 100853
肝脏血管周上皮样细胞瘤的CT和MRI表现
赵秀丽1ZHAO Xiuli胡儒华1HU Ruhua王平怀2WANG Pinghuai陈志晔2CHEN Zhiye
作者单位
1. 山东省青州市人民医院影像科山东青州262519 2. 解放军总医院影像科北京100853
目的 肝脏血管周上皮样细胞(PEComa)为少见,容易误诊,本研究探讨肝脏PEComa的CT与MRI表现。资料与方法 回顾性分析经病理证实的22例肝脏PEComa患者的临床及影像资料。13例行肝脏CT平扫及双期增强扫描,11例行肝脏MR平扫及多期多时相扫描,其中2例同时行肝脏CT和MR检查。结果 单发型19例,大小2.3~11.5 cm,呈圆形或类圆形;多发型3例,大小0.5~23.3 cm,呈巨大不规则形肿块伴多发圆形或类圆形子灶。肿瘤平扫密度/信号大部分均匀,CT平扫为稍低密度,MR平扫呈稍长T1稍长T2信号,DWI呈相对均匀明显高信号。病灶内部可含成熟脂肪(脂肪变性)或坏死囊变、出血而呈混杂密度/信号。增强扫描所有病灶均血供丰富,动脉期中度至明显强化,以病变中心或周边见增粗纡曲血管影为特征表现,门静脉期呈等信号或趋于等信号,延迟期呈低信号。结论肝脏PEComa的CT、MRI表现有一定的特征,当发现肝脏肿瘤大部分密度/信号相对均匀,含或不含成熟脂肪(脂肪变性),增强扫描中心或边缘见粗大纡曲强化血管时,结合临床可提示性诊断。
肝肿瘤;血管周上皮样细胞肿瘤;体层摄影术,螺旋计算机;磁共振成像
血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)是在组织学和免疫表型上具有血管周上皮样细胞特征的间叶性肿瘤[1]。PEComa包括血管平滑肌脂肪瘤(angiomyolipoma,AML)、肺的透明细胞瘤(clear cell tumor,CCT)、淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM)、镰状韧带的透明细胞肌黑色素瘤(clear cell myo melanoxytic tumor,CCMMT)及其他部位罕见的透明细胞瘤[2]。发生于肝脏的PEComa较罕见[3-4],影像学诊断准确率低,临床上常误诊为其他疾病。提高对肝脏PEComa影像特征的认识,早期诊断,对确定治疗方案和改善患者预后具有重要意义。本研究回顾性分析经病理证实的肝脏PEComa患者资料,探讨其影像表现,以增加对本病的认识。
1 资料与方法
1.1研究对象 回顾性分析2008年11月-2015年9月中国人民解放军总医院收治的22例肝脏PEComa患者,其中男1例,女21例;年龄23~70岁,平均(41.54±12.09)岁。20例经手术病理证实,2例经穿刺病理证实。临床表现:17例体检B超发现肝占位,5例腹部不适。所有患者均无乙型肝炎、肝硬化病史,血清甲胎蛋白(AFP)阴性。术前13例诊断为肝脏恶性肿瘤,3例诊断为肝腺瘤,6例诊断为AML。19例行肝叶或肿瘤切除术,2例行肝动脉插管碘油栓塞术,1例行全肝切除并亲体左半肝移植术。13例行腹部CT平扫及双期增强扫描,11例行腹部MRI平扫及多期多时相扫描,其中2例同时行CT和MRI检查。
1.2仪器与方法 采用Siemens Sensation Cardiac64层螺旋CT扫描仪。扫描前5 min口服清水500 ml。管电压120 kV,管电流300 mA,层厚5 mm,无间距扫描,螺距1.375。以3.0 ml/s的流速经静脉团注对比剂(碘海醇,碘300 mg/ml)90 ml,分别于注射后25~30 s、60~65 s行动脉期、门静脉期扫描。MRI检查采用GE Signa Excite HD1.5TMR扫描仪及体部表面线相控阵线圈检查。扫描参数:全肝横轴位呼吸触发脂肪抑制序列T2WI:TR 8000 ms,TE 105 ms,回波链长度12,层厚6~7 mm,层间隔1 mm,视野(FOV)400 mm× 400 mm,激励次数2,矩阵224×228;横轴位双回波屏气梯度扰相T1WI:TR 230.0 ms,TE 为2.2 ms及4.5 ms,回波链长度17 , 翻转角80°,FOV 400 mm×400 mm,激励次数1,矩阵256×170,带宽62.5 kHz。增强扫描序列为横轴位屏气脂肪抑制肝脏快速三维容积采集序列扫描,层厚5 mm,间距为0,翻转角12°,FOV 400 mm× 400 mm,矩阵320×192,带宽62.5 kHz。对比剂采用钆喷替酸葡甲胺(Gd-DTPA),采用高压注射器以2 ml/s的流速注射,对比剂总量按0.1 mmol/kg计算,注射对比剂后20~25 s、30~35 s、5~6 min分别行动脉期、门静脉期和延迟期扫描。
1.3图像分析 由3名从事影像诊断工作20年以上的副主任医师采用双盲法共同阅片,达成一致意见。分析CT/MRI图像上病变的部位、形态、大小、密度/信号特征、肿瘤强化情况及侵犯范围等。病理结果由2名主任医师进行综合分析。
2 结果
2.1生长部位、大小、形态 22例肝脏PEComa中,单发型19例,多发型3例。单发型19个,大小为2.3~11.5 cm,呈圆形或类圆形,边界清晰。肝右叶11个,肝左叶8个,其中1个病灶全部位于肝外,呈外生性生长,局部与肝左叶外侧段分界不清(图1)。3例多发型病灶分布于肝左右叶,但以肝左叶为主,大小为0.5~23.2 cm,表现为肝左右叶交界处一巨大肿块(23.2 cm、17.6 cm、15.7 cm)突向肝外生长,且肝左右叶多发0.5~5.2 cm子灶。巨大肿块形态不规则,边界欠清晰,子灶呈圆形或类圆形,边界清晰。
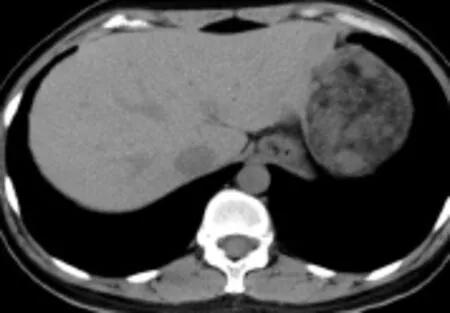
图1 女,35岁,单发型PEComa。CT平扫轴位图像示肝左叶外侧段见一向肝外生长混杂密度肿块,内见成熟脂肪密度(箭)
2.2CT密度特征、血供及强化方式 13例行CT平扫及双期增强扫描,11例为单发型,2例为多发型。11例单发型病灶平扫实性部分CT值为36~48 HU,其中4例病灶见不同范围脂肪密度,CT值为-104~ -33 HU;2例多发型病灶均表现为肝左右叶交界处1个巨大肿块伴肝内多发子灶,子灶均表现为均匀低密度。增强扫描所有病灶均表现为血供丰富,动脉期病灶实性部分不均匀明显强化(图2A),CT值为96~154 HU,净增值>30 HU,10例病灶中心或周边见粗大纡曲增强供血动脉影(图2A);门静脉期所有病灶均持续强化,但强化幅度下降。
2.3MRI信号特征、血供及强化方式 11例行肝脏MR平扫及多期多时相扫描,8例为单发型(图3A、B),3例为多发型。其中3个病灶内见短T1长T2 信号,脂肪抑制呈低信号,化学位移成像呈边缘信号减低,提示为成熟脂肪(图4A、B),2个病灶化学位移成像中反相位出现片状信号差异,提示含有细胞内脂质(图5A、B)。3例为多发型,其中1个病灶内部见短T1、长T2成熟脂肪信号,2个病灶内部长T1、长T2坏死信号区域见片状短T1信号,脂肪抑制未见明显信号减低,提示可能为出血。单发型5个病灶及多发型3个巨大病灶T2WI加权像中心或边缘见流空血管影(图2B)。单发型7个病灶及多发型3个巨大病灶边缘出现短T2信号且延迟强化,考虑为假包膜(图2B)。增强扫描所有病灶均表现为血供丰富,强化方式呈动脉期中度至明显强化,其中10个病灶中心或边缘见粗大强化血管影(图2C),门脉期所有病灶呈等信号或趋于等信号,延迟期呈稍低信号。其中1个单发型病灶平扫内部见一长条状长T1长T2信号,动脉期无明显强化,门静脉期及延迟期强化并引流至下腔静脉,提示为血流缓慢的引流静脉(图5C、D)。
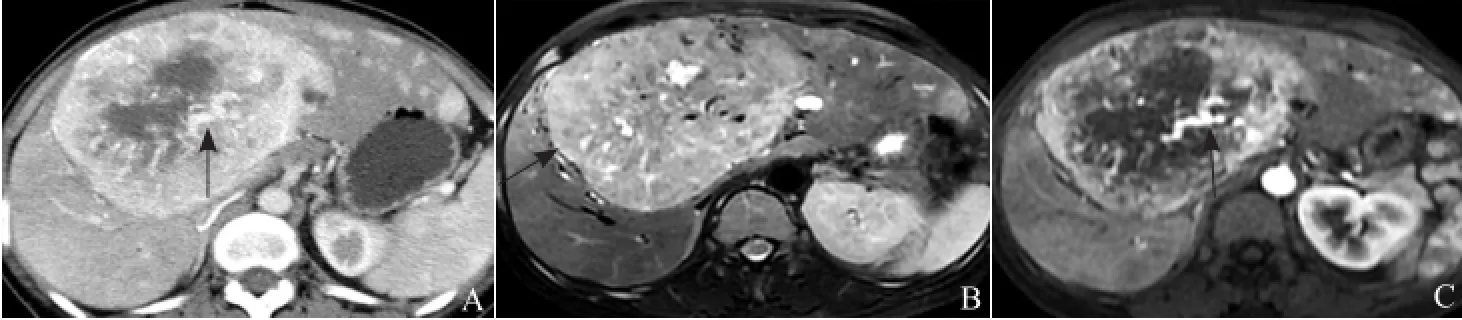
图2 女,44岁,多发型PEComa。CT增强动脉期横轴位图像示病灶不均匀明显强化,内见不规则片状无强化低密度坏死,病灶内见多发异常强化粗大血管影(箭,A);T2WI图像示巨大病灶呈大部分均匀稍长T2信号,内见片状长T2坏死信号,边缘或中央见多发流空血管,边缘见短T2假包膜影(箭,B);肝左叶见多发长T2结节状子灶;增强动脉期图像示巨大病灶不均匀明显强化,内见强化异常增粗血管影(箭,C),子灶均匀强化

图3 女,54岁,单发型PEComa。T2WI图像示肝右叶后下段稍长T2均匀信号结节(无成熟脂肪/脂肪变性)(箭,A);DWI图像示病灶呈均匀明显高信号(箭,B)

图4 女,39岁,多发型PEComa。T1WI同相位图像示巨大病灶信号不均匀,内见大片状短T1信号(箭,A);T1WI反相位图像示病变边缘呈环形信号减低,提示为成熟脂肪(箭,B)

图5 女,32岁,单发型PEComa。T1WI同相位图像示病变呈稍短T1信号(箭头,A);内见长条状长T1信号(A,箭);T1WI反相位图像示病灶呈片状信号减低(箭头,B);提示细胞内含脂质。增强动脉期图像示病灶均匀明显强化,内见长条状无强化影(箭,C);门静脉期图像示病灶持续均匀强化,强化幅度下降,内见长条状异常强化血管与下腔静脉相连(箭,D)
3 讨论
PEComa于1991年由Bonetti等[5]提出,其发病部位最多见于女性子宫,其次是肾脏,肝脏PEComa较为罕见,2000年由Yamasaki等[6]首次报道。肝脏PEComa女性多发,好发年龄40~50岁,好发于右肝,多为单发[7]。临床上,肝脏PEComa大多为患者因体检发现或因肿物过大出现压迫症状而就诊[8-9]。本研究患者的性别、发病年龄及临床症状均与文献报道相符。本研究发现肝脏 PEComa左、右叶均可发生,单发型右叶(11例)略多于左叶(8例),与文献报道相符,而多发型3例病变却以左叶分布为主,未见相关文献报道。肝脏 PEComa病理学特点为肿瘤由单形性血管周上皮样细胞构成,其具有黑色素细胞、神经内分泌细胞和肌细胞的某些特征,既可呈血管、平滑肌、脂肪三向分化,亦可以三者中的某种成分为主,免疫组织化学表达为黑色素生成标志物(HMB-45、melan2A)阳性[10]。PEComa的生物学行为大多表现为良性,偶尔表现为侵袭性行为甚至可以类似于高度恶性的肿瘤[11-13]。因此,术后须定期随访,以便对复发和转移灶早发现、早治疗。本组22例均为良性。
3.1影像学诊断 肝脏PEComa术前影像学诊断准确率较低,CT联合MRI对本病的诊断准确率也只有20%[14-15]。CT平扫一般表现为呈圆形或类圆形软组织肿块,边界清晰,病灶大部分密度均匀,内部可因含脂肪、坏死囊变及出血而密度混杂,罕见有钙化[16,18]。当合并有脂肪肝背景时,病灶可表现为等或高密度。动态增强扫描动脉期病灶不均匀明显强化,典型病灶边缘或中心可有异常强化粗大血管影;门静脉期持续强化,但强化幅度下降[18-20]。本研究CT表现和强化方式与文献报道相符。肝脏 PEComa的MRI信号表现可因肿瘤内部成分不同而复杂多样,病变可含或不含成熟脂肪(脂肪变性)、可见坏死囊变及出血,较大病灶边缘可见短T2假包膜[20]。肿瘤一般在T1WI显示为稍低信号,T2WI上呈稍高信号,DWI显示为高信号,增强后动脉期中度至明显强化,门静脉期呈等信号或趋于等信号,延迟期表现为低信号,同时可观察到点状或线状血管影及延迟强化假包膜[19,21]。肿瘤内部不含或含有极少脂肪时常误诊为肝癌[18,21-22]。本研究13例术前诊断为肝脏恶性肿瘤,3例诊断为肝腺瘤,误诊原因主要是对本病的影像学特征认识不足。
3.2鉴别诊断 肝脏 PEComa 主要与以下几种血供丰富的肿瘤相鉴别:①肝细胞癌:肝脏 PEComa 可以出现与肝细胞癌相似的“快进快出”的强化方式,前者供血动脉一般粗大,后者供血动脉较小、较脆易出血;且肝细胞癌一般有乙肝、肝硬化病史,AFP往往较高,而肝脏PEComa临床及实验室检查一般均无特殊表现[23]。②肝腺瘤:增强扫描腺瘤供血动脉一般位于边缘,而肝脏PEComa供血动脉大多位于中心,同时结合避孕药、类固醇等服药史不难鉴别。③肝局灶性结节增生(focal nodular hyperplasia,FNH):FNH病灶中心瘢痕延迟强化为其较具特征性的表现,可鉴别。④肝血管瘤:血管瘤在T2WI表现为“亮灯征”,且强化方式以周边结节样强化并向心性充填,较易鉴别。
总之,肝脏PEComa临床上罕见,虽然起病隐匿,症状也缺乏特异性,但CT、MRI表现有一定的特征,当发现肝脏肿瘤大部分密度/信号相对均匀,含或不含成熟脂肪(脂肪变性),增强扫描中心或边缘见粗大纡曲强化血管时,结合临床可提示性诊断。
[1] Folpe AL. Neoplasms with perivascular epithelioid cell differentiation (PEComas). Pathology and genetics of tumours of soft tissue and bone//Fletcher CDM, Unni KK, Epstein J, et al. WHO classification of tumours. Lyon: IARC Press, 2002: 221-222.
[2] Armah HB, Parwani AV. Perivascular epithelioid cell tumor. Arch Pathol Lab Med, 2009, 133(4): 648-654.
[3] Rouquie D, Eggenspieler P, Algayres JP, et al. Malignant-like angiomyolipoma of the liver: report of one case and review of the literature. Ann Chir, 2006, 131(5): 338-341.
[4] 韩威, 蒋伟, 李建设, 等. 肝脏血管周上皮样细胞瘤1例报告并文献复习. 中国实用外科杂志, 2008, 28(7): 556-558.
[5] Bonetti F, Pea M, Martignoni G, et al. Cellular heterogeneity in lymphangiomyomatosis of the lung. Hum Pathol, 1991, 22(7): 727-728.
[6] Yamasaki S, Tanaka S, Fujii H, et al. Monotypic epithelioid angiomyolipoma of the liver. Histopathology, 2000, 36(5): 451-456.
[7] Parfitt JR, Bella AJ, Izawa JI, et al. Malignant neoplasm of perivascular epithelioid cells of the liver. Arch Pathol Lab Med,2006, 130(8): 1219-1222.
[8] Zhao LJ, Yang YJ, Wu H, et al. Perivascular epithelioid cell tumor of the liver: a case report and literature review. Eur Rev Med Pharmacol Sci, 2013, 17(12): 1665-1668.
[9] Strzelczyk JM, Durczynski A, Szymanski D, et al. Primary perivascular epithelioid cell tumor (PEComa) of the liver: report of a case. Surg Today, 2009, 39(10): 916-921.
[10] Insabato L, De Rosa G, Terracciano LM, et al. Primary monotypic epithelioid angiomyolipoma of bone. Histopathology, 2002, 40(3): 286-290.
[11] Folpe AL, Mentzel T, Lehr HA, et al. Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin: a clinicopathologic study of 26 cases and review of the literature. Am J Surg Pathol, 2005, 29(12): 1558-1575.
[12] Folpe AL, Kwiatkowski DJ. Perivascular epithelioid cell neoplasms: pathology and pathogenesis. Hum Pathol, 2010,41(1): 1-15.
[13] Jafari A, Fischer HP, Von Websky M, et al. Primary perivascular epithelioid cell tumor (PEComa) of the liver: case report and review of the literature. Z Gastroenterol, 2013,51(9): 1096-1100.
[14] Yang X, Li A, Wu M. Hepatic angiomyolipoma: clinical,imaging and pathological features in 178 cases. Med Oncol,2013, 30(1): 416.
[15] Yang CY, Ho MC, Jeng YM, et al. Management of hepatic angiomyolipoma. J Gastrointest Surg, 2007, 11(4): 452-457.
[16] 李淑英, 方松华. 肝脏血管周上皮样细胞瘤2例. 医学影像学杂志, 2007, 17(9): 1009-1010.
[17] 陈洋, 李建军. 肝脏血管周上皮样细胞瘤1例. 实用放射学杂志, 2009, 25(11): 1614, 1619.
[18] Ji JS, Lu CY, Wang ZF, et al. Epithelioid angiomyolipoma of the liver: CT and MRI features. Abdom Imaging, 2013, 38(2): 309-314.
[19] 刘江泽, 谢欢, 刘四斌. 肝脏血管周上皮样细胞瘤6例多层螺旋CT表现. 中国医学影像学杂志, 2012, 20(9): 675-676.
[20] Tan Y, Xiao EH. Hepatic perivascular epithelioid cell tumor(PEComa): dynamic CT, MRI, ultrasonography, and athologic features--analysis of 7 cases and review of the literature. Abdom Imaging, 2012, 37(5): 781-787.
[21] Lee SJ, Kim SY, Kim KW, et al. Hepatic angiomyolipoma with minimal fat, mimicking hepatocellular carcinoma. Clin Mol Hepatol, 2012, 18(3): 330-335.
[22] Saito Y, Shimada M, Utsunomiya T, et al. Hepatic epithelioid angiomyolipoma with arterioportal venous shunting mimicking hepatocellular carcinoma: report of a case. J Med Invest, 2013,60(3-4): 262-266.
[23] Akitake R, Kimura H, Sekoguchi S, et al. Perivascular epithelioid cell tumor (PEComa) of the liver diagnosed by contrast-enhanced ultrasonography. Intern Med, 2009, 48(24): 2083-2086.
(本文编辑张晓舟)
CT and MRI Manifestations of Hepatic Perivascular Epithelioid Cell Tumor
Purpose The hepatic perivascular epithelioid cell tumor (PEComa) is rare and easily misdiagnosed. The purpose of this study is to investigate CT and MRI findings of hepatic PEComa. Materials and Methods Clinical and imaging data of 22 patients with hepatic PEComa confirmed by pathology were retrospectively analyzed. Thirteen cases underwent pre-contrast abdominal CT scan and dual-phase enhanced scan. Eleven cases underwent unenhanced MRI scans and multi-phage scans. Two cases simultaneously underwent CT and MRI scan. Results Nineteen cases had solitary lesions with round or round-like shape, and diameter ranged 2.3-11.5 cm. Three cases were multiple lesions, 0.5-23.3 cm in diameters, which showed huge irregular mass with multiple round or round-like star lesions. On precontrast CT images, tumors showed homogeneous slightly low density,and on precontrast MR images, tumors demonstrated slightly low signal intensity on T1WI and slightly high signal intensity on T2WI. DWI demonstrated diffusion restricted. The lesion presented as heterogeneous due to mature adipose (steatosis), cystic necrosis, or hemorrhage in it. All the lesions were hypervascular, which showed moderate to obviously enhancement on arterial phase with tortuous vascular in the center of lesions or at the peripheral. On portal venous phase, the tumors showed iso-intensity, and on the delayed phase were low signal intensity. Conclusion There are some characteristic CT or MRI manifestations of hepatic PEComa. When the liver tumors show majority homogeneous density/signal intensity, with or without mature adipose (steatosis), having tortuous vascular in the centre or at the peripheral, it may prompt diagnosis.
Liver neoplasms; Perivascular epithelioid cell tumor; Tomography, spiral computed; Magnetic resonance imaging
10.3969/j.issn.1005-5185.2016.09.008
陈志晔
Department of Radiology, Chinese PLA General Hospital, Beijing100853, China
Address Correspondence to: CHEN Zhiye E-mail: yyqf@hotmail.com
R445;R735.7
2016-02-07
修回日期: 2016-04-03
中国医学影像学杂志
2016年 第24卷 第9期:669-673
Chinese Journal of Medical Imaging 2016 Volume 24 (9): 669-673
