MRI T1rho值在诊断大鼠肝纤维化分期中的应用
2016-11-29SHIDa李师思LIShisi李静宇LIJingyu梅颖洁MEIYingjie阎超群YANChaoqun李欣明LIXinming全显跃QUANXianyue
史 达 SHI Da李师思 LI Shisi李静宇 LI Jingyu梅颖洁 MEI Yingjie阎超群 YAN Chaoqun李欣明 LI Xinming全显跃 QUAN Xianyue
MRI T1rho值在诊断大鼠肝纤维化分期中的应用
史达1SHI Da李师思1LI Shisi李静宇2LI Jingyu梅颖洁3MEI Yingjie阎超群1YAN Chaoqun李欣明1LI Xinming全显跃1QUAN Xianyue
作者单位
1. 南方医科大学珠江医院影像中心广东广州510282 2. 南方医科大学珠江医院病理科广东广州510282 3. 飞利浦医疗保健事业部广东广州510055
目的 既往研究发现MRI T1rho值随大鼠肝纤维化的进展而升高,本研究探讨MRI T1rho值在诊断大鼠肝纤维化分期中的应用价值,为临床无创观察肝纤维化发展提供新思路。材料与方法 将65只健康SD大鼠随机分为模型组50只及空白组15只,通过皮下注射50% CCl4橄榄油溶剂建立大鼠肝纤维化模型。MRI扫描后对大鼠肝脏行肝纤维化病理分期,比较各肝纤维化分期间T1rho值的差异,评价T1rho值对大鼠肝纤维化分期的诊断效能,分析T1rho值与大鼠肝纤维化分期、胶原面积比(CPA)、细胞脂肪变性程度及炎症评分的相关性。结果 S0~S4期大鼠分别有15只、11只、12只、10只、10只,S0~S4期大鼠肝脏T1rho值分别为(41.234±1.833)ms、(47.981±4.213)ms、(50.516±4.204)ms、(54.772±4.468)ms、(58.119±2.892)ms,各期T1rho值差异有统计学意义(P<0.01)。T1rho值鉴别S0期和S1~S4期、S0~S1期和S2~S4期、S0~S2期和S3~S4期、S0~S3和S4期的AUC值分别为0.989、0.925、0.932、0.923。T1rho值与肝纤维化分期、CPA值及炎症评分呈正相关(r=0.712、0.562、0.388,P<0.05、P<0.01),T1rho值与细胞脂肪变性程度无明显相关性(r=0.226,P>0.05)。结论 MRI T1rho值在诊断大鼠肝纤维化分期中具有较高的应用价值。
肝硬化;磁共振成像;病理学;疾病模型,动物;大鼠,Sprague-Dawley
肝纤维化是肝组织对各种病因所致急慢性肝损伤的修复反应,随着肝纤维化的发展,肝功能逐步减退,最终将演变为肝硬化甚至肝癌。目前已有研究证实肝纤维化甚至早期肝硬化具有可逆转性[1-2],肝纤维化的早期、精准诊治对改善病程发展及提高患者的生活质量具有十分重要的意义。T1rho序列通过“频率清扫”调谐脉冲实现自旋锁定,施加振幅不同的自旋锁定脉冲后,平行于纵轴的磁距与有效磁场同步随时间衰减,这种旋转坐标系下的纵向弛豫可通过T1rho值表示[3]。T1rho值随大鼠肝纤维化的进展呈升高趋势[4],但是否T1rho值可分期诊断大鼠肝纤维化及在大鼠肝纤维化过程中影响T1rho值的因素尚需进一步探讨。本研究通过各病理分期的大鼠肝纤维化模型T1rho成像结果,评价T1rho值对大鼠肝纤维化分期的诊断效能,分析肝纤维化过程中T1rho值与肝纤维化分期、胶原含量、炎症评分及细胞脂肪变程度的相关性,初步探讨T1rho值在评估肝纤维化分期中的应用价值。
1 材料与方法
1.1实验动物 本实验于2015年5—8月在南方医科大学实验动物中心完成造模,在南方医科大学珠江医院完成MRI及病理检查。选取65只雄性SD大鼠[动物许可证编号:SCXK(粤)2011-0015],体重(200±20)g,在SPF级环境下分笼饲养,饲养温度18~20℃,湿度60%~70%,12 h∶12 h昼夜照明,实验期间自由饮食。实验期间参与研究的人员严格遵守动物实验的各项伦理。
将65只大鼠随机分为模型组50只和空白组15只。CCl4大鼠肝纤维化模型制作参考本课题组前期实验所用方法[5],适当减少注射剂量并延长造模时间,方法如下:适应性喂养1周后,模型组于大鼠背部皮下注射50% CCl4橄榄油溶液0.2 ml/100 g,每周2次,实验过程中每周注射前称重2次以适当调节剂量。
空白组15只大鼠适应1周后麻醉行MRI及病理检查。模型组于注药后第2、3、4、5、6、7、8、9、10、11周从模型组随机取出3~5只大鼠麻醉后依次行MRI及病理检查。
1.2仪器与方法 采用Philips Archieve 3.0T TX MR扫描仪,接收线圈为动物线圈。大鼠采用3%戊巴比妥0.2 ml/100 g腹腔注射麻醉后扫描,头先进、俯卧位,扫描前在大鼠腹部加垫海绵以限制活动。常规扫描序列采用快速自旋回波序列,扫描范围覆盖全肝,扫描参数:T1WI:TR 400 ms,TE 10 ms,视野(FOV)60 mm× 60 mm,矩阵120×93;T2WI:TR 1080 ms,TE 120 ms, FOV 60 mm×60 mm,矩阵120×88;层厚均为3 mm。T1rho检查采用快速梯度回波序列,扫描参数:TR 4.9 ms,TE 2.4 ms,FOV 60 mm×60 mm,翻转角40°,矩阵100×100,层厚2 mm,自旋锁定频率500 Hz,自旋锁定时间分别为0、10、20、40、60 ms,每一自旋锁定时间采集5帧图像,像素0.54 mm×0.54 mm。采用Image J软件测量T1rho值,取大鼠肝脏5个较大层面,每个层面随机选取5个感兴趣区(ROI),左、右肝均需测量,每个ROI的平均范围为3~4 mm2,肝实质内共取25个ROI,取其平均值为该大鼠肝脏对应T1rho值。测值时尽量避开肝脏边缘、明显的肝血管及伪影区域,因该区域的T1rho值有一定的偏差[4,6]。
1.3肝脏组织病理学检查 扫描结束后采用过量麻醉方法处死大鼠,取出大鼠肝组织行甲醛溶液固定、石蜡包埋及连续切片,然后行HE及Masson三色染色。由2名病理医师采用盲法于显微镜下进行肝纤维化分期,意见不一致时讨论得出结论。
1.4肝纤维化分期标准 按照METAVIR分级标准[7]:S0期,无纤维化;S1期,汇管区及其周围纤维化和局限窦周纤维化;S2期,纤维间隔形成,但小叶结构大部仍保留;S3期,大量纤维间隔,分隔并破坏肝小叶,未达肝硬化;S4期,肝硬化。
1.5观察指标 ①采用Knodell评分系统[8]对肝组织炎症进行评分。②细胞脂肪变性的评估方法[9]:轻度,小叶内肝细胞脂肪变性占5%~33%;中度,小叶内肝细胞脂肪变性占34%~66%;重度,小叶内肝细胞脂肪变性>66%。③胶原面积比(collagen proportionate area,CPA)测定:采用Image-Pro plus 6.0软件进行所采集图片CPA的测定[10]。所有图片均由同一名病理科主治医师采用盲法在相同的设定条件下测定:物镜放大倍数为10倍,光源强度均调整为同一水平,随机采集5个不相重叠的较典型视野,采集过程中尽量避开大血管以减少过度评估,取5个视野内的CPA平均值作为该样本的CPA值。
1.6统计学方法 采用SPSS 20.0软件,以肝脏病理结果为诊断标准,采用单因素方差分析比较肝纤维化各期T1rho值的差异,利用受试者工作特征(ROC)曲线分析T1rho值对肝纤维化各期的诊断效能,应用Youden指数得出T1rho值对大鼠肝纤维化各期的诊断敏感度、特异度及截断值。大鼠肝纤维化分期、细胞脂肪变性程度与T1rho值的相关性采用Spearman相关分析,CPA值及炎症评分与T1rho值的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1大鼠分期结果 空白组15只大鼠均完成实验,即S0期15只;模型组7只大鼠在实验过程中死亡;43只完成实验,肝纤维化分期:S1期11只,S2期12只,S3期10只,S4期10只;33只出现肝纤维化,10只出现肝硬化。各期病理图片及对应T1rho伪彩图见图1。

图1 各期大鼠肝脏病理图片及T1rho伪彩图。A、C、E、G、I分别为S0~S4期大鼠肝组织病理图片(Masson染色,×400),A为正常大鼠肝脏组织;C、E、G、I中可见S1~S4期大鼠肝脏组织出现蓝染的胶原纤维伴细胞水肿及脂肪变;B、D、F、H、J分别为S0~S4期大鼠对应的T1rho伪彩图,T1rho值分别为40.304 ms、44.897 ms、47.716 ms、52.486 ms、59.458 ms(箭示肝内脉管,箭头示胃泡)
2.2大鼠肝纤维化各期T1rho值 大鼠肝纤维化S0~S4期的T1rho值见表1,T1rho值与大鼠肝纤维化分期呈正相关(r=0.712,P<0.01)。单因素方差分析结果显示,各期T1rho值差异有统计学意义(F=45.73,P<0.01);两两比较结果显示,除S1期及S2期T1rho值差异无统计学意义(P>0.05)外,其他各期间T1rho值差异均有统计学意义(P<0.05),见表1。
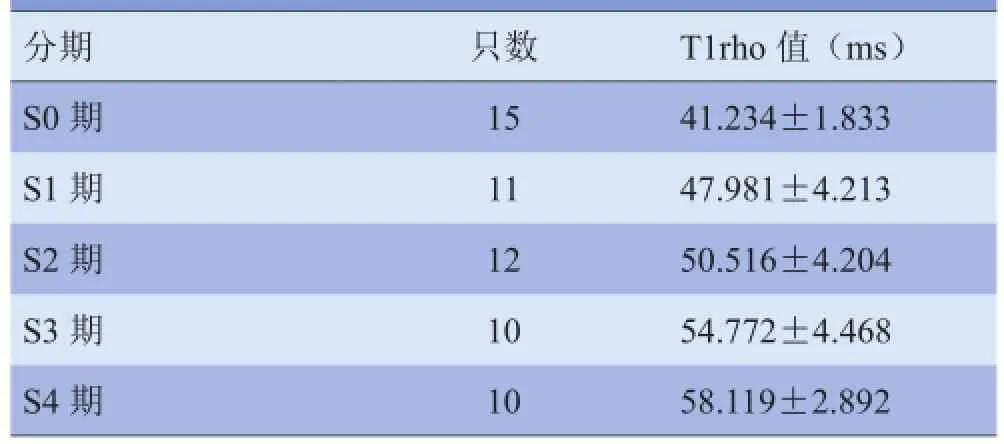
表1 大鼠肝纤维化各期T1rho值比较
2.3T1rho值区分大鼠肝纤维化各期的诊断效能T1rho值区分大鼠肝纤维化各期的曲线下面积、对应的敏感度、特异度及其最佳截点见表2。
2.4T1rho值与组织病理学指标的相关性 T1rho值与CPA值及肝细胞炎症评分均呈正相关(r=0.562、0.388,P<0.01、P<0.05);T1rho值与细胞脂肪变程度无明显相关性(r=0.226,P>0.05),细胞脂肪变性程度在S1~S3期呈增高趋势,S2~S3期为著,S4期程度减低。
3 讨论
目前,肝穿刺病理学活检是诊断肝纤维化的“金标准”,但其为有创性的检查[11],同时存在抽样误差,不适用于长期动态观察病情进展。目前无创性影像学检查在肝纤维化的诊断过程中并未达到满意的诊断效果,而血清学检查对肝纤维化的分期诊断也存在一定的困难[12-13]。缺乏可靠的无创性检查方法已成为临床上进行抗肝纤维化药物研究的阻碍。

表2 T1rho值诊断大鼠肝纤维化各期AUC、对应截断值、敏感度及特异度
MRI T1rho弛豫主要反映水分子与周围大分子之间相互作用引起的弛豫,其对分子低频运动及静止过程敏感,适用于研究组织中大分子组成及质子交换[4,14-15],在国内外已广泛应用于膝关节及椎间盘退变的研究[16-19]。在肝纤维化的发展过程中,多种因素共同作用于肝星状细胞造成大量细胞外基质沉积,主要为胶原及蛋白多糖等[20]。而T1rho弛豫对于水和大分子之间的质子交换有较高的敏感性,故使T1rho检查探查肝纤维化过程中细胞外大分子变化成为可能。
Zhao等[21]及Takayama等[22]的研究表明,3.0T MRI T1rho序列应用于肝脏呈现良好的可重复性,且不同测量者间得到的结果差异较小。同时在Zhao等[21]的研究中发现注射CCl4后大鼠肝纤维化随给药天数进展T1rho值增高。本研究结果发现,大鼠肝脏T1rho值与肝纤维化分期呈高度正相关(r=0.712,P<0.01),且T1rho值在大鼠肝纤维化各期间及两两比较中,除S1、S2期间差异无统计学意义(P>0.05)外,其他各期两两比较差异均有统计学意义(P<0.05)。此外,在区分大鼠肝纤维化各期时,T1rho值均具有较高的诊断效能,相应的敏感度及特异度可达到临床应用标准,表明T1rho值在分期诊断大鼠肝纤维化的应用中具有较大潜力,特别是区分正常大鼠和早期肝纤维化大鼠的过程中表现突出。
本研究中,尽管T1rho值在诊断大鼠肝纤维化分期时具有较好的诊断效能、敏感度及特异度,但此过程中引起T1rho值变化的机制尚未完全阐明。肝纤维化过程中,胶原成分在细胞外大量沉积,且常伴随肝细胞炎症及脂肪变性,本研究发现,T1rho值与CPA值及肝细胞炎症评分均呈正相关(r=0.562、0.388,P<0.01、P<0.05),而与细胞脂肪变程度无明显相关性(r=0.226,P>0.05),表明在大鼠肝纤维化发展过程中,胶原含量升高对T1rho值升高有明显影响,坏死性炎症的进展同样对其有一定的影响,而肝细胞脂肪变性对T1rho值无明显影响。在应用T1rho技术诊断关节退变的过程中,T1rho值升高与关节软骨内蛋白多糖减少有明显相关性[23-24],肝纤维化过程中蛋白多糖也是细胞外基质的主要沉积成分,而尚无学者在利用T1rho探索其在肝纤维化诊断的研究中得出T1rho值与蛋白多糖的沉积是否具有相关性的结论。本研究仅对大鼠肝纤维化过程中可能影响T1rho值的因素进行了初步探讨,在大鼠肝纤维化过程中,T1rho值升高可能由生物、生化及物理等各方面因素共同造成,故需更完善的模型来探讨肝纤维化过程中T1rho值升高的具体机制[25],以便为临床应用提供坚实的理论基础。此外,是否MRI T1rho技术在肝纤维化的诊断中较扩散加权成像、磁共振弹性成像、磁敏感加权成像、CT灌注等其他影像学方法更有优势,或结合血清学检查等其他无创性检查是否能提供更为精准的量化诊断指标尚需进一步探讨。
本研究的局限性:①动物模型肝纤维化的发展过程与人类肝纤维化过程的病理变化存在一定的差异,本研究仅通过CCl4溶剂进行大鼠肝纤维化造模,不能完全反映多种病因下人类肝纤维化发展的病理改变;②本研究未能完全揭示在肝纤维化进展过程中T1rho值升高的机制;③本研究样本量较小,需增加样本量进一步探讨。
MRI T1rho值与大鼠肝纤维化病理分期有高度相关性,且在分期诊断大鼠肝纤维化方面具有较高的诊断效能,作为一项无创性影像检查技术,T1rho值在诊断大鼠肝纤维化分期中具有较高的应用价值。然而在大鼠肝纤维化过程中,引起T1rho值升高的具体机制有待进一步探讨。
[1] Pellicoro A, Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Fibrogenesis Tissue Repair, 2012, 5(Suppl 1): S26.
[2] Schuppan D, Afdhal NH. Liver cirrhosis. Lancet, 2008,371(9615): 838-851.
[3] Santyr GE, Henkelman RM, Bronskill MJ. Spin locking for magnetic resonance imaging with application to human breast. Magn Reson Med, 1989, 12(1): 25-37.
[4] Wang YX, Yuan J, Chu ES, et al. T1 rho MR imaging is sensitive to evaluate liver fibrosis: an experimental study in a rat biliary duct ligation model. Radiology, 2011, 259(3): 712-719.
[5] Hu G, Chan Q, Quan X, et al. Intravoxel incoherent motion MRI evaluation for the staging of liver fibrosis in a rat model. J Magn Reson Imaging, 2015, 42(2): 331-339.
[6] Deng M, Zhao F, Yuan J, et al. Liver T1ρ MRI measurement in healthy human subjects at 3 T: a preliminary study with a two-dimensional fast-field echo sequence. Br J Radiol, 2012,85(1017): e590-e595.
[7] Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology, 1996, 24(2): 289-293.
[8] Knodell RG, Ishak KG, Black WC, et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology, 1981, 1(5): 431-435.
[9] Kleiner DE, Brunt EM, Van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology, 2005, 41(6): 1313-1321.
[10] Ding H, Ma JJ, Wang WP, et al. Assessment of liver fibrosis: the relationship between point shear wave elastography and quantitative histological analysis. J Gastroenterol Hepatol,2015, 30(3): 553-558.
[11] Thampanitchawong P, Piratvisuth T. Liver biopsy: complications and risk factors. World J Gastroenterol, 1999, 5(4): 301-304.
[12] Costelloe SJ, Theocharidou E, Tsochatzis E, et al. Hepascore and hyaluronic acid as markers of fibrosis in liver disease of mixed aetiology. Eur J Gastroenterol Hepatol, 2015, 27(3): 313-320.
[13] Gümüşay O, Ozenirler S, Atak A, et al. Diagnostic potential of serum direct markers and non-invasive fibrosis models in patients with chronic hepatitis B. Hepatol Res, 2013, 43(3): 228-237.
[14] Akella SV, Regatte RR, Gougoutas AJ, et al. Proteoglycaninduced changes in T1rho-relaxation of articular cartilage at 4T. Magn Reson Med, 2001, 46(3): 419-423.
[15] Szyperski T, Luginbühl P, Otting G, et al. Protein dynamics studied by rotating frame 15N spin relaxation times. J Biomol NMR, 1993, 3(2): 151-164.
[16] Wang L, Vieira RL, Rybak LD, et al. Relationship between knee alignment and T1ρ values of articular cartilage and menisci in patients with knee osteoarthritis. Eur J Radiol, 2013,82(11): 1946-1952.
[17] Mulligan KR, Ferland CE, Gawri R, et al. Axial T1ρ MRI as a diagnostic imaging modality to quantify proteoglycan concentration in degenerative disc disease. Eur Spine J, 2015,24(11): 2395-2401.
[18] 王伟, 梁文, 陈玲, 等. 磁共振T1ρ技术定量检测椎间盘早期退变的初步研究. 中国医学影像学杂志, 2013, 21(6): 406-410.
[19] Wong CS, Yan CH, Gong NJ, et al. Imaging biomarker with T1ρ and T2 mappings in osteoarthritis - in vivo human articular cartilage study. Eur J Radiol, 2013, 82(4): 647-650.
[20] Rauscher I, Eiber M, Ganter C, et al. Evaluation of T1ρ as a potential MR biomarker for liver cirrhosis: comparison of healthy control subjects and patients with liver cirrhosis. Eur J Radiol, 2014, 83(6): 900-904.
[21] Zhao F, Wang YX, Yuan J, et al. MR T1ρ as an imaging biomarker for monitoring liver injury progression and regression: an experimental study in rats with carbon tetrachloride intoxication. Eur Radiol, 2012, 22(8): 1709-1716.
[22] Takayama Y, Nishie A, Asayama Y, et al. T1 ρ Relaxation of the liver: a potential biomarker of liver function. J Magn Reson Imaging, 2015, 42(1): 188-195.
[23] Duvvuri U, Reddy R, Patel SD, et al. T1rho-relaxation in articular cartilage: effects of enzymatic degradation. Magn Reson Med, 1997, 38(6): 863-867.
[24] Nishioka H, Hirose J, Nakamura E, et al. T1ρ and T2 mapping reveal the in vivo extracellular matrix of articular cartilage. J Magn Reson Imaging, 2012, 35(1): 147-155.
[25] Sirlin CB. Science to practice: can T1rho imaging be used to diagnose and assess the severity of hepatic fibrosis? Radiology,2011, 259(3): 619-620.
(本文编辑张春辉)
MRI T1rho Value in the Staging of Liver Fibrosis in Rats
Purpose Previous studies found MRI T1rho values increased with the progression of liver fibrosis in rats. This study assesses the significance of MRI T1rho values in staging liver fibrosis to provide a new approach to noninvasively observing the progression of liver fibrosis in clinical practice. Materials and Methods Sixty-five healthy rats were randomly divided into experimental group (n=50) and control group (n=15). Liver fibrosis model was established by subcutaneous injection of 50% CCl4 and olive oil. Rats in the experimental group and blank group were sacrificed after MR scan, and the liver tissue was sampled for pathological test and liver fibrosis staging. Statistical analysis was performed to evaluate the difference among each stages and the diagnostic efficacy of T1rho values in liver fibrosis staging, and to determine the correlation between T1rho values and histopathologic data. Results There were 15, 11, 12, 10 and 10 rats in stage 0 to stage 4, respectively. The mean T1rho values were (41.234±1.833) ms, (47.981±4.213) ms,(50.516±4.204) ms, (54.772±4.468) ms and (58.119±2.892) ms, respectively. T1rho values were significantly different among each stages (P<0.01). Area under ROC curve of T1rho values for differentiating liver fibrosis S0 and S1-4, S0-1 and S2-4, S0-2 and S3-4,S0-3 and S4 were 0.989, 0.925, 0.932 and 0.923, respectively. T1rho values was positively correlated with fibrosis staging, CPA values and necroinflammation scoring (r=0.712, 0.562 and 0.388, P<0.05 and P<0.01). The level of cell fatty degeneration was not significantly correlated with T1rho values (r=0.226, P>0.05). Conclusion T1rho value is a valuable parameter for staging liver fibrosis in rats.
Liver cirrhosis; Magnetic resonance imaging; Pathology; Disease models,animal; Rats, sprague-dawley
10.3969/j.issn.1005-5185.2016.09.002
全显跃
Department of Imaging Center, Zhujiang Hospital, Southern Medical University,Guangzhou510282, China
Address Correspondence to: QUAN Xianyue E-mail: quanxianyue@163.com
广东省自然科学基金项目(2015A030313269)。
R-33;R445.2
2016-03-15
修回日期: 2016-05-04
中国医学影像学杂志
2016年 第24卷 第9期:645-649
Chinese Journal of Medical Imaging 2016 Volume 24 (9): 645-649
