甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响
2016-11-28王艳芳付风云李家家吴萌萌张桂娟陈学森毛志泉
王艳芳,付风云,李家家,王 森,战 将,吴萌萌,张桂娟,沈 向,陈学森,毛志泉,*
1 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室, 泰安 271018 2 山东农业大学化学与材料科学学院, 泰安 271018 3 山东青云街道办事处林业站, 新泰 271000
甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响
王艳芳1,2,付风云1,李家家1,王 森1,战 将2,吴萌萌2,张桂娟3,沈 向1,陈学森1,毛志泉1,*
1 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室, 泰安 271018 2 山东农业大学化学与材料科学学院, 泰安 271018 3 山东青云街道办事处林业站, 新泰 271000
研究在苹果连作土壤中添加甲壳素对苹果幼苗生长、土壤酶及土壤真菌群落结构的影响,探讨甲壳素缓解苹果连作障碍的可能性,为防控苹果连作障碍提供依据。盆栽条件下,以平邑甜茶幼苗为试材,在苹果连作土壤中分别添加0,0.5,1.0和2.5 g/kg的甲壳素,测定了连作土壤中添加不同量的甲壳素后,幼苗生物量、根系保护酶活性、土壤主要酶(蔗糖酶、脲酶、磷酸酶等)活性以及土壤中真菌群落结构的变化。9月份结果表明,与对照相比,1.0 g/kg的甲壳素处理连作土,可显著提高平邑甜茶幼苗株高和干鲜重,分别比对照增加了36.8%、82.1%和100.8%;甲壳素处理能增加幼苗根系保护酶活性,其中1.0 g/kg甲壳素处理SOD、POD和CAT活性最高,其次为0.5 g/kg,而2.5 g/kg甲壳素处理显著抑制了幼苗根系保护酶活性。1.0 g/kg甲壳素处理可提高土壤中细菌/真菌值,并且提高了土壤中蔗糖酶、脲酶、蛋白酶、磷酸酶、过氧化氢酶和多酚氧化酶活性,分别比对照提高了8.6%、40.5%、81.1%、15.3%、18.7%和49.8%,2.5 g/kg甲壳素处理则降低土壤酶活性或者使土壤酶活性与对照相当。根据T-RFLP的图谱中OUT的数量、种类及丰度,分别计算了不同处理土壤的真菌多样性,发现1.0 g/kg甲壳素处理的连作土具有最高的多样性、均匀度和丰富度指数,分别比对照增加了52.2%、8.0%和87.1%。主成分分析(PCA)结果显示,不同剂量甲壳素处理的连作土壤中真菌被PC2分成了两部分,其中0.5 g/kg和1.0 g/kg的甲壳素添加量分布在PC2的负方向上,而CK和2.5 g/kg的甲壳素处理分布在PC2的正方向上,这说明添加不同量的甲壳素对连作土壤真菌群落多样性有显著影响,添加量太多或者太少均会造成土壤真菌多样性下降,只有适量的甲壳素可提高真菌群落结构多样性。实验结果表明1.0 g/kg的甲壳素可提高连作平邑甜茶幼苗生物量,改善连作土壤环境,有效缓解平邑甜茶的连作障碍。
连作障碍;平邑甜茶;甲壳素;土壤酶活;真菌群落结构
连作障碍是指同一作物或近缘作物连作以后,即使在正常管理的情况下,也会产生产量降低、品质变劣、生长发育状况变差的现象。苹果连作障碍表现为植株矮小、叶片变小、生长衰弱、根系分生能力差且抗性差、果实品质低劣,而且再植成活率低[1]。尽管连作障碍的产生的原因复杂多样,但土壤中的微生物群落结构失衡,尤其是土壤中真菌群落结构的变化是引起连作障碍的主要原因[2]。在苹果连作土壤中不断分离出腐霉菌 (Pythium)、镰刀菌(Fusarium)、柱孢菌(Cylindrocarponspp.)以及少量丝核菌 (Rhizoctoniaspp.) 等有害真菌[3];大蒜长期连作后,土壤中的真菌成上升趋势,根际土壤微生物结构失调,连作障碍明显[4];刘星等[5]研究认为根际土壤真菌群落组成结构的改变,特别是与土传病害有关的致病菌滋生可能是导致马铃薯连作障碍的重要原因。因此,土壤真菌群落结构变化的研究,对于进一步了解和预防苹果连作障碍具有重要意义。
土壤化学消毒法是缓解连作障碍的有效措施之一,但是随着现代社会的发展,人们对绿色无公害食品的需求,探寻其他无污染、可缓解防控连作障碍的措施是生产者亟需解决的问题。研究表明土壤添加剂可以改善土壤结构,促进作物生长,提高农作物的品质与产量,如连作土壤中添加外源物质如NO、有机物料、芥菜籽粉、壳质粗粉、绿肥、饼肥、堆肥和粪肥等有利于提高土壤养分,降低土壤中有害物质,提高土壤质量,缓解连作障碍[6]。张国斌等[7]研究发现外源 NO 和 ABA 可提高自毒作用下辣椒抗氧化酶活性,有效地阻止辣椒体内 MDA 积累,缓解自毒作用对辣椒幼苗的伤害,增强辣椒的抗逆性。连作果园连续两年施用芥菜籽粉后,苹果根际具有独特的细菌和真菌群落,其中包括一部分对病原真菌有抑制作用的微生物,因此可缓解连作障碍[8]。孙海兵等[9]研究发现,春季发酵60 d、夏季和秋季发酵45 d的有机物料发酵流体,对促进连作苹果幼树株高、地茎、鲜重及干重增加的影响最大,缓解苹果连作障碍的效果最好。袁玉娟等[10]以拮抗菌枯草芽孢杆菌SQR9和哈茨木霉T37制成的生物有机肥可有效防治连作条件下黄瓜枯萎病。甲壳素及其水解产物壳聚糖可有效促进植物的生长,提高作物的产量,并且可以改善土壤的结构,因此也可作为土壤添加剂[11]。壳聚糖可提高茶树叶片中保护酶活性,对提高茶树抗逆能力具有潜在的调节作用[12]。甲壳素可提高苹果幼苗的抗旱性[13]。关于甲壳素缓解逆境胁迫方面已有较多报道,但是甲壳素对连作条件下平邑甜茶幼苗生长的影响,以及对连作土壤酶和土壤真菌群落结构的影响未见报道,缺乏对其施用效果和作用机制的研究和探讨。本实验以60a果园连作土为研究对象,通过添加不同量的甲壳素,测定苹果幼苗植株生物量、主要土壤酶活性,结合土壤真菌多样性、丰富度以及群落结构的变化,分析甲壳素对苹果连作土壤的改良效果,以期为有效减轻苹果连作障碍提供科学依据。
1 材料与方法
1.1 试验材料

1.2 试验处理
幼苗移栽缓苗一周后,用甲壳素处理。甲壳素浓度参照崔健和刘怀锋[13]的试验结果及本试验预试结果设定。试验共设4个处理,各处理的甲壳素在连作土中的用量分别为:0,0.5、1.0、2.5 g/kg。每处理30盆,每盆2株幼苗,随机排列,正常肥水管理。分别于7、8、9月份取样测定植株生物量;9月份测定植株生物量的同时,对根系保护酶活性、MDA含量,以及相应的土壤环境进行测定。土壤样品研磨过2mm筛,分3部分保存,一部分装入无菌封口袋,放入实验室4℃冰箱保存,用于测定土壤微生物数量;另一部分风干,用于土壤酶活的测定;第三部分带回实验室-20 ℃冰箱保存,用于提取DNA,分析土壤中微生物多样性。
1.3 试验方法
根系抗氧化酶SOD、POD、CAT活性按照Wang[14]等试验方法测定,MDA含量按照赵世杰[15]方法测定。
土壤酶活采用关松荫[16]的方法测定。
土壤细菌、真菌、放线菌均用平板涂抹法测定[17],测定前计算水分系数。细菌采用牛肉膏蛋白胨培养基,真菌采用马丁氏培养基,放线菌采用高氏一号培养基。
1.4 土壤总DNA提取及T-RFLP分析
取0.5 g不同处理的样品土壤,按照E.Z.N.A.TM土壤DNA提取试剂盒 (Omega Bio-tek Omc. USA)说明书操作,提取样品DNA,每个样品重复3次。然后用真菌ITS区通用片段引物(ITS1-F和ITS4)[18]进行扩增,反应体系为:25 μL 2×Taq Master Mix,3 μL DNA模板,ITS1-F和ITS4 (10 μmol/L)各3 μL,加ddH2O至50 μL。PCR反应条件为94 ℃预变性3 min;94 ℃变性1 min,51 ℃退火1 min,72 ℃延伸1 min,共34个循环;最后72 ℃延伸10 mim。取5 μL ITS-PCR扩增产物经1.5% (g/mL)琼脂糖凝胶电泳检测,然后用EasyPure PCR纯化试剂盒(北京全式金生物技术有限公司)纯化。将纯化产物用限制性内切酶FastDigest HhaⅠ(Thermo Scientific, USA)进行酶切。酶切反应体系为10 μL ITS-PCR纯化产物,2 μL HhaⅠ(10 U/L),2 μL 10×Buffer,加ddH2O至30 μL。反应体系于37 ℃保温孵育15 min,将酶切产物送至上海生工生物技术有限公司进行测序,扫描结果采用 Peak Scanner 1.0 软件输出。
1.5 统计分析
通过SPSS 19.0进行方差分析,采用 Duncan′s 新复极差法进行差异显著性检测,用Origin 8.5完成对试验数据的制图。
选择介于50 bp和500 bp间的T-RFS,仅采用峰面积比重>1%的 T-RFs 进行分析。每个 T-RF视为1个 OTU(Operational Taxonomic Unit),以相对峰面积作为对应 OTU 的丰度。BIO-DAP程序(http://nhsbig.inhs.uiuc.edu/wes/populations.html)计算 Shannon-Wiener 指数、Simpson 指数、Pielou 指数和 Margalef 指数,分别对应真菌群落的多样性、优势度、均匀度和丰富度[19-20]。使用SPSS 19.0软件进行主成分分析。
2 结果
2.1 甲壳素对幼苗生物量的影响
由表1可以看出,7、8、9三月份甲壳素对平邑甜茶幼苗的影响趋势相同,因此分析9月份的影响。与对照相比,1.0 g/kg的甲壳素添加量可显著平邑甜茶幼苗株高和干鲜重,分别比对照增加了36.8%、82.1%和100.8%。添加0.5 g/kg的甲壳素也能使幼苗的株高、干鲜重增加,但促进不明显。而添加2.5 g/kg的甲壳素后,却明显抑制了连作条件下幼苗生长。

表1 甲壳素对平邑甜茶幼苗生物量影响
表中不同小写字母表示不同处理简的差异(P<0.05)
2.2 甲壳素对幼苗根系保护酶SOD、POD、CAT活性和MDA含量的影响
由图1可以看出,不同添加量的甲壳素处理后,平邑甜茶幼苗根系SOD活性大小不一,其中以1.0 g/kg甲壳素处理SOD活性最高,其次为0.5 g/kg和对照,2.5 g/kg甲壳素处理显著抑制了幼苗根系SOD活性,POD和CAT活性变化与SOD变化趋势一致,均是1.0 g/kg甲壳素处理使得根系抗氧化酶活性最高,SOD、POD和CAT活性分别为对照的2.1、1.7、1.8倍。
与对照相比,0.5 g/kg和1.0 g/kg甲壳素处理可显著降低根系MDA的含量,分别为对照的58.3%和43.8%,而2.5 g/kg甲壳素处理使得根系MDA含量显著增加。

图1 甲壳素对平邑甜茶幼苗根系保护酶活性和MDA的影响Fig.1 Effects of chitin on the antioxidant enzyme activities and the MDA content in root of Malus hupehensis Rehd. seedling表中不同小写字母表示不同处理简的差异(P<0.05)
2.3 甲壳素对土壤酶活性的影响
由表2可以看出,添加0.5 g/kg和1.0 g/kg的甲壳素添加量均可增加各种土壤酶活性,蔗糖酶、脲酶、蛋白酶、磷酸酶、过氧化氢酶和多酚氧化酶活性分别比对照提高了7%、30.8%、14.9%、12.5%、17.6、26.8和8.6%、40.5%、81.1%、15.3%、18.7%、49.8%,2.5 g/kg甲壳素处理则降低土壤酶活性或者使土壤酶活性与对照相当。甲壳素处理后蔗糖酶、多酚氧化酶活性随甲壳素添加量的改变而显著变化,但蛋白酶、磷酸酶、过氧化氢酶活性除1.0 g/kg处理显著增加外,其他处理变化不明显。
2.4 甲壳素对土壤微生物数量的影响
由表3可以看出,连作土壤中加入0.5 g/kg和1.0 g/kg甲壳素后,均使土壤中真菌数量明显减少而细菌数量显著增加,但是对放线菌影响规律不明显。2.5 g/kg的甲壳素添加量,增加了真菌、细菌数量,减少了放线菌数量。细菌/真菌比值以1.0 g/kg处理最高,为476.8;其次是0.5 g/kg处理为247.0,对照为168.4;最后是2.5 g/kg甲壳素处理,为144.1。
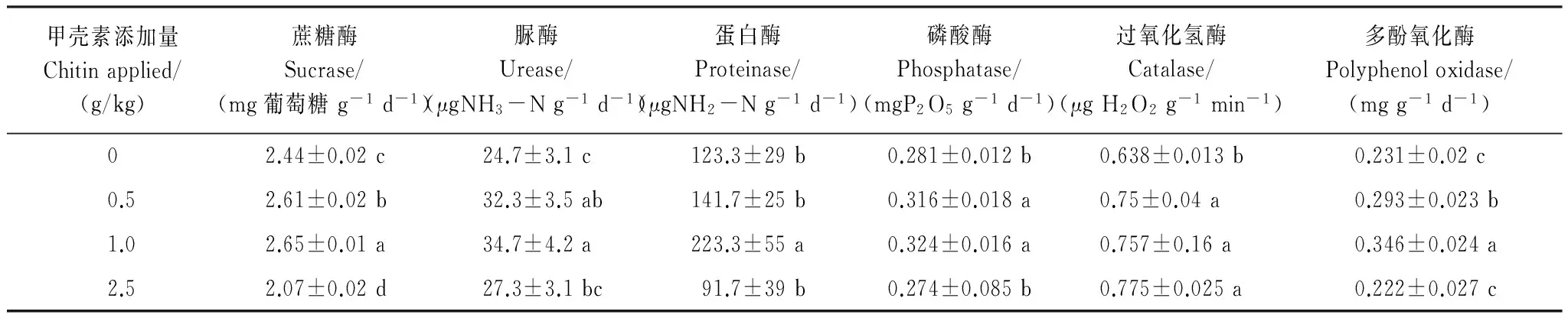
表2 甲壳素对土壤酶活性的影响

表3 甲壳素对微生物数量的影响
2.5 T-RFLP图土壤真菌多样性分析
根据T-RFLP的图谱中OUT的数量、种类及丰度,分别计算了不同处理土壤的真菌多样性指数(表4)。1.0 g/kg甲壳素处理的连作土具有最高的多样性、均匀度和丰富度指数,分别比对照增加了52.2%、8.0%和87.1%,同时具有最低的优势度。而2.5 g/kg甲壳素处理的连作土壤中的多样性、均匀度和丰富度最低,优势度是最高的,比对照增加了68%。

表4 甲壳素对土壤真菌多样性的影响
2.6 T-RFLP图谱的主成分分析

图2 不同添加量甲壳素处理间T-RFLP图谱主成分分析Fig.2 PCA for different treatments
根据主成分分析的提取原则,被选的主成分所代表的主轴总长度占所有主轴长度之和约85%即可。本研究根据不同添加量甲壳素处理样品的T-RFs在图谱中的分布及丰度进行主成分分析(PCA),结果显示,第一主成分方差贡献率为66.36%,第二主成分方差贡献率为19.83%,两者贡献和为86.19%,可以代表整个系统状况(图2)。不同添加量的甲壳素处理的连作土壤中真菌被PC2分成了两部分,其中0.5 g/kg和1.0 g/kg的甲壳素添加量分布在PC2的负方向上,而CK和2.5 g/kg的甲壳素处理分布在PC2的正方向上,这说明不同添加量的甲壳素对连作土壤真菌群落多样性有强烈的影响,添加量太多或者太少均会造成土壤真菌多样性下降,只有适量的甲壳素可提高真菌群落结构多样性。
3 讨论
大量研究表明,壳质粗粉、植物残体、绿肥、堆肥、粪肥和生物炭等土壤添加剂有利于提高土壤养分,降低土壤中有害物质,改善土壤的微生物体系以及团粒结构,提高土壤质量,增强土壤生态系统的稳定性,降低连作土壤中农作物病害的发生,从而缓解连作障碍[6, 14, 21-22]。本研究发现当连作土壤中添加的甲壳素的量为1.0 g/kg时,可显著增加平邑甜茶幼苗株高与干鲜重,增强幼苗根系抗氧化酶SOD、POD和CAT活性,降低根系MDA含量的积累,显著提高幼苗抗性。马彦霞等[23]在辣椒叶面喷施壳聚糖,结果发现壳聚糖可提高辣椒抗氧化物质的含量,降低 MDA的积累,进而缓解水分胁迫对幼苗造成的膜脂过氧化,增强辣椒幼苗的抗旱性。甲壳素对于提高“嘎啦”苹果幼苗的光合作用有非常明显的效果,在很大程度上缓解了干旱胁迫[13]。高浓度的甲壳素(2.5 g/kg)则抑制连作条件下幼苗的生长,这可能是因为施入过量的甲壳素对幼苗根系产生了毒害作用,进而抑制了幼苗的生长发育。
土壤酶是土壤活跃的有机组分之一,是土壤中物质、能量代谢的驱动力,对土壤养分循环和污染物的净化起着重要作用[16],土壤酶来源于动物、植物、微生物及它们的分泌物,其活性受多种因素的控制,可反映土壤中各种生物化学过程的强度和方向,也是土壤肥力评价的重要指标之一。玉米长期连作土壤脲酶活性呈先上升后下降的趋势[24];大豆重茬使土壤脲酶和转化酶活性均显著降低[25],陈慧等研究发现地黄连作土壤中过氧化氢酶活性降低[26];连作土壤中,过氧化氢酶、脲酶、蔗糖酶和中性磷酸酶活性降低,可能是连作使土壤环境恶化表现之一,而浇灌3%浓度的有机物料发酵液可提高苹果连作土壤酶活性[27]。本研究结果发现,连作土壤中添加1.0 g/kg甲壳素可提高土壤中蔗糖酶、脲酶、蛋白酶、磷酸酶、过氧化氢酶和多酚氧化酶活性,2.5 g/kg的甲壳素仅仅提高了过氧化氢酶活性,对其他酶活影响不明显,这可能是因为适量甲壳素可改变土壤细菌群落结构[28],而其脱N-乙酰基后产物的壳聚糖对多种植物病原菌均显示出良好的抑菌性能[29],因此甲壳素和壳聚糖可改变土壤中微生物群落结构,使主要由土壤微生物产生的土壤酶数量和活性增加,改善了土壤酶系统,推测这可能是甲壳素缓解连作障碍的一个原因。
微生物是土壤生态系统中最具活力的组成部分,长期连作可导致土壤微生物群落结构失衡、增加病原菌数量而减少有益微生物,使土壤微生物从细菌主导型向真菌主导型转化,使病原菌更容易侵染植物而引发植物的各种土传病害[30]。本研究用平板涂布法结合末端限制性片段长度多态性(T-RFLP)技术研究连作苹果园土壤中微生物数量和真菌群落结构。基于T-RFLP图谱,运用多样性指数和主成分分析比较了不同处理间真菌多样性及群落结构。结果发现,添加1.0 g/kg甲壳素能增加土壤中细菌、放线菌的数量,降低土壤真菌数量,显著增加细菌/真菌值,使土壤类型由真菌型向细菌型转变。而2.5 g/kg的甲壳素却增加了土壤中真菌的数量,对细菌数量影响不大。甲壳素的添加,对连作土壤中真菌种类及丰度均产生了一定的影响,添加适量的甲壳素可提高连作土壤中真菌的多样性、均匀度和丰富度,降低其优势度,使得病原菌数量减少,整个真菌群落结构往更利于幼苗生长的方向渐变。因此,在生产应用中,连作土壤中添加适量的甲壳素可使连作土壤由真菌型向细菌型转变,而且也有利于维持土壤微生物群落结构的多样性,缓解连作障碍,提高连作条件下苹果幼苗生长发育。
适宜添加量的甲壳素(1.0 g/kg)可提高平邑甜茶幼苗根系保护酶活性,降低根系MDA的积累,提高连作土壤酶活性,增加土壤细菌和放线菌数量,增加土壤微生物多样性,缓解苹果连作障碍。
[1] Yim B, Smalla K, Winkelmann T. Evaluation of apple replant problems based on different soil disinfection treatments—links to soil microbial community structure?. Plant and Soil, 2013, 366(1): 617- 631.
[2] Tewoldemedhin Y T, Mazzola M, Botha W J, Spies C F J, McLeod A. Characterization of fungi (FusariumandRhizoctonia) and oomycetes (PhytophthoraandPythium) associated with apple orchards in South Africa. European Journal of Plant Pathology, 2011, 130(2): 215- 229.
[3] Tewoldemedhin Y T, Mazzola M, Labuschagne I, McLeod A. A multi-phasic approach reveals that apple replant disease is caused by multiple biological agents, with some agents acting synergistically. Soil Biology and Biochemistry, 2011, 43(9): 1917- 1927.
[4] 刘素慧, 刘世琦, 张自坤, 尉辉, 齐建建, 段吉锋. 大蒜连作对其根际土壤微生物和酶活性的影响. 中国农业科学, 2010, 43(5): 1000- 1006.
[5] 刘星, 邱慧珍, 王蒂, 张俊莲, 沈其荣. 甘肃省中部沿黄灌区轮作和连作马铃薯根际土壤真菌群落的结构性差异评估. 生态学报, 2015, 35(12): 3938- 3948.
[6] 樊琳, 柴如山, 刘立娟, 黄利东, 章永松. 稻草和猪粪发酵残渣配施菌剂对大棚连作土壤的改良作用. 植物营养与肥料学报, 2013, 19(2): 437- 444.
[7] 张国斌, 郁继华, 冯致, 马彦霞, 吕剑. NO和ABA对辣椒幼苗自毒作用缓解的生理生化机制. 园艺学报, 2013, 40(3): 458- 466.
[8] Mazzola M, Hewavitharana S S, Strauss S L.Brassicaseed meal soil amendments transform the rhizosphere microbiome and improve apple production through resistance to pathogen reinfestation. Phytopathology, 2014, 105(4): 460- 469.
[9] 孙海兵, 胡艳丽, 陈学森, 毛志泉. 发酵时间对有机物料发酵流体成分含量变化及对连作苹果生物量的影响. 植物营养与肥料学报, 2012, 18(6): 1469- 1477.
[10] 袁玉娟, 胡江, 凌宁, 仇美华, 沈其荣, 杨兴明. 施用不同生物有机肥对连作黄瓜枯萎病防治效果及其机理初探. 植物营养与肥料学报, 2014, 20(2): 372- 379.
[11] 蒋小姝, 莫海涛, 苏海佳, 张小勇. 甲壳素及壳聚糖在农业领域方面的应用. 中国农学通报, 2013, 29(6): 170- 174.
[12] 孙世利, 骆耀平. 壳聚糖对茶树抗性酶调节作用的研究. 浙江大学学报: 农业与生命科学版, 2009, 35(1): 84- 88.
[13] 崔健, 刘怀锋. 甲壳素对苹果幼苗抗旱生理效应的影响. 北方园艺, 2007, (11): 19- 22.
[14] Wang Y F, Pan F B, Wang G S, Zhang G D, Wang Y L, Chen X S, Mao Z Q. Effects of biochar on photosynthesis and antioxidative system ofMalushupehensisRehd. seedlings under replant conditions. Scientia Horticulturae, 2014, 175: 9- 15.
[15] 赵世杰. 植物生理学实验指导. 北京: 中国农业科技出版社, 1998.
[16] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
[17] 沈萍, 陈向东. 微生物学实验(第4版). 北京: 高等教育出版社, 2007.
[18] Högberg M N, Yarwood S A, Myrold D D. Fungal but not bacterial soil communities recover after termination of decadal nitrogen additions to boreal forest. Soil Biology and Biochemistry, 2014, 72: 35- 43.
[19] Tipayno S, Kim C -G, Sa T. T-RFLP analysis of structural changes in soil bacterial communities in response to metal and metalloid contamination and initial phytoremediation. Applied Soil Ecology, 2012, 61: 137- 146.
[20] 李志鹏, 姜娜, 刘晗璐, 崔学哲, 荆祎, 杨福合, 李光玉. 基于DGGE和T-RFLP分析采食不同粗饲料梅花鹿瘤胃细菌区系. 中国农业科学, 2014, 47(4): 759- 768.
[21] Mazzola M. Replant disease control and soil system resilience to pathogen infestation in response toBrassicaceaeseed meal amendment. Phytopathology, 2012, 102: S4-S4.
[22] Jaiswal A K, Elad Y, Graber E R, Frenkel O.Rhizoctoniasolanisuppression and plant growth promotion in cucumber as affected by biochar pyrolysis temperature, feedstock and concentration. Soil Biology and Biochemistry, 2014, 69: 110- 118.
[23] 马彦霞, 郁继华, 张国斌, 曹刚. 壳聚糖对水分胁迫下辣椒幼苗氧化损伤的保护作用. 中国农业科学, 2012, 45(10): 1964- 1971.
[24] 程红玉, 肖占文, 秦嘉海, 王瑞. 连作对玉米制种田土壤养分和土壤酶活性的影响. 土壤, 2013, 45(4): 623- 627.
[25] 谷岩, 邱强, 王振民, 陈喜凤, 吴春胜. 连作大豆根际微生物群落结构及土壤酶活性. 中国农业科学, 2012, 45(19): 3955- 3964.
[26] 陈慧, 郝慧荣, 熊君, 齐晓辉, 张重义, 林文雄. 地黄连作对根际微生物区系及土壤酶活性的影响. 应用生态学报, 2008, 18(12): 2755- 2759.
[27] 尹承苗, 陈学森, 沈向, 张兆波, 孙海兵, 毛志泉. 不同浓度有机物料发酵液对连作苹果幼树生物量及土壤环境的影响. 植物营养与肥料学报, 2013, 19(6): 1450- 1458.
[28] Hallmann J, Rodrguez-Kábana R, Kloepper J W. Chitin-mediated changes in bacterial communities of the soil, rhizosphere and within roots of cotton in relation to nematode control. Soil Biology and Biochemistry, 1999, 31(4): 551- 560.
[29] 孟玲, 王雷. 壳聚糖对多种植物病原菌的抑菌效果概述. 农药, 2009, 48(11): 781- 783.
[30] 吕毅, 宋富海, 李园园, 沈向, 陈学森, 吴树敬, 毛志泉. 轮作不同作物对苹果园连作土壤环境及平邑甜茶幼苗生理指标的影响. 中国农业科学, 2014, 47(14): 2830- 2839.
Effects of chitin on the growth ofMalushupehensisRehd. seedlings and soil environment under replant condition
WANG Yanfang1,2, FU Fengyun1, LI Jiajia1, WANG Sen1, ZHAN Jiang2, WU Mengmeng2, ZHANG Guijuan3, SHEN Xiang1, CHEN Xuesen1,MAO Zhiquan1,*
1StateKeyLaboratoryofCropBiology/CollegeofHorticulturalScienceandEngineering,ShandongAgriculturalUniversity,Taian271018,China2CollegeofChemistryandMaterialScience,ShandongAgriculturalUniversity,Taian271018,China3ForestryStationofQingyunSubdistrictOfficeinShandongProvince,Xintai271000,China
The effects of different concentrations of chitin on the activity of enzymes and fungal communities existing in replant soils were explored, for enrichment of soils to alleviate apple replant disease (ARD). In this study,MalushupehensisRehd. seedlings potted in replant soil were treated with four concentrations of chitin (0, 0.5, 1.0, and 2.5 g/kg). The growth of seedlings was monitored though plant height, fresh and dry weight, antioxidant enzyme activities, such as superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT), and lipid peroxidation in roots. Simultaneously, soil enzyme activities, soil microbial load, and fungal community structure, which was measured by terminal-restriction fragment length polymorphism (T-RFLP) profiles, were determined in soil samples subjected to the four chitin treatments. Compared with the control, seedlings treated with 1.0 g/kg chitin showed 36.8%, and 82.1% and 100.8% increase in plant height, and fresh and dry weight, respectively. The optimal dose of chitin could increase antioxidant enzyme activity in the root system of the seedlings, whereas high doses inhibited enzyme activity. The effectiveness of chitin treatment for inhibiting the activity of SOD, POD, and CAT in the root system ofM.hupehensisseedlings decreased in the following order: 1.0 g/kg > 0.5 g/kg > 0 g/kg > 2.5 g/kg. Chitin treatment at 1.0 g/kg enhanced the bacterial-fungal ratio, and resulted in a “bacteria-rich soil”; consequently, sucrase, urease, protease, phosphatase, catalase, and polyphenol oxidase activities increased by 8.6%, 40.5%, 81.1%, 15.3%, 18.7%, and 49.8%, respectively. Remarkable differences in T-RFLP profiles were observed among control, 0.5 g/kg, 1.0 g/kg, and 2.5 g/kg treatments. A significant difference in fungal community structure was observed with the application of different doses of chitin. The Shannon diversity, evenness, and richness indexes were the highest in replanted soil treated with 1.0 g/kg chitin and the least in soil treated with 2.5 g/kg chitin. Principal component analysis indicated that fungal community structure of soil treated with 1.0 g/kg chitin was considerably different from that of the control soil and soil treated with 2.5 g/kg chitin. The present study showed that low concentrations of chitin could alleviate ARD stress inM.hupehensisRehd. seedlings, whereas high concentrations could aggravate ARD stress. Collectively, these findings suggest that chitin applied to replant soil at 1.0 g/kg obviously enhanced plant height, fresh and dry weight, improved the soil environment, and effectively alleviate ARD stress inM.hupehensisRehd. seedlings, therefore, a chitin dose of 1.0 g/kg was considered optimal for replant soil.
replant disease;MalushupehensisRehd.; chitin; soil enzyme activity; fungal community
现代农业产业技术体系建设专项资金(CARS- 28);教育部长江学者和创新团队发展计划(IRT1155);泰安市科技发展计划项目(32802)
2015- 01- 27;
日期:2016- 01- 15
10.5846/stxb201501270221
*通讯作者Corresponding author.E-mail: mzhiquan@sdau.edu.cn
王艳芳,付风云,李家家,王森,战将,吴萌萌,张桂娟,沈向,陈学森,毛志泉.甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响.生态学报,2016,36(19):6218- 6225.
Wang Y F, Fu F Y, Li J J, Wang S, Zhan J, Wu M M, Zhang G J, Shen X, Chen X S,Mao Z Q.Effects of chitin on the growth ofMalushupehensisRehd. seedlings and soil environment under replant condition.Acta Ecologica Sinica,2016,36(19):6218- 6225.
