球形和花形ZnO纳米结构的可控制备及其光催化机理
2016-11-28李丽刘晓明周舒婷刘仕涛贾殿赠
李丽 刘晓明 周舒婷 刘仕涛 贾殿赠
(1新疆大学化学化工学院,乌鲁木齐830046) (2新疆大学应用化学研究所先进功能材料自治区级重点实验室,乌鲁木齐830046)
球形和花形ZnO纳米结构的可控制备及其光催化机理
李丽*,1,2刘晓明1周舒婷1刘仕涛2贾殿赠2
(1新疆大学化学化工学院,乌鲁木齐830046) (2新疆大学应用化学研究所先进功能材料自治区级重点实验室,乌鲁木齐830046)
报道了一种简单的制备球形和花形ZnO纳米结构的无模板水热法。在Zn(NO3)2·6H2O与NH3·H2O的体系中,通过改变乙二醇和水的体积比,140℃水热反应2 h分别制备出球形和花形ZnO纳米结构。采用SEM、XRD、UV-Vis DRS和PL对其进行了表征和分析,结果表明球形ZnO纳米结构的直径为500 nm~1 μm,它是由纳米颗粒自组装而成;花形ZnO纳米结构是由长度为300~700 nm,直径为100~300 nm的纳米棒组装而成。研究了乙二醇在球形和花形ZnO纳米结构形成过程中的作用并提出了可能的生长机理。室温下分别以球形和花形ZnO纳米结构为光催化剂,以偶氮染料甲基橙MO作为光催化研究对象,紫外光照2 h,对MO的降解率分别为83%和55%。以叔丁醇(t-Butanol)、乙二胺四乙酸二钠(EDTA-2Na)为自由基和空穴的捕获剂,推测其催化机理主要为空穴氧化和自由基协同氧化历程。
氧化锌;球形和花形结构;光催化;乙二醇
0 引言
众所周知,纳米材料具有不同于体材料的物理和化学性能,这些物理化学性能不仅取决于材料的尺寸而且还与其形貌有关,同时不同形貌的纳米结构也是构建纳米器件的基本模块[1]。ZnO作为一种重要的宽禁带直接带隙半导体材料,其禁带宽度为3.37 eV,激子结合能高达60 meV[2],由于其独特的光学、电子学和化学性质,在光催化、发光二极管、场发射、太阳能电池、化学与生物传感器和压电等领域具有广泛的应用前景[1,3]。近年来关于不同形貌ZnO的合成与性能研究异常活跃。目前,人们已采用各种物理、化学方法制备出多种形貌的ZnO纳米结构。例如:ZnO纳米球、纳米线、纳米棒、纳米盘、纳米管、多孔的纳米片和纳米带以及一维ZnO纳米棒、纳米带阵列等纳米结构[4,5],研究了它们的光电子[6]、场发射[7]、压电[8]、化学传感[9]和光催化特性[10-18]。在纳米材料的研究中新合成方法的发现以及不同形貌纳米结构的可控合成是极具挑战性的研究领域。
最近方等[19]以Zn(CH3COOH)2·2H2O和NaOH为原料,加入CTAB 160℃水热反应12 h制备出花形ZnO纳米结构;在葡萄糖与Zn(CH3COOH)2·2H2O体系中180℃水热反应12 h制备出C/ZnO球形颗粒,再将其加热至600℃保温1 h制备出球形ZnO纳米结构,在500 W汞灯下照射140 min后,球形和花形ZnO纳米结构对MO的降解率分别为98%和75%。杨等[4]在Zn(CH3COO)2-丁胺-四氢呋喃体系中,通过改变丁胺与Zn2+的摩尔比,140℃水热反应12 h分别制备出锥形、梯形和六角片形ZnO纳米结构,在300 W汞灯下照射180 min后,锥形、梯形和六角片形ZnO纳米结构对MO的降解常数别为0.007 1、0.009 3和0.025 6 min-1。虽然已有一些关于不同形貌ZnO纳米结构可控合成的报道,但是以上方法不是利用表面活性剂和碳球做软硬模板就是加入一些有毒溶剂,制备过程繁琐。在纳米材料的制备中寻求一种简单易行,经济安全的途径制备不同形貌ZnO纳米结构仍然具有十分重要意义。另外,有关球形和花形ZnO纳米结构的光催化机理研究至今未见报道。
本文报道了一种条件更为温和、简单的制备球形和花形ZnO纳米结构的无模板水热法。即在Zn(NO3)2·6H2O-NH3·H2O体系中,通过改变乙二醇和水的体积比140℃水热反应2 h分别制备出球形和花形ZnO纳米结构。采用SEM、XRD、UV-Vis DRS和PL对其进行了表征和分析,研究了乙二醇在球形和花形ZnO纳米结构形成过程中的作用并提出了可能的生长机理。以偶氮染料甲基橙MO作为光催化研究对象,研究了球形和花形ZnO纳米结构的光催化降解能力,以叔丁醇(t-Butanol)、EDTA-2Na为自由基和空穴的捕获剂,推测了其紫外光催化机理。
1 实验部分
1.1球形和花形ZnO纳米结构的制备
将0.5 mmol Zn(NO3)2·6H2O溶解到1 mL去离子水中,缓慢滴加浓氨水(质量分数25%)至生成的白色沉淀刚好消失,向溶液中再加入9 mL乙二醇,搅拌3 min后,将该溶液转移到25 mL聚四氟乙烯内胆的反应釜中,密封,置于140℃烘箱中保温2 h,自然冷却到室温,得白色沉淀。沉淀分别用去离子水和无水乙醇洗涤数次,50℃干燥4 h,得球形ZnO纳米结构。花形ZnO纳米结构的制备方法同球形ZnO纳米结构,只是将水与乙二醇的体积比从1:9增加到5:5,最后得到花形ZnO纳米结构。
1.2产物表征
采用扫描电子显微镜(SEM)和全自动X射线衍射仪(XRD)对所制备的样品进行形貌和结构表征。扫描电子显微镜采用的是德国LEO公司的1430VP型扫描电子显微镜;X射线粉末衍射测试使用德国Bruker公司D8 Advance型X射线衍射仪器,Cu Kα辐射(λ=0.154 18 nm),管电压为40 kV,管电流为100 mA。红外光谱采用德国Bruker公司EQUINOX 55傅里叶变换红外光谱仪。光致发光谱采用上海分析仪器总厂的棱光970CRT型荧光光谱仪。固体和液体紫外可见吸收光谱采用的是日立公司的U-3010和U-3900H型紫外可见扫描分光光度计。总有机碳(TOC)值在德国Elementar vario TOC总有机碳分析仪上测定。
1.3光催化降解实验
取30 mg样品加入到40 mL浓度为6×10-5mol·L-1的MO溶液中,将石英试管放入XPA-7型旋转式反应仪(南京胥江机电厂),在黑暗中预吸附0.5 h即可达到吸附平衡,然后在300 W的高压汞灯照射下反应,紫外线波长为365 nm。实验过程中要磁力搅拌,每隔30 min取4 mL溶液,采用高速离心的方法将光催化剂与溶液分离,取上层清液用UV-3900H型紫外可见扫描分光光度计进行跟踪分析测定。并计算甲基橙光照t时刻的降解率:

式中Dt为MO的降解率,C0和Ct分别为吸附达到平衡后MO的起始浓度和光照t时刻甲基橙的浓度,A0和At分别为吸附达到平衡后MO起始时刻的吸光度和光照t时刻的吸光度。所有实验均在室温下进行。相同条件下外加3 mL的叔丁醇(tbutanol)和0.12 g乙二胺四乙酸二钠(EDTA-2Na)考察MO的降解情况用来推测光催化降解机理。
2 结果与讨论
2.1水与乙二醇体积比对产物形貌的影响
研究了水与乙二醇的不同体积比对ZnO形貌的影响,结果见图1。图1(a,b)、(c,d)和(e,f)为在Zn (NO3)2·6H2O-NH3·H2O体系中,V水∶V乙二醇分别为0: 10、1∶9和5∶5时所制备产物不同放大倍数的SEM电镜照片。结果发现,当V水∶V乙二醇=0∶10时,产物为大面积的类球形颗粒,粒径在100~300 nm,见图1 (a)。从其高倍扫描照片图1(b)可以看出,类球形颗粒是由尺寸更小的纳米颗粒组装而成;当V水∶V乙二醇=1∶ 9时,产物为大面积的球形颗粒,球的粒径在500 nm~1 μm,如图1(c)所示。由高倍照片图1(d)可以看出,球形颗粒也是由纳米颗粒组装而成;当V水∶V乙二醇=5∶5时,从图1(e)发现产物不是球形颗粒,而是花形结构,由高倍扫描图1(f)可以看出,花形结构是由长度在300~700nm、直径在100~300 nm的纳米棒组装而成。以上结果表明,通过调节水与乙二醇体积比可实现对产物形貌的控制。对所制备的球形和花形结构样品进行了XRD分析,结果见图2。图中2θ为31.6°、34.3°、36.2°、47.5°、56.5°、62.7°、66.1°、67.9°、69.0°和76.8°的衍射峰分别与纤锌矿结构ZnO (JCPDS No.36-1451,晶胞参数a=0.3250 nm,c= 0.5207 nm)的(100)、(002)、(101)、(102)、(110)、(103)、(200)、(112)、(201)和(202)晶面的衍射峰位相对应,说明在不同体积比的乙二醇水溶液中所制备的球形和花形结构均为六方相纤锌矿结构ZnO。

图1 不同水和乙二醇体积比下所得产物的SEM图Fig.1SEM images of samples synthesized by varying the volume ratio of water and ethylene glycol
2.2反应时间对球形ZnO纳米结构的影响
通过改变反应时间研究了球形ZnO纳米颗粒的形成过程,图3(a,b)、(c,d)、(e,f)和(g,h)为Zn(NO3)2· 6H2O和NH3·H2O在V水∶V乙二醇=1∶9的溶剂中,水热反应0.5、1.0、4.0和6.0 h所的样品SEM照片。从图中可以看出,当反应0.5 h时,产物大面积为球形颗粒,球的粒径在500~900 nm[图3(a,b)];当反应时间延长到1 h,球的粒径在500 nm~1 μm,如图3(c,d)所示。当反应时间延长到2 h和4 h时,从图1(c,d)和图3(e,f)的SEM照片可以看出球的粒径基本没有改变;当反应时间延长到6.0 h时,产物除了有球形颗粒外,还观察到很多碎小颗粒,如图3(g,h)所示。以上结果表明反应0.5 h时,就可以形成球形ZnO纳米结构,随着反应时间的延长,球形ZnO纳米结构的粒径基本没有发生变化,当反应时间延长到6.0 h时,一部分球形ZnO纳米结构破碎,产生很多碎小颗粒。
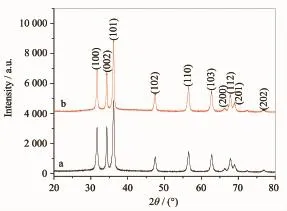
图2 球形(a)和花形(b)样品的XRD图Fig.2XRD patterns of spherical(a)and flower-like(b) ZnO nanostructures

图3 不同反应时间所得产物SEM图Fig.3SEM images of samples synthesized for different reaction time
2.3球形和花形ZnO纳米结构的生长机理
以上实验结果说明,Zn(NO3)2·6H2O与NH3·H2O水热反应生成了ZnO,其反应过程为Zn(NO3)2·6H2O与NH3·H2O形成[Zn(NH3)4]2+配离子,[Zn(NH3)4]2+解离出Zn2+,Zn2+与NH3·H2O解离出的OH-结合形成Zn(OH)2,Zn(OH)2在140℃下水热生成ZnO。其反应方程式如下:

随着反应(4)的发生,化学平衡(1),(2)和(3)向右移动以维持ZnO的成核和生长。为了研究乙二醇在球形和花形ZnO纳米结构的形成中的作用,在水热体系中不加乙二醇,让[Zn(NH3)4]2+溶液140℃水热反应2 h,对得到的产物进行SEM和XRD分析,结果见图4(a)和4(b)。从图4(a)发现产物的形貌不是球形和花形ZnO纳米结构而是分散的一维棒状结构。纳米棒直径分布较宽,其值和长度分别在100~600 nm和600 nm~3 μm。图4(b)的XRD说明产物是六方相纤锌矿结构ZnO。此结果表明,乙二醇在球形和花形ZnO纳米结构的形成中起着非常重要的作用。CH2的弯曲振动。此外,还观察到位于499 cm-1Zn-O伸缩振动吸收峰。以上结果说明所制备的球形和花形ZnO纳米结构的表面都吸附有乙二醇分子。

图4 (a)不加乙二醇产物的SEM图;(b)产物的XRD图Fig.4SEM image(a)and XRD(b)pattern of the product synthesized by the reaction of Zn(NO3)2·6H2O with NH3·H2O at 140℃for 2 h
为进一步研究乙二醇的作用机理,对在乙二醇水溶液中制备的球形和花形ZnO纳米结构进行IR研究,结果如图5(a)和图5(b),图中3 426 cm-1为OH的伸缩振动吸收峰;2 926和2 845 cm-1附近处弱的峰为CH2的反对称伸缩和对称伸缩振动吸收峰。1623cm-1为H-O-H键的弯曲振动吸收峰,1382 cm-1处的吸收峰为C-H的弯曲振动,1 088 cm-1为C-O的振动峰,1 043、882、639 cm-1处的吸收峰为
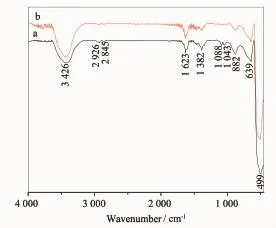
图5 球形(a)和花形(b)ZnO纳米结构的IR图Fig.5IR spectra of spherical(a)and flower-like(b)ZnO nanostructures
六方结构的ZnO是由一系列O2-和Zn2+组成的四面体沿着c轴交替堆积而成,它的一个重要特性就是具有极性表面,即带有正电荷的Zn-(0001)和带有负电荷的O-(0001)面,从而沿着c轴产生偶极矩和自发极化。利用其表面极性的特点,可以通过改变这些方向上的生长速率从而合成出不同形貌的ZnO纳米结构。根据以上的实验结果,我们认为在Zn(NO3)2·6H2O与NH3·H2O水热体系中,Zn(NO3)2· 6H2O经反应(1~4)成核后形成尺寸很小的纳米晶,这些纳米晶沿着具有较高化学活性Zn-(0001)面生长,形成了ZnO纳米棒[3],如图4(a)所示。向上述水体系加入乙二醇,乙二醇分子会吸附在ZnO纳米晶带正电荷的Zn-(0001)表面,形成了Zn-OCH2-CH2-OH,从而降低了(0001)表面能,阻碍了ZnO纳米晶沿[0001]方向的生长。当水与乙二醇的体积比为5∶5时,乙二醇含量较少,只有少量的乙二醇分子吸附在Zn-(0001)表面上,得到的是纳米短棒,棒棒之间通过乙二醇分子之间的氢键作用相互连接,就形成了花形结构。当水与乙二醇的体积比为增加到1∶9时,由于乙二醇的大量存在,ZnO纳米颗粒的表面上吸附了一层乙二醇分子,使得ZnO[0001]的生长进一步被抑制,从而得到的是ZnO纳米颗粒,颗粒之间通过乙二醇分子之间的氢键作用自组装形成了球形结构。
2.4球形和花形ZnO纳米结构的固体紫外分析
对球形和花形ZnO纳米结构进行了固体紫外可见分析,结果见图6。由图6可以看出球形和花形ZnO纳米结构的紫外吸收曲线其形状非常接近,在低于400 nm范围有连续的宽紫外吸收带,最大吸收峰位于330 nm处,并有明显的吸收带边,但球形ZnO纳米结构的吸收强度略低于花形结构。在紫外区的强吸收是由于价带与导带间的电子跃迁产生的,最大吸收峰被指认为O2-→Zn2+的电子跃迁,反映出ZnO具有良好的半导体特性。由公式(αhν)2=A(hν-Eg)(其中α代表本征吸收系数,hν代表光子能量,A代表跃迁常数),可以计算得到禁带宽度(Eg)。球形和花形ZnO纳米结构的的Eg可以根据(αhν)2-hν曲线在x轴上的截距求得,如图6的右上角插图所示,图中曲线的切线与横坐标的交接点处即为该样品的Eg值,由此得出球形和花形ZnO纳米结构的Eg分别为3.14 ev(<395 nm)和3.17 ev(<391 nm),说明球形比花形ZnO纳米结构具有更好的光吸收性能。

图6 球形(a)和花形(b)ZnO纳米结构的固体紫外可见光谱图Fig.6UV-Vis diffuse reflectance spectra of spherical(a) and flower-like(b)ZnO nanostructures

图7 室温下球形(a)和花形(b)ZnO纳米结构的PL图Fig.7Photoluminescence spectra of spherical(a)and flower-like(b)ZnO nanostructures at room temperature
2.5球形和花形ZnO纳米结构的光致发光分析
ZnO的光致发光(PL)信号和强度与其光催化性能的大小有密切的关系,近年来,朱等[20-21]已将PL谱用于光催化作用的研究。图7(a)和7(b)为室温下在300 nm紫外光激发下球形和花形ZnO纳米结构的PL谱,从图中可以观察到球形和花形ZnO纳米结构在350~550 nm范围内都有发光信号,谱线的形状相似,在401、413、420、440、453、469、482、492和534 nm处出现了明显的PL峰,与文献报道[20-21]的ZnO的PL谱一致。根据半导体固体的光致发光机理,当受到能量高于半导体带隙能的光激发时,PL峰起源于半导体价带与导带之间的电子跃迁。在纳米ZnO半导体中除去价带和导带构成的能级状态以外,在价带和导带的带隙之间靠近导带底部附近还存在着丰富的束缚状态,它们是由氧空位、缺陷和表面态等结构性杂质引起的[22]。测定PL谱时,在300 nm紫外光激发下ZnO的价带电子跃迁到导带,形成了光生电子和空穴对,部分光生电子会到达导带附近的束缚状态,形成带边自由激子;部分光生电子会很快被氧空位和缺陷捕获,形成束缚激子,由于束缚态比导带处于更有利的能级位置上,因此结合光生电子的几率很大,激子经辐射跃迁回至价带并与空穴复合的过程便产生了发光信号。文献中把401 nm的PL峰归属于自由激子复合产生的ZnO宽带隙带边的发射[3]。410~440 nm的蓝光发光起归属于导带上的电子与间隙氧上空穴之间的复合或价带上的空穴与间隙锌之间的复合[23]。534 nm的绿光发光归属于表面上离子化氧空位中的电子与价带中光激发的空穴之间的复合[23]。除了上述发光峰外,还观测到发光峰位于453、469、482和492 nm的蓝绿光发光,这些可见光的发光通常与ZnO中的缺陷结构有关[23],多个PL峰也说明了球形和花形ZnO纳米结构的表面态是丰富的。一般来说,颗粒尺寸越小,氧空位量越高,形成激子概率越大,激子发光信号越强[22]。由图1(c,d)和(e,f)可以看出球形结构是有尺寸小的纳米颗粒组装而成,花形ZnO结构是由尺寸较大的纳米棒组装而成,因此,球形结构比花形ZnO纳米结构具有较多的氧空位,PL强度也就高于花形结构。
2.6球形和花形ZnO纳米结构的光催化机理研究
在进行光催化降解实验前,首先研究了球形和花形ZnO纳米结构对MO溶液的吸附性能。图8(a)和(b)为30 mg球形和花形ZnO纳米结构加入到40 mL 6×10-5mol·L-1的MO水溶液中,对MO染料不同时间的吸附动力学曲线。其中C0和Ct分别代表MO的原始溶液和任意时刻的浓度,从图中可以看出黑暗下搅拌30 min后,球形和花形ZnO纳米结构的Ct/C0值分别是0.989和0.992,随着搅拌时间的延长,Ct/C0值基本无变化,表明球形和花形ZnO纳米结构与MO溶液在30 min内达到吸附/脱附平衡,其饱和吸附量可以通过公式qe=(C0-Ce)×V/ W来得出,式中Ce为MO溶液的平衡浓度(mg·L-1),V为MO溶液的体积(L),W为球形或花形样品的质量(g)。通过计算得出球形和花形ZnO纳米结构的qe分别为0.28和0.21 mg·g-1,说明制得的球形和花形ZnO纳米结构对MO溶液不具有好的吸附能力。
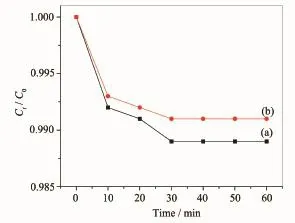
图8 球形(a)和花形(b)ZnO纳米结构对MO染料的吸附动力学曲线Fig.8 Adsorption kinetics of the spherical(a)and flowerlike(b)ZnO nanostructures for MO

图9 (a)球形ZnO光催化降解MO溶液的紫外吸收光谱图;(b)MO、MO/球形ZnO和MO/花形ZnO的紫外光催化降解率图Fig.9(a)Absorption spectra ofMO stock solution,MO solution after 30 min adsorption by the spherical ZnO nanostructures and(Ⅲ~Ⅺ)MOsolutionduringthephotocatalyticdegradationprocessoverthesphericalZnOnanostructures;(b)Photodegradation of the MO solutions without catalyst,over the sphericaland flower-likeZnO nanostructures under UV light
分别以球形和和花形ZnO纳米结构作为光催化剂,比较了其在紫外灯下对MO的光催化降解性能,结果如图9(a)和9(b)所示。图9(a)是球形ZnO纳米结构加入到的MO水溶液中,用1根波长为365 nm、功率为300 W的紫外灯管照射不同时间后溶液的的光降解曲线图。从图中可以看出,MO溶液在紫外灯光照射2 h后,甲基橙最大吸收峰的强度降低了83%。另外,对比了球形ZnO、花形ZnO纳米结构和MO在紫外光照射相同时间后它们的光降解率,结果如图9(b)所示。图9(b)中曲线Ⅰ,Ⅱ和Ⅲ分别是MO、MO/球形ZnO和MO/花形ZnO在不同时间的光催化降解率。根据朗伯比耳定律,吸光度与溶液浓度成正比,因此,用(C0-Ct)/C0代替(A0-At)/A0。从图中曲线I看到,不加催化剂的MO溶液在紫外光照射2 h,MO仅被降解了14%;从图中曲线Ⅱ和Ⅲ看到,分别以球形ZnO和花形ZnO纳米结构作为催化剂,紫外光照射2 h后,MO的降解率分别为83%和55%,以上结果表明球形ZnO颗粒的光催化性能好于花形ZnO纳米结构。在光催化反应过程中,氧空位或缺陷能够成为光生电子的捕获中心,从而有效抑制光生电子和空穴的复合,这意味着氧空位和缺陷有利于样品光催化活性的提高。由于球形比花形ZnO纳米结构具有较多的氧空位和缺陷,因此其光催化性能好于花形ZnO纳米结构,这一结果与UV-Vis DRS和PL分析结果是一致的。另外,对球形和花形样品降解2 h后的MO溶液进行了TOC检测,分别为5.824和6.822 mg·L-1,溶液中的总有机碳含量偏高,可能是由于球形和花形样品表面都吸附有乙二醇分子造成的。
为了弄清影响球形和花形ZnO纳米结构光催化性能的因素是ZnO的形貌(球形和花形)还是其组成(纳米颗粒和纳米棒),在相同的实验条件下测试了ZnO纳米棒(图4(a))和商品ZnO纳米颗粒对MO溶液的降解性能。图10为球形、花形、棒形及ZnO纳米颗粒在汞灯照射下对MO的降解率效果图,从图中看出在紫外灯光照射2 h后,球形、花形、棒形及ZnO纳米颗粒对MO的降解率分别为83%、 55%、62%和98%,ZnO纳米颗粒及棒形ZnO的催化活性优于球形和花形ZnO纳米结构,实验结果表明制备的ZnO样品的光催化性能依赖于其形貌。
为了考察球形ZnO结构作为光催化剂的重复利用性,在相同的实验条件下进行了3次循环光催化实验,结果如图11所示。实验结果表明经过3次循环再生使用,球形ZnO结构光催化效率略有降低,第3次重复使用后对MO的降解率约75%,降解性能的降低在很大程度上可能是由于部分样品损失导致的,因为粉体样品在循环实验中难以回收完全。

图10 相同质量的球形、花形、棒形ZnO和商品ZnO颗粒紫外光照2 h的光降解MO效果图Fig.10Photodegradation of MO solution over the spherical,flower-like,rod-like ZnO nanostructures and ZnO nanoparticle with the same weight

图11 球形ZnO纳米结构循环光催化降解MO溶液的效果图Fig.11Cyclic photodegradation of MO solution with the spherical ZnO nanostructures
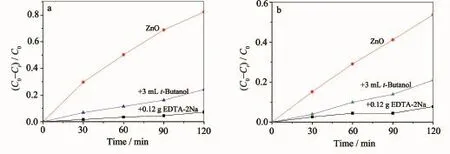
图12 EDTA和叔丁醇对球形(a)和花形ZnO(b)紫外光催化降解MO的影响Fig.12Plots of photogenerated carriers trapping in the system of photodegradation of MO solution by spherical(a)and flower-like(b)ZnO nanostructures under UV light
ZnO的光催化基本原理为当催化剂ZnO受到大于禁带宽度能量的光子照射后,电子从价带跃迁到导带,产生电子和空穴,电子与氧气结合,并与水分子反应,上述3个过程促使3种活性粒子形成,即h+、·O2-和·OH。这些活性粒子可促使有机染料分解为CO2和H2O等无机物[22]。为了验证光催化过程主要的活性粒子,本文采用外加叔丁醇(t-butanol)和EDTA-2Na到MO/球形ZnO和MO/花形ZnO光催化体系中,叔丁醇是·OH的清除剂,EDTA-2Na能捕获h+,观察其对·OH和空穴抑制程度,以验证催化过程中·OH还是h+是主要的氧化物种,实验结果如图12 (a)和图12(b)所示。图12(a)分别为MO/球形ZnO、MO/球形ZnO/EDTA-2Na和MO/球形ZnO/t-butanol在紫外光照射下不同时间的光降解率图。从图12(a)中可以观察到,当加入EDTA-2Na和叔丁醇后,球形ZnO的光降解率从83%降低到7%和24%,说明球形ZnO紫外光降解MO过程中,·OH和h+是主要的活性物种,另外,加入EDTA-2Na后ZnO的光降解率为7%,明显低于加入叔丁醇后ZnO的光降解率24%,表明h+在球形ZnO紫外光降解MO过程中起着主要作用。从图12(b)可以看出花形ZnO纳米结构紫外光降解MO过程中,同样是h+起着主要作用。以上结果表明球形和花形ZnO纳米结构紫外光催化降解机理为空穴氧化和自由基协同氧化过程。
3 结论
在硝酸锌溶液中,以氨水为配位剂,通过改变水与乙二醇的体积比,140℃水热反应2 h分别制备出了球形和花形ZnO纳米结构。研究了不同反应时间对球形ZnO纳米结构的影响。室温下以偶氮染料MO作为光催化研究对象,紫外光照射2 h,球形和花形ZnO纳米结构球对MO的光催化降解率分别达到83%和55%。以叔丁醇(t-butanol)、EDTA-2Na为·OH和h+的捕获剂,推测其催化机理主要为空穴氧化和自由基协同氧化历程。该方法不需要任何软硬模板或有毒溶剂,简单、实用,可望应用于其他氧化物纳米结构的可控合成。
[1]LI Li(李丽),YANG He-Qing(杨合情),YU Jie(余杰),et al. Acta Chim.Sinica(化学学报),2008,66(3):335-342.
[2]Liu D,Lü Y H,Zhang M,et al.J.Mater.Chem.A,2014,2: 15377-15388
[3]YANG He-Qing(杨合情),LI Li(李丽),SONG Yu-Zhe (宋玉哲),et al.Sci.China Ser.B(中国科学B辑),2007,37 (5):417-425
[4]Chen Y,Zhao H,Liu B,et al.Appl.Catal.B:Environ., 2015,163:189-197
[5]Wang Z L.J.Phys.:Condens Matter.,2004,16:R829-R858
[6]Kind H,Yan H Q,Messer B,et al.Adv.Mater.,2002,14(2): 158-160
[7]Fan Z Y,Lu J G.Appl.Phys.Lett.,2005,86(3):032111
[8]Wang Z L,Song J H.Science,2006,312:242-245
[9]Wang C H,Chu X F,Wu M M.Sens.Actuators B,2006,113 (1):320-323
[10]Zhang L N,Yang H Q,Ma J H,et al.Appl.Phys.A,2010, 100(4):1061-1067
[11]Guo M Y,Ng A M C,Liu F Z,et al.J.Phys.Chem.C, 2011,115(22):11095-11101
[12]Wang Y X,Li X Y,Lu G,et al.J.Phys.Chem.C,2008, 112(19):7332-7336
[13]Wang X J,Zhang Q L,Wan Q,et al.J.Phy.Chem.C,2011, 115(6):2769-2775
[14]Chu D W,Masuda Y,Ohji T,et al.Langmuir,2010,26(4): 2811-2815
[15]Sun T J,Qiu J S,Liang C H.J.Phys.Chem.C,2008,112 (3):715-721
[16]Zeng J H,Jin B B,Wang Y F.Chem.Phys.Lett.,2009,472 (1/2/3):90-95
[17]Ye C H,Bando Y,Shen G Z,et al.J.Phys.Chem.B,2006, 110(31):15146-15151
[18]Lu F,Cai W P,Zhang Y G.Adv.Funct.Mater.,2008,18(7): 1047-1056
[19]Fang Y L,Li Z Y,Xu,S,et al.J.Alloys Compd.,2013,575: 359-363
[20]LÜ Y H,Pan C S,Ma X G,et al.Appl.Catal.B:Environ., 2013,138-139:26-32
[21]Chen D M,Wang Z H,Ren T Z,et al.J.Phys.Chem.C, 2014,118:15300-15307
[22]JING Li-Qiang(井立强),YUAN Fu-Long(袁福龙),HOU Hai-Ge(侯海鸽),et al.Sci.China Ser.B(中国科学B辑), 2004,34(4):310-314
[23]Li L,Yang H Q,Qi G C,et al.Chem.Phys.Lett.,2008, 455:93-97
Controllable Synthesis and Photocatalytic Mechanism of Spherical and Flower-like ZnO Nanostructures
LI Li*,1,2LIU Xiao-MingZHOU Shu-Ting1LIU Shi-Tao2JIA Dian-Zeng2(1College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi 830046,China) (
2Key Laboratory of Advanced Functional Materials,Autonomous Region,Institute of Applied Chemistry,Xinjiang University, Urumqi 830046,China)
The spherical and flower-like ZnO nanostructures have been synthesized by a simple hydrothermal reaction of Zn(NO3)2·6H2O with NH3·H2O by varying the volume ratio of ethylene glycol and water at 140℃for 2 h, respectively.TheproductswerecharacterizedbySEM,XRD,UV-VisDRSandPL,theresultsshowedthat theproducts were single crystalline with the wurtzite structure.The diameter of spherical ZnO nanostructure assembled nanoparticles is ranged from 500 nm~1 μm.The flower-like ZnO nanostructures are assembled from one-dimensional nanorods with the diameter is ranged from 100~300 nm and length is ranged from 300~700 nm.The influence of ethylene glycol on the morphology development was investigated.Possible growth mechanisms of the spherical and flower-like ZnO nanostructures were proposed.Photocatalytic activities of the spherical and flower-like ZnO nanostructures in the degradation of methyl orange were investigated.The degradation rate of the spherical and flowerlike ZnO nanostructures under 2 h UV irradiation were 83%and 55%,respectively.The study on photocatalytic mechanism confirmedthat h+and·OHwerethemainreactivespeciesduringthephotocatalyticprocess.
ZnO;spherical and flower-like nanostructures;photocatalytic;ethylene glycol
O614.24+1
A
1001-4861(2016)02-0241-09
10.11862/CJIC.2016.041
2015-08-07。收修改稿日期:2015-12-11。
新疆大学先进功能材料自治区重点实验室开放课题(No.XJDX0902-2013-03)和国家自然科学基金(No.21567026)资助。
*通信联系人。E-mail:lili1972@xju.edu.cn;Tel:0991-8583083
