基于主成分分析的不同预处理方法对关节软骨分类的影响
2016-11-28毛之华高浩尹建华
毛之华,高浩,尹建华
(南京航空航天大学自动化学院生物医学工程系,南京 210016)
基于主成分分析的不同预处理方法对关节软骨分类的影响
毛之华,高浩,尹建华*
(南京航空航天大学自动化学院生物医学工程系,南京 210016)
本文采用不同方法对来自正常和病变关节软骨样本的红外光谱进行预处理,而后利用主成分分析对关节软骨进行鉴别分析。首先对关节软骨切片实现傅里叶变换红外光谱采集,其次分别采用基线校准、标准化、多元散射校正和标准正态变量变换对软骨的红外光谱进行预处理,然后对原始光谱(矩阵)以及预处理光谱进行主成分分析,根据得分矩阵对样本进行分类分析。结果表明:预处理方法结合主成分分析可以更好地对正常和病变关节软骨样本进行分类,而且多种预处理方法的结合可以更好地增强样本间的区分度。另外,针对关节软骨样本,多元散射校正比标准正态变量变换具有更好的增强效果。
关节软骨;傅里叶变换红外光谱;预处理;主成分分析
1 引言
关节软骨是一类半透明的结缔组织,呈淡蓝,表面光滑。其覆盖于骨关节表面,主要的生理功能是在关节活动过程中减少摩擦、承受压力以及缓冲震动[1]。关节软骨由软骨细胞外基质和软骨细胞组成。软骨基质从外表面到软骨下骨之间呈现出明显的板层状结构,一般分为4层:表层区(SZ)、过渡区(TZ)、放射区(RZ)和钙化区[2]。基质中主要含有胶原蛋白、蛋白多糖、无机盐离子以及水等物质[3]。其中,胶原蛋白形成的纤维结构,构成了软骨基质的主要骨架,维持了关节软骨的形状和结构。胶原纤维可以有效地固定蛋白多糖并承受压力[4]。而蛋白多糖可以保证关节软骨的弹性及耐压性[5]。由于关节软骨生理功能以及力学特性的要求,基质中蛋白多糖的含量及胶原纤维的空间结构随深度变化而变化[6]。增龄、创伤以及肥胖等因素都有可能引起软骨基质中化学成分含量和结构的变化,进一步发展将会导致骨关节炎(OA)的发生[7-8]。OA早期的症状主要表现在基质中组分含量和结构的变化,以及软骨细胞形态和活性的改变,但不会出现明显的临床症状,也没有明显的组织结构性损伤[9],对骨关节炎早期的诊断造成了困难。
傅里叶红外光谱显微成像(FTIRI)技术可以在实现样品红外光谱扫描的基础上构建其红外吸收图像。图像中每个像素即代表对应位置的红外光谱,并通过伪彩色表示该处对红外光的平均吸收率。FTIRI可以用于直观地表征样品中各组分的空间分布和含量变化[10-11],具有较高的空间分辨率、光谱分辨率及灵敏度。FTIRI结合化学计量学方法可以实现对关节软骨定量或定性的分析[12]。主成分分析(PCA)是化学计量学中的常用方法,通过对原变量进行线性组合,利用新产生的变量来表示原矩阵的数据信息。PCA可以从光谱数据中提取主成分的半定量信息,在简化数据量的同时,可以在一定程度上去除噪声的影响。PCA的主要过程是将光谱矩阵分解成载荷矩阵和得分矩阵。其中,载荷矩阵表示对应主成分的归一化光谱,得分矩阵表示其相对浓度[13]。得分矩阵可用于定性分析,例如可以作为样本之间马氏距离的特征变量来判断界外样本,或者利用得分向量的二维散点图实现不同样本的分类[14]。
由于光谱采集过程中不可避免的基线漂移,光源强度的变化、样品的散射效应对光谱的影响以及光谱仪自身存在的误差,在PCA分析前往往需要对光谱进行一定的预处理。但是在关节软骨的相关研究方面还没有文献报道。本文拟采用不同方法对来自正常和病变关节软骨样本的红外光谱进行预处理,利用PCA对正常和病变的关节软骨样本进行分类。并对分类结果进行比较分析,讨论不同预处理方法对软骨样本的PCA的影响。
2 实验过程
2.1 实验仪器及样品制备
本实验所采用的成像系统为PerkinElmer Spotlight-300 FTIRI System (Wellesley,MA),主要由一台傅里叶变换红外光谱仪和一套显微成像系统组成。其中,显微成像系统的探测部分由一个16阵元汞镉碲化合物(MCT)线阵列检测器和一个单点的MCT检测器组成,两个探测器均由液氮冷却,用于样本的红外信号采集。另外,成像系统还包含一个与上述探测器共轴的可见光CCD探测器,用于样本的可见光图像的获取。红外光谱仪主要是由红外光源、迈克逊干涉仪、反射光路、样品室和检测器组成。
实验所用样品取自正常和病变的狗膝关节软骨(各5个样本)。病变软骨的获得是通过对犬膝关节的前十字交叉韧带进行手术,从而诱导OA的发生。样本的制备过程主要是:首先将实验所需的关节软骨组织切割成2 mm × 2 mm × 2 mm的小立方块;然后利用生理盐水清洗1 min后,经液氮快速冷冻;最后利用低温切片机(Leica CM 1950,Germany)在-20 ℃的条件下将小立方块处理成厚度为10m的切片,用于光谱采集和显微成像。为了去除水分对红外光谱测量的影响,将切片风干2 h。
2.2 图像采集和光谱提取
利用成像系统对制得的切片进行图像采集,获得可见光图像以及红外吸收图像。其中,红外图像中的像素大小为6.25m,所采集到的光谱范围为4000~744 cm-1,间隔为8个波数。对于OA早期,关节软骨基质的变化主要表现为蛋白多糖的流失,而且最明显的区域一般为SZ和TZ[12]。另外,需要注意的是当软骨切片贴附在载玻片上时,其边缘的厚度梯度会使信号光发生散射和漫反射[9],从而导致该处所探测得到的红外光谱发生变形,无法准确反映对应组分的特征信息。所以,本文采用软骨表面下深度50m左右区域内的红外光谱(间隔10m)进行分析,并酌情剔除1至2组来自软骨基质表层区外缘的红外光谱。每个样本提取5组光谱,共得到50组光谱数据(编号#1~50)。
2.3 光谱数据分析
考虑到光谱采集过程中不可避免的基线漂移,光源强度变换对定量分析造成的不便以及样品的散射效应对光谱的影响,另外光谱软件中获取的红外光谱已经过一定的平滑处理。本文采用基线校准(Baseline Correction,BC)、标准化(Normalization,Nor)、多元散射校正(Multiplicative Scatter Correction,MSC)和标准正态变量变换(Standardized Normal Variate,SNV)四种算法以及以上方法不同的组合对光谱矩阵进行预处理。
PCA过程中,首先计算光谱矩阵的协方差矩阵;再计算得到协方差矩阵的特征值和特征向量;而后根据特征值计算主成分的累计方差贡献率,并选取合适的主成分个数;然后根据特征向量获得主成分的载荷矩阵;最后计算对应主成分的得分矩阵,并绘制散点图。通过计算样本数据点之间的欧氏距离,依据类内距离最短、类间距离最大的原则来区分界外样本,实现对关节软骨样本进一步的分类分析。PCA的主要目的是用尽可能少的因子来解释研究对象,同时尽量保证数据信息不丢失。因此,主成分因子数选择的主要依据是主成分的特征值以及累计方差贡献率。实验中,为了尽量减少光谱矩阵中所包含数据信息的损失,本文主成分个数选取的标准为累计方差贡献率达85%以上。
3 结果与讨论
3.1 图像及光谱分析
图1所示为成像系统获得的正常关节软骨的红外吸收光谱。其中,酰胺I、酰胺II、酰胺III特征峰的中心波数分别为1650 cm-1、1550 cm-1和1250 cm-1,而1338 cm-1表示脯氨酸侧链亚甲基的摇摆振动峰,1072 cm-1则为糖带谱峰。另外,图1所示光谱为多组分光谱,由于基质中各组分的红外光谱存在相似谱峰,光谱互相叠加,任何一个吸收峰的强度都不能直接与对应组分的浓度进行关联[9]。
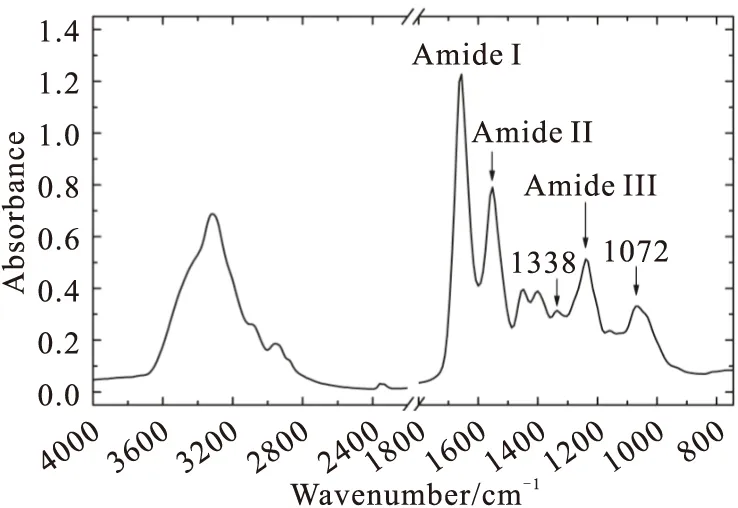
Fig.1 The infrared absorption spectra extracted from the healthy cartilage sample
图2所示分别为正常和病变样本的红外吸收及可见光图像。在红外图像中,软骨细胞表现为亮斑,而在可见光图像中则为椭圆状的暗斑。与正常样本相比,病变关节软骨中细胞的大小、形态和数量发生了明显的改变[15-16]。通过对关节软骨的红外光谱进行归属分析,1338和1072 cm-1谱带更适合用于表征胶原蛋白和蛋白多糖的含量和空间分布。因此,本文利用图2(b)和2(c)定性地对软骨样本中的胶原蛋白和蛋白多糖进行表征。图中可见,相比于正常关节软骨样本,病变样本中胶原蛋白和蛋白多糖的含量明显较低,尤其在SZ与TZ区域。
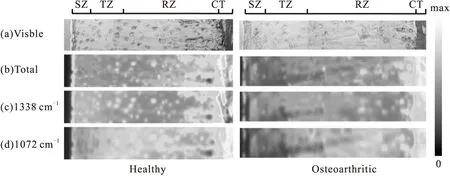
Fig.2 Visible image(a) and FTIR images of total absorption (b), at 1338 cm-1(c) and 1072 cm-1(d) from healthy and OA cartilage sections. The absorption max for (b), (c) and (d) are 1.5,1.8 and 2.2, respectively
3.2 主成分分析
表1所示为不同方法预处理后以及原始光谱数据经PCA降维后所得前四个主成分(PC1,PC2,PC3,PC4)的累计贡献率。其中,PC1和PC2可能分别对应软骨基质中的两类主成分(胶原蛋白和蛋白多糖),PC3及PC4可能对应样品中的一些微量成分。由表可知:各组光谱数据的前两个主成分的累计贡献率均高于85%,能够表示光谱数据的大部分特征。其中,由BC以及Nor处理后的光谱矩阵的前两个主成分的累计贡献率要略高于未处理的光谱矩阵,而其他方法处理后的累计贡献率相对较低。
不同方法预处理后以及原始光谱矩阵的前两个主成分的得分矩阵的散点图如图3所示。
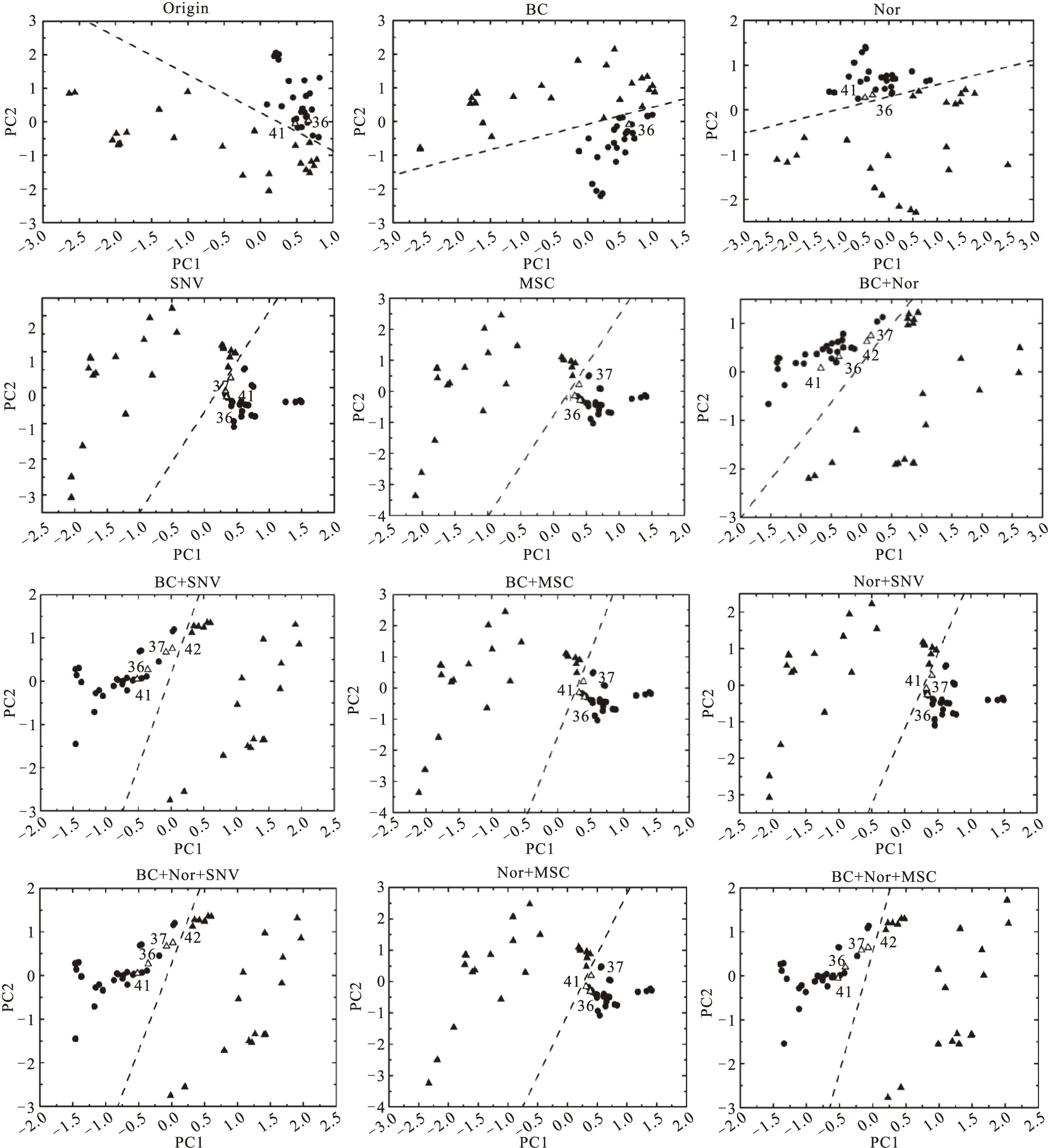
Fig.3 The scatter plot of PC1 and PC2 in score matrix calculated by PCA.The solid triangles and circles represent the spectra from OA (▲) and healthy (●) group,respectively
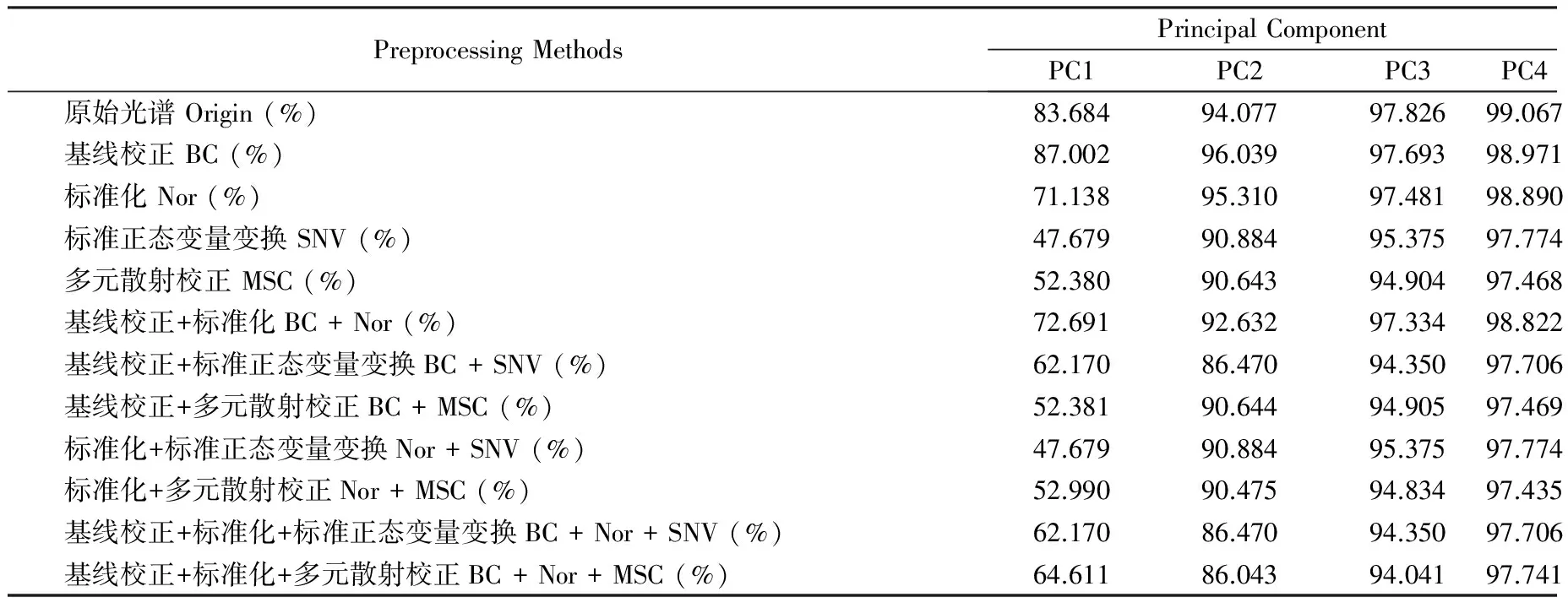
Tab.1 The principal component cumulative variance
图中数据点可以被虚线大致分成两类,其中三角形表示病变样本,圆形表示正常样本。由图可知:第一,相比于病变样本的数据点分布,正常样本的数据点相对较为集中,说明不同正常样本的主成分含量差别不大。而病变样本由于病变程度不一,导致了病变样本数据点分布较为分散。第二,与原始光谱相比,经预处理后的正常与病变数据点之间的距离明显增大,即样本间区分度增加。这可能是由于经预处理后的光谱之间的差别增大,数据特征更为明显。第三,比较不同方法预处理后的结果可以发现,多种方法处理的结果要优于单一方法处理的结果。而且在相同条件下,MSC处理后的结果要优于SNV处理后的结果,表现为数据点之间距离变化的程度。第四,虽然预处理后的样本间区分度增加,但是根据虚线所划分的分类区域,可以发现预处理后的误判案例比原始光谱的误判案例多。通过比对数据点所对应的光谱编号,可以发现靠近正常样本区域,甚至出现误判的数据点均来自的两个样本,说明误判案例的存在有可能是样本本身带来的误差。第五,比较表1与图3的结果,表1中主成分累计贡献率较低的光谱数据,却在二维散点图中显示出较好的样本间区分度。这说明主成分累计贡献率与样本分类灵敏度没有必然关系。
4 结论
本文利用FTIRI技术对正常和病变关节软骨样本进行成像,提取红外吸收光谱后,采用不同方法对光谱进行预处理,而后利用PCA对数据进行降维,并对样本进行分类分析。结果表明:不同预处理方法均对PCA二维散点图中样本区分度有非常显著的提高,多种预处理方法的结合可以更好地增强样本间的区分度。另外,针对关节软骨样本,MSC 比SNV具有更好的增强效果。综上所述:预处理方法结合PCA可以更好地对正常和病变关节软骨样本进行分类。
致谢
本文FTIRI数据部分是在Oakland University (Rochester, MI)的Prof. Yang Xia实验室获得。期间,Prof. Yang Xia受到美国NIH基金R01-AR052353资助。
Reference
[1] Mauck R L,Soltz M A,Wang C C,etal.Functional tissue engineering of articular cartilage through dynamic loading of chondrocyte-seeded agarose gels [J].J Biomech Eng,2000,122(3):252-260.
[2] Ramakrishnan N,Xia Y,Bidthanapally A,etal.Determination of zonal boundaries in articular cartilage using infrared dichroism[J].Appl Spectrosc,2007,61(12):1404-1409.
[3] Buckwalter J A,Mankin H J.Articular cartilage:tissue design and chondrocyte-matrix interactions [J].Instr Course Lect,1997,47:477-486.
[4] Eyre D.Collagen of articular cartilage [J].Arthritis Res Ther,2002,4(1):30-35.
[5] Schmidt M B,Mow V C,Chun L E,etal.Effects of proteoglycan extraction on the tensile behavior of articular cartilage [J].J Orthop Res,1990,8(3):353-363.
[6] Jeffery A K,Blunn G W,Archer CW,etal.Three-dimensional collagen architecture in bovine articular cartilage [J].J Bone Joint Surg Br,1991,73(5):795-801.
[7] Bank R A,Bayliss M T,Lafeber F P,etal.Ageing and zonal variation in post-translational modification of collagen in normal human articular cartilage [J].Biochem J,1998,330(Pr1):345-351.
[8] Buckwalter J A,Martin J,Mankin H J.Synovial joint degeneration and the syndrome of osteoarthritis [J].Instr Course Lect,1999,49:481-489.
[9] Yin J,Xia Y,Lu M.Concentration profiles of collagen and proteoglycan in articular cartilage by Fourier transform infrared imaging and principal component regression [J].Spectrochim Acta A Mol Biomol Spectrosc,2012,88:90-96.
[10] 肖芝燕,张学喜,尹建华.关节软骨和骨关节炎的傅里叶变换红外光谱学显微成像研究进展[J].科学通报,2014,59(27):2645-2651(Xiao Zhiyan,Zhang Xuexi,Yin Jianhua.Fourier transform infrared spectroscopic imaging on articular cartilage and osteoarthritis[J].Chin Sci Bull,2014,59(27):2645-2651).
[11] Potter K,Kidder L H,Levin I W,etal.Imaging of collagen and proteoglycan in cartilage sections using Fourier transform infrared spectral imaging [J].Arthritis Rheum,2001,44(4):846-855.
[12] Yin J,Xia Y.Proteoglycan concentrations in healthy and diseased articular cartilage by Fourier transform infrared imaging and principal component regression [J].Spectrochim Acta A Mol Biomol Spectrosc,2014,133:825-830.
[13] 褚小立.化学计量学方法与分子光谱分析技术[M].北京:化学工业出版社,2011:55-57(Chu Xiaoli.Molecular spectroscopy analytical technology combined with chemometrics and its applications[M].Beijing:Chemical industry press,2011:55-57).
[14] 徐永群,孙素琴,袁子民,等.红外光谱结合主成分分析鉴别道地山药[J].分析化学,2002,30(10):1231-1233(Xu Yongqun,Sun Suqin,Yuan Zimin,etal.Discrimination of trueborn tuber dioscoreae by fingerprint infrared spectra and principal component analysis[J].Chin J Anal Chem,2002,30(10):1231-1233).
[15] Goldring M B.The role of the chondrocyte in osteoarthritis[J].Arthritis Rheum,2000,43(9):1916-1926.
[16] Yamamoto K,Shishido T,Masaoka T,etal.Morphological studies on the ageing and osteoarthritis of the articular cartilage in C57 black mice[J].J Orthop Surg (Hong Kong),2005,13(1),8-18.
The Classification of Articular Cartilage with Different Preprocessing Methods Based on Principal Component Analysis
MAO Zhi-hua,GAO Hao,YIN Jian-hua*
(DepartmentofBiomedicalEngineering,NanjingUniversityofAeronauticsandAstronautics,Nanjing210016,China)
In this study,different methods were used to preprocess the infrared spectra of healthy and osteoarthritic articular cartilage.Before the principal component analysis (PCA) was applied to classify the articular cartilage samples.First,FTIRI on articular cartilage specimens was achieved.After extracted from the FTIR images,the infrared spectra were preprocessed by baseline correction,normalization,multiplicative scatter correction and standardized normal variate.And then,the original and preprocessed spectra were imported into SPSS software for PCA and the cartilage samples were classified based on the score marix.It is indicated that preprocessing methods combined with the principal component analysis can classify the samples of healthy and osteoarthritic articular cartilage better.The combination of different preprocessing methods was helpful to differentiate the samples. In addition, the Multiple scatter correction was better than Standardized normal variate in articular cartilage classification.
articular cartilage;fourier transform infrared microscopy imaging;preprocessing;principal component analysis
2015-07-31; 修改稿日期:2015-11-25
国家自然科学基金(61378087);江苏省自然科学基金(BK20151478)
毛之华(1992-),男,硕士,主要研究方向为生物医学光谱学及成像分析.E-mail:mzh163161@163.com
尹建华.E-mail:yin@nuaa.edu.cn
1004-5929(2016)03-0264-06
O433;O657.3;Q-3
A
10.13883/j.issn1004-5929.201603012
