光谱法研究pH值对纳米银及其与赖氨酸相互作用的影响
2016-11-28张磊姬文晋宋巍陈志舜赵肃清
张磊,姬文晋,宋巍,陈志舜,赵肃清
(广东工业大学轻工化工学院,广州 510006)
光谱法研究pH值对纳米银及其与赖氨酸相互作用的影响
张磊,姬文晋,宋巍,陈志舜,赵肃清*
(广东工业大学轻工化工学院,广州 510006)
利用化学方法合成纳米银,调节pH值,加入赖氨酸溶液,通过紫外光谱和动态光散射法研究pH对纳米银及纳米银-赖氨酸体系稳定性的影响,利用表面增强拉曼光谱考察赖氨酸与纳米银的相互作用方式。紫外光谱显示纳米银和纳米银-赖氨酸体系在pH值为5~10时,均具有较强的吸收峰;应用动态光散射测定了不同pH的纳米银及其赖氨酸体系的粒径及强度自相关函数,在pH值为5~10时,粒径分布均匀,DLS自相关曲线平滑,说明纳米银和纳米银-赖氨酸体系稳定性良好;SERS研究了pH为4、7、10时,赖氨酸在银粒子表面的吸附作用,体系出现比较明显的赖氨酸特征峰,当pH为4时,为 δ(NH3+) 的1444 cm-1谱峰和δ(COO-)的1576 cm-1,此时赖氨酸通过氨根和羧酸根共同与银纳米粒子发生相互作用,当pH为10时,NH3+发生去质子化,此时赖氨酸只出现COO-的伸缩振动在1576 cm-1处,说明此条件下赖氨酸以羧酸根吸附在银粒子表面。
纳米银;赖氨酸;pH值;表面增强拉曼光谱;动态光散射
1 引言
近年来,纳米材料由于特殊的物理和化学特性引起人们的关注,被广泛应用于生物医药、化学、环境等各个领域。将生物分子与纳米材料进行结合,为生物医疗技术提供了新的方法和手段[1-2]。纳米银具有良好的光电特性、较高的催化活性和潜在的光催化杀菌活性,在催化剂材料、光电材料,生物分析检测、疾病诊断与治疗中发挥着重要的作用[3-4]。目前银纳米粒子被广泛用作比色传感器检测重金属离子、生物分子及有机小分子等物质;用银纳米粒子增敏与金纳米粒子标记的方法联用检测DNA序列,比荧光团标记具有更高的选择性和灵敏度;利用银纳米粒子作为表面增强拉曼散射的基体,可以应用于生物分子,如DNA、蛋白质和其他生物活性小分子的检测和鉴定;此外,银纳米粒子染色,也是一种灵敏度高、抗干扰性强的蛋白质测量方法[5-7]。因此,随着纳米银越来越多地应用于生物医药领域,使得纳米银的生物分子功能化成为目前研究的热点。
在纳米材料的生物功能化过程中,氨基酸作为一种简单的有机物具有良好的前景。氨基酸是蛋白质的基本单位,研究氨基酸修饰的纳米颗粒可以作为肽与蛋白质修饰的纳米材料的简单模型,常用的研究手段主要有紫外可见光谱法、荧光分光光度法、红外光谱法、圆二色光谱法等。表面增强拉曼光谱(SERS)技术已经被广泛用于检测核酸碱基、氨基酸和蛋白质[8-9],虞丹尼等[10]通过研究亮氨酸、异亮氨酸及缬氨酸三种支链氨基酸在金/银核-壳复合粒子基底表面的SERS光谱,探讨了三种支链氨基酸在此基底表面不同的作用方式及其吸附模式,通过对比苯丙氨酸、组氨酸、色氨酸三种带环状结构的氨基酸分子在银粒子表面的SERS,推测了三种环状结构氨基酸的吸附状态,探讨了氨基酸与银胶的不同作用模式及其不同浓度、pH值对吸附状态的影响。赖氨酸是一种两性小分子,包裹纳米颗粒后在药物传送、医药治疗、放射领域都是研究的热点[11]。研究赖氨酸在纳米银颗粒表面的结合情况、修饰特性对于纳米银的氨基酸及多肽修饰具有独特的价值。但是,氨基酸与银胶表面的这种相互作用的研究仍存在诸多疑问,尤其是在不同条件环境下,生物大分子结构的多变性为这种研究带来了极大的困难[12]。
利用经典的化学法制备的银纳米粒子,由于比表面积大、表面能高,属于热力学不稳定体系,颗粒间极易团聚,形成尺寸较大的团聚体,导致最终应用时失去纳米颗粒应有的物性和功能。王蕊等通过紫外吸收光谱法研究了溶液pH值、醇/水比例及表面活性剂等因素对纳米银溶胶分散稳定性的影响[13];吴丽萍等利用动态光散射和透射电镜法研究了pH值和NaCl对丝胶蛋白微观结构的影响,说明纳米颗粒和蛋白质在介质中的分散与许多因素有关[14]。因此本文研究在不同pH值下纳米银与纳米银-赖氨酸体系的分散稳定性并考察赖氨酸在纳米银表面的相互作用方式。
2 实验部分
2.1 仪器与试剂
LabRAM HR 800型激光紫外拉曼光谱仪(法国HORIBA Jobin Yvon公司)。TU-1901型紫外可见分光光度计(普析通用)。Zeta PALS 型Zeta电位及粒度分析仪(美国Brookhaven公司)。KDC-16H型高速离心机。Nova Nano SEM430型超高分辨率场发射扫描电子显微镜(荷兰FEI)。超声波清洗器。
硝酸银(含量≥99.8%,国药集团化学试剂有限公司),L-赖氨酸(含量≥98.5%,萨恩化学技术有限公司),柠檬酸三钠(含量≥99.0%,天津市大茂化学试剂厂),HCl溶液(含量36.0%~38.0%,广州化学试剂厂),NaOH(含量99.6%,广州化学试剂厂),以上试剂皆为分析纯。实验中所有水均为屈臣氏蒸馏水。
2.2 实验方法
利用柠檬酸三钠还原硝酸银的方法制备银溶胶。对制得的银溶胶高速离心提纯,转速为12000 r/min,离心30分钟,去除上层清液,底部沉淀加入蒸馏水重新分散,超声振荡10分钟。再进行第二次高速离心15分钟,将沉淀分散于不同pH值的水溶液中,由HCl和NaOH溶液调节pH值(3~11)。
配制1×10-4mol·L-1的赖氨酸溶液。取300L上述赖氨酸溶液与不同pH值的银溶胶溶液均匀混合,(混合体系记为:AgNPs-Lysine)。静置2小时后观察发现,pH=3、pH=4和pH=11的AgNPs-Lysine溶液由黄绿色变无色,并有黑色沉淀生成。分散于不同pH值水溶液的银溶胶并未发生聚沉。
将银溶胶调节pH值为4,7,10,分别与1×10-4mol·L-1的赖氨酸溶液混合,离心分散于蒸馏水中,自然晾干,测SERS。
2.3 表征
纳米银粒子大小和形貌采用Nova Nano SEM430型超高分辨率场发射扫描电子显微镜观察。吸收光谱采用TU-1901型紫外可见分光光度计测定。采用Zeta电位及粒度分析仪测试银溶胶和AgNPs-Lysine体系的粒径及DLS光强自相光曲线。表面增强拉曼光谱采用LabRAM HR 800型激光紫外拉曼光谱仪进行测定,激光波长为623.8 nm,曝光10 s,2次循环测试。
3 结果与讨论
3.1 紫外吸收光谱
图1为纳米银的紫外吸收光谱图和扫描电镜图。合成的纳米银特征吸收峰为~423 nm,平均粒径为45 nm左右,以球形为主,少量棒状,分散性良好。
图2为纳米银和AgNPs-Lysine体系在不同pH值溶液的紫外吸收光谱。纳米银在pH值为3~10范围内有特征吸收峰。当pH值为3,4,5时,纳米银的特征峰变宽,最大吸收峰强度降低,说明粒径分布不均匀,稳定性开始变差,出现了粒子间的部分团聚;当pH值11时,银溶胶完全聚沉,已无吸收峰,稳定性受到了影响。这是因为酸碱性溶液中的电荷会破坏银溶胶的电荷平衡,导致颗粒间排斥力急剧减小,出现粒子间的团聚。对于AgNPs-Lysine体系,吸收光谱发生蓝移至418 nm,可以看到在pH值为3,4,11时,赖氨酸修饰的银溶胶已没有明显的特征峰,观察溶液颜色由黄绿色变成无色,出现黑色沉淀,说明纳米银颗粒出现了明显的聚沉[15],在此过程中,AgNPs-Lysine体系不稳定。而在pH值为5~10时其紫外峰形与峰值未发生明显改变,说明在pH值为5~10条件下纳米银和赖氨酸得到稳定的修饰体系。
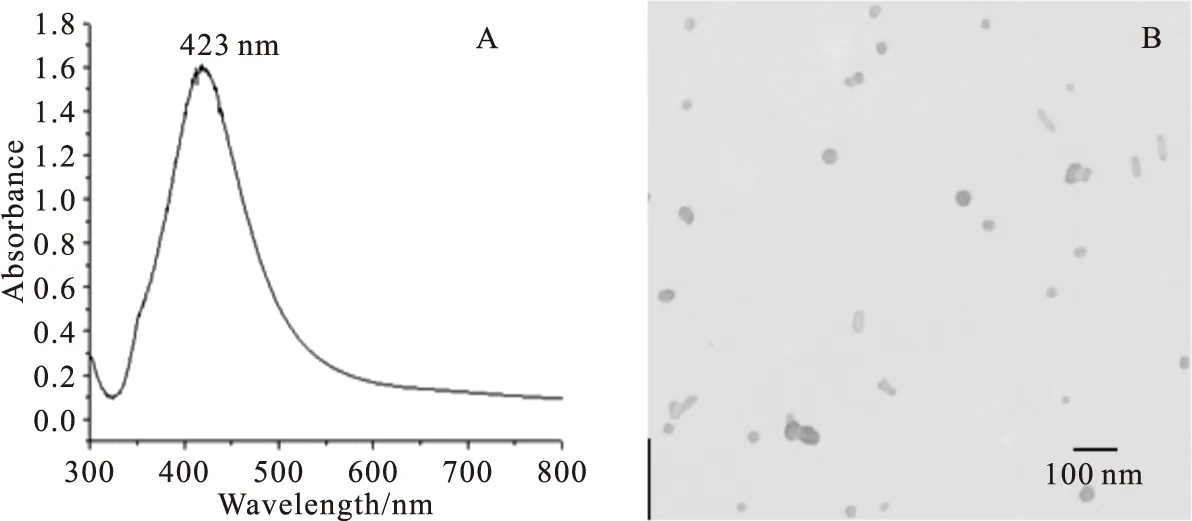
Fig.1 UV-Vis spectrum(A) and SEM image of Ag colloids (B)
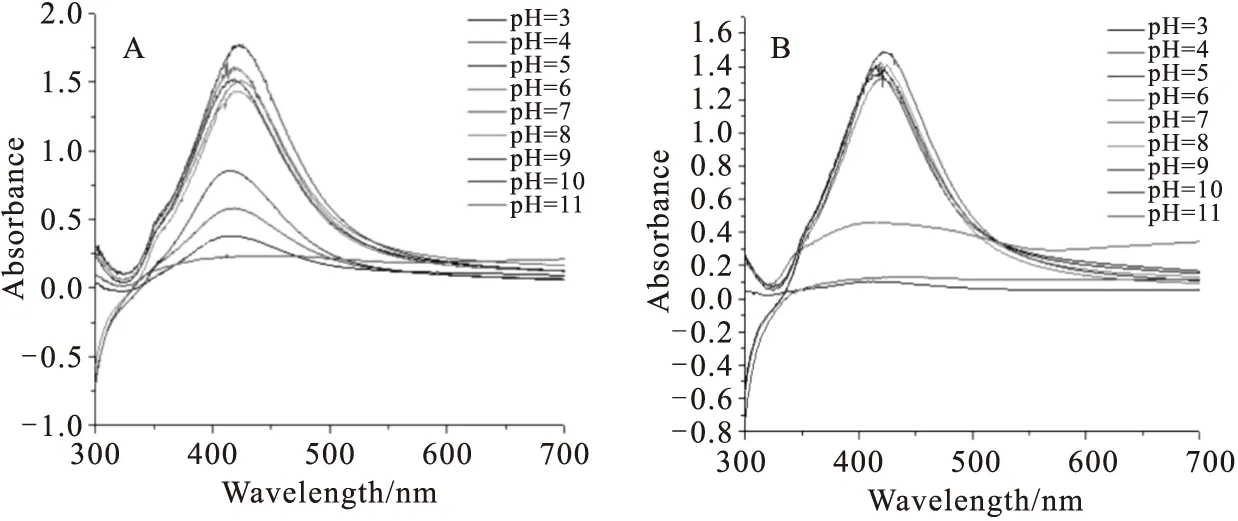
Fig.2 UV-Vis spectra of Ag colloids(A) and AgNPs-Lysine(B) at different pH values
3.2 动态光散射
图3为不同pH值纳米银溶液的DLS光强自相关函数图像。根据图像可以观察到,纳米银在pH 5~10溶液时,自相关曲线比较平滑(图3(c)(d)(e)(f)(g)(h)),说明纳米银溶液比较稳定。而纳米银在pH为3、4和11时,光强-自相关曲线明显变差,纳米银不稳定,与紫外吸收光谱的结果一致。
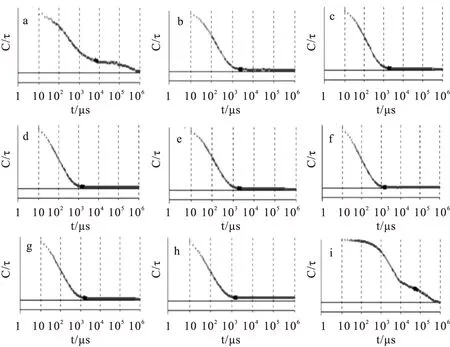
Fig.3 DLS correlation curves of AgNPs at different pH values (a)pH=3; (b)pH=4; (c)pH=5; (d)pH=6; (e)pH=7; (f)pH=8; (g)pH=9; (h)pH=10; (i)pH=11
根据AgNPs-Lysine体系的DLS光强-自相光曲线可以观察到(图4),AgNPs-Lysine体系在pH 5~10溶液时,自相关曲线比较平滑(图4(c)(d)(e)(f)(g)(h)),说明赖氨酸在银溶胶中得到了稳定的修饰体系。而AgNPs-Lysine在pH值为3,4,11溶液时,光强-自相关曲线衰减慢,曲线不平滑,说明体系不稳定,这与吸收光谱的结果一致。
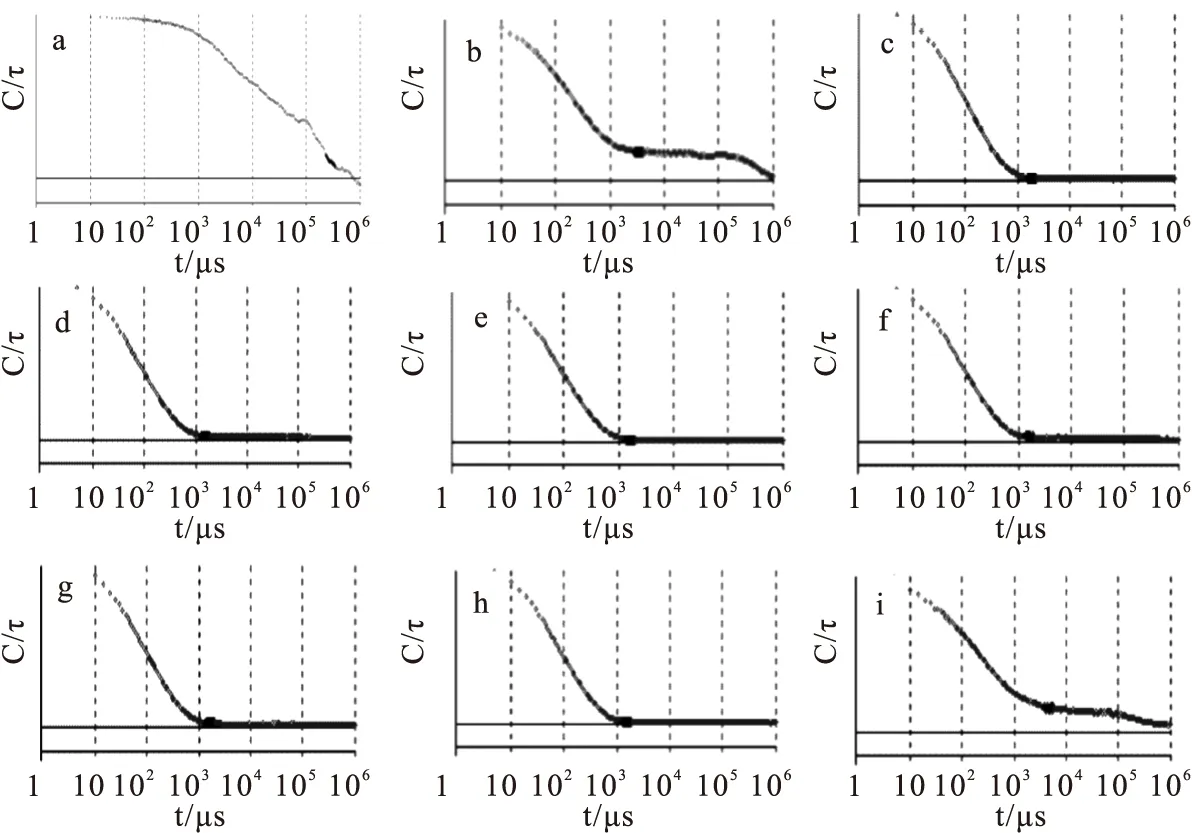
Fig.4 DLS correlation curves of AgNPs-Lysine at different pH value (a)pH=3; (b)pH=4; (c)pH=5; (d)pH=6; (e)pH=7; (f)pH=8; (g)pH=9; (h)pH=10; (i)pH=11
3.3 粒径分布
表1为不同pH值下纳米银、AgNPs-Lysine体系粒径数据。数据分析表明:pH值在4~10之间,纳米银粒径分布比较集中,但pH值为11时,银溶胶发生聚沉。不同的pH值下的纳米银粒径不同,说明调节银胶体的pH值可改变银胶体的稳定性。加入赖氨酸后,粒径都发生了变化,说明纳米银与赖氨酸进行了结合,纳米银-赖氨酸体系在pH值为5~10的范围内稳定,结果与吸收光谱和DLS自相关曲线一致。
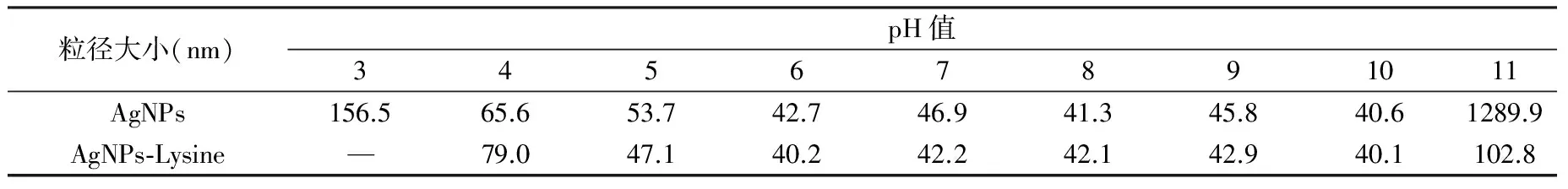
Tab.1 Particle size of AgNPs and AgNPs-Lysine
3.4 AgNPs-lysine体系表面增强拉曼光谱
本实验得到了pH=4,pH=7,pH=10时赖氨酸在纳米银粒子上的SERS光谱(图5)。
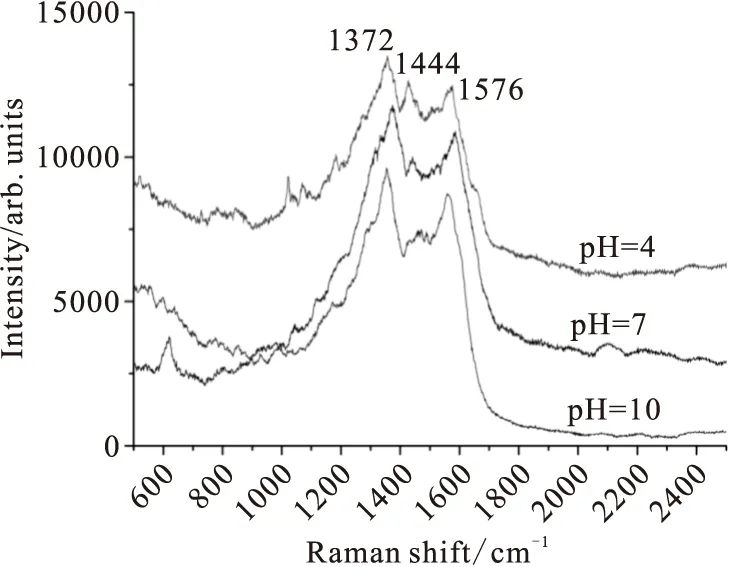
Fig.5 SERS of AgNPs-Lysine at different pH values
从赖氨酸的表面增强拉曼谱图中可以看出(图5),在pH=4、pH=7、pH=10时,均出现了比较明显的赖氨酸特征拉曼峰,但峰位不完全相同[12,16]。当pH为4和7时,赖氨酸的拉曼谱图出峰相似,为δ(NH3+) 的1444 cm-1谱峰和δ(COO-)的1576 cm-1,此时赖氨酸通过氨根和羧酸根共同与银纳米粒子发生相互作用;当pH为10时,NH3+发生去质子化,此时赖氨酸只出现COO-的伸缩振动在1576 cm-1处,说明此条件下赖氨酸以羧酸根吸附在银粒子表面。最强峰1372 cm-1和其他谱峰为赖氨酸侧链的-CH2和NH2振动产生。
4 结论
纳米银及其与赖氨酸混合体系的稳定性及其相互作用与所处环境的pH值有着密切联系。在不同pH值下,纳米银的粒径会有所改变。纳米银本身是带电荷的,不同的pH值会影响胶体的电荷平衡,因此改变溶液pH值可使纳米银粒子聚集、长大,产生聚沉。对于赖氨酸-纳米银体系,经紫外吸收光谱和Zeta电位及粒度分析仪测定,在pH为5~10范围内,具有较强的吸收峰,DLS自相关曲线平滑,粒径分布集中,说明体系稳定。当溶液偏酸性时,体系呈亚稳团聚状态,同时根据赖氨酸的SERS谱图分析,此时赖氨酸通过氨根和羧酸根共同吸附在银纳米粒子表面。随着pH值的增大,体系的稳定性逐步增强,当pH值为10时,此时赖氨酸仅以羧酸根吸附在纳米银表面。本论文的研究为肽、蛋白质等生物分子与纳米材料的相互作用研究提供简单的吸附模型。
[1] Zhang S.Fabrication of novel biomaterials through molecular self-assembly[J].Nat Biotechnol,2003,21:1171-1178.
[2] You C,Chompoosor A,Rotello V M.The biomacromolecule nanoparticle interface[J].Nanotoday,2007,2:34-43.
[3] Liang G D,Bao S P,Tjong S C.Microstructure and properties of polypropylene composites filled with silver and carbon nanotube nanoparticles prepared by melt-compounding[J].Mater Sci Eng,B,2007,142(2-3):55-61.
[4] Taton T A,Mirkin C A,Letsinger R L.Scanometric DNA array detection with nanoparticle probes[J].Science,2000,289:1757-1760.
[5] Stephan T,Dubas,Panittamat K,Pranut P.Layer-by-layer deposition of antimicrobial silver nanoparticles on textile fiber[J].Colloids Surf,A, 2006,289(1-3):105-109.
[6] Chunling Zhang,Kaijun Wang,Dejun Han,etal.Surface enhanced Raman scattering(SERS) spectra of trinitrotoluene in silver colloids prepared by microwave heating method[J].Spectrochim Acta,Part A,2014,122:387-391.
[7] Farhadi K,Forough M,Molaei R,eta1.Highly selective Hg2+colorimetric sensor using green synthesized and unmodified silver nanoparticles[J].Sens Actuators,B,2012,161(1):880-885.
[8] 莫冰,李和平,陈娟,等.表面增强拉曼光谱(SERS)及其在定量测量中的研究进展[J].光散射学报,2013,25(3):219-234 (Mo Bing,Li Heping,Chen Juan,etal.Surface enhanced Raman spectroscopy and its progress in quantitative detection[J].The Journal of Light Scattering,2013,25(3):219-234.)
[9] 李勤,张崇起,方炎,等.聚赖氨酸结构的表面增强傅里叶拉曼散射研究[J].光散射学报,1995,7(2,3):227-228 (Li Qin,Zhang Chongqi,Fang Yan,etal. The NIR-FT-SERS of Ply-L-lysine adorbent by silver colloid[J].The Journal of Light Scattering,1995,7(2,3):227-228.)
[10] 虞丹尼.几种羧基生物分子的Raman 光谱及其表面增强拉曼散射(SERS)研究[D].硕士学位论文:西南大学,2008.( Yu Danni.The Study of biomolecules contained carboxyl by FT-Raman spectroscopy and surface enhanced Raman scattering(SERS)[D].Master Dissertation,Southwest University,2008.
[11] Dreher M.R.,Liu,W,Michelich C R.,etal.Thermal cycling enhances the accumulation of a temperature-sensitive biopolymer in solid tumors[J].CancerRes,2007,67 (9):4418-4424.
[12] A.E.Aliaga,I.Osorio-Roman,C.Garrido,etal.Surface enhanced Raman scattering study of L-lysine[J].Vib Spectrosc,2009,50,131-135.
[13] 王蕊,唐连国,周厚强,等.纳米银的分散稳定性和光谱性质研究[J].金属功能材料,2010,17(1):17-21 (Wangrui,Tang Lianguo,Zhou Houqiang,etal.Research on dispersion stability of nano silver[J].Metallic Functional Materials,2010,17(1):17-21.)
[14] 吴丽萍,冷小京,孙雁,等.动态光散射和投射电镜法研究pH 和NaCl 对丝胶蛋白微观结构的影响.[J] 光谱学与光谱分析,2010,30(5):1391-1395 (Wu Liping,Leng Xiaojing,Sunyan,etal.Analysis of the effects of pH and salt on the conformation of the sericin particles by DLS and TEM measurements[J].Spectroscopy and Spectral Analysis,2010,30(5):1391-1395.)
[15] Volodymyr C,Oleksandre R,Andrii L,etal.Gold Nanoparticles aggregation:drastic effect of cooperative functionalities in a single molecular conjugate[J].J Phys Chem C,2012,116:2683-2690.
[16] 王茹.纳米金的生物分子修饰研究[D].硕士学位论文:南京理工大学,2013(Wang Ru.Study on the modification of gold nanoparticles by biomolecules[D].Master Dissertation,Nanjing University of Science & Technology,2013.)
Effects of pH on Silver Nanoparticles and Its Interaction with Lysine Studied by Spectroscopy
ZHANG Lei,JI Wen-jin,SONG Wei,CHEN Zhi-shun,ZHAO Su-qing*
(SchoolofChemicalEngineeringandLightIndustry,Guangdonguniversityoftechnology,Guangzhou,510006)
The prepared silver nanoparticles synthesized by chemical method was bound with lysine at different pH values.The UV-Vis spectrum and dynamic light scattering methods were used to study the stability of Ag colloids and AgNPs-lysine system.The interaction of Ag nanoparticles and lysine was surveyed by SERS.The results showed at the pH value of 5~10,the UV-Vis spectra appeared strong adsorption peak,the particle size was uniform distribution and DLS intensity auto-correlation curve was smooth,which indicated that the system had good stability.The interaction of lysine binding to Ag nanoparticle surface was investigated by SERS.At the pH value of 4,the SERS band at 1440 cm-1is assigned to δ(NH3+),and the band of 1576 cm-1is assigned to δ (COO-),which tells the lysine adsorbs on the Ag surface through the interaction of the amino and carboxyl groups together.At the pH value of 10,the main characteristic Raman spectrum was δ(COO-) at 1576 cm-1,it demonstrated that the lysine was adsorbed on the surface of silver nanoparticles with the NH3+group.
silver nanoparticles; lysine; pH value; SERS; DLS
2015-07-14; 修改稿日期:2015-11-02
国家自然科学基金项目(41271340),广东工业大学校青年基金项目(13ZK0386)资助
张磊(1986-),女,甘肃高台人,实验师,研究方向为纳米金属材料的制备表征及表面增强拉曼光谱应用,E-mail:zhangleishg@163.com
赵肃清,E-mail:sqzhao@gdut.edu.cn
Q517
A
10.13883/j.issn1004-5929.201603001
