不同性别杨树应答低氮胁迫的生理学研究
2016-11-26李小冬王小利
李小冬,蔡 璐,张 瑜,王 茜,王小利*
(1.贵阳省农业科学院 贵州省草业研究所,贵阳 550006;2.贵阳省农业科学院 贵阳省生物技术研究所,贵阳 550006)
不同性别杨树应答低氮胁迫的生理学研究
李小冬1,蔡 璐2,张 瑜1,王 茜1,王小利1*
(1.贵阳省农业科学院 贵州省草业研究所,贵阳 550006;2.贵阳省农业科学院 贵阳省生物技术研究所,贵阳 550006)
杨树是林业研究领域的模式植物,其作为雌雄异株的代表植物之一,是研究性别差异导致的生理、基因表达以及表观遗传等热门领域的重要研究对象。氮元素是植物生长发育必不可少的营养元素,氮吸收及同化的机理,尤其是在同一种植物的不同性别中氮元素利用差异的机理研究还比较少。本文采用水培的方法对正常条件和低氮条件下雌雄杨树的碳氮含量、光合作用效率及其参数、抗氧化酶活性,以及可溶性蛋白与游离氨基酸含量的变化进行研究。结果表明:在低氮条件下,植株碳含量增加,雌株比雄株对低氮更加敏感。总活性氧物质(ROS)含量在雌雄单株中没有显著差异,但活性氧清除酶,如过氧化物酶(POD)、超氧化物岐化酶(SOD)、谷胱甘肽合成酶(GS)等,在雌株中的活性比雄株高。可溶性蛋白含量在雌株与雄株中没有显著差异,而氨基酸的组成与含量在雌雄单株间以及胁迫处理前后有显著差异,天门冬氨酸(Asp),丝氨酸(Ser),以及精氨酸(Arg)等含量在雄株中较高,大部分游离氨基酸含量受低氮胁迫抑制,而蛋氨酸(Met)、亮氨酸(Leu)与络氨酸(Tyr)等的含量基本不受影响。本研究主要从生理学角度分析了低氮胁迫条件下杨树雌株与雄株的生理学差异,并对雌株比雄株对低氮胁迫敏感可能的机制进行了讨论。
杨树;低氮胁迫;抗氧化酶活性;游离氨基酸
0 引 言
氮元素是植物必不可少的生命元素之一,其不仅是氨基酸、核苷酸、叶绿素以及植物激素的必须组成元素,还参与碳氮平衡调控、氨基酸代谢与蛋白质合成等重要生物学过程,在植物生长发育过程中起着举足轻重的作用[1]。氮代谢途径的紊乱对植物生长与形态建成造成不利影响,如影响植物根系发育、叶片叶绿素含量以及种子产量等[2]。在模式植物以及农作物中,通过突变体或者组学分析的方法已经鉴定了许多参与氮吸收以及氮合成的关键基因。这些关键基因的表达与外界可利用的氮元素的浓度水平存在一个负反馈调节:当植物感知外界氮元素含量低,会上调这些基因的表达,反之则下调[3]。研究植物应对低氮胁迫的生理与分子机制,对培育耐低氮胁迫的种质资源具有重要的意义。
以往对非生物逆境胁迫的研究主要集中在雌雄同株的植物中,而对于雌雄异株植物的研究较少。雌雄异株植物总共约有14 000多种,只占到被子植物总数的6%,但是它们是陆地生态系统十分重要的组成部分[4]。因此,雌雄异株植物的不同性别对不利环境的适应机理是研究的热点。之前已经针对雌雄异株的性别分化和优化树种选择做了深入研究,并提出“生殖差异会导致性别特化与资源需求不同”的观点[5-6],最终对该种群生态系统的组成与稳定性造成影响。杨树是雌雄异株的模式植物之一,其雄株与雌株的生态分布常常具有空间的不一致性。雌株多分布在水肥条件好,而雄株多分布在干旱或营养比较缺乏的区域,这种现象在雌雄异株的植物中比较常见[7-8]。这种性别空间分布的隔离能够满足繁殖所需的性别需求同时减少种间竞争[9]。最近的研究发现,木本植物中雌株应对不利环境的耐受能力通常较差,往往比雄株更加敏感[10]。云南白杨的雌株和雄株在高盐、干旱特别是高盐与干旱协同处理时的表现有显著的差异[11];并且在高浓度的CO2条件下云南白杨的雄株比雌株的光合作用的效率更高[12]。类似的研究在其他杨树品种中也有报道,在青杨中,雌株与雄株在应对干旱[13]、紫外辐射与高浓度CO2[14]等不利条件时均表现显著的性别差异。然而对于不同性别的杨树应对营养元素缺乏的研究还比较少,其生理、分子等机理还有待进一步阐明。本研究以美洲黑杨与速生杨杂交F1为实验材料系统分析了雌株与雄株材料在低氮胁迫条件下的生理指标变化,对解析雌雄异株植物应对非生物胁迫反应的应答机理有重要意义。
1 研究方法
1.1 材料来源与生长条件
本研究采用的植物材料为一年龄的广西南宁培育的杨树品种,雄株为Nanlin1388,雌株为Nanlin985(都是北美黑杨与欧美速生杨的杂交品种,Populusdeltoides×Populuseuramericana),分别将直径为2 cm的两个材料的枝条切成20 cm长的插扦种苗进行水培育,培养条件参考[15],具体为光照16 h,黑暗8 h,生长温度22℃,光照强度为230~300 μE/m2·s。
1.2 实验处理及测定方法
1.2.1 水培以及低氮胁迫处理
培养方法参考Gan[16]等,并进行了修改,具体如下:将准备好的插扦种苗分别置于Hoagland全营养培养液中(1.25 mM KNO3,1.25 mM Ca(NO3)2·4H2O,0.5 mM MgSO4·7H2O,0.25 mM KH2(PO4),11.6 μM H3BO3,4.6 μM MnCl2·4H2O,0.19 μM ZnSO4·7H2O,0.12 μM Na2MoO4·2H2O,0.08 μM CuSO4·5H2O和10 μM Fe(Ⅲ)-EDTA,用HCl调整pH值到6.0)培养30 d。等插扦苗长出新根与新叶,将材料按雌株与雄株分成两组,一组继续在正常培养条件下培养,另外一组置于低氮培养基中进行胁迫培养(1.25 mM KCl,1.25 mM CaCl2,0.5 mM MgSO4·7H2O,0.25 mM KH2(PO4),11.6 μM H3BO3,4.6 μM MnCl2·4H2O,0.19 μM ZnSO4·7H2O,0.12 μM Na2MoO4o2H2O,0.08 μM CuSO μ4·5H2O 和10 μM Fe(Ⅲ)-EDTA,用HCl调整pH值到6.0),胁迫处理7 w,分别取雄株与雌株顶端往下的第3~4叶片液氮速冻,保存于-80℃冰箱,每个指标样品测定的重复数详见对应的测定方法。预培养与处理所用的水培容器为30 cm×20 cm×15 cm培养盒,每个培养盒水培4株,用于培养的苗木带芽点,不带长成的叶片。
1.2.2 碳氮含量的测定
取处理组与对照组杨树叶片,80℃烘干至恒重,粉碎后用20目的筛子除去叶脉等,称取1 g样品测定总氮含量,采用杜马式燃烧法测定(LECO FP-428 Deter-minator St.Joseph,MO,USA),称取1 g样品测定总碳含量参考[17],每个指标测定6个生物学重复。
1.2.3 叶绿素含量测定
叶绿素含量的测定方法如下:以直径为0.8 cm的打孔器分别对处理组与对照组的叶片进行打孔取样,10个叶盘作为一个样品,称重后加入5 mL 80%的丙酮溶液进行萃取,分别测定663、646、470 nm萃取液的吸光值(Spectronic Genesys-5,Milton Roy,USA),叶绿素a与叶绿素b的含量分别按照以下方法计算:Chlorophyll a = 12.21×OD663-2.81×OD646;Chlorophyll b = 20.13×OD646-5.03×OD663。每个指标至少测3个生物学重复。
1.2.4 光合速率测定
叶片气体交换与叶绿素荧光采用Li-6400(LI-COR Inc.,Lincoln,NE,USA)开放气体交换系统进行测量。在人工气侯室中,每天上午的8:00-11:30进行测量,光合作用以LED灯(6400-02)作为光源,强度为饱和光源(1 500 μE/m2·s),叶片周围CO2浓度为400±5 μmol/mol,叶片温度控制在25℃,空气湿度为50%,具体操作方法参考[18],分别测定净光合速率(Pn),蒸腾速率(E),细胞内二氧化塘浓度(Ci)等指标,每个指标至少测3个生物学重复。
1.2.5 抗氧化酶活性测定
取100 mg新鲜叶片组织称重,加入细胞裂解液或者PBS进行研磨。超氧化物歧化酶(SOD),过氧化氢酶(CAT),谷氨酰胺合成酶(GS)等抗氧化酶等活性测定采用碧云天试剂盒(货号依次为S0102,S0051与S0055),过氧化物酶(POD)采用南京建成试剂盒(A084-3),活性氧物质含量(ROS)的测定采用博耀ROS ELISA测定试剂盒(BH8990),ATP浓度的测定采用上海酶连生物的植物ATP ELISA试剂盒(ml091201)。所有生理指标的测定参照试剂盒说明书进行,每个指标测定3个生物学重复。
1.2.6 总蛋白以及氨基酸含量测定
称取100 mg新鲜的低氮胁迫处理和对照材料叶片用液氮磨碎,用1 mL提取缓冲液(甲醇∶H2O=1∶1)超声萃取30 min,静置2 min,所有样品在4 ℃ 13 000 g离心10 min,取其上清液用来测定可溶性蛋白和游离氨基酸含量。测定由北京艾米诺生物医学研究中心完成,具体方法参考[19],每个样品测3个生物学重复。
1.3 统计分析与作图
实验数据采用Excel 2010进行分析,样品差异显著性分析采用t测验,p<0.05被认为是差异显著,作图采用Excel 2010 与PowerPoint 2010。
2 结果与分析
2.1 低氮胁迫显著影响了碳氮平衡
分别测定正常条件和低氮胁迫条件下雄株Nanlin1388和雌株Nanlin895中的总氮与总碳含量,结果显示:无论在正常或低氮胁迫条件下,雌株碳含量要略高于雄株;同时,与正常条件相比,低氮胁迫减低植株碳含量,但差异没有达到显著水平(如图1(a)所示)。在正常情况下,雄株与雌株的总氮含量没有显著差异;低氮胁迫后,雄株和雌株叶片的含氮量都显著下降,且下降幅度基本相同,但在两组材料中没有显著差别(如图1(b)所示)。然而碳氮比发生显著变化,在正常条件下,雄株的碳氮比为5.14∶1,雌株为5.75∶1;在氮胁迫条件下,雄株的碳氮比为8.79∶1,雌株为11.79∶1,因此,低氮胁迫显著影响了植物碳氮平衡。

图1 碳氮含量测定Fig.1 Detection of total carbon and total nitrogen 注:在正常条件(CK)与氮胁迫条件下(N-stress)总碳含量(a)与总氮含量测定(b)。雄株为Nanlin1388,雌株为Nanlin895。同一个图中不同字母表示对照组与处理组之间差异水平为P<0.05。
2.2 叶绿素含量及光合作用效率的变化
在正常条件下,雄株总叶绿素含量(TC)比雌株要低,但是叶绿素a与叶绿素b的比例在两个材料间没有显著差异。低氮胁迫后,雄株和雌株的叶绿素含量都显著下降,雌株下降幅度更大,但在两个材料中没有显著差异(见表1)。测定光合速率相应指标发现,在正常情况下,雌株与雄株的净光合速率(Pn)以及PSII原初光能转化效率(Fv/Fm)在雄株与雌株材料中没有显著差异,而雄株的蒸腾效率(E)显著高于雌株,雌株的细胞内CO2浓度(Ci)以及气孔导度(Cond)显著比雄株要高。低氮胁迫后,雄株的的净光合速率(Pn)显著提高,而雌株显著降低,PSⅡ原初光能转化效率(Fv/Fm)在雄株中基本维持不变,而雌株显著下降。与对照组相比,低氮胁迫显著降低了雄株与雌株的蒸腾速率(E)与气孔导度(Cond),其中,蒸腾速率在处理组的雄株与雌株中没有显著差异,而雌株的气孔导度显著比雄株高。低氮处理组雄株细胞内的CO2浓度(Ci)显著下降,而雌株不受影响,雄株比雌株拥有更高的光合效率,并且在低氮胁迫条件下差异更加显著。
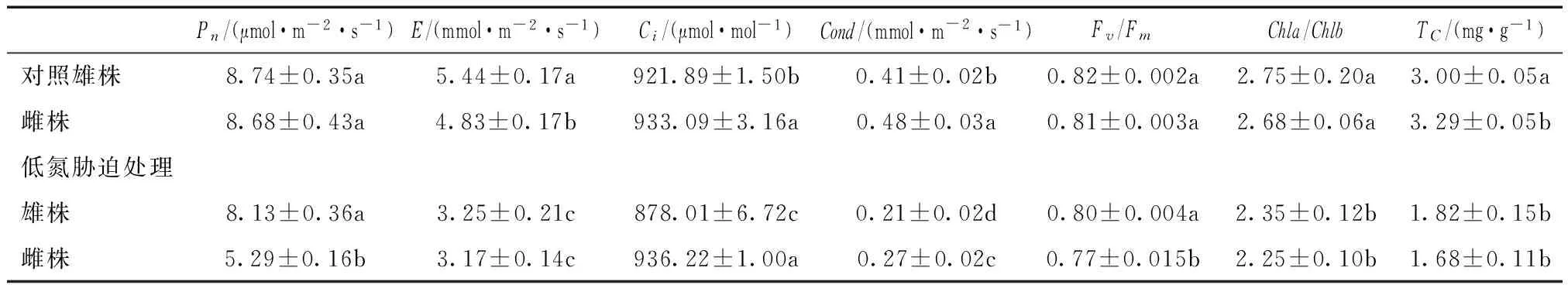
表1 叶绿素含量以及光合速率指标测定Tab.1 Detections of chlorophyll content and photosynthetic parameters
注:同一列中不同字母表示雄株与雌株之间或处理组与对照组之间差异水平为p<0.05。
2.3 抗氧化酶活性的变化
植物在受逆境胁迫时常常会造成体内活性氧等物质含量发生变化,因此测定了处理组与对照组在活性氧含量以及多种抗氧化酶的变化。在正常条件下,雄株Nanlin1388的过氧化物酶(POD)含量显著比雌株低,而其他生理指标如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽合成酶(GS)等酶活,腺苷三磷酸(ATP)以及活性氧物质(ROS)在雄株和雌株中都没有显著差别(如图2(a)~(d)所示)。低氮胁迫诱导后,POD,GS的活性以及ATP含量显著升高而细胞内总活性氧物质的含量在雌雄单株中都不受低氮胁迫的影响(如图2(f)所示)。POD活性和ATP含量在雄株与雌株中没有显著差别,GS活性在雌株中诱导程度较低,而SOD则特异的在雌株中受低氮诱导表达(如图2(b)所示),CAT活性在雌株中被特异性抑制(如图2(c)所示)。在正常条件下,抗氧化酶含量在不同性别的杨树植株中没有显著区别(除POD),在低氮胁迫调件下,雄株与雌株抗氧化酶含量的变化既有共性,也有相同性别特异性。

图2 抗氧化酶活性与腺苷三磷酸和活性氧浓度测定。Fig.2 Detection of antioxidant enzymes activities and concentrations of ATP and ROS
注:CK:正常生长条件,N-stress:氮胁迫条件。雄株:Nanlin1388,雌株:Nanlin895。同一个图中不同字母表示雄株与雌株之间或处理组与对照组之间差异水平为P<0.05。
2.4 可溶性蛋白与游离氨基酸含量的测定
在正常生长条件下,雄株与雌株可溶性蛋白的含量没有显著差异。低氮胁迫组中,可溶性蛋白的含量显著下降,但在不同性别的杨树中差异不显著。采用液相质谱分析叶片中游离氨基酸成分发现,在正常条件下,天门冬氨酸(Asp)、丝氨酸(Ser)、甘氨酸(Gly)、丙氨酸(Ala)、苏氨酸(Thr)、精氨酸(Arg)与苯丙氨酸(Phe)的含量在雄株中的含量显著比雌株高,其他氨基酸的含量在雌、雄株中没有显著差异。低氮处理组中,大部分游离氨基酸的含量在雄株与雌株个体中都显著下降,而苯丙氨酸、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)与络氨酸(Tyr)的含量基本不受影响。组氨酸(His)的含量特异的在低氮胁迫的雌株中被抑制,缬氨酸(Val)的含量在雄株中被抑制。在检测的氨基酸含量变化中,色氨酸(Trp)的含量受低氮胁迫的诱导,但在雄株与雌株中的差异不显著(见表2)。因此,在正常水培条件下,雌株与雄株氨基酸组成具有一定的偏好性,而低氮胁迫显著降低了氨基酸含量,在雄株和雌株中可能激活了不同的氨基酸代谢应对低氮胁迫。

表2 可溶性蛋白与游离氨基酸成分分析Tab.2 Soluble protein and free amino acid concentration
注:每个测量都是3个生物学重复,Asp,天门冬氨酸;Glu,谷氨酸;Ser,丝氨酸;Gly,甘氨酸;Arg,精氨酸;Thr,苏氨酸,Ala,丙氨酸;Pro,脯氨酸;His,组氨酸;Met,蛋氨酸;Val,缬氨酸;Cys,胱氨酸;Ile,异亮氨酸;Leu,亮氨酸;Phe,苯丙氨酸;Lys,赖氨酸;Tyr,络氨酸;Trp,色氨酸。同一列中不同字母表示雄株与雌株之间或处理组与对照组之间差异水平为p<0.05。
3 讨 论
杨树是生长迅速的高大乔木,常常被人们种植用来生产木材、生物能源以及纸张,同时也是人工造林减少CO2的排放的候选植物[20]。然而杨树多被种植在贫瘠的土地,面临严峻的营养胁迫,关于杨树在低氮条件下的生理以及基因表达变化的研究是一个重要的热点。氮元素是植物生长发育中最重要的营养元素,能被植物直接利用的氮元素主要有铵态氮(NH4+)和硝态氮(NO3-)两种,在植物细胞中对应的存在AMTs与NRTs两种不同的转运子[21]。在三叶杨树中,共存在14个AMTs,以及79个NRTs[22],其中AMT1-1,AMT2-1,NRT1-1与NRT2-1可能在该过程中起重要作用,因为它们的表达受氮元素调节的幅度最大[23-25]。然而在杨树中开展雌株与雄株对低氮胁迫的应答机制的研究还比较少,本项目以北美黑杨与欧美速生杨的杂交品种为材料开展相关研究,为在其他品种(尤其是西南喀斯特地区的杨树材料)中开展类似研究提供参考。
雌雄单株的碳氮平衡会受外源碳氮供给来源差异而表现出不相同[26],以往的研究主要集中在高浓度CO2条件下,碳氮平衡的变化主要表现为氮元素含量的下降,并提出由于生物量的增加对氮元素的稀释效应[27],以及高浓度CO2减少了氮元素在叶中的分配,增加了其在叶鞘和根中的分配等[28]等多种假说。而对于在低氮条件下,植物碳元素的变化,尤其是在雌雄异株植物中开展相关的研究还较少。在本文中,相同性别植株的含碳量在处理前后有下降趋势,并且雌株比雄株含碳量略高,说明在杨树中,氮元素供应水平以及性别差异对碳代谢的影响较少,这种微小的变化差异可能主要受光合作用差异造成,因为碳氮平衡主要是通过谷氨酰胺合成酶/谷氨酸合成酶循环、卡尔文循环、三羧酸循环实现[29]。但两个都没有达到差异显著水平,如图1(a)所示,可能是由于处理时间不够长或者统计样本不够多而不能显示微小差异。
在正常条件下,雌株杨树的叶绿素含量、气孔导度与细胞内CO2浓度显著比雄株高,但蒸腾速率比雄株低,说明雌株可能比雄株拥有更高的光合作用效率,这也可能是雌株体内总碳含量比雄株略高的原因。在低氮胁迫条件下,雌株受到影响更大,叶绿素含量下降幅度比雄株大,尽管气孔导度、细胞内CO2的浓度比雄株高,但净光合作用效率显著比雄株低,这也与以往提出“雌株比雄株对不利环境更加敏感”的结论一致[10]。但是尽管低氮条件下,雄株与雌株的光合作用速率都不同程度下降,但总碳含量在处理前后的两种材料中均没有表现显著差异,可能与选取幼嫩(3~4片叶)叶片为材料造成的,因为氮元素以及光合作用产物都能够在植物中进行长距离运输,植物可能会优先保证幼嫩组织的营养供给,具体原因还有待于后续研究解答。
光合作用和呼吸作用是植物能量转化最重要的两个过程,在这个过程中常常伴随大量的活性氧(ROS)的产生与清除,高浓度的活性氧往往对植物磷脂、蛋白以及DNA等造成不可逆的损伤[30],最近的研究还发现活性氧物质可以作为一种信号分子参与Ca2+、ABA等信号通路调节植物抗逆性[31]。而活性氧物质在氮胁迫条件下不同性别的杨树中的研究还比较少,在本研究中,无论在正常或低氮胁迫条件下,雌株细胞内的总活性氧含量显著低于雄株材料,这可能与两者抗氧化酶活性有关,因为除了过氧化氢酶之外,其余功能酶在雌株的活性显著高于雄株。此外,雌雄单株光合作用的效率也可能是抗氧化酶活性差异的主要原因,以往研究发现强光条件下,SOD、APX以及MDA还原酶的活性显著增加[32]。
在雌株与雄株中,可溶性蛋白的含量没有显著差异,但都显著受低氮胁迫抑制,这种差异可能是由可利用的游离氨基酸下降造成。氨基酸的组成和含量也会受不同胁迫而改变。在四球藻中,脯氨酸和谷氨酸的含量受低氮和镉离子的诱导[33]。在小叶杨中添加铵态氮或硝态氮两种不同形态氮元素作为氮源,其叶片中氨基酸的种类和浓度具有显著差异,其中精氨酸、缬氨酸和谷氨酸的含量显著受铵态氮含量的调节,而精氨酸和谷氨酸的含量主要受硝态氮的调节,其他氨基酸含量则没有显著区别[34]。在本研究中,天门冬氨酸、丝氨酸、苏氨酸以及精氨酸等含量在雌雄材料中存在显著差异,而苯丙氨酸、组氨酸、亮氨酸以及异亮氨酸等氨基酸的含量不受性别和低氮胁迫的影响,但是色氨酸的含量在低氮胁迫条件下含量特异性升高,这种现象产生的机理还有待进一步研究。
[1]Frink C R,Waggoner P E,Ausubel J H.Nitrogen fertilizer:retrospect and prospect[J].Proceedings of the National Academy of Sciences,1999,96(4):1175-1180.
[2]Good A G,Shrawat A K,Muench D G.Can less yield more? Is reducing nutrient input into the environment compatible with maintaining crop production?[J].Trends in Plant Science,2004,9(12):597-605.
[3]Cerezo M,Tillard P,Filleur S,et al.Major alterations of the regulation of root NO3-uptake are associated with the mutation of Nrt2.1 and Nrt2.2 genes in Arabidopsis[J].Plant Physiology,2001,127(1):262-271.
[4]Renner S S,Ricklefs R E.Dioecy and its correlates in the flowering plants[J].American Journal of Botany,1995,82(5):596-606.
[5]何 梅,孟 明,施大伟,等.雌雄异株植物对干旱胁迫响应的性别差异[J].植物资源与环境学报,2015,24(1):99-106.
[6]陈 娟,李春阳.漫谈雌雄异株植物[J].生命世界.2015(11):40-45.
[7]Dawson T E,Ehleringer J R.Gender-specific physiology,carbon isotope discrimination,and habitat distribution in boxelder,Acer negundo[J].Ecology,1993,74(3):798-815.
[8]杨马进,严贤春,罗建勋,等.曼地亚红豆杉雌雄株枝条与叶片形态特性研究[J].四川林业科技,2016,37(1):37-40.
[9]Eppley S M.Females make tough neighbors:sex-specific competitive effects in seedlings of a dioecious grass[J].Oecologia,2006,146(4):549-554.
[10]Zhang S,Jiang H,Peng S,et al.Sex-related differences in morphological,physiological,and ultrastructural responses ofPopuluscathayanato chilling[J].Journal of Experimental Botany,2010,62(2):675-686.
[11]Chen L,Zhang S,Zhao H,et al.Sex-related adaptive responses to interaction of drought and salinity inPopulusyunnanensis[J].Plant,Cell & Environment,2010,33(10):1767-1778.
[12]Wang X,Curtis P S.Gender-specific responses ofPopulustremuloidesto atmospheric CO2enrichment[J].New Phytologist,2001,150(3):675-684.
[13]Xu X,Yang F,Xiao X,et al.Sex-specific responses ofPopuluscathayanato drought and elevated temperatures[J].Plant,Cell & Environment,2008,31(6):850-860.
[14]Xu X,Zhao H,Zhang X,et al.Different growth sensitivity to enhanced UV-B radiation between male and femalePopuluscathayana[J].Tree Physiology,2010,30(12):1489-1498.
[15]Li X,Yu E,Fan C,et al.Developmental,cytological and transcriptional analysis of autotetraploid Arabidopsis[J].Planta,2012,236(2):579-596.
[16]Gan H,Jiao Y,Jia J,et al.Phosphorus and nitrogen physiology of two contrasting poplar genotypes when exposed to phosphorus and/or nitrogen starvation[J].Tree Physiology,2016,36(1):22-38.
[17]Cavani L,Ciavatta C,Gessa C.Identification of organic matter from peat,leonardite and lignite fertilisers using humification parameters and electrofocusing[J].Bioresource Technology,2003,86(1):45-52.
[18]He J,Qin J,Long L,et al.Net cadmium flux and accumulation reveal tissue-specific oxidative stress and detoxification inPopulus×canescens[J].Physiologia Plantarum,2011,143(1):50-63.
[19]Feng Z,Zhou X,Wu F,et al.Both dietary supplementation with monosodium L-glutamate and fat modify circulating and tissue amino acid pools in growing pigs,but with little interactive effect[J].PloS One,2014,9(1):e84533.
[20]Luo Z B,Polle A.Wood composition and energy content in a poplar short rotation plantation on fertilized agricultural land in a future CO2atmosphere[J].Global Change Biology,2009,15(1):38-47.
[21]Rennenberg H,Wildhagen H,Ehlting B.Nitrogen nutrition of poplar trees[J].Plant Biology,2010,12(2):275-291.[22]Plett D,Toubia J,Garnett T,et al.Dichotomy in the NRT gene families of dicots and grass species[J/OL].PloS One,2010,5(12):http://dx.doi:10.1371/journal.pone.0015289.
[23]Li H,Li M,Luo J,et al.N-fertilization has different effects on the growth,carbon and nitrogen physiology,and wood properties of slow-and fast-growing Populus species[J].Journal of Experimental Botany,2012,63(17):6173-6185
[24]Ehlting B,Dluzniewska P,Dietrich H,et al.Interaction of nitrogen nutrition and salinity in Grey poplar (Populustremula×alba)[J].Plant,Cell & Environment,2007,30(7):796-811.
[25]Dluzniewska P,Gessler A,Dietrich H,et al.Nitrogen uptake and metabolism inPopulus×canescensas affected by salinity[J].New Phytologist,2007,173(2):279-293.
[26]Coruzzi G M,Zhou L.Carbon and nitrogen sensing and signaling in plants:emerging ’matrix effects’[J].Current Opinion in Plant Biology,2001,4(3):247-253.
[27]Gifford R M,Barrett D J,Lutze J L.The effects of elevated [CO2]on the C:N and C:P mass ratios of plant tissues[J].Plant and Soil,2000,224(1):1-14.
[28]Makino A,Harada M,Sato T,et al.Growth and N allocation in rice plants under CO2enrichment[J].Plant Physiology,1997,115(1):199-203.
[29]包爱丽.超量表达氮代谢关键基因对水稻碳氮代谢的影响[D].武汉:华中农业大学,2013.
[30]Cross C E,Halliwell B,Borish E T,et al.Oxygen radicals and human disease[J].Annals of Internal Medicine,1987,107(4):526-545.
[31]Cho D,Shin D,Jeon B W,et al.ROS-mediated ABA signaling[J].Journal of Plant Biology,2009,52(2):102-113.
[32]Mishra N P,Mishra R K,Singhal G S.Changes in the activities of anti-oxidant enzymes during exposure of intact wheat leaves to strong visible light at different temperatures in the presence of protein synthesis inhibitors[J].Plant Physiology,1993,102(3):903-910.
[33]Chia M A,Lombardi A T,Melão M G,et al.Combined nitrogen limitation and cadmium stress stimulate total carbohydrates,lipids,protein and amino acid accumulation inChlorellavulgaris(Trebouxiophyceae)[J].Aquatic Toxicology,2015,160:87-95.
[34]Meng S,Su L,Li Y,et al.Nitrate and ammonium contribute to the distinct nitrogen metabolism ofPopulussimoniiduring moderate salt stress[J/OL].PLoS One,2016,11(3):http://dx.doi.org/doi:10.1016/j.aguat ox.2015.01.002.
Physiological Study on Sexual Differences in Responseto Nitrogen Stress in Poplar Trees
Li Xiaodong1,Cai Lu2,Zhang Yu1,Wang Qian1,Wang Xiaoli1*
(1.Guizhou Institute of Prataculture,Guizhou Academy of Agriculture Scuence,Guiyang,Guizhou 550006;2.Guizhou Institute of Prataculture,Guizhou Academy of Agricultve Suience,Gui yang,Guizhou 550006)
Poplar tree is a model plant in forestry research.As The representative dioecious plant,poplar plays an important role in physiological,gene expression and derived epigenetic researches from sexual differences.Nitrogen is essential for plant growth and development,however,the mechanisms of nitrogen absorption and assimilation especially the nitrogen use efficiency in two different genders of one plant have not been well studied yet.In this study,a systematical examination of carbon and nitrogen content,photosynthesis efficiency and its parameters,the antioxidant enzyme activities as well as soluble protein and free amino acid concentrations were performed in male and female poplar trees under normal and nitrogen stress conditions.It was found that carbon content increased under nitrogen stress condition,and the female plants were more sensitive than the male plants.Total reactive oxygen species (ROS) concentration was insignificantly different between the male and female plants,but the activities of antioxidant enzymes,such as peroxidase (POD),superoxide dismutase (SOD) and glutathione synthetase (GS),were higher in female individuals than that in male ones.Soluble protein concentrations were similar in the two genders,while the amino acids content varied a lot in male and female individuals under the control and under the nitrogen stress conditions.Aspartic acid (Asp),serine(Ser),as well as arginine (Arg),etc.were higher in male plants under normal condition;most of the free amino acids were suppressed by nitrogen stress except methionine (Met),leucine (Leu) and tyrosine (Tyr),etc.We mainly analyzed physiological difference between the female and male poplar plants under the normal and nitrogen conditions.A and the potential mechanisms were also discussed.
Poplar tree;Nitrogen stress;Antioxidant enzyme activity;Free amino acid
2016-04-19
农科院自主创新科研专项(黔农科院自主创新科研专项字[2014]010号);贵州省联合基金项目(黔科合J字LKN[2013]04号);贵州省农科院院专项基金(黔农科院院专项[2013]003号)
李小冬,博士,副研究员。研究方向:植物生理与分子生物学。
*通信作者:王小利,博士,副研究员。研究方向:分子生物学与基因组学研究。E-mail:wangxiaolizhenyuan@126.com
李小冬,蔡 璐,张 瑜,等.不同性别杨树应答低氮胁迫的生理学研究[J].森林工程,2016,32(6):24-29.
S 757.2
A
1001-005X(2016)06-0024-06
