两种植物在不同生长期控制Na+流入的差异
2016-11-24王春梅朱新强贺洞口杰段慧荣王晓力
王春梅,张 茜,朱新强,贺洞口杰,段慧荣,王晓力
(中国农业科学院兰州畜牧与兽药研究所,兰州 730050)
草地与牧草
两种植物在不同生长期控制Na+流入的差异
(中国农业科学院兰州畜牧与兽药研究所,兰州 730050)
控制Na+进出植物根系的能力是研究植物耐盐机制的关键,但由于测量技术和条件的限制,目前关于植物根系Na+内流速率受生长阶段的影响还无相关研究。该研究采用非损伤微测技术,选取小麦与野大麦为代表材料,研究了单子叶甜土植物与单子叶盐生植物在不同生长阶段下的根系Na+内流速率差异。结果表明:2个盐浓度处理下野大麦和小麦根系的Na+内流速率都随生长而逐渐增大:2~3叶期,2个材料之间Na+内流速率差异不显著(P>0.05);4叶期时,浓度为25 mmol/L NaCl处理下野大麦比小麦低10%,但差异也不显著(P>0.05);浓度为100 mmol/L NaCl时野大麦比小麦高19%,差异显著(P<0.05)。可见,生长阶段能显著影响植物控制Na+流入的能力,4叶期以后的野大麦比小麦吸收更多的Na+。因此,在比较植物耐盐能力以及相关研究时应考虑生长阶段的影响。
非损伤微测技术;Na+内流;甜土植物;盐生植物
拒盐是单子叶植物主要的耐盐方式之一[1],主要通过测定植物根系Na+的内流速率来表现[2]。目前,对于根系Na+的内流研究的植物种类较多,例如拟南芥[3]、盐芥[4]、大麦[5-6]、拟漆姑[7]、小麦[8-10]、玉米[11]、碱蓬[12]等。但是关于植物生长阶段对根系Na+的内流速率的影响还没有系统研究。如果不考虑生长阶段的影响,就很难对不同研究中(尤其是在不同物种之间)的结果作出合理判断[2]。因此,本研究选取小麦(Triticum aestivum,陇春26,甜土植物)与野大麦(Hordeum brevisubulatum(Trin.)Link,盐生植物)为代表,测定了这两种植物2~4叶期的Na+单向内流速率变化差异,以期为相关研究提供参考。
1 材料与方法
1.1 材料培养及盐处理
将小麦(Triticum aestivum,陇春26)与野大麦种子置白瓷盘中铺有吸水纸的萌发架上,浇蒸馏水萌发,暗培养,25℃。萌发后改光照培养16 h/8 h(昼/夜),光强度约600 μmol/m2,并改浇修正的Hoagland营养液[10]。至植株第2叶出现时移至培养盒中,以Hoagland营养液通气泵加气培养,野大麦每5棵为一重复,小麦每2棵为一重复。分别至植株发育到第2叶、第3叶、第4叶,以25 mmol/L和100 mmol/L NaCl(按浓度递增50 mmol/12 h)的营养液进行盐胁迫处理,处理7 d后进行示踪实验。
1.2 植株根系Na+内流速率测定
参考Sun等[14]的方法,通过非损伤微测技术(MIFE)测定活体野大麦和小麦根系表面的净Na+流速。首先将微电极用Na+(0.3 mmol/L,0.9 mmol/L,3 mmol/L)缓冲液分别进行校准,之后将不同生长阶段的小麦和野大麦的全株从NaCl处理过的培养液中取出,轻轻冲洗根表面,之后置于培养皿中加入10 mL的测试液平衡15 min。测试液的成分为:0.1 mmol/L KCl,0.1 mmol/L CaC12, 0.1 mmol/L MgC12,0.5 mmol/L NaCl,0.2 mmol/L Na2SO4,0.3 mmol/LMES,pH值6.0。平衡结束取出植株将根置于测试液中,电极置于根尖分生区后接近侧根生长区的位置,记录电压信号变化幅度相对稳定的0~400 s。之后通过旭月公司的软件(Mage Flux software)换算得到Na+流速(pmol·cm-2·s-1),并将0~400 s之间的平均值作为本实验的Na+流速计算值。为了消除实验中其他离子影响的误差,将得到的流速数据以对照值(0 mmol/L NaCl)设为0作为基准值进行换算得到最终的流速值,每个处理设6个重复。
软件计算原理公式:①Nerst方程:V-lg[C]②Fick's第一扩散定律:J-dC
1.3 数据处理及计算
所有数据用平均值±标准误进行计算,用SPSS程序对所有数据进行差异显著性分析。
2 结果与分析
2.1 根鲜重
从图1可以看出,由于野大麦与小麦隶属于小麦族的不同属,单株鲜重差异较大,但是二者根鲜重随着生长阶段的增加幅度相近。在25 mmol/LNaCl处理下,3、4叶期的野大麦根鲜重分别为2叶期的2.0倍和3.8倍(图1 a);小麦则分别为1.9倍和2.6倍(图1 b)。在100 mmol/L NaCl处理下,3、4叶期的野大麦根鲜重分别为2叶期的1.9倍和3.5倍(图1 a);小麦则分别为1.6倍和2.3倍(图1 b)。可见,两个材料根生长状况相似,实验具有可比性。
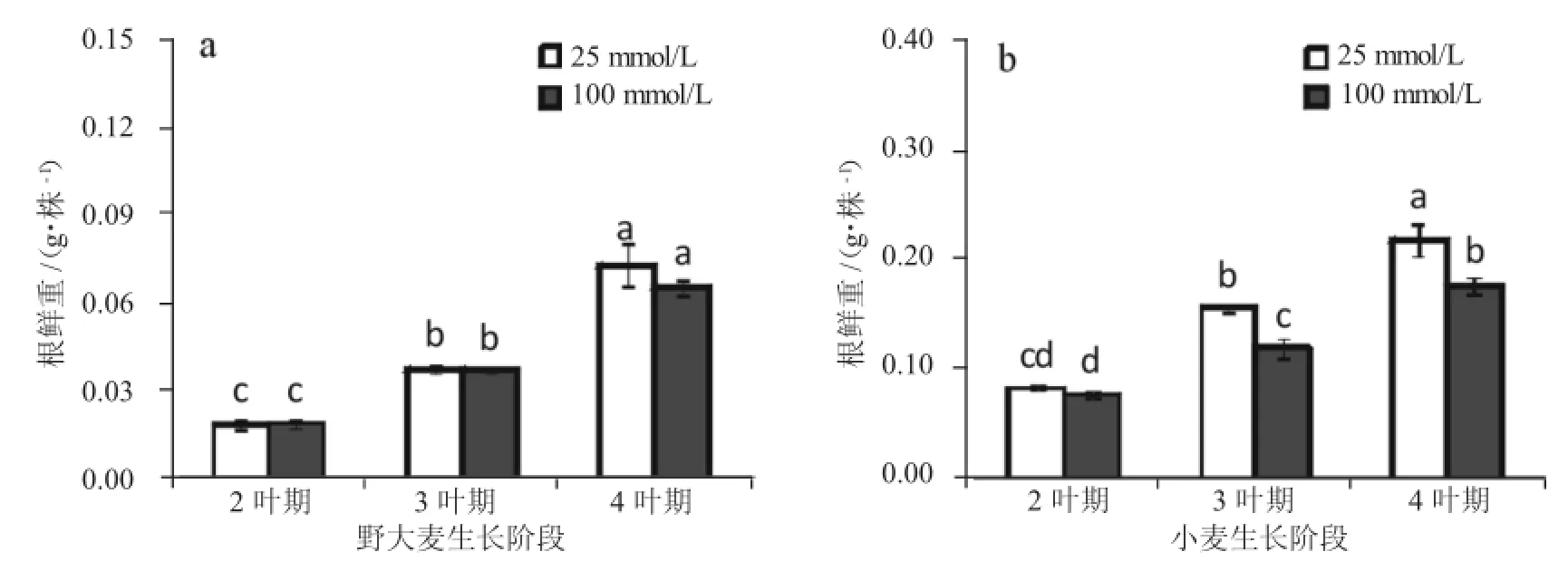
图1 不同生长阶段下野大麦(a)与小麦(b)根系鲜重的变化情况
2.2 Na+内流速率
从图2可以看出,两个实验材料根系的单向Na+内流速率均随着生长阶段增加而逐步增大。在2~3叶期,野大麦与小麦的Na+内流速率均差异不显著(P>0.05)(图2 a,b)。在4叶期,野大麦与小麦Na+内流速率差距随着生长阶段逐渐增大:浓度为25 mmol/L NaCl时野大麦比小麦低10%,但差异不显著(P>0.05);浓度为100 mmol/L NaCl时野大麦比小麦高19%,分别为0.82 μmol/(g根鲜重·min)和0.66 μmol/(g根鲜重·min),且差异显著(P<0.05)(图2 b)。可见,生长阶段对两种植物内流速率的影响差异主要体现在高盐胁迫条件和4叶期以后。
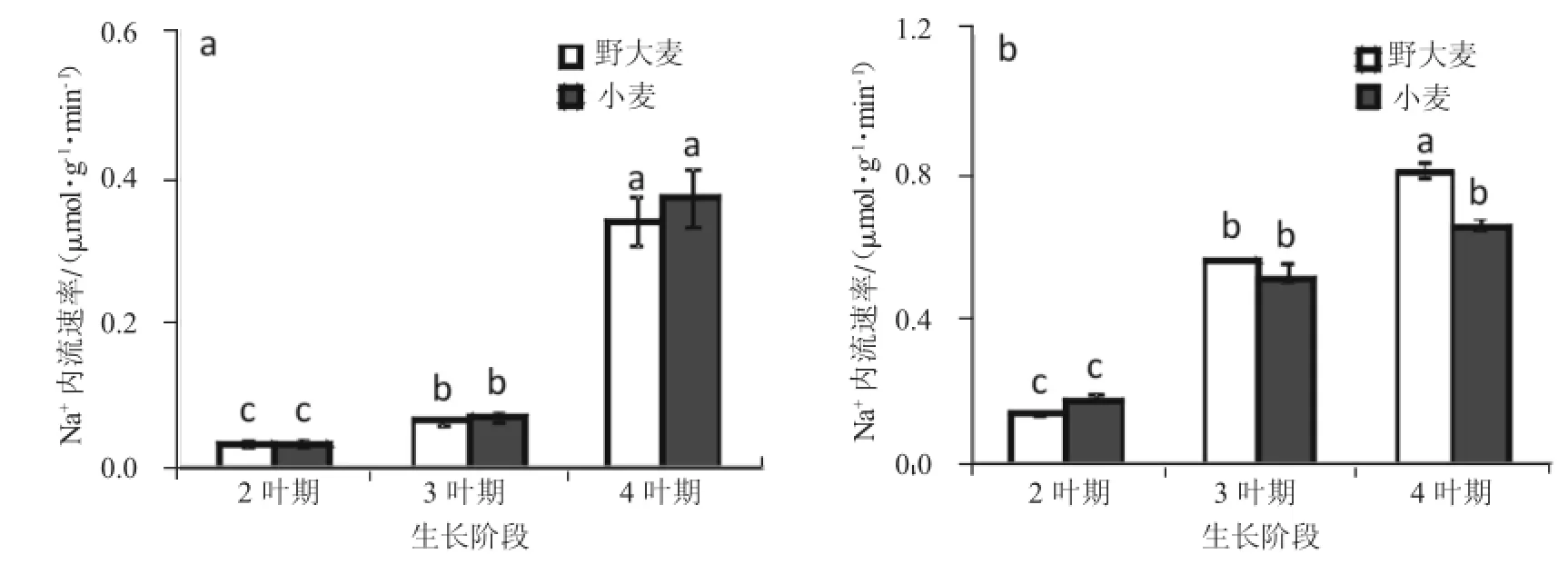
图2 25 mmol/L(a)、100 mmol/L(b)NaCl浓度处理下,2~4叶期野大麦与小麦内流速率的变化
3 讨论
盐分胁迫对植物生长发育各阶段都能产生重要影响,而植物发育早期对盐度的适应能力是决定其生存优势的关键因素。在2~4叶期,野大麦与小麦根系Na+内流速率均随生长发育阶段而逐步增大。这可能由于一方面幼苗生长初期的根皮层、木质部、气孔、叶绿体等组织发育不完全,蒸腾和光合较低[13],水分和离子运输量较小,另一方面种子储存的淀粉、蛋白、脂肪等营养物质保持了幼苗细胞质中较高的渗透势,使得二者Na+内流速率在初期均较低;之后随着植株的生长发育,营养物质逐渐消耗,光合与蒸腾增强,水分和离子内流速率随之增大。
在低浓度NaCl(25 mmol/L)处理下,野大麦与小麦Na+内流速率差异不显著(P>0.05),说明低浓度NaCl条件下野大麦与小麦组织均未受到盐分胁迫,对于Na+内流的控制能力相似。在高盐浓度(100 mmol/LNaCl)处理下,2~3叶期的野大麦与小麦Na+内流速率之间差异不显著(P>0.05),这可能是因为野大麦生长初期耐盐性还没有体现出与小麦之间的区别。Davenport等[9]认为一般植物组织在3叶期以后发展较为成熟。4叶期时野大麦内流速率显著高于小麦(P<0.05),说明4叶期以后野大麦耐盐系统发育逐步完善,可以通过大量吸收Na+积累到液泡中作为渗透调节物质进行渗透调节。因此,在比较不同物种间的耐盐能力时,应选择适合的生长阶段进行实验才更科学。
[1] Greenway H,Munns R.Mechanisms of salt tolerance in nonhalophytes[J].Annual Review of Plant Physiology,1980,31:149-190.
[2] Tester M,Davenport R.Na+tolerance and Na+transport in higher plants[J].Annals of Botany,2003,91:1-25.
[3] Essah P A,Davenport R,Tester M.Sodium influx and accumulation in Arabidopsis[J].Plant Physiol,2003,133:307-318.
[4] Wang B,Davenport R J,Volkov V,et al.Low unidirectional sodium influx into root cells restricts net sodium accumulation in Thellungiella halophila,a salt-tolerant relative of Arabidopsis thaliana[J].Journal of Experimental Botany,2006,57(5):1161-1170.
[5] Kronzucker H J,Szczerba M W,Moazami-Goudarzi M,et al.The cytosolic Na+:K+ratio does not explain salinity induced growth impairment in barley:a dual-tracer study using42K+and24Na+[J].Plant,Cell Environ,2006,29:2228-2237.
[6] Chen Z H,Pottosin II,Cuin T A,et al.Root plasma membrane transporters controlling K+/Na+homeostasis in salt stressed barley[J].Plant Physiol,2007,145:1714-1725.
[7] Lazof D.Cheeseman J M.Sodium transport and compartmentation in Spergularia marina[J].Plant Physiol,1986,81:742-747.
[8] Davenport R J,Reid R J,Smith F A.Sodium-calcium interactions in two wheat species differing in salinity tolerance[J].Physiologica Plantarum,1997,99:323-327.
[9] Davenport R,James R A,Zakrisson-Plogander,et al.Control of sodium transport in durum wheat[J].Plant Physiol,2005,137:807-818.
[10]Wang C M,Zhang J L,Liu X S,et al.Puccinellia tenuiflora maintains a low Na+level under salinity by limiting unidirectional Na+influx resulting in a high selectivity for K+over Na+[J].Plant,Cell Environ,2009,32:486-496.
[11]Schachtman D P,Liu W H.Molecular pieces to the puzzle of the interaction between potassium and sodium uptake in plants[J].Trends in Plant Science,1999,4:281-287.
[12]Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyte Suaeda maritima[J].Plant Physiol,2007,145:559-571.
[13]许祥明,叶和春,李国凤.植物抗盐机理的研究进展[J].应用与环境生物学报,2000,6(4):379-387.
[14]J Sun,S L Chen,S X Dai,et al.NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and salt-sensitive poplar species[J].Plant Physiol,2009(149):1141-1153.
Influence of Growth Stage on Na+Influx in Two Plant Species
WangChunmei,ZhangQian,WangXiaoli,et al
(Lanzhou Institute ofHusbandryand Pharmaceutics sciences ofCAAS,Lanzhou 730050,China)
The abilityofcontrollingNa+influxand effluxofplant roots is the keytostudythe mechanismofsalt tolerance in plants. However,due tothe limitation ofmeasurement techniques and conditions,the influence of growth stage on the ability of Na+influx in plants remains elusive.Gramineous halophyte wild barleyand glycophyte wheat were chosen there,for testingthe unidirectional Na+influxes of monocotyledonous at 2 leaves,3 leaves and 4 leaves stages,respectively.The micro-electrode ion flux estimation technique experiments showed that Na+influx increased obviously with the plant growth stage in both species.There was no significant difference between wild barleyand wheat under 2-3 leave stage(P>0.05).At 4 leaves stage,wild barleywas lower by 10%than that ofwheat under 25 mmol/LNaCl(P>0.05),but under 100 mmol/LNaCl,Na+influxofwild barleywas significantly higher by 19%than that of wheat(P<0.05).These indicated that growth stage had obvious influence on the Na+fluxes in both species;and wild barleyhad stronger abilityofNa+influxthan wheat under 4 leaves stage.Therefore,plant growth stage should be considered in salt tolerance and relative researches.
micro-electrode ion fluxestimation technique;Na+influx;glycophyte;halophyte
S54
A
2095-3887(2016)05-0039-03
10.3969/j.issn.2095-3887.2016.05.010
2016-06-27
国家自然科学基金(31201841);中国农业科学院科技创新工程项目(CAAS-ASTIP-2014-LIHPS-08)
王春梅(1981-),女,助理研究员。研究方向:牧草抗逆生理与育种学。
王晓力,女,副研究员。
