基于纳米有机液体的高性能温差电池
2016-11-22孙浩宇濮金欢唐桂华
孙浩宇 濮金欢 唐桂华
(西安交通大学能源与动力工程学院,热流科学与工程教育部重点实验室,西安710049)
基于纳米有机液体的高性能温差电池
孙浩宇濮金欢唐桂华*
(西安交通大学能源与动力工程学院,热流科学与工程教育部重点实验室,西安710049)
传统液体温差电池较低的热电转换性能一直无法得到有效改善,亟需寻找新的热电转换机制来提升热电转换效率。本文采用分子动力学(MD)方法,数值模拟研究了不同温度下以不同配比的甘油-水为溶剂的氯化钠溶液在碳纳米管(CNT)内离子、分子分布情况。结果表明:离子、分子的分布受温度影响较大,近壁面净电荷、电势分布随温度升高出现明显的分层。根据模拟结果提出以CNT为电极材料,甘油氯化钠溶液或甘油水氯化钠溶液为电解质溶液组成温差电池。其热电转换性能远优于大多数温差电池,同时温度适用范围也显著增加。以多孔碳为电极材料,甘油氯化钠溶液为电解质溶液组成的热电转换装置实验验证了可行性。
分子动力学;温差电池;碳纳米管;低温能源利用;热电转换
本文提出采用甘油氯化钠溶液和甘油水二元混合氯化钠溶液作为电解质溶液,可明显降低溶液的表面张力,使溶液更易于浸润CNT,稳定性也相应地提高,同时随着甘油在溶剂中的比例增大,相同温差下产生的电势也随之增大,热电转换性能显著增加。除此之外甘油与水相互混合增加了热电转换的温度范围,不再局限于0-100°C内,显著增加了液体热电转换的适用范围。
2 数值方法及物理模型
采用分子动力学方法,基于开源软件Lammps26进行计算。物理模型如图1所示,计算中选用CNT(20,20)扶手椅型碳纳米管并固定,其半径R=1.356 nm,计算长度l=9.838 nm,不同模拟工况其电解质溶液组分见表1,初始温度T=300 K,压力为p=0.1 MPa。本文采用Class 2力场中的PCFF力场(force field for polycarbonate)以及宏观正则系综(NVT系综,其中N代表体系中原子个数,V代表体积,T代表温度),CNT与溶液中分子、离子之间的势能函数为E=εij[2(σij/rij)9-3(σij/ rij)6],交互作用参数采用Lorentz-Berthelot混合计算法则,截断半径设为1 nm,盒子轴向采用周期性边界条件,时间步长为1 fs。模拟1 ns使溶液达到平衡阶段,平衡之后继续模拟1 ns并进行数据输出,总模拟时间为2 ns。
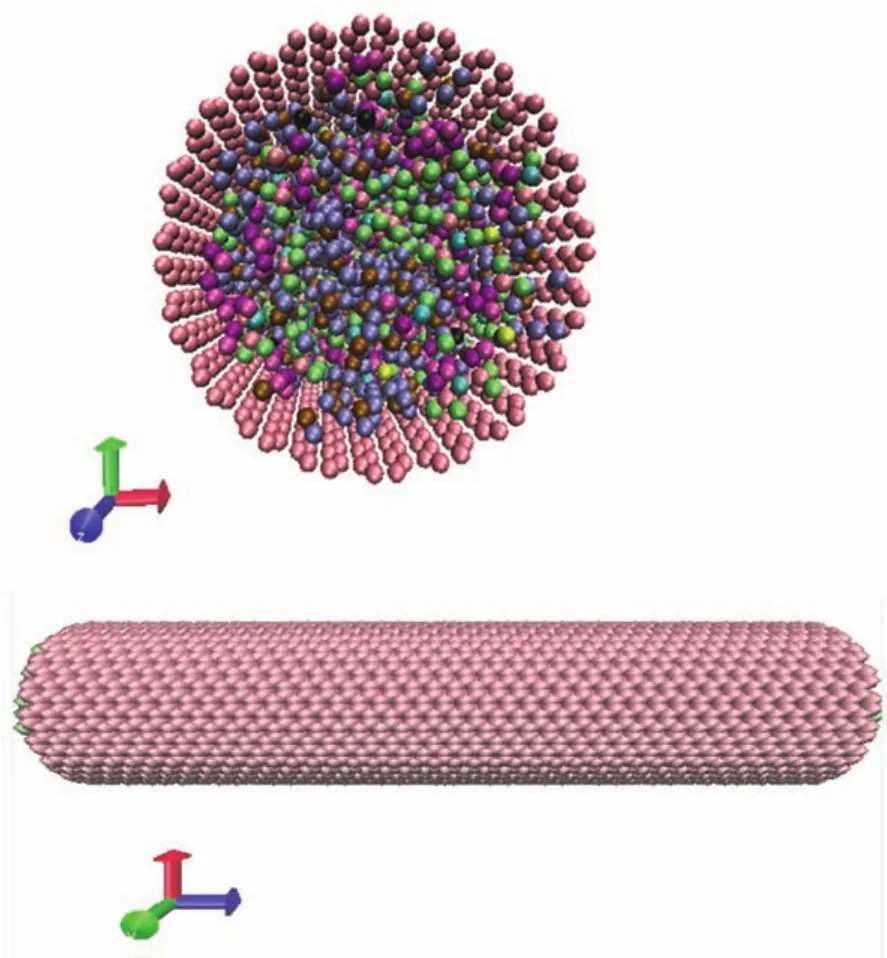
图1 模拟的物理模型Fig.1 Physical model of simulation
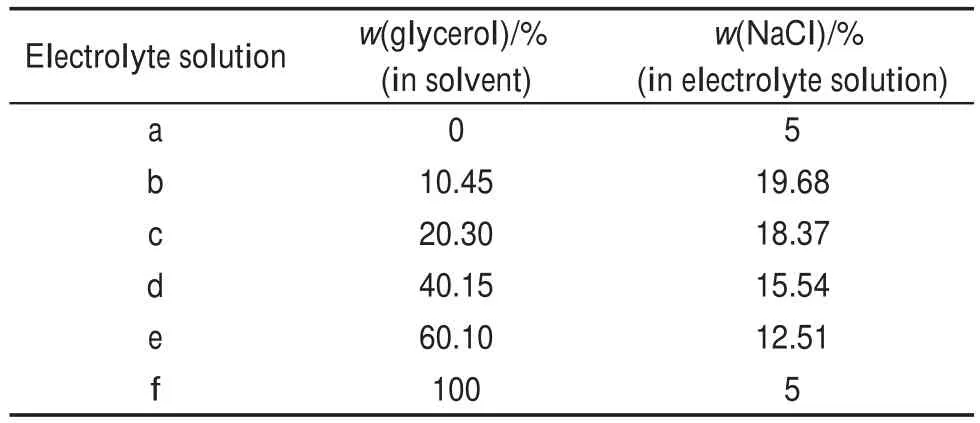
表1 甘油/甘油-水电解质溶液各组分含量Table 1 Content of each component in glycerine/glycerolaqueous electrolyte solution
3 结果与分析
3.1CNT内分子和离子分布特性
图2为温度300 K时CNT内电解质溶液中离子、分子的分布情况,横坐标表示距离管径中心的距离。图2(A)为不同工况下Na+分布情况,图2 (B)为H(甘油分子中与碳原子直接成健的氢原子)分布情况。从图2(A)中可知,不同工况下近壁面处Na+具有相似分布特性,从图2(B)可知,不同工况下近壁面处H的分布特性同样相似。事实上不同工况下溶液中其他离子、分子均表现出相似的分布特性,本文不再赘述。由于不同工况下CNT内离子、分子分布特性相似,下文选取溶剂中甘油含量为60.10%的氯化钠电解质溶液(简称60.10%甘油电解质溶液)进行分析。图2(C)为Na+和Cl-在CNT中径向分布情况;图2(D)为甘油分子和水分子在CNT内分布情况,左边纵坐标是甘油分子中各原子(C1表示分子链中间碳原子,C2表示碳链两端的碳原子,H表示直接与碳原子连接的氢原子,HO表示与氧原子相连的氢原子,OH表示与氢原子相连的氧原子)密度在CNT中径向分布数值,右边纵坐标是水分子中各原子(H1表示水中的氢原子,O1表示水中的氧原子)密度在CNT中径向分布数值。由图3可知,阴阳离子以及分子密度在近壁面处出现大的波动。溶液中的H原子距离壁面比O和C原子近,Na+距离壁面比Cl-近。前者是因为H受到CNT壁面的斥力比溶液中的O、C弱;后者主要因为Na+的半径比Cl-的半径小,所以Na+受到来自H原子的引力较强,受到O、C原子的斥力较弱22。
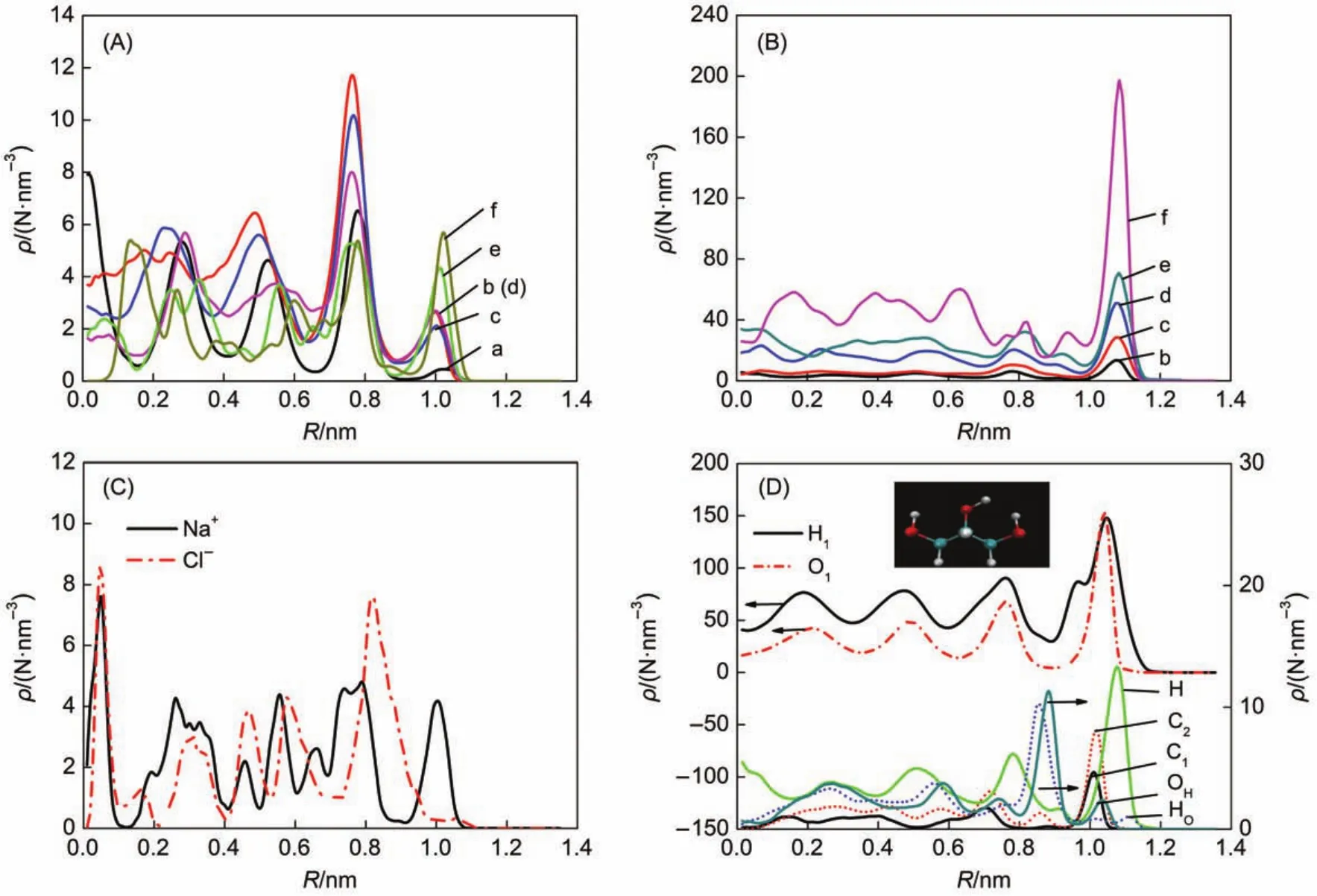
图2 300 K时CNT中电解质溶液离子、分子分布Fig.2 Number density distribution of the ions and molecules in electrolyte solution of the CNT at 300 K
根据Poisson方程可以得到相应的电势φ分布,Poisson方程如下

式中,ε0表示真空介电常数;ε表示溶液的介电常数;ρne(r)表示净电荷密度,可由下式获得:

式中,n表示溶液中粒子总数;ci表示第i个离子或原子的电荷量。
根据二元无规混合物有效介电常数的计算公式,可得到甘油水氯化钠溶液的有效介电常数ε,其计算公式如下27
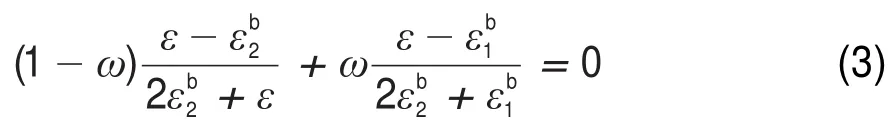
式中,ω表示溶质质量分数;ε1b=2ω/(3-ω)ε21,εb=2(1-ω)/(2+ω)ε1,ε2表示氯化钠的介电常数,ε2表示甘油或甘油水混合溶液的介电常数,如表2所示28。
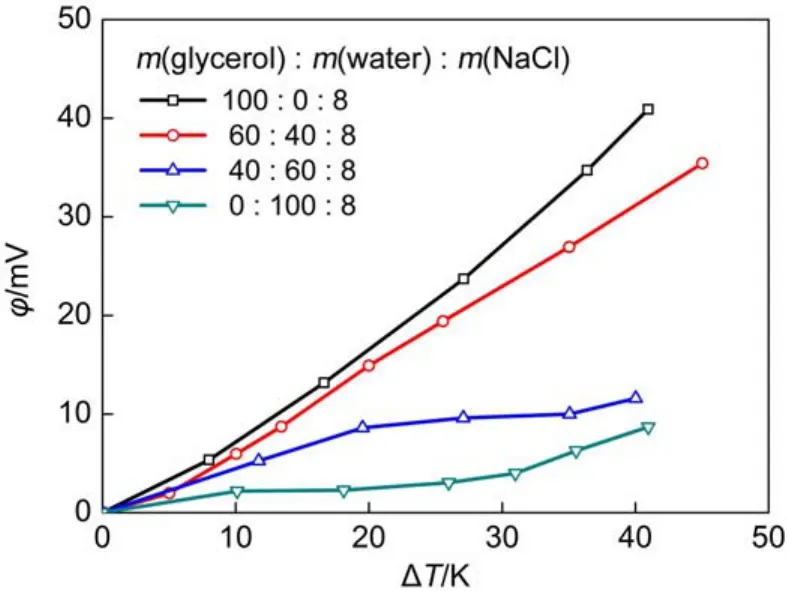
图3(A)为T=300 K时60.10%甘油电解质溶液在CNT内净电荷密度分布情况。可见,在CNT管壁附近的净电荷密度波动较大,这是由于CNT管壁附近离子、原子密度分布不均匀,并且相对集中;同时在CNT内近壁面净电荷密度分布随着温度的升高而下降,这是因为温度越高,近壁面附近的离子越易获得能量,脱离近壁面的束缚,导致净电荷密度降低,即温度越高,近壁面内净电荷密度越低。图3(B)表示不同温度时60.10%甘油电解质溶液在CNT内电势分布。可见,近壁面电势随温度升高而增大,这是由于CNT内近壁面净电荷密度分布随温度升高而下降所导致。图3(C)为T=300 K时不同工况CNT内净电荷密度分布。观察到以纯水为溶剂的氯化钠溶液与以甘油为溶剂的氯化钠溶液相比波动的峰值比较平均,纯甘油氯化钠溶液的净电荷主要集中在近壁面附近;不同比例的甘油水混合饱和氯化钠溶液净电荷密度分布具有相同的波动规律,同时随甘油含量的增加和氯化钠含量的减少而降低。图3(D)给出了各工况处于不同温度CNT相互连接(如图3(E))输出电势φ随温差ΔT变化,同时与Chen等22模拟结论进行对比。可知,输出电势φ随温差ΔT增大而增加;纯甘油氯化钠溶液的输出电势φ明显大于纯水氯化钠溶液的输出电势;甘油水二元混合饱和氯化钠溶液的输出电势φ随甘油含量的增加及氯化钠含量的减少而升高,而根据Chen等22研究,纯水氯化钠溶液的输出电势φ应该随纯水氯化钠浓度减少而降低,所以输出电势φ逐渐增大主要是由甘油含量增加所导致。由图3(D)可知,本文模拟的氯化钠水溶液的结果与Chen等模拟结论相符合。

图3 CNT内电解质溶液净电荷密度及电势分布情况Fig.3 Distribution of net charge and electric potential in the CNT
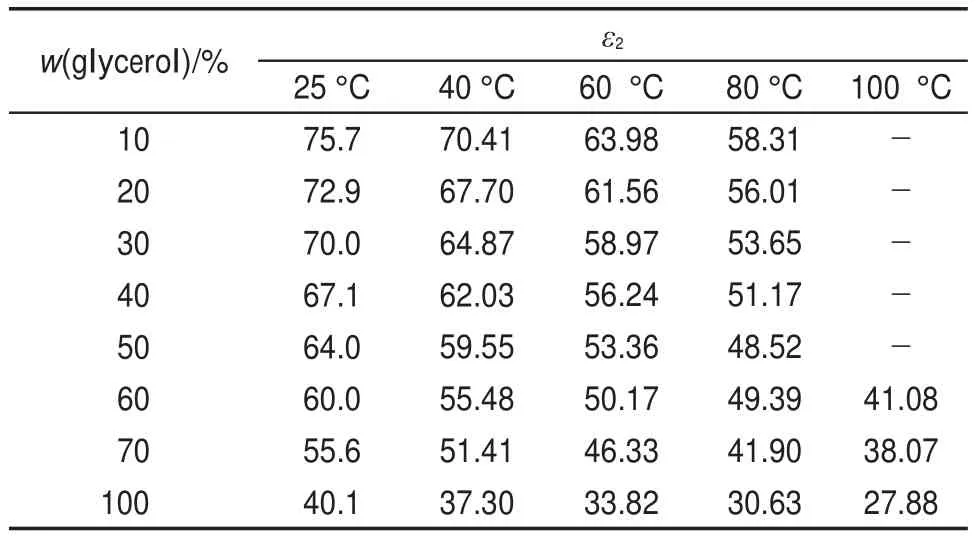
表2 不同比例的甘油和水混合物在不同温度下介电常数(ε2)Table 2 Dielectric constants(ε2)of glycerol-water solutions under different temperatures
3.2热电转换效率与Seebeck系数
热电转换效率公式为η=Winput/Woutput,其中Winput表示输入功,Woutput表示输出功。液体温差电池热电转换过程类似于电容放电,输出功的过程也相当于电极放电做功,所以输出功Woutput可由下式给出22

其中U=Q/CT,则:

式中CT表示电容,ΔQ表示最大电荷变量,Q为近壁面总的初始电荷量。由于电容是由阴、阳极电容组成,故:

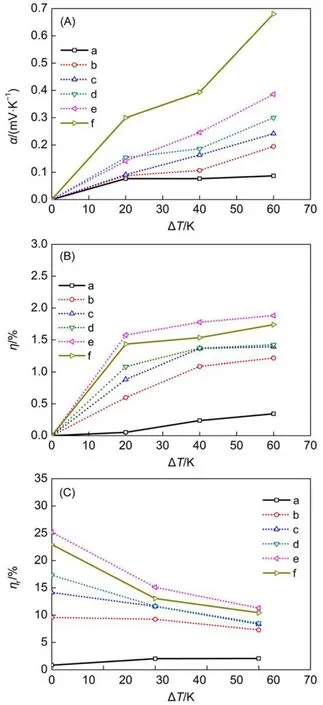
式中,Ca表示阳极电容;Cc表示阴极电容29。本文所选取的CNT属于介孔(2 nm 系统的输入功Winput为: 式中,Ci表示各原子/离子的比热容。对于甘油分子、水分子、C、Na+和Cl-的比热分别为202.58、74.54、8.52、27.60和33.95 J·mol-1。为了更好地描述系统的性能,通常采用其相对于卡诺循环的效率ηr: Seebeck系数计算公式为α=∂V/∂T,V表示电势,T表示温度;α表示电势随温度变化快慢。 图5(A)为不同工况下热电转换Seebeck系数α与温差ΔT的关系,发现纯甘油氯化钠溶液和甘油水氯化钠溶液热电转换的Seebeck系数随温差ΔT增加而增加,而纯水氯化钠溶液的Seebeck系数α随温差ΔT升高变化不明显;当温差ΔT=40,60 K时,甘油水氯化钠溶液的α随甘油含量的增加而增大。这说明在较大温差时,随着甘油含量的增加CNT内电解质溶液对温度的敏感性越高。图5(B)表示不同工况下热电转换效率η随温差变化,发现相同氯化钠浓度时,纯甘油氯化钠电解质溶液的效率η要远高于纯水氯化钠溶液;甘油水二元混合饱和氯化钠溶液时,热电转换效率随甘油含量的增加(氯化钠浓度减小)而增加,根据Chen等22研究可知,氯化钠浓度减小,热电转换效率减少,所以甘油含量的增加是引起热电转换效率升高的主要原因。图5(C)为不同工况下该机制相对于卡诺循环的热电转换效率ηr随温差的变化。纯甘油氯化钠溶液和甘油水氯化钠溶液热电转换ηr均随温差增加而减小,说明该机制的热电转换效率温差越小越接近卡诺循环效率,温差越大越偏离卡诺循环。 综上所述,在CNT内氯化钠浓度相同时氯化钠甘油溶液比氯化钠水溶液性能更佳;甘油水二元混合饱和氯化钠电解质溶液的热电转换性能在温差较小、甘油含量较多情况下更加优异。本文热电转换机制在ΔT=60 K时,相对于卡诺循环的热电转换效率ηr高达~11.30%,而大多数液体温差电池相对于卡诺循环的热电转换效率ηr仅为~1.40%13,16,20,30。 图4 电解质溶液中离子在介孔内分布示意图Fig.4 Schematic of distribution of ions in the mesopore in electrolyte solution 图5 不同浓度甘油溶剂电解质溶液的α、η、ηr随温差ΔT的变化情况Fig.5 Changes of α,η,and ηrwith ΔT in different electrolyte solutions 3.3实验验证 当电解质溶液限制在CNT中,由于阴阳离子径向分布的差异,以及溶剂分子中各原子分布不同而产生偶极子的有序取向31,32,会导致其内部电荷分布不均匀,产生净电荷及电势。通过模拟分析可知,CNT内净电荷及电势分布受温度影响较大,由此将处于不同温度下的CNT连接形成回路,能够输出电势φ,实现热能向电能的转换。本实验采用碳纳米多孔材料炭黑代替CNT验证该机制可行性。 实验以工业炭黑(纯度>99.5%,天津金秋实化工有限公司)为电极材料,甘油水-氯化钠溶液(甘油纯度>99%,氯化钠纯度>99.5%)为电解质溶液组成热电转换装置。首先,将炭黑用丙酮(纯度>98.5%)清洗4 h晾干;然后将其压制成直径为10 mm的圆盘电极,每个圆盘电极的质量电极大约为90 mg;最后用导电银胶将电极与边长为5 mm的铜箔(作为集流器)连接并放入DZ-3AII真空干燥箱(奥环电子产品有限公司)内,120°C烘干4 h,并将连接集流器侧的电极表面进行防水处理。实验系统示意图如图6所示。实验采用F26-ME恒温水浴系统(德国Julabo公司)保证两端温度恒定,冷、热两端采用直径为5 mm的盐桥连接。冷端温度保持25°C不变,通过调节高温端恒温水浴的温度来改变温差ΔT。用Keithley 2700数据采集器(美国Keithley公司)采集温度T以及不同温差ΔT下输出的电压φ。 图6 纳米有机液体温差电池实验示意图Fig.6 Schematic of the thermogalvanic cell based on organic nanofluids 图7 电极两端电势随温差ΔT变化情况Fig.7 Output electric potential between two electrodes 通过实验得到甘油氯化钠电解质溶液温差电池电势随温差变化情况,如图7所示。可知,电势随着温差ΔT的增大而增大,相同氯化钠浓度下氯化钠甘油电解质溶液产生的电势高于氯化钠水电解质溶液,甘油/水混合氯化钠电解质溶液电势随甘油含量的增加而增大,与数值模拟结果一致。同时发现,当氯化钠浓度相同时,溶剂中甘油含量下降到40%,电势随温差ΔT升高而增加的量明显下降,与纯水氯化钠电解质溶液接近,说明此时电解质溶液中甘油对离子分布的影响下降,本文认为是因为氯化钠在水中的溶解度大于在甘油中的溶解度导致。实验结果与数值模拟结果定量上的差异是由于实验所用的多孔电极的孔径及导电、导热性能和表面粗糙度均与碳纳米管存在差异。 通过MD方法模拟CNT-甘油氯化钠溶液及CNT-甘油水氯化钠溶液的纳米有机液体温差电池的热电转换过程以及实验验证研究,获得以下主要结论: (1)CNT内溶液中的离子、分子分布不均,近壁面净电荷密度ρne随温度升高而下降,近壁面电势φ随温差增加而增加。 (2)CNT内近壁面净电荷密度ρne随甘油含量增加以及氯化钠含量的降低而降低。 (3)将处于不同温度下的CNT相互连接形成回路能够实现热能向电能的转换,热电转换Seebeck系数及热电转换效率随温差的增加而增大,甘油/水二元混合饱和氯化钠溶液时,热电转换效率随甘油含量增加而增加;低温差时具有较高的ηr,其性能优于传统温差电池。 (4)实验验证发现,氯化钠浓度相同时,氯化钠甘油溶液热电转换性能要优于氯化钠水溶液,甘油水氯化钠电解质溶液电势随甘油含量增加而增加。 另外,CNT孔径、氯化钠的浓度、初始温度等均会影响热电转换性能。该热电转换机制具有以下优点:电极与溶液不存在化学反应,所以对电极材料的损耗极低,碳的排放量为零;电极材料可由工业炭黑代替,成本低;不同比例甘油水混合溶剂的凝固点和沸点不再局限于0和100°C,热电转换温度范围显著增加。该热电转换机制具有较高的转换效率,对将来的低温热电转换研究具有指导意义。 References (1) Heremans,J.P.;Dresselhaus,M.S.;Bell,L.E.;Morelli,D.T. Nat.Nanotech.2013,8,471.doi:10.1038/nnano.2013.129 (3) Snyder,J.G.;Toberer,E.S.Nat.Mater.2008,7,105. doi:10.1038/nmat2090 (5) Poudel,B.;Hao,Q.;Ma,Y.;Lan,Y.C.;Minnich,A.;Yu,B.; Yan,X.;Wang,D.Z.;Muto,A.;Vashaee,D.;Chen,X.Y.;Liu, J.M.;Dresselhaus,M.S.;Chen,G.;Ren,Z.F.Science 2008, 320,634.doi:10.1126/science.1156446 (6) Kongtragool,B.;Wongwises,S.Renew.Sust.Energy Rev.2003, 7,131.doi:10.1016/S1364-0321(02)00053-9 (7)Kong,X.O.;Wang,R.Z.;Huang,X.H.Energ.Convers. Manage.2004,45,433.doi:10.1016/j.enconman.2003.09.009 (8) Kongtragool,B.;Wongwises,S.Renew.Energy 2007,32,547. doi:10.1016/j.renene.2006.03.003 (9) Thombare,D.G.;Verma,S.K.Renew.Sust.Energy Rev.2008, 12,1.doi:10.1016/j.rser.2006.07.001 (11) Mancini,T.;Heller,P.;Butler,B.;Osborn,B.;Schiel,W.; Goldberg,V.;Buck,R.;Diver,R.;Andraka,C.;Moreno,J. ASME J.Sol.Energy 2003,125,135.doi:10.1115/1.1562634 (12) Kuzminskii,Y.V.;Zasukha,V.A.;Kuzminskaya,G.Y. J.Power Sources 1994,52,231.doi:10.1016/0378-7753(94) 02015-9 (13) Quickenden,T.I.;Mua,Y.J.Electrochem.Soc.1995,142, 3985.doi:10.1149/1.2048446 (15) Debethune,A,J.;Licht.T.S.;Swendeman,N.J.Electrochem. Soc.1959,106,616.doi:10.1149/1.2427448 (16) Gunawa,A.;Lin,C.H.;Buttry,D.A.;Mujica,V.;Taylor,R.A.; Prasher,R.S.;Phelan,P.E.Nano.Micro.Therm.2013,17(4), 304.doi:10.1080/15567265.2013.776149 (17) Quickenden,T.I.;Vernon,C.F.Sol.Energy 1986,36,63. doi:10.1016/0038-092X(86)90061-7 (18) Kang,T.J.;Fang,S.;Kozlov,M.E.;Haines,C.S.;Li,N.;Kim, Y.H.;Chen,Y.S.;Baughman,R.H.Adv.Funct.Mater.2012, 22,477.doi:10.1002/adfm.201101639 (19)Yu,Q.;Punyamurtual,V.K.;Han,A.;Lim,H.J.Power Sources 2008,183,403.doi:10.1016/j.jpowsour.2008.05.008 (20) Hu,R.C.;Cola,B.A.;Haram,N.;Barisci,J.N.;Lee,S.; Stoughton,S.;Wallace,G.;Too,C.;Thomas,M.;Gestos,A.; Cruz,M.E.D.;Ferraris,J.P.;Zakhidow,A.A.;Baughman,R. H.Nano Lett.2010,10,838.doi:10.1021/nl903267n (21) Chen,X.;Xu,B.X.;Liu,L.Appl.Mech.Rev.2014,66,050803. doi:10.1115/1.4026913 (22) Xu,B.X.;Liu,L.;Lim,H.;Qiao,Y.;Chen,X.Nano Energy2012,1,805.doi:10.1016/j.nanoen.2012.07.013 (23) Xu,B.X.;Yu,Q.;Park,T.;Tak,M.;Zhou,Q.L.;Chen,X. Energy Environ.Sci.2011,4,3632.doi:10.1039/c1ee01405f (24)Li,Q.;Yang,D.F.;Wang,J.H.;Wu,Q.;Liu,Q.Z.Acta Phys.-Chim.Sin.2016,32(3),691.[李清,杨登峰,王建花,武琪,刘清芝.物理化学学报,2016,32(3),691.] doi:10.3866/PKU.W HXB201512182 (25) Shen,Z.L.;He,G.H.;Zhang,N.;Hao,C.Acta Phys.-Chim. Sin.2015,31(6),1025.[谌庄琳,贺高红,张宁,郝策.物理化学学报,2015,31(6),1025.]doi:10.3866/PKU. WHXB201504141 (27) Xue,Q.Z.;Li,W.Y.J.University Petroleum 1999,23(4),102. [薛庆忠,李文瀛.石油大学学报,1999,23(4),102.]doi:1000-5870(1999)04-0102-03 (28) Association,G.P.Physical Properties of Glycerine and Its Solutions;Glycerine Producers′Association:New York 1963; p 17. (29) Zhang,L.L.;Zhao,X.S.Chem.Soc.Rev.2009,38,2520. doi:10.1039/b813846j (30) Mua,Y.;Quickenden,T.I.J.Electrochem.Soc.1996,143(8), 2558.doi:10.1149/1.1837047 (31) Mann,D.J.;Halls,M.D.Phys.Rev.Lett.2003,90,195503. doi:10.1103/PhysRevLett.90.195503 High-Performance Thermogalvanic Cell Based on Organic Nanofluids SUN Hao-YuPU Jin-HuanTANG Gui-Hua* The thermoelectric performance of traditional thermogalvanic cells is relatively low and a more efficient conversion mechanism is required.In this paper,the distribution of glycerol/glycerin in an aqueous sodium chloride solution in a carbon nanotube(CNT)is investigated by molecular dynamics(MD)simulation. The distributions of ions,molecule net charge,and electrical potential of the system are markedly affected by temperature.We propose a novel nanofluid thermoelectric conversion method based on the CNT and glycerol/ glycerin aqueous sodium chloride solution.The thermoelectric performance of the proposed system is much higher than that of most of current liquid thermogalvanic cells,and the application temperature range is also widened considerably.Apreliminary thermal-to-electrical energy conversion experiment based on nanoporous carbon with mixtures of sodiumchloride and glycerol is also conducted to qualitatively verify the numerical results. Molecular dynamics;Thermogalvanic cell;Carbon nanotube;Low-temperature energy utilization;Thermoelectric conversion 随着不可再生能源的日益枯竭以及能源需求增大,低温能源(工业废水、汽车尾气、地热以及太阳能等)的开发与利用受到越来越多的关注,其对改善能源环境问题及可持续发展具有深远的意义。针对应用固体热电材料1-5和斯特林发动机的低温能源利用进行了大量的研究6-9,虽然取得了较大的进步,但是仍存在成本高、经济性低以及可靠性差10,11等问题。因此有学者将注意力转移到液体温差电池上12,13,利用电解质溶液氧化还原对以实现热电转换,例如Cu-CuSO4和Zn-ZnSO4、FeCN3--FeCN4-以及Fe3+-Fe2+等14-18。然而依靠氧化还原对实现热电转换的经济性和热电转换性能仍不能满足工业需求。为了突破液体温差电池的技术瓶颈,部分学者开始研究碳纳米管(CNT)中电解质溶液的性质,并将其成功应用于低温热电转换过程。Yu等19以多孔碳为电极,氯化钠水溶液为电解质溶液组成的装置有效地将热能转换成电能。Hu等20以CNT为电极,FeCN3--FeCN4-水溶液为电解质溶液制作成液体温差电池,得到较高的电势和热电转换效率。Chen等21-23研究发现当氯化钠水溶液被限制在CNT内时,溶液中的分子、离子分布会发生各向异性变化,导致CNT管壁产生电势,并且该电势大小受温度影响较大,利用这个机理能够实现热电转换且具有较高的转换效率;同时CNT在热能、电能、机械能相互转换及海水淡化24,25等方面也具有优良的性能。但是水溶液存在表面张力较大、不易浸入CNT以及稳定性差、易受环境影响等缺点。 May 13,2016;Revised:June 27,2016;Published online:June 28,2016. .Email:ghtang@mail.xjtu.edu.cn;Tel:+86-29-82665319. O646 10.3866/PKU.WHXB201606281 The project was supported by the National Natural Science Foundation of China(51576156).国家自然科学基金(51576156)资助项目©Editorial office ofActa Physico-Chimica Sinica (2) Tritt,T.M.Annu.Rev.Mater.Res.2011,41,433.10.1146/ annurev-matsci-062910-100453 (4) Bell,L.E.Science 2008,321,1457.10.1126/ science.1158899 (10) Vining,C.B.Nat.Mater.2009,8,83.10.1038/nmat2361 (14) Bouty,E.J.Phys.1880,9,229.10.1051/jphystap: 018800090022901 (26) Plimpton,S.J.Comput.Phys.1995,117,1.10.1006/ jcph.1995.1039 (32) Zhu,F.;Schulten,K.Biophys.J.2003,85,236.10.1016/ S0006-3495(03)74469-5
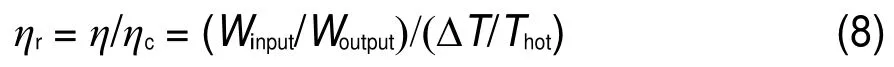

4 结论
(Key Laboratory of Thermal-fluid Science and Engineering of Ministry of Education,School of Energy and Power Engineering,Xi′an Jiaotong University,Xi′an 710049,P.R.China)1 引言
