LiCl-KCl-LaCl3熔盐体系中La(III)的电化学行为
2016-11-22彭述明张密林
姜 涛 田 杰 王 宁 彭述明,* 李 梅 韩 伟 张密林
(1中国工程物理研究院核物理与化学研究所,四川绵阳621999;2哈尔滨工程大学材料科学与化学工程学院,教育部超轻材料与表面技术重点实验室,哈尔滨150001)
LiCl-KCl-LaCl3熔盐体系中La(III)的电化学行为
姜涛1田杰1王宁1彭述明1,*李梅2韩伟2张密林2
(1中国工程物理研究院核物理与化学研究所,四川绵阳621999;2哈尔滨工程大学材料科学与化学工程学院,教育部超轻材料与表面技术重点实验室,哈尔滨150001)
在773 K条件下,研究了La(III)在LiCl-KCl熔盐中W和Ni电极上的电化学行为。La(III)还原反应是一步三电子转移的准可逆反应;通过在Ni电极上直接电沉积La的方法可以获得La-Ni金属间化合物;恒电位电解可以获得含三种金属间化合物(LaNi5、La7Ni16和La2Ni3)的La-Ni合金层,并且通过X射线衍射仪(XRD)和扫描电镜-能谱分析仪(SEM-EDS)确定物相并表征结构。采用开路计时电位法估算了LaNi5金属间化合物的标准生成吉布斯自由能。揭示了恒电位电解方法是制备La-Ni镀层合金以及提取熔盐中La的有效方法。
LiCl-KCl-LaCl3;La-Ni;镀层合金;吉布斯自由能
另外,含有镧系元素和第一长周期过渡金属元素的金属间化合物因其有趣的物理化学性质,使得它们成为储氢和永磁材料制备的基础原料8。LaNi5和La7Ni16是研究较为广泛的永磁材料9。而La-Ni合金作为储氢材料的研究开始于20世纪70年代10。LaNi5合金因其易活化、适中的分解氢压和低平衡压等特点,成为优异的低温储氢材料11-13。并且ABx型镧系-Ni基储氢合金拥有更大的储氢性能,其中La7Ni16是典型的此类储氢合金14。
近年来,许多学者对熔盐电解法分离Ln并制备Ln-Ni合金进行了研究。Taxil小组15在LiF-CaF2-LnF3熔盐中的活性Ni电极上通过电化学还原镧系元素(Nd、Gd和Sm)分别制备了NdNi2、NdNi3、GdNi2、GdNi、SmNi2和SmNi3等金属间化合物。Saïla等16研究了LiF-CaF2熔盐中在W、Ni和Cu电极上Dy(III)的电化学行为,并通过恒电流电解获得了Dy2Ni17和DyNi4合金镀层。Chandra等17在LiFCaF2熔盐中研究了Ce(III)在W和Ni电极上的电化学氧化还原行为,并且制备了CeNi5和Ce2Ni7两种金属间化合物。Ito等18,19分别在LiCl-KCl-SmCl3和LiCl-KCl-YbCl3熔盐中研究了SmNi5、SmNi3和SmNi2,以及Yb2Ni17和YbNi2在Ni电极上的电化学制备。Yasuda等20在NaCl-KCl-NdCl3熔盐中研究了Nd-Ni合金的电化学制备,得到了NdNi2、NdNi3、 Nd2Ni7和NdNi5等四种金属间化合物。
综上所述,研究利用活性Ni电极来实现熔盐中La的提取,以及实现La-Ni合金制备都具有重大的意义。为此采用多种电化学技术(循环伏安、方波伏安、计时电位和开路计时电位)研究了La(III)在LiCl-KCl熔盐中的电化学行为和La-Ni金属间化合物的制备机理,并估算了LaNi5金属间化合物的标准生成吉布斯自由能。
2 实验部分
实验中使用的主要试剂有氯化锂(分析纯,98%)、氯化钾(分析纯,99.5%)、氯化镧(分析纯,99.9%)、银丝(直径1 mm,99.99%)、钨丝(直径1 mm,99.99%)和镍棒(直径7 mm,99.99%),以上试剂和材料均为Alfa Aesar中国化学有限公司产品;无水乙醇(分析纯,99.7%)为国药集团化学试剂有限公司产品;石墨棒(直径6 mm,光谱纯)为上海碳素厂产品;氩气(99.99%)为成都天一科技有限公司产品。
实验过程中使用的所有水溶液都采用二次蒸馏水配制。整个电化学实验在装备井式电炉(SRH-50-10F,哈尔滨丞焱热处理设备制造有限公司)和Ar气保护的手套箱(LS1200,成都德力斯实业有限公司)中进行。电解质LiCl-KCl装在电炉中的Al2O3坩埚中。LiCl和KCl(50%:50%(w))在973和573 K温度下分别干燥24 h以除去残留的水分。La离子以无水LaCl3的形式进入熔盐中。所有电化学测量采用Autolab AUT302N型电化学工作站(梅特勒公司,瑞士)和Nova1.10软件。将一根银丝插入含AgCl(1%(w))和LiCl-KCl(50%:50%(w))的Al2O3管中作为参比电极。所有称量工作采用电子天平(AB204-N,上海Mettler-Toledo有限公司)进行。实验中所有电位都相对于该Ag/AgCl电极。W作为工作电极,石墨作为对电极。实验前W电极末端用SiC砂纸打磨后在乙醇溶液中用超声波清洗。有效电极面积通过每次插入熔盐的电极长度来进行计算。长度用游标卡尺(CD-15CPX,Mitutoyo公司,日本)进行测量。通过恒电位的方法来制备La-Ni合金镀层。电解后,所有样品在乙醇溶液中用超声波清洗以去除残留的盐,后放置在干燥箱中待测。
样品的X射线衍射(X′Pert Pro,Philips公司,荷兰)表征,以Cu-Kα射线作为射线源,工作电压40 kV,工作电流40 mA,扫描角度(2θ)范围为10°-90°,扫描步长0.02°,扫描速率0.06(°)·s-1。样品用扫描电镜(JSM-6480,JEOL公司,日本)表征,样品经过打磨和抛光后在乙醇溶液中用超声波清洗完毕后进行扫描电子显微镜测试。
3 结果与讨论
3.1La(III)在LiCl-KCl-LaCl3熔盐中Ni电极上的电化学行为
3.1.1循环伏安
采用循环伏安法研究了W和Ni电极在LiCl-KCl熔盐中的电化学窗口。之所以选择W作为Ni电极的对比电极,是因为根据二元W-Li和W-La相图,在773 K时W与Li和La都不会形成金属间化合物21,22。图1为LiCl-KCl熔盐中W电极上和加入LaCl3后再W和Ni电极上的循环伏安曲线。在黑色曲线上,仅观察到一个阴极还原峰(-2.45 V),可以归属为Li的沉积,而对应的氧化峰则是Li的溶解。图1中绿色曲线代表加入LaCl3后在W电极上的循环伏安曲线。还原峰A(-2.10 V附近)对应于La(III)还原为La(0),该结果与其他学者的观察相一致1-3。在反向扫描方向,氧化峰A′可以归属为La(0)的氧化溶解,这与Fabian等4的观察结果相一致。黑色曲线代表LiCl-KCl-LaCl3熔盐中La(III)在Ni电极上的循环伏安曲线,与在W电极上的循环伏安曲线不同。除了阴极/阳极峰A/A′对应于La的还原/氧化峰外,其余在La(III)还原之前的三个峰(-1.38、-1.70和-1.97 V)则对应金属或者金属间化合物在W电极上的沉积。这三对峰(I/I′、II/II′和III/III′)分别对应于La-Ni金属间化合物的生成。但是在Ni电极上未观察到明显的A/A′峰。

图1 LiCl-KCl-(3.5%(w))LaCl3熔盐中W和Ni电极上的循环伏安曲线图Fig.1 Cyclic voltammogram curves of LiCl-KCl melts (red curve)on a W electrode,LiCl-KCl-(3.5%(w))LaCl3melts on W(green curve)and Ni(black curve)electrodes
3.1.2方波伏安
方波伏安法是比循环伏安法更灵敏的方法,并且能计算转移电子数。图2(a)显示在LiCl-KCl-LaCl3熔盐体系中的不同频率的方波伏安曲线。在插图中频率的1/2次方与电流强度成线性关系。根据半峰宽公式(1)计算23,24:

计算转移电子数n≈2.85,接近3,因此我们认为La(III)是一步3电子转移:


图2 (a)LiCl-KCl-(3.5%(w))LaCl3熔盐中不同频率的方波伏安曲线;(b)LiCl-KCl-(3.5%(w))LaCl3熔盐中W和Ni电极上的方波伏安曲线图Fig.2 (a)Square-wave voltammogram curves for the reduction of(a)La(III)on a W electrode;(b)square-wave voltammogram curves of the LiCl-KCl-(3.5%(w))LaCl3molten on W and Ni electrodes
我们采用方波伏安法进一步研究La(III)在Ni电极上的电化学行为。图2(b)所示为773 K、Ni电极、电位步长1 mV,频率30 Hz时的方波伏安曲线。图中明显出现四个峰(A:-2.10 V,I:-1.97 V,II:-1.70 V,III:-1.38 V),分别对应于La还原和3种La-Ni金属间化合物,这与之前的循环伏安结果相一致。并且由于方波伏安曲线更加灵敏,循环伏安曲线中的峰A可以在方波伏安曲线中识别。
3.1.3计时电位
图3所示为不同电流密度下LiCl-KCl-(3.5%(w)) LaCl3熔盐中的计时电位曲线。当电流密度分别达到-0.031 A·cm-2(-10 mA),-0.062 A·cm-2(-20 mA),-0.124 A·cm-2(-40 mA)和-0.186 A·cm-2(-60 mA)时,曲线出现三个电位平台(III、II和I),对应La在Ni电极上的欠电位沉积并生成La-Ni金属间化合物。当阴极电流密度达到-0.217 A·cm-2(-70 mA)时,新电位平台A出现,对应La的沉积。

图3 不同电流下LiCl-KCl-(3.5%(w))LaCl3熔盐中Ni电极上的方计时电位曲线图Fig.3 Chronopotentiograms obtained at different currents on a Ni electrode in the LiCl-KCl-(3.5%(w))LaCl3melts S=0.322 cm2,T=773 K
3.2恒电位电解与La-Ni合金镀层表征
根据La-Ni二元相图(图4)25可知,相图共有8种La-Ni金属间化合物,我们实验中出现3种金属间化合物。因此,我们采用恒电位电解,根据XRD以及SEM/EDS确定是哪种金属间化合物。

图4 La-Ni二元合金相图25Fig.4 Phase diagram of La-Ni binary alloy25A:atomic fraction;w:mass fraction
基于循环伏安、方波伏安和计时电位的结果,分别在-2.08、-1.85和-1.55 V(vs Ag/AgCl)电位下,在Ni电极上电解制备La-Ni金属间化合物。
采用XRD表征在-2.08 V下电解3 h后的样品a,发现有三种金属间化合物存在,分别是La2Ni3、La7Ni16和LaNi5(如图5a所示)。通过SEMEDS分析样品La和Ni的元素分布,发现获得的LaNi5镀层(图6a中点A)最接近Ni电极,很致密但非常薄,厚度大约为10 μm。中间层La7Ni16(图6a中点B)不明显而且多孔,厚度大约为50 μm。最外层主要是La2Ni3(图6a中点C),均匀且致密,厚度大约为75 μm。EDS能谱分析结果表明,镀层主要由Ni和La两种元素组成。三个选点(A、B和C)的Ni/La原子比分别为6.31、2.29和1.87。当考虑测量误差后,我们进一步确定分别为LaNi5、La7Ni16和La2Ni3相金属间化合物。而在-1.85 V下电解3 h后的样品b中发现有两种金属间化合物存在,分别是La7Ni16和LaNi5(如图5b所示)。通过SEM-EDS分析样品La和Ni的元素分布,发现获得的LaNi5镀层(图6b中点A)最接近Ni电极,很致密、均一且较厚,厚度大约为20 μm。最外层主要是La7Ni16(图6b中点B),疏松且很厚,厚度大约为30 μm。EDS能谱分析结果表明,镀层主要由Ni和La两种元素组成。两个选点(A和B)的Ni/La原子比分别为8.00和2.06。当考虑测量误差后,我们进一步确定分别为LaNi5和La7Ni16相金属间化合物。

图5 LiCl-KCl-(3.5%(w))LaCl3熔盐中Ni电极上不同沉积电位下获得样品的XRD谱图Fig.5 XRD patterns of deposit samples obtained by potentiostatic electrolysis at different potentials on a Ni electrode in the LiCl-KCl-(3.5%(w))LaCl3melts
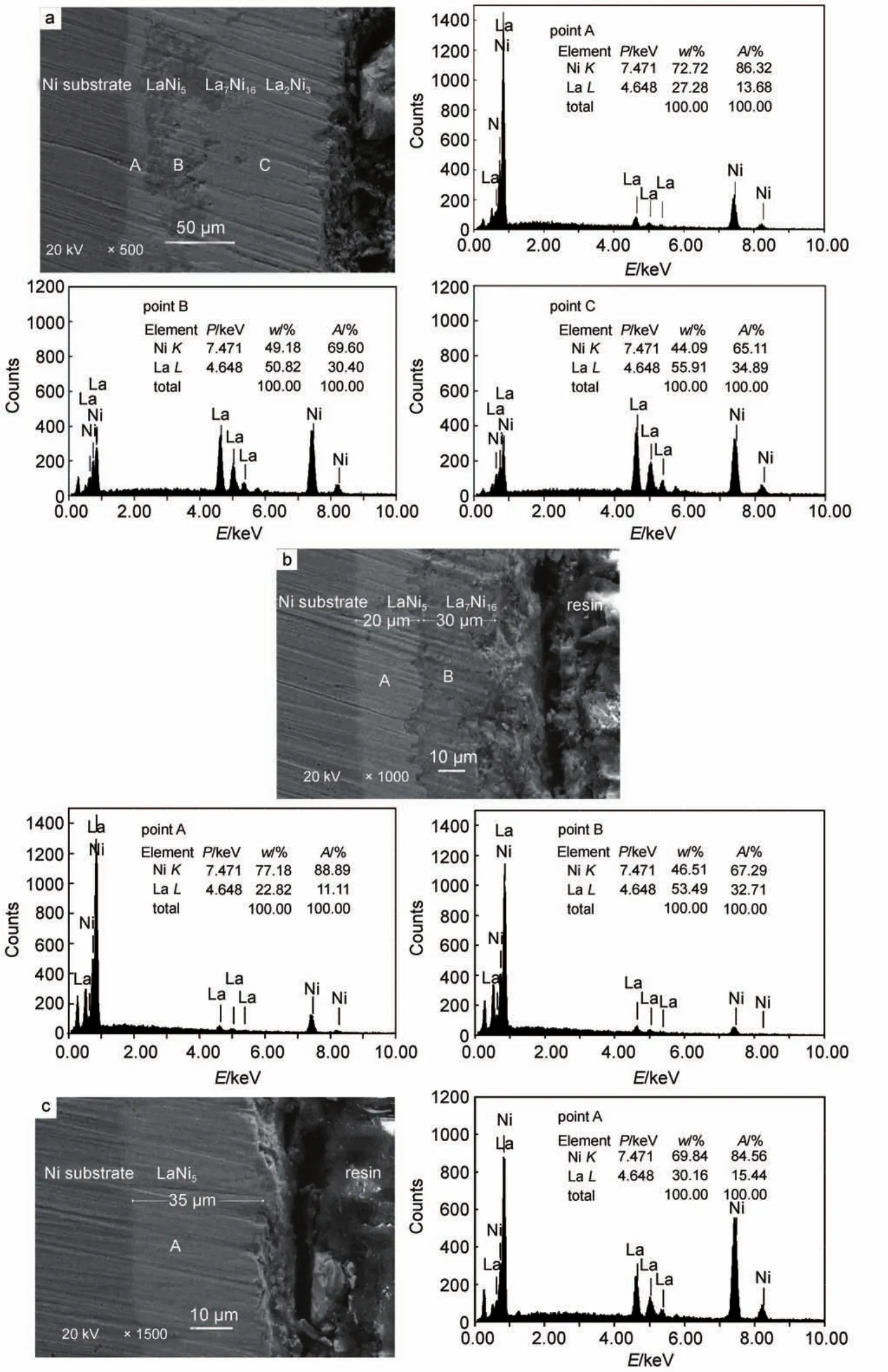
图6 镍电极上不同沉积电位(P)下获得样品的SEM-EDS谱图Fig.6 SEM-EDS analysis of the sample obtained by potentiostatic electrolysis at different potentials(P)on a Ni electrode
在-1.55 V下电解3 h后的样品c中发现仅有一种金属间化合物存在,即LaNi5(如图5c所示)。通过SEM-EDS分析样品La和Ni的元素分布,发现获得的LaNi5镀层(图6c中点A)紧挨Ni电极,很致密、均一且很厚,厚度大约为35 μm。EDS能谱分析结果表明,镀层主要由Ni和La两种元素组成。一个选点(A)的Ni/La原子比为5.48。当考虑测量误差后,我们进一步确定为LaNi5相金属间化合物。
3.3La-Ni金属间化合物生成的热力学研究
采用开路计时电位曲线进一步研究了La-Ni金属间化合物生成的热力学。根据以上XRD以及SEM-EDS分析可知道,该浓度下的循环伏安和方波伏安曲线只出现3个I、II和III三种金属间化合物,并且恒电位电解只获得3种产物。我们可以确定I、II和III三种金属间分别是La2Ni3、La7Ni16和LaNi5。根据相图可知,LaNi5是最富Ni的金属间化合物,我们可以根据开路计时电位计算LaNi5的生成吉布斯自由能26。
采用开路计时电位曲线进一步研究了La-Ni金属间化合物生成的热力学。在LiCl-KCl-(3.5%(w)) LaCl3熔盐中Ni电极上,-2.50 V沉积50 s,获得La-Ni合金的一个薄层。图7为773 K条件下,恒电位的开路计时电位曲线。我们可以清楚地观察到4个平台,平台A表示La(III)/La的平衡。而平台I、II和III则分别表示La2Ni3、La7Ni16和LaNi5三种金属间化合物。
电位平台的平衡电位可以转化对于La(0)的电动势,可以估算LaNi5金属间化合物的生成吉布斯自由能26,数据如表1所示。从表中数据可以看出,本文中获得的生成吉布斯自由能要大于Dischinger27和Lantelme6等的实验数据。分析原因认为:(1)实验温度不同;(2)平台对应的电化学反应不同;(3)对平台的确定和取值不同。(4)测量方法不同。

图7 电沉积后LiCl-KCl-(3.5%(w))LaCl3熔盐中Ni电极的开路计时电位曲线图Fig.7 Open-circuit potential transient curve for a Ni electrode after electrodepositing

表1 LaNi5金属间化合物的生成吉布斯自由能数据Table 1 Gibbs energies of formation for LaNi5intermetallic compounds
4 结论
通过多种电化学方法研究了773 K条件下La (III)在LiCl-KCl熔盐中W和Ni电极上的电化学行为。根据循环伏安、方波伏安和开路计时电位法的研究可知,通过在Ni电极上直接电沉积La的方法可以获得La-Ni金属间化合物。恒电位电解可以获得含三种金属间化合物(LaNi5、La7Ni16和La2Ni3)的La-Ni合金层,并且通过XRD和SEM-EDS确定物相并表征结构。采用电动势方法估算了LaNi5金属间化合物的生成吉布斯自由能。电解方法可成为制备La-Ni金属间化合物以及提取熔盐中La的有效方法。
References
(1)Castrillejo,Y.;Bermejo,M.R.;Martinez,A.M.;DiazArcas,P. J.Min.Metall.Sect.B:Metall.2003,39(102),109.
(2) Masset,P.;Konings,R.J.M.;Malmbeck,R.;Serp,J.;Glatz,J. P.J.Nucl.Mater.2005,344(1-3),173.doi:10.1016/j. jnucmat.2005.04.038
(3) Vandarkuzhali,S.;Gogoi,N.;Ghosh,S.;Prabhakara Reddy,B.; Nagarajan,K.Electrochim.Acta 2012,59,245.doi:10.1016/j. electacta.2011.10.062
(4) Fabian,C.P.;Luca,V.;Chamelot,P.;Massot,L.;Caravaca,C.; Lumpkin,G.R.J.Electrochem.Soc.2012,159(4),F63. doi:10.1149/2.057204jes
(5) Qiao,H.;Nohira,T.;Ito,Y.J.Alloy.Compd.2003,359(1-2), 230.doi:10.1016/S0925-8388(03)00203-2
(6) Lantelme,F.;Cartailler,T.;Berghoute,Y.;Hamdani,M. J.Electrochem.Soc.2001,148(9),C604.doi:10.1149/ 1.1385819
(7)Han,W.;Zhang,Y.;Ye,K.;Yan,Y.;Zhang,M.Metall.Mater. Trans.B 2010,41(5),1123.doi:10.1007/s11663-010-9395-z
(8) Rong,Q.;Schaller,H.J.J.Alloy.Compd.2004,365(1-2),188. doi:10.1016/S0925-8388(03)00667-4
(9) Hsu,S.E.;Beibutian,V.M.;Yeh,M.T.J.Alloy.Compd.2002, 330-332,882.doi:10.1016/S0925-8388(01)01669-3
(10) Srivastava,S.;Srivastava,O.N.J.Alloy.Compd.1999,290(1-2),250.doi:10.1016/S0925-8388(99)00196-6
(11) Prigent,J.;Joubert,J.M.;Gupta,M.J.Solid State Chem.2011, 184(1),123.doi:10.1016/j.jssc.2010.10.037
(12) Dhaou,H.;Askri,F.;Ben Salah,M.;Jemni,A.;Ben Nasrallah, S.;Lamloumi,J.Int.J.Hydrog.Energy 2007,32(5),576. doi:10.1016/j.ijhydene.2006.07.001
(13)Ao,B.Y.;Chen,S.X.;Jiang,G.Q.J.Alloy.Compd.2005,390 (1-2),122.doi:10.1016/j.jallcom.2004.05.092
(14) Kandavel,M.;Bhat,V.V.;Rougier,A.;Aymard,L.;Nazri,G. A.;Tarascon,J.M.Int.J.Hydrog.Energy 2008,33(14),3754. doi:10.1016/j.ijhydene.2008.04.042
(15) Chamelot,P.;Massot,L.;Hamel,C.;Nourry,C.;Taxil,P. J.Nucl.Mater.2007,360(1),64.doi:10.1016/j. jnucmat.2006.08.015
(16) Saïla,A.;Gibilaro,M.;Massot,L.;Chamelot,P.;Taxil,P.; Affoune,A.M.J.Electroanal.Chem.2010,642(2),150. doi:10.1016/j.jelechem.2010.03.002
(17) Chandra,M.;Vandarkuzhali,S.;Ghosh,S.;Gogoi,N.; Venkatesh,P.;Seenivasan,G.;Reddy,B.P.;Nagarajan,K. Electrochim.Acta 2011,58,150.doi:10.1016/j. electacta.2011.09.012
(18) Iida,T.;Nohira,T.;Ito,Y.Electrochim.Acta 2001,46(16), 2537.doi:10.1016/S0013-4686(01)00470-4
(19) Iida,T.;Nohira,T.;Ito,Y.Electrochim.Acta 2003,48(11), 1531.doi:10.1016/S0013-4686(03)00031-8
(20) Yasuda,K.;Kobayashi,S.;Nohira,T.;Hagiwara,R. Electrochim.Acta 2013,92,349.doi:10.1016/j. electacta.2013.01.049
(21) Sangster,J.;Pelton,A.D.J.Phase Equilib.1991,12(2),203. doi:10.1007/BF02645715
(23) Ramaley,L.;Krause,M.S.Anal.Chem.1969,41(11),1362. doi:10.1021/ac60280a005
(24) Osteryoung,J.G.;Osteryoung,R.A.Anal.Chem.1985,57. doi:10.1021/ac00279a789
(25) Okamoto,H.J.Phase Equilib.2002,23(3),287. doi:10.1361/105497102770331884
(26) von Barner,J.H.;Noyé,P.;Barhoun,A.;Lantelme,F. J.Electrochem.Soc.2005,152.doi:10.1149/1.1833313
(27) Dischinger,J.;Schaller,H.J.J.Alloy.Compd.2000,312(1-2), 201.doi:10.1016/S0925-8388(00)01151-8
Electrochemical Behavior of La(III)in Molten LiCl-KCl-LaCl3
JIANG Tao1TIAN Jie1WANG Ning1PENG Shu-Ming1,*LI Mei2HAN Wei2ZHANG Mi-Lin2
(1Institute of Nuclear Physics and Chemistry,China Academy of Engineering Physics,Mianyang 621999,Sichuan Province,P.R. China;2Key Laboratory of Superlight Materials and Surface Technology,Ministry of Education,College of Materials Science and Chemical Engineering,Harbin Engineering University,Harbin 150001,P.R.China)
Electrochemical and thermodynamic studies on the formation of La-Ni intermetallic compounds in molten LiCl-KCl-(3.5%(w))LaCl3at 773 K were performed.The electrochemical reduction of La(III)ions was investigated on inert W and reactive Ni electrodes by cyclic voltammetry.The reduction potential of La(III)/La on a Ni electrode was observed at more positive potential than that on a W electrode because of the formation of La-Ni intermetallic compounds when La ions reacted with the Ni substrate.Square-wave voltammetry, chronopotentiometry,and open-circuit chronopotentiometry provided further evidence for the formation of La-Ni intermetallic compounds.Potentiostatic electrolysis on a Ni electrode led to the formation of three La-Ni intermetallic compounds,LaNi5,La7Ni16and La2Ni3,according to X-ray diffraction(XRD)and scanning electron microscopy-energy-dispersive X-ray spectroscopy(SEM-EDS)analyses.The standard Gibbs free energies of formation for LaNi5were estimated from open-circuit chronopotentiometric measurements using the Gibbs-Helmholtz equation and Hess law.The formation of the La-Ni alloy layer could be controlled by the applied potential and time.Potentiostatic electrolysis was an effective method for electrochemical extraction of La.
LiCl-KCl-LaCl3;La-Ni;Alloy layer;Gibbs free energy
1 引言
镧(La)是镧系中原子量最小的元素,它的中子吸收截面较大,能够阻碍可嬗变锕系元素俘获中子,降低嬗变效率,因此在乏燃料干法后处理中必须考虑它的分离提取问题。对于La(III)在惰性电极上的电化学行为进行了许多研究,包括LiCl-KCl1-4、CaCl2-NaCl1和LiF-NaF-KF-LaF32熔盐体系。这些实验结果表明,在LiCl-KCl熔盐中,La (III)的还原是一步三电子转移反应3,4。Castrillejo等1利用循环伏安、计时电位和计时电流技术探讨了La(III)的反应机理、成核现象和电活性离子的输运参数。Vandarkuzhali等3在LiCl-KCl熔盐中活性Al电极上利用瞬态电化学技术研究了La(III)的电化学行为,获得了Al11La3金属间化合物,并利用开路计时电位曲线计算了其生成热力学参数(吉布斯自由能)和La(III)的扩散系数。Ito小组5在LiFNaF-KF-LaF3熔盐中Pd电极上研究了Pd3La合金镀层的电化学制备。Lantelme等6利用瞬态电化学技术研究了LiCl-KCl熔盐中镧系(La、Ce、Pr、Gd和Y)离子的热力学和动力学性质,并计算了La-Ni和Gd-Ni金属间化合物的生成吉布斯自由能。张密林课题组7在LiCl-KCl-MgCl2-KF-Ln2(CO3)3熔盐中电解制备了Mg-Li-Ce-La四元合金。
March 18,2016;Revised:June 21,2016;Published online:June 22,2016.
.Email:pengshuming@caep.cn;Tel:+86-816-2493835.
O641;O643
10.3866/PKU.WHXB201606223
The project was supported by the Major Research Plan of the National Natural Science Foundation of China(91426302)and National Natural Science Foundation of China(21301163).
国家自然科学基金重大研究计划-集成项目(91426302)和国家自然科学基金(21301163)资助©Editorial office ofActa Physico-Chimica Sinica
(22) Okamoto,H.J.Phase Equilib.2001,22(6),693.10.1007/ s11669-001-0048-4
