利用芯片式高场非对称波形离子迁移谱技术快速检测苯丙氨酸
2016-11-19郭大鹏汪永欢徐天白张媛李灵锋陈金凯汪小知李鹏骆季奎
郭大鹏 汪永欢 徐天白 张媛 李灵锋 陈金凯 汪小知 李鹏 骆季奎


摘 要 采用金属扩散管芯片式高场非对称波形离子迁移谱 (FAIMS) 技术对苯丙氨酸进行了快速检测,设定测试压强为250 kPa,金属扩散管温度为190℃,在优化的最佳分析条件下,即:载气流速为2000 mL/min,分离电压为152.8 V时,在正模式下获得了苯丙氨酸的离子特征谱图和补偿电压特征值
Symbolm@@ 0.62 V。另外,利用FAIMS对不同浓度的苯丙氨酸样品气进行了检测,确定了FAIMS检测的定量线性范围为6~20 mg/L和检出限为5.9 mg/L。本实验为FAIMS应用于苯丙氨酸的快速检测提供了重要参考。
关键词 苯丙氨酸; 快速检测; 高场非对称波形离子迁移谱; 金属扩散管
1 引 言
苯丙氨酸(Plenylalanine,PHE)属于芳香族氨基酸,是机体合成各种激素、蛋白质及神经递质的重要前体物质,苯丙氨酸的代谢紊乱会引发多种疾病如苯丙酮尿症(PKU)[1]、高苯丙氨酸血症[2]、白化病[3]以及神经损伤[4]等。测定PHE的含量是PKU诊治的主要指标,对于PKU患者的诊断和监测极为重要[5,6〗]。因此,PHE含量的测定对于人体健康、相关疾病研究以及临床诊断具有重要意义。目前,苯丙氨酸常见的分析检测方法有同步荧光法[7,8]、高效毛细管电泳法(HPCE)[9]、高效液相色谱法(HPLC)[5,6,10]、质谱法(MS)[11~13]以及细菌抑制法和苯丙氨酸脱氢霉法[5]。但是上述几种方法,涉及到繁杂的预处理, 且分析检测周期长,不适合现场快速检测的需求。
高场非对称波形离子迁移谱(FAIMS)技术的出现,为物质在大气环境下的快速检测提供了可能。FAIMS又称差分式离子迁移谱(DMS),是在大气环境下对气相离子进行快速分离识别的一种新兴技术[14,15]。FAIMS基于离子迁移率非线性变化在高场下凸显的特性,在离子前进方向构建非对称性高电场,利用扫描电场、补偿电压及离子信号产生谱图,从而对物质离子进行分离识别的气相痕量物质检测[16]。自FAIMS诞生以来,经过短短几十年各国科研和商业机构的研究和开发[17~19],该技术现已经成为主流的气相检测手段之一[20],被广泛用于爆炸物和毒品[21~23]、生物医药[24,25]以及环境监测[26]等领域的现场检测。基于微纳米加工工艺的FAIMS灵敏度高、检测速度快、无溶剂和前处理,符合绿色化学的理念,且加工成本低廉,可大规模生产,另外操作电压低[27],可实现正负离子同步连续扫描[23,28]。
FAIMS在生物分子领域的研究和应用已有报道,但FAIMS都是作为前端过滤装置,和HPLC及MS联用[29~31]。芯片式FAIMS装置也已成功应用于爆炸物、毒品、危险品的检测以及常见色素和中西药添加成分的检测[22,23,32,33]。本实验基于芯片式FAIMS的优势,将其作为单独的检测装置应用于苯丙氨酸的检测,优化了检测条件并在此基础上建立了芯片式FAIMS快速检测苯丙氨酸的新方法,获得了苯丙氨酸的FAIMS特征谱图,确定了FAIMS检测苯丙氨酸的检出限和定量线性检测范围。
2 实验部分
2.1 仪器与试剂
FAIMS谱仪由浙江大学与微木智能系统有限公司共同开发[22,23]。采用63Ni放射源作为电离源,芯片大小为7 mm×7 mm,其中迁移沟道呈U型来回曲折,共47个沟道。单个沟道长度为115 mm,宽度为35 μm,深度为300 μm。FAIMS芯片的原理示意图如图1所示。非对称性射频场强度最高可达61100 V/cm,频率为25 MHz,其占空比为0.25。直流补偿电压扫描范围为
Symbolm@@ 6~6 V。芯片式FAIMS谱仪是基于微纳米加工技术(MEMS),采用深反应离子刻蚀(DRIE)在硅片上刻蚀出沟道,体积小,使得芯片式FAIMS谱仪的尺寸大大缩小,从而为便携式的现场检测提供了帮助。并且芯片沟道宽度窄,场强可达60000 V/cm以上,进一步拓宽了仪器的检测范围、选择性和灵敏度,极大的缩短了检测时间[23,32,34]。ES225SMDR分析型天平(瑞士Precisa公司)。
苯丙氨酸(分析纯,阿拉丁试剂上海有限公司);甲醇(分析纯,南京化学试剂有限公司)。载气为空气压缩机产生的连续稳定的清洁空气,依次经过活性炭和分子筛过滤。
2.2 实验方法
2.2.1 标准溶液制备 精确称取苯丙氨酸0.5 mg,溶于2 mL纯水中,再用8 mL甲醇定容至10 mL,超声溶解,制得质量浓度为50 mg/L 的苯丙氨酸母液。将制得的苯丙氨酸母液按照不同比例稀释,得到不同浓度的苯丙氨酸的标准溶液。
2.2.2 样品气的制备 样品气制备使用自制的气体反生器(VG炉,含有金属扩散管和加热模块,炉结构如图2A所示。开启加热模块,温度升至设定值(190℃),旋开金属扩散管密封盖,使用微量进样器移取10 μL苯丙氨酸标准溶液,将溶液迅速打入管中后密封,待测溶液在加热状态下气化,通入洁净载气(活性炭和分子筛净化)混合后转化成测试样品气体。测试总流量为1600~2500 mL/min。
2.2.3 检测方法 采用扩散管进样,用FAIMS检测不同浓度苯丙氨酸样品气,确定其检出限及寻找定量检测线性范围。检测流程图如图2B所示。图2中所示装置,已有过相关文献报道[22,23,32,33]。利用空气压缩机产生连续稳定的空气作为载气,载气依次经过滤芯(分子筛和活性炭)和气体质量流量控制器(MFC)后将气体发生器(VG炉)里的样品带入FAIMS谱仪中进行检测,密封气路的末端加一个针阀控制压强,数值可以通过检测器读出。其中设置载气的流速为2000 mL/min,压强设定为
250 kPa。VG炉扩散管加热模块的温度设定为190℃。射频(RF)场扫描电场强度设定为最大电场强度值的60%~100%,补偿电压范围为
Symbolm@@ 3~3 V。对不同浓度的标准溶液,移取相同体积10 μL的样品溶液,进行测试,对每个浓度的样品都进行7次扫描,以验证样品气检测的重复性。
3 结果与讨论
3.1 实验条件对苯丙氨酸检测的影响及优化
在压强设定为250 kPa,气体发生器温度为190℃时,苯丙氨酸的FAIMS谱图稳定出峰。本实验均在此压强和温度下进行。所用载气是由空压机制得并经干燥后的纯净气体,保证了湿度的恒定。因此,影响FAIMS检测的因素主要是载气流量以及分离电压对离子信号和分辨能力的影响。
3.1.1 分离电压 图3展示了FAIMS对20 mg/L苯丙氨酸检测时的响应强度和分辨能力随着射频分离电压幅值变化的趋势图。其中离子信号与到达检测极板的离子数目有关,单位无量纲;分辨能力(Rd)由公式Rd=VC/Wh/2计算得出,式中VC为补偿电压, Wh/2为在该补偿电压下的苯丙氨酸的离子特征峰半峰宽。从图3可见,当分离电压由134.6 V增加到177.4 V时,苯丙氨酸的分辨能力从0.94增加到1.58,同时,苯丙氨酸相应的响应强度却随着分离电压的增加而减小,从0.14下降到0.07。离子信号下降的原因在于,随着分离电压的增加,高场下离子的迁移率增加,使得纵向的净位移增加,从而打到两个极板上的离子数目增多,到达检测极板的离子数目减小,从而使离子信号减小。综合考虑分辨率与灵敏度, 选择152.8 V为最优的分离电压幅值。
图3 苯丙氨酸响应强度和分辨能力随着分离电压幅值变化的趋势图
Fig.3 Resolution and ion intensity of phenylalanine versus dispersion voltage
3.1.2 载气流速 图4展示了FAIMS检测20 mg/L苯丙氨酸时的响应强度随着载气流量变化的趋势图,所需补偿电压随分离电压变化的趋势图。当流速小于2000 mL/min时,响应强度随着流量的增加,这是由于到达检测极板的离子数目随流量增多,离子信号随之增加;而当流速大于2000 mL/min时,响应信号值迅速减小,其原因是载气大于临界值后,待测物质尚未检测就被带出检测区域,从而使离子信号值下降。因此,本实验选择2000 mL/min为最佳载气流量值。
3.2 谱图特征
实验表明,苯丙氨酸在正模式有响应信号,但在负模式下几乎没有响应。其原因可能是苯丙氨酸质子亲和能比较高的原因。图5A是在载气流速为2000 mL/min时,通过扩散管进样后,FAIMS在正模式下对
图4 苯丙氨酸离子信号强度随载气流速的变化图
Fig.4 Ion intensity of phenylalanine as a function of carrier gas flow rate
20 mg/L的苯丙氨酸在不同分离电压场强下进行补偿电压和离子电流值的连续扫描得到的FAIMS谱图。谱图扫描完成时间约为20 s。其中,分离电压从128.4 V扫描到214.0 V。对于每一条扫描电压,直流补偿电压都会在
Symbolm@@ 3~3 V的区间扫描一遍。由离子响应的补偿电压位置确定对应的离子。信号区域的颜色深度则表示了离子信号的大小。在苯丙氨酸的FAIMS特征谱图中可以观察到3组特征峰,其中,左侧是反应物离子峰,中间是待测物苯丙氨酸的离子峰,右边是杂质离子峰。图5B是在最优化的分离电压幅值152.8 V下的FAIMS二维曲线。纵坐标为离子电流值,横坐标为补偿电压值。对照图5A可知,在152.8 V时,最左侧的反应物离子峰已经消失,图5B中二维曲线的两组峰分别对应苯丙氨酸特征峰和杂质峰。在选定的152.8 V分离电压下,对应的补偿电压
Symbolm@@ 0.62 V即为苯丙氨酸的特征值。可见,FAIMS对苯丙氨酸有很好的分辨能力。
3.3 谱图分析
从图5A的FAIMS特征谱图中可见,中间的苯丙氨酸特征峰,是呈弧状的分布。即,随着分离电压的增加,捕捉到的离子信号对应的补偿电压的绝对值先增大后减小。为此,在图6展示了FAIMS对苯丙氨酸检测时,所需的补偿电压随着分离电压变化的趋势图(空心点连线)。当分离电压小于171.2 V时,扫描到的补偿电压的绝对值随着分离电压的增大而增大;而当分离电压大于171.2 V时,补偿电压的绝对值随着分离电压的增大而减小。从前面的分析可知,补偿电压绝对值的变化与高低电场下积累的位移差的变化有关。为了解释这一现象,从离子迁移率的非线性函数入手。
在高场下,离子的迁移率系数K与电场强度的关系是一个非线性关系,可由下式表示[23],
Symbolm@@ 21V·m2)。从式(3)可知,求出α2和α4就能够描绘出非线性函数随分离电压V的分布,将其展示在图6(实心点连线)中。从图6可见,当分离电压小于171.2 V时,随着分离电压的增加,由于N值较大, (E/N)2 起主要作用。综上,α2占据主导,非线性函数是正向增大的,即离子迁移率是增加的,对应离子在高场下的位移也是增加的,位移差开始变大,需要的补偿电压的绝对值也越来越大;而当分离电压大于171.2 V时,随着分离电压的增加,(E/N)4 的作用开始凸显,α4开始占据主导,α4是负的,对非线性函数的贡献也是负的,因此, 离子迁移率是减小的,对应离子在高场下的位移是减小的,此时位移差又开始变小,需要的补偿电压的绝对值也越来越小。这就是苯丙氨酸特征谱呈现弧形分布的原因。
3.4 苯丙氨酸的动态响应
在优化的实验条件下,即压强为250 kPa, 载气流速为2000 mL/min,分离电压为152.8 V,补偿电压为
Symbolm@@ 0.62 V,定量检测了不同浓度的苯丙氨酸。图7展示了苯丙氨酸特征离子峰信号和质量浓度之间关系曲线。
结果表明,当浓度超过20 mg/L时,由于样品分子的离化率随着样品浓度的增大而增幅降低,检测到离子电流值增长缓慢。而苯丙氨酸在6~20 mg/L范围内呈现较好的线性关系,相关系数r=0.994。通过计算在信噪比S/N=3时得到苯丙氨酸的检出限(LOD)为5.9 mg/L。对不同浓度的苯丙氨酸样品气进行重复检测,表明重复性较好。图8A为6 mg/L苯丙氨酸样品在正模式下的FAIMS谱图,可以观察到3组峰,左边是反应物离子峰,中间是苯丙氨酸特征离子峰,右边是杂质离子峰。图8B为载气(空气)的背景FAIMS谱图。左边是反应物离子峰,右边是杂质离子峰。对比可知,图8A 中间的苯丙氨酸特征峰出峰明显,说明FAIMS在检出限浓度附近对苯丙氨酸有良好的分辨能力。
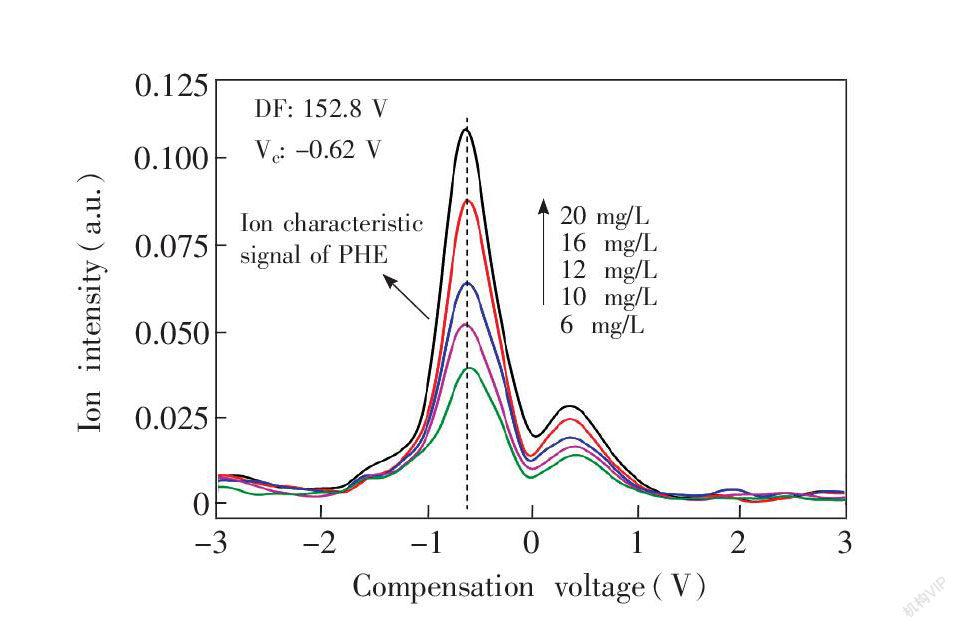
通过对不同浓度的苯丙氨酸样品气体进行FAIMS检测,获得一系列在不同浓度下的FAIMS动态响应和谱图,并确定了FAIMS定量检测浓度线性范围为6~20 mg/L。图9展示了在此区间内,处在最佳分离电压152.8 V下的离子电流值和补偿电压二维曲线。浓度在6 mg/L时,苯丙氨酸的特征峰信号和杂质峰的信号比S/N≥3,补偿电压为
Symbolm@@ 0.62 V。医学中正常儿童血清苯丙氨酸浓度的参考值为(16.46
SymbolqB@ 3.10) mg/L[6]。可见FAIMS对苯丙氨酸的定量线性范围包含了这个正常范围。与高效液相色谱及荧光法相比[5~7],操作简单,检测时间明显缩短,具有很大的优势。
图8 浓度为6 mg/L的苯丙氨酸样品气在正模式下的FAIMS谱图 (A) 和背景 (空气) 的FAIMS谱图
Fig.8 FAIMS spectra of phenylalanine gas (A) and background (air) (B) in positive mode when phenylalanine concentration is 20 mg/L
图9 苯丙氨酸在不同浓度下的离子信号强度随补偿电压变化的二维曲线图
Fig.9 Plots of ion intensity of phenylalanine versus compensation voltage with different phenylalanine concentrations
4 结 论
采用扩散管芯片式高场非对称波形离子迁移谱技术对苯丙氨酸进行了快速检测分析,考察了分离电压、补偿电压和采样流速对苯丙氨酸检测的影响规律,计算出苯丙氨酸的非线性迁移率系数并对苯丙氨酸特征谱的形状做出了理论解释。在优化的检测条件下,确定了苯丙氨酸的检出限和定量线性范围。为FAIMS应用于快速检测苯丙氨酸提供了依据。整个过程检出时间仅为30 s,与高效液相色谱荧光法[5,6]的检测时间30 min相比,本实验的装置虽然分辨率有待提高,但是检测时间优势明显。本方法进样简单,直接将样品气化进行测试;没有涉及前处理;所需的试剂少,只需要纯水和甲醇,操作简单便捷。
References
1 Pey A L, Desviat L R, Gámez A, Ugarte M, Pérez B. Hum. Mutat., 2003, 21(4): 370-378
2 YE Jun, LIU XiaoQing, MA XieQin, ZHANG YaFen, HUANG XiaoDong, CHEN RuiGuan, GU XueFan. Chinese Med. J.Peking, 2002, 115(2): 217-221
叶 军, 刘晓青, 马燮琴, 张雅芬, 黄晓东, 陈瑞冠, 顾学范. 中华医学杂志英文版, 2002, 115(2): 217-221
3 Halaban R, Cheng E, Hebert D N. J. Invest. Dermatol., 2002, 119(2): 481-488
4 Morrow B A, Elsworth J D, Roth R H. Synapse, 1996, 22(2): 100-105
5 HONG Min, TANG AiGuo. J. Cent. South Univ. (Med Sci), 2004, 29(1): 67-71
洪 敏, 唐爱国. 中南大学学报 (医学版), 2004, 29(1): 67-71
6 QIN LiXin, HONG Min, TANG AiGuo, MO XiMing. Pract Prevent Med., 2006, 12(3): 529-531
秦立新, 洪 敏, 唐爱国, 莫喜明. 实用预防医学, 2006, 12(3): 529-531
7 HUANG XianZhi, XU JinGou, LI YaoQun. Chinese J. Anal. Chem., 1987, 15(3): 199-202
黄贤智, 许金钩, 李耀群. 分析化学, 1987, 15(3): 199-202
8 CAO Wei, FU PeiYu. Spectrosc. Spect. Anal., 1995, 15(2): 119-122
曹 伟, 付佩玉. 光谱学与光谱分析, 1995, 15(2): 119-122
9 CAI Sheng, TU ChunYan, ZOU JiaQin, YANG DongHong. Journal of Nanjing University of Chemical Technology, 1999, 21(3): 39-43
蔡 升, 屠春燕, 邹家庆, 杨冬红. 南京化工大学学报, 1999, 21(3): 39-43
10 CHEN YongBo, RAO Bin. Amino. Acids & Biotic Resources., 2000, 22(1): 55-58
陈永波, 饶 斌. 氨基酸和生物资源, 2000, 22(1): 55-58
11 Armstrong M, Jonscher K, Reisdorph N A. Rapid Commun. Mass Spectrom., 2007, 21(16): 2717-2726
12 McCooeye M, Mester Z. Rapid Commun. Mass Spectrom., 2006, 20(11): 1801-1808
13 AlarcónFlores M I, RomeroGonzález R, Frenich A G, Vidal J L M, Reyes R C. Anal. Methods., 2010, 2(11): 1745-1751
14 Buryakov I A, Krylov E V, Nazarov E G, Rasulev U K. Int. J. Mass Spectrom. Ion Process., 1993, 128(3): 143-148
15 LIU YouJiang, CHEN ChiLai, ZHANG XiaoTian, WANG HongWei, ZHANG LeHua, KONG DeYi. Chinese J. Anal.Chem., 2014, 42(9): 1259-1263
刘友江, 陈池来, 张乐华, 张晓天, 王泓伟, 孔德义. 分析化学, 2014, 42(9): 1259-1263
16 Cohen M J, Karasek F W. J. Chromatogr. Sci., 1970, 8(6): 330-337
17 Guevremont R. J. Chromatogr. A, 2004, 1058(1-2): 3-19
18 Prieto M, Yost R A. Int. J. Ion Mobil. Spectrom., 2011, 14(23): 61-69
19 Shvartsburg A A, Seim T A, Danielson W F, Norheim R, Moore R J, Anderson G A, Smith R D. J. Am. Soc. Mass Spectrom., 2013, 24(1): 109-114
20 Nazarov E G. Int. J. Ion Mobil. Spectrom., 2012, 15(3): 83-84
21 Cumeras R, Gràcia I, Figueras E, Fonseca L, Santander J, Salleras M, Calaza C, Sabaté N, Cané C. Sen. Actuat B: Chem., 2012, 170: 13-20
22 ZHANG Jie, LI LingFeng, GUO DaPeng, ZHANG Yuan, WANG Qi, LI Peng, WANG XiaoZhi. Chinese J. Anal. Chem., 2013, 41(7): 986-992
张 洁, 李灵锋, 郭大鹏, 张 媛, 王 琦, 李 鹏, 汪小知. 分析化学, 2013, 41(7): 986-992
23 Guo D, Wang Y, Li L, Wang X, Luo J. J. Mass Spectrom., 2015, 50(1): 198-205
24 Shvartsburg A A, Smith R D. Anal. Chem., 2012, 85(1): 10-13
25 O Donnell R M, Sun X, Harrington P D B. TRACTrends Anal. Chem., 2008, 27(1): 44-53
26 LI Zhuang, LIN BingTao, CHEN ChiLai, LIU Ying, KONG DeYi, CHENG YuPeng, WANG DianLing, WANG HuanQin. Chinese J. Anal. Chem., 2011, 39(1): 107-110
李 庄, 林丙涛, 陈池来, 刘 英, 孔德义, 程玉鹏, 王电令, 王焕钦. 分析化学, 2011, 39(1): 107-110
27 LIN BingTao, CHEN ChiLai, KONG DeYi, LI Zhuang, WANG HuanQin, CHENG YuPeng, WANG DianLing, MEI Tao. Chinese J. Anal. Chem., 2010, 38(7): 1027-1030
林丙涛, 陈池来, 孔德义, 李 庄, 王焕钦, 程玉鹏, 王电令, 梅 涛. 分析化学, 2010, 38(7): 1027-1030
28 Tsai C, Yost R A, Garrett T J. Bioanalysis, 2012, 4(11): 1363-1375
29 McCooeye M, Mester Z. Rapid Commun. Mass Spectrom., 2006, 20(11): 1801-1808
30 Xia Y, Wu S T, Jemal M. Anal. Chem., 2008, 80(18): 7137-7143
31 Wu S T, Xia Y Q, Jemal M. Rapid Commun. Mass Spectrom., 2007, 21(22): 3667-3676
32 LI LingFeng, WANG TieSong, HAN Ke, XU TianBai, WANG Qi, LI Peng, WANG XiaoZhi. Chinese J. Anal. Chem., 2014, 42(4): 519-524
李灵锋, 王铁松, 韩 可, 徐天白, 王 琦, 李 鹏, 汪小知. 分析化学, 2014, 42(4): 519-524
33 LI Juan, ZHAO WeiJun, LI LingFeng, LI Xin, LI Peng, WANG XiaoZhi. Chem. J. Chinese Universities, 2014, 35(7): 1403-1408
李 娟, 赵伟军, 李灵锋, 李 鑫, 李 鹏, 汪小知. 高等学校化学学报, 2014, 35(7): 1403-1408
34 Wilks A, Hart M, Koehl A, Somerville J, Boyle B, RuizAlonso D. Int. J. Ion Mobil. Spectrom., 2012, 15(3): 199-222
Rapid Determination of Phenylalanine by Microchip based Field
Asymmetric Waveform Ion Mobility Spectrometry
GUO DaPeng1, WANG YongHuan1, XU TianBai1, ZHANG Yuan2, LI LingFeng1,
CHEN JinKai1, WANG XiaoZhi*1, LI Peng2, LUO JiKui1
1(Department of Information Science & Electronic Engineering, Zhejiang University, Hangzhou 310027, China)
2(Suzhou Wei Mu Intelligent System Ltd., Suzhou 215163, China)
Abstract Field asymmetric ion mobility spectrometry (FAIMS) technology was used for the rapid analysis of phenylalanine (PHE) using a metal diffusion tubemicrochip FAIMS system. The test pressure was set at 250 kPa, and the temperature of the gas generator for the diffusion tube was at 190℃. The ion characteristic spectra were acquired under the optimized conditions with a gas flow rate of 2000 mL/min, a dispersion voltage of 152.8 V and a compensation voltage value of
Symbolm@@ 0.62 V for phenylalanine in positive mode. Phenylalanine gas samples with different concentrations were analyzed by FAIMS. The results showed that the ion intensity was linearly correlated to phenylalanine concentration in the range from 6 mg/L to 20 mg/L, and the limit of detection for phenylalanine was 5.9 mg/L. This investigation shows the feasibility of FAIMS technique for rapid detection of phenylalanine. The FAIMS instrument is simple and sensitive, and can be used for rapid detection of phenylalanine.
Keywords Phenylalanine; Rapid Determination; Field asymmetric ion mobility spectrometry; Metal diffusion tube
(Received 6 September 2015; accepted 31 October 2015)
This work was supported by the National Natural Science Foundation of China (No.61301046)
