基于阵列微流控细胞芯片的植物组分抗氧化活性分析
2016-11-19张潇丹徐溢张涛吕君江
张潇丹 徐溢 张涛 吕君江

1
摘 要 设计并制作了一种集成有8个重复6×6细胞培养单元的阵列微流控细胞芯片,以实现细胞培养和系列植物组分的细胞抗氧化活性(Cellular antioxidant activity,CAA)分析。芯片主要包含聚二甲基硅烷盖片、288个圆形培养腔体,48个独立平行通道的玻璃基底层,一次可完成8个样本的6个浓度筛选,并可在酶标仪上实现测试。槲皮素、芦丁和山奈酚等植物组分与芯片上培养的细胞作用24 h,细胞存活率大于90%。以芯片上培养的人肝癌细胞HepG2为细胞载体,以2′,7′二氯荧光素乙酰乙酸酯(2′,7′Dichlorofluorescin diacetate, DCFHDA)为荧光探针,采用2,2′偶氮二异丁基脒二盐酸盐(2,2′azobis(2amidinopropane) dihydrochloride,ABAP)为细胞内活性氧(Reactive oxygen species,ROS)引发剂,测得槲皮素、芦丁、山奈酚等植物组分的CAA unit分别为71.42±0.19、74.31±0.36和69.92±0.09(±s, n=3),IC50分别为(7.20±0.06) μmol/L, (52.06±0.14) μmol/L, (32.55±0.03) μmol/L(±s, n=3)。
关键词 阵列微流控细胞芯片; 细胞抗氧化活性; 高通量; 筛选
1 引 言
近年来,药物细胞毒性和药效评价已成为新药研发中化合物筛选的主要观测指标。在抗氧化活性评价研究中,Wolfe[1]建立了细胞抗氧化活性(Cellular antioxidant activity,CAA)分析方法,在细胞水平上测定抗氧化剂对自由基氧化的抑制效果,并对水果和蔬菜中活性物质进行抗氧化活性测定。随后,Karl[2]和Zhao[3]等借鉴该法进行了植物提取物CAA分析。然而,这些方法依旧面临着通量低、测试过程复杂等问题。因此,如何更好地将CAA测试方法与高通量、高内涵分析技术结合,实现快速准确、高自动化的筛选,仍是亟需解决的问题。为此,研究人员开发了多种新型技术,以便在药物研发过程中尽早确定化合物的安全特性和功效。其中微流控芯片分析技术较以往的筛选技术更具有优势,可将样品预处理、反应、衍生、分离和检测等分析步骤微型化到一个芯片上,以流体和阵列多通道的形式缩短分析时间,在低耗样量的状态下提供一个进行细胞生理、生化分析的微环境,具有快速分析、信息量大、制作成本低等优点[4],因而成为极具潜力的药效测试新平台。如,Frey等[5]设计的可重组式微液滴器官芯片、Espulgar等[6]设计的离心式细胞芯片。Ye等[7]设计了结构非常紧密的由8个对称的药物浓度梯度发生器和细胞培养区组成的微流控芯片,一次可完成8个样本的8个浓度筛选,利用该芯片培养肝微粒体,通过与下游的芯片电泳和细胞培养单元集成,可同时完成药物代谢物检测和毒性评价。Xu等[8]基于浓度梯度发生器和三维细胞培养单元建立的药敏测试平台中的芯片设计更为简单巧妙,浓度梯度的产生依赖于3组不同长度的微通道(5.7/7.5/12.5 mm)和不同直径的弯曲通道(0.2/0.23/0.3 mm),利用该芯片一次完成了4个样本3个浓度的测试,可方便地用于肺癌的个体化治疗。因此,将微流控芯片技术用于细胞内抗氧化活性测试研究,对于抗氧化活性药物的高通量高内涵测试和筛选同样具有启发性。
本研究设计并制作了一种集成了8个重复6×6阵列细胞培养单元的阵列微流控细胞芯片,实现了芯片上细胞连续培养和化合物对细胞毒性检测,将其与CAA测试方法结合,搭建了一个细胞抗氧化活性芯片分析平台,并采用植物抗氧化剂槲皮素、芦丁和山奈酚进行芯片功能测试。结果表明,此芯片可以很好地发挥体外活性评价作用。
2 实验部分
2.1 仪器与试剂
HH.CP7W二氧化碳培养箱(上海博迅公司);ZDX35BI电热压力蒸汽灭菌器(上海申安公司);IX71奥林巴斯荧光显微镜(日本奥林巴斯株式会社);SynergyTM HT多功能酶标仪(美国BioTek公司)。SWCJ1FD超净台(苏州净化公司);流动注射泵(美国Harward公司)。
含10%胎牛血清的DMEM细胞培养基(美国HyClone公司)。二甲基亚砜、多聚赖氨酸(分子量30000~70000)、2,2′偶氮二异丁基脒二盐酸盐、二氯二氢荧光素乙酰乙酸酯、羟基荧光素二醋酸盐琥珀酰亚胺脂(美国Sigma公司)。山奈酚、芦丁和槲皮素(纯度>98%)。人肝癌细胞HepG2悬浮液,浓度为106 个/mL,生存状态为对数生长期,取自重庆市西南医院消化科。
2.2 实验方法
2.2.1 阵列微流控细胞芯片的制作及检测系统 如图1A和图2所示,设计了基于6×6细胞培养单元的阵列微流控细胞芯片及其检测系统。采用标准光刻湿刻方法将掩膜图形转移至玻璃板,经过曝光、显影、湿法刻蚀和去胶等步骤(图1B),最终制成了一个含有288个圆形培养腔体、48个独立平行通道的芯片玻璃层。实验前将聚二甲基硅烷(Polydimethylsiloxane,PDMS)预聚体与固化剂混合均匀,脱气后浇铸于载玻片上,放置在烘箱中80℃条件下加热固化1 h形成PDMS盖片。与芯片玻璃层可逆键合成PDMS玻璃复合芯片。在检测时,将芯片固定在孔板读数仪的托架上,仪器参数设置选择96孔板板型,并通过Plate layout设置相应检测孔。
2.2.2 阵列微流控细胞芯片上肝癌细胞HepG2的培养 将芯片清洗干净,灭菌处理。通过流动注射泵,从芯片中心口M到两端口E连续泵入10 μg/mL的多聚赖氨酸(PolyLLysine,PLL)溶液5~10 min,泵出多余液体,将芯片放置于超净台内晾干,使PLL充分包被微流控阵列芯片的微腔和管道。接种细胞前,由芯片中心口M到两端口E连续泵入无水乙醇以排除气泡,PBS清洗和培养基浸润管道。随后取对数生长期的HepG2细胞由芯片两端口E到中心口M接种于芯片上,在37℃于5%CO2培养箱中培养4 h, 更换新鲜培养基。此后每隔6~7 h为芯片上所培养的细胞换液。
2.2.3 阵列微流控细胞芯片上植物抗氧化剂与细胞相互作用测试 芯片上培养细胞24 h。利用自行搭建的微分析系统,测试植物抗氧化剂对芯片上HepG2细胞生长的影响。将系列含不同浓度植物抗氧化剂的培养基,从芯片两端口E输入,保持液体在两端口与中心口液面的高度差,液体缓缓地流过阵列微流控细胞芯片的PDMS玻璃通道和微腔,汇集到芯片中心口M,由M引出多余液体。芯片于培养箱中继续培养。在系列植物抗氧化剂作用下细胞继续生长24 h。由M到E用PBS冲洗细胞2 min,通入50 μmol/L 羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)孵育细胞3 min。选择488 nm激发波长和518 nm观测波长, 孔板读数仪上读数。测试中需手动调节芯片位置1次。实验测得各细胞腔体内不同样本浓度作用下CFSE标记细胞荧光强度,按照公式(1)计算细胞活力(Cell viabitity, CV):
CV(%)=Fludose/Flucontrol×100% (1)
式中:Fludose表示单次实验中化合物作用下微腔平均荧光强度,Flucontrol表示单次实验中对照腔体平均荧光强度。
2.2.4 阵列微流控细胞芯片上植物抗氧化剂的CAA测试
芯片上培养细胞24 h后,除去培养液,PBS清洗2 min,同2.2.2节操作,芯片两端口E通入系列含不同浓度植物抗氧化剂和25 μmol/L DCFHDA的细胞培养基,将芯片静置于37℃、5% CO2培养箱中30 min,无菌PBS由M到E小心冲洗5 min。用200 μmol/L ABAP溶液处理,在孔板读数仪上,同2.2.3节操作,选择488 nm激发波长和525 nm观测波长测定作用0~90 min的荧光值。同时,在90 min时,荧光倒置显微镜下逐个观察各腔体内HepG2细胞的荧光图谱。
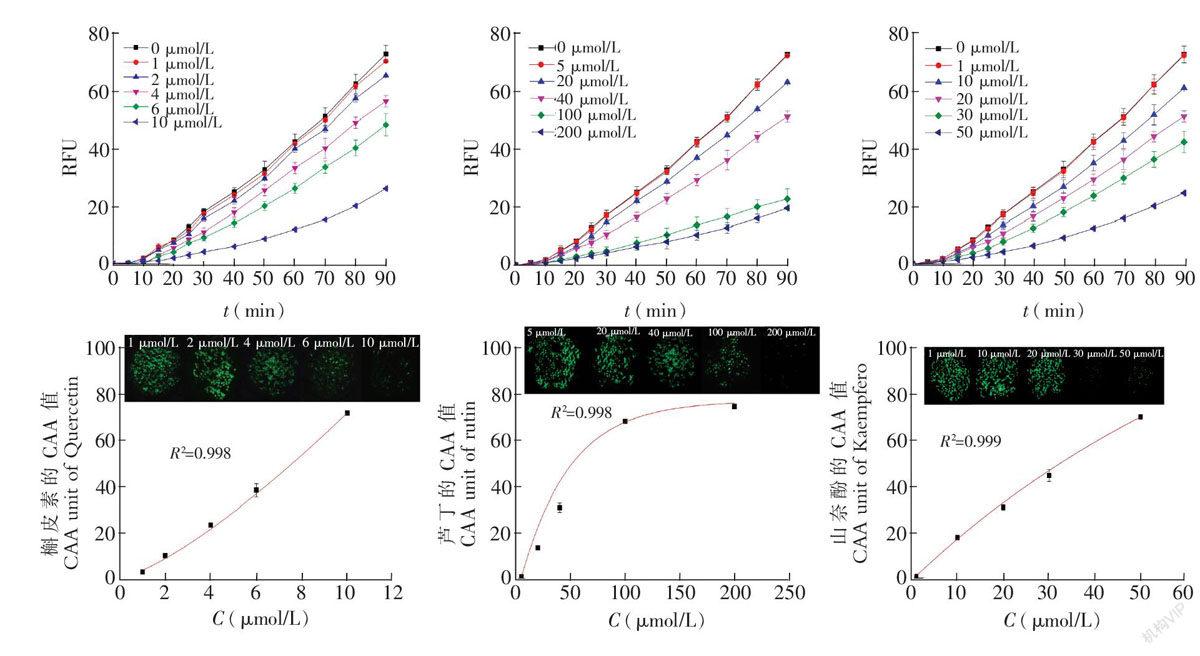
实验测得HepG2细胞平均相对荧光强度时间曲线,用Origin8.5软件计算积分面积,按照公式(2)计算CAA值。通过CAA值浓度关系反映细胞荧光物质的减少量,从而反映该化合物的抗氧化能力。
3 结果与讨论
3.1 阵列微流控细胞芯片的设计制作及表征
如图1A,设计的阵列微流控细胞芯片的每个芯片单元有6条平行的阵列管道,每条管道有6个直径为500 μm的圆形细胞培养腔,可同时进行6组不同的实验,每组有6个平行实验值,有效提高了结果的重复性和准确性。圆形腔体设计能有效减缓流速,降低剪切力对细胞的影响,有利于细胞停留。每条管道相距5 mm,相邻培养腔中心连线相距1 mm,与酶标仪相匹配。芯片中心口M和两端口E分别设有储液池。实体单元芯片的尺寸如图1A,深度为50 μm,尺寸符合设计要求。基于高通量药物测试的需求,将8个这样的芯片单元集成在一块96孔板尺寸大小的玻璃上,集成芯片上有288个培养腔,48个独立通道,可完成8种不同样本的6个浓度筛选。
3.2 阵列微流控细胞芯片上肝癌细胞HepG2的培养
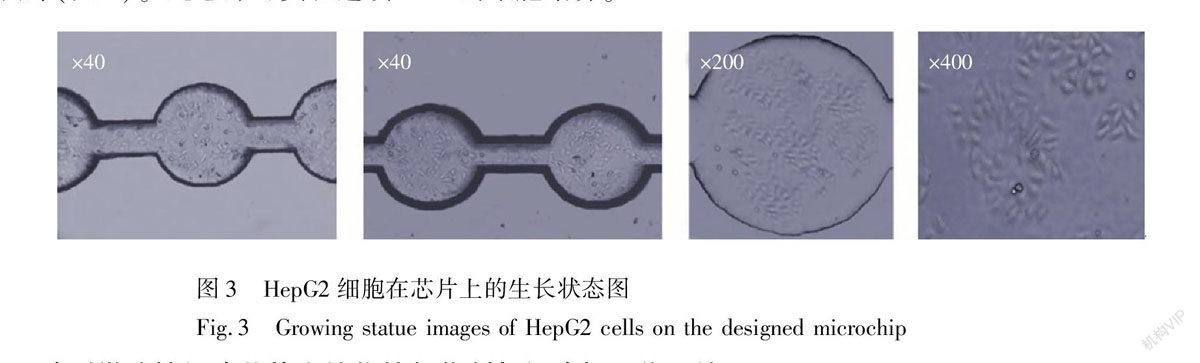
PLL能形成一层带正电荷的亲水性表面,从而促使表面含有大量阴性糖蛋白的细胞更易吸附在培养腔内。实验发现通过PLL处理微管道和培养腔后,细胞贴壁时间可缩至4 h,且在腔体内分布均匀,与细胞培养瓶等常规细胞培养载体相比,细胞的形态和生长增值无显著差异。培养24 h后细胞生长状态良好(图3)。此芯片可实现连续72 h的细胞培养。
3.3 阵列微流控细胞芯片上植物抗氧化剂与细胞相互作用结果
实验中每个样本由图2A所示的1个6×6芯片单元完成其与细胞相互作用的测试,设5个样本浓度,1个空白对照,每个浓度6个平行。用SPSS17.0统计软件对浓度为0~300 μmol/L的槲皮素、芦丁和山奈酚对细胞生长影响进行统计分析,p>0.05,无统计学意义,表明在以上浓度范围内植物氧化剂对HepG2细胞生长基本无影响(表1)。槲皮素、芦丁和山奈酚作用于HepG2细胞24 h后,与对照组腔体中一样,培养腔内细胞数量多,排列紧密,生长状态良好,CFSE标记细胞发出均匀一致的绿色荧光(图4)。
3.4 阵列微流控细胞芯片上系列植物抗氧化剂的CAA测试结果
实验中每个样本采用图2A所示的1个芯片单元,设5个样本浓度,1个空白对照,每个浓度6个平行腔体。酶标仪上测得槲皮素、芦丁和山奈酚作用下的DCFHDA标记HepG2细胞荧光强度时间曲线(图5),其荧光强度随阵列微流控细胞芯片不同管道内通过的抗氧化剂摩尔浓度增加而有不同程度的下降。在芯片荧光测试过程中,用荧光倒置显微镜观察不同浓度的槲皮素、芦丁和山奈酚作用下细胞内荧光强度的变化,可更加直观地看出其抗氧化效果。
CAA法测定抗氧化剂作用下阵列微流控细胞芯片上所培养HepG2细胞中产生的ROS导致DCF形成的能力。与对照组相比,细胞荧光物质的减少量就能反映该化合物的抗氧化能力。实验中的DCFHDA本身没有荧光,它可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成无荧光的DCFH。而DCFH不能通透细胞膜,从而使DCFHDA荧光探针很容易地被装载到细胞内。同时,进入细胞内的ABAP裂解成ROS,可以氧化DCFH生成有荧光的DCF,检测DCF的荧光强度就可以反应细胞内ROS水平。由于HepG2细胞荧光强度与细胞内ROS水平呈正比,荧光强度越高,ROS含量越高,因此与对照组相比,化合物降低细胞荧光强度能力可以反映其能够降低细胞内ROS的水平,即此化合物的抗氧化能力。
槲皮素、芦丁和山奈酚具有明显的抗氧化活性,并且存在一定的剂量效应关系,即抗氧化作用随其摩尔浓度的增加而增强(p<0.05)。如图5所示,随着浓度增大,不同植物抗氧化剂作用下腔体内细胞荧光强度越来越弱。可以清楚的看到,槲皮素的活性氧清除效率要优于芦丁,但是最终能够清除的活性氧量,芦丁要优于槲皮素。CAA值达到50时,3种化合物的摩尔浓度IC50如表1所示。
由表1可知,在作用于HepG2时,槲皮素、芦丁和山奈酚的CAA值:芦丁>槲皮素>山奈酚,IC50:芦丁>山奈酚>槲皮素,即这3种植物抗氧化剂细胞内自由基清除能力:芦丁>槲皮素>山奈酚,而自由基清除效率:槲皮素>山奈酚>芦丁,数据趋势与文献中96孔板测试一致[2,10]。研究表明,黄酮类化合物具有很强的抗氧化性,在水溶液体系中双糖苷优于苷元。此外,清除自由基活性与羟基数目相关,一般酚羟基越多,抗氧化性越好。而在生物模型中,由于细胞膜是脂溶性的,脂溶性药物更易进入细胞,抗氧化活性苷元优于双糖苷。如表1和图5所示,高浓度下,当细胞内环境中有充足的抗氧化剂时,抗氧化能力表现出与水溶液中实验结果相似的特性,表现为双糖苷(芦丁)优于黄酮苷元(槲皮素),优于类黄酮(山奈酚)。而在低浓度下,化合物抗氧化能力取决于进细胞难易,因此,黄酮苷元(槲皮素)优于类黄酮(山奈酚),优于双糖苷(芦丁)。因此,利用此实验芯片不仅可以实现细胞的连续培养,通过灵活组合单元芯片,还可以实现多种植物氧化剂与细胞相互作用分析和抗氧化活性的评价,与已有结果符合。芯片设计不仅充分体现了CAA方法在抗氧化活性评价中的优越性,而且与酶标仪匹配,检测方便快捷。
4 结 论
本研究设计并制作了基于6×6细胞培养单元的阵列微流控细胞芯片,芯片结构简单,操作方便,实验中可据不同测试需要对各单元和进出口进行灵活组合。实验中,将芯片与CAA测试方法相结合,利用实验室自行搭建的微流控分析平台,定量评价了植物抗氧化剂(槲皮素、芦丁和山奈酚)的活性氧清除效率和活性氧清除能力,表现为其IC50分别为(7.20±0.06) μmol/L、 (52.06±0.14) μmol/L和(32.55±0.03) μmol/L,CAA值分别为71.42±0.19、74.31±0.36和69.92±0.09。此阵列微流控细胞芯片上可同时完成8种不同样本的多浓度测试,为高通量测试奠定基础。实验表明,此微系统和测试方法样本适应性强,不仅具有很好的区分各种抗氧化剂的抗氧化效果,包括自由基清除效率和能力,定量评价抗氧化剂的抗氧化活性,还可以用于药物对肿瘤细胞杀伤作用的研究,为现代药物筛选和研究中的高内涵测试提供参考。
References
1 Wolfe K L, Liu R H. J. Agric. Food Chem., 2007, 55: 8896-8907
2 Karl G L, André, P, Jean L. Food Chem., 2009, 115: 720-726
3 Zhao C F, Dou J L, Guang H. S. Food Chem., 2015, 169: 484-491
4 LI WenJuan, XU Yi, FAN Qi, CAO Kun, ZHANG Qing, WANG ChangRui. Chin. J. Chin. Mater. Med., 2012, 37(8): 2492-2497
李文娟, 徐 溢, 范 琪, 曹 坤, 张 庆, 王昌瑞. 中国中药杂志, 2012, 37(8): 2492-2497
5 Frey O, Misun P M, Fluri D A, Hengstler J G, Hierlemann A. Nat. Commun., 2014, 37(8): 2492-2497
6 Espulgar W, Aoki W, Ikeuchi T, Mita D,Saito M, Leeb J K, Tamiy E. Lab Chip, 2015, 15(17): 3572-3580
7 Ye NN, Qin J H, Shi W W, Liu X, Lin B C . Anal. Chem., 2008, 28(3): 1-5
8 Xu Z Y,Gao Y H, Hao Y Y, LI E C, Wang Y, Zhang J N, Wang W X, Gao Z C, Wang Q. Biomaterials, 2013, 5(34): 4109-4117
9 Maciej J, Schaeff C T, Kanitz E, Tuchscherer A, Bruckmaier R M, Wolffram S, Hammon H M. J. Dairy Sci., 2015, 98(6): 3906-3917
Assessing Plant Antioxidants by Cellular Antioxidant Activity Assay
Based on Microfluidic Cell Chip with Arrayed Microchannels
ZHANG XiaoDan1,2,3, XU Yi1,2,3, ZHANG Tao1,2,3, L
JunJiang1
1(College of Chemistry and Chemical Engineering, Chongqing University, Chongqing 400030, China)
2(Key Disciplines Lab of Novel Micronano Devices and System Technology, Chongqing 400030, China)
3(International R & D center of Micronano Systems and New Materials Technology, Chongqing 400030, China)
Abstract An integrated microfluidic chip with arrayed micro channels that consisted of eight repeat arrayed 6×6 cell culture chamber was designed and fabricated. The analytical microsystem combined with designed microchip, measuring device and environmental control unit was established for cell culture and parallel cellular antioxidant activity (CAA) analysis of plant antioxidants. The microfluidic chip included a polydimethylsiloxane (PDMS) cover and glass substrate that consisted of two hundreds and eightyeight round cell culture microchambers and fortyeight independent parallel array channels. Eight groups of different samples with six different concentrations could be investigated simultaneously with multimode reader in one test. HepG2 cells were successfully cultured on the microchip. Moreover, the viability percentage of the HepG2 cells exposed to these plant antioxidants solutions at different concentrations for 24 h was higher than 90%. With 2′,7′Dichlorofluorescin diacetate (DCFHDA) as a fluorescence probe, 2,2′azobis(2amidinopropane) dihydrochloride (ABAP) as the initiator of intracellular reactive oxygen species (ROS), we tested the inhibitory effect of several plant antioxidants such as quercetin, rutin and kaempferol on free radicals. The CAA units were calculated by the data measured from cellular morphology and fluorescence intensity over time. It was shown that the CAA units of quercetin, rutin and kaempferol were 71.42±0.19, 74.31±0.36 and 69.92±0.09 (±s, n=3), while the calculated IC50 were (7.20±0.06) μmol/L, (52.06±0.14) μmol/L and (32.55±0.03) μmol/L (±s, n=3), respectively.
Keywords Microfluidic cell chip with arrayed microchannels; Cellular antioxidant activity; High throughput; Screening
(Received 27 July 2015; accepted 4 October 2015)
This work was supported by the National Natural Science Foundation of China (No. 21375156), National Mightech R&D Program (863 program)(No.2015AA021104) and the Fundamental Research Fund for the Central Universities (No. 106112015CDJZR225512)
