液滴微流控技术在生物医学中的应用进展
2016-11-19闫嘉航赵磊申少斐马超王进义
闫嘉航 赵磊 申少斐 马超 王进义

摘 要 液滴微流控是微流控芯片领域的一个重要分支,由于其诸多独特优势而得到了广泛的应用与研究。本文将概述液滴微流控的特点和基本原理,同时对近年来其在生物医学中的应用进行了简要综述,并展望了液滴微流控技术的发展前景。
关键词 微流控; 液滴; 药物传递; 综述
1 引 言
微流控(Microfluidics)是指在微米尺度空间对流体进行操控的一种技术,该技术可以将化学、生物等实验室的基本功能微缩到一个几平方厘米芯片上,因此又被称为芯片实验室 (Labonachip)[1]。微流控芯片系统可以在几十到几百微米的微小通道或构件中操控流体的流动,所操控的流体体积可小至10
Symbolm@@ 9~10
Symbolm@@ 18L。它把样品反应、制备、分离、检测等生化实验的基本操作集成到很小的芯片上,以可控流体由微通道形成网络贯穿于微流控系统,在实现了常规生化实验室各项功能的同时,降低了分析检测的成本,加快了反应速度,提高了反应效率,使得实验可控性更强[2]。微流控芯片制作简单、成本低廉、分析速度快,现已广泛应用于生物、化学和医学等研究领域[1~4]。
液滴微流控作为微流控芯片研究中的重要分支,是近年来在传统连续流微流控系统基础上发展起来的,利用互不相溶的两液相产生分散的微液滴进行实验操作的非连续流微流控技术[5]。在微流控芯片中,液滴是两相界面处的表面张力和剪切力共同作用形成的,根据分散相和连续相的不同,液滴可分为两种:油相中的水相微液滴(W/O型液滴),和水相中的油相微液滴(O/W型液滴)。液滴微流控实现了液滴在微小通道中的流动控制,为生物和医学研究搭建了一个全新的平台[6]。迄今为止,液滴技术已广泛应用于DNA、蛋白质、酶等生物大分子的分析检测以及药物传递等生物医学领域。
2 液滴微流控概况
2.1 液滴微流控的特点
传统的连续流微流控系统,由于低雷诺数层流的特点,连续流体的混合比较困难,同时也增加了其样品的消耗量。此外,当需要增加平行测试的数目以提高反应或分析的通量时,往往会增加芯片的尺寸和复杂性。另外,均相流体也易造成交叉污染[7,8]。与之相比,液滴微流控技术由于结合了微流控以及液滴技术,使其兼有两者的特点:
(1)体积微小 通过微流控液滴技术,产生的微液滴体积可在纳升甚至飞升范围内。体积的减小增加了液滴的比表面积和传质性能,能与连续相之间发生高效的物质传递和能量转移,从而减少了液滴内样品混合及反应的时间。Leman等[9]在飞升(fL)水平的液滴中进行操控并获得显著成效,在75 fL的液滴中它们的混合时间为45 μs,远远快于此前的报道。液滴由于反应快速,所需样品量消耗微少,适用于对单细胞、单分子进行分析,尤其也适合一些珍贵样品的筛选与分析[10~12]。
(2)生成速度快 微液滴在微流控技术下的产生频率在0.1~ 2000 Hz之间,因此微液滴能为一些酶反应和基于细胞筛选的实验提供高分辨率的优质数据支持[13,14]。此外,液滴微流控这一特性可以在短时间内产生大量平行重复的反应单元,从而在高通量基因分析和药物筛选等方面被广泛应用[15~17]。
(3)大小均匀,体系封闭 由于每个微液滴处在连续相中被彼此分开。每个液滴中的样品互不影响,这样就使得样品浓度保持相对稳定,且避免了样品之间的交叉污染。另外,水相微液滴由于被油相包裹,内部环境稳定,外部蒸发受到抑制,反应条件在短时间内所受外界的影响微乎其微[18],这些条件在宏观的实验中是很难实现的。此外,微液滴还可包裹单个细胞或者细胞团,甚至可对活生物体进行培养来测定特定刺激下所产生的可溶性代谢产物[19]。
(4)单分散性良好 由于多分散性所产生的液滴大小不同,传统的液滴方法在实际研究中很难进行定量分析,而液滴微流控技术所产生的微液滴凭借其良好的单分散性,使反应物的浓度保持相同,反应条件保证一致,因而有助于实验的定量分析与研究[20,21]。此外,还可将检测装置集成于微流控芯片上,使液滴能被直接分析,从而极大地扩展了其应用范围[22,23]。
2.2 液滴的生成方法
在微流控芯片上产生液滴,是一相流体在另一相不互溶或部分互溶流体中分散的过程,两种互不相溶的液体,以其中的一种作为连续相,另一种作为分散相,分散相以微小体积(10
Symbolm@@ 15~10
Symbolm@@ 9 L)单元的形式分散于连续相中,形成液滴[24~26]。目前形成液滴的方法可以分为被动法和主动法两类[27,28]。被动法是指通过控制微管道结构和两相流速比来控制液滴的生成[29~32],而主动法一般通过外加力来驱动和控制液滴的生成[23]。
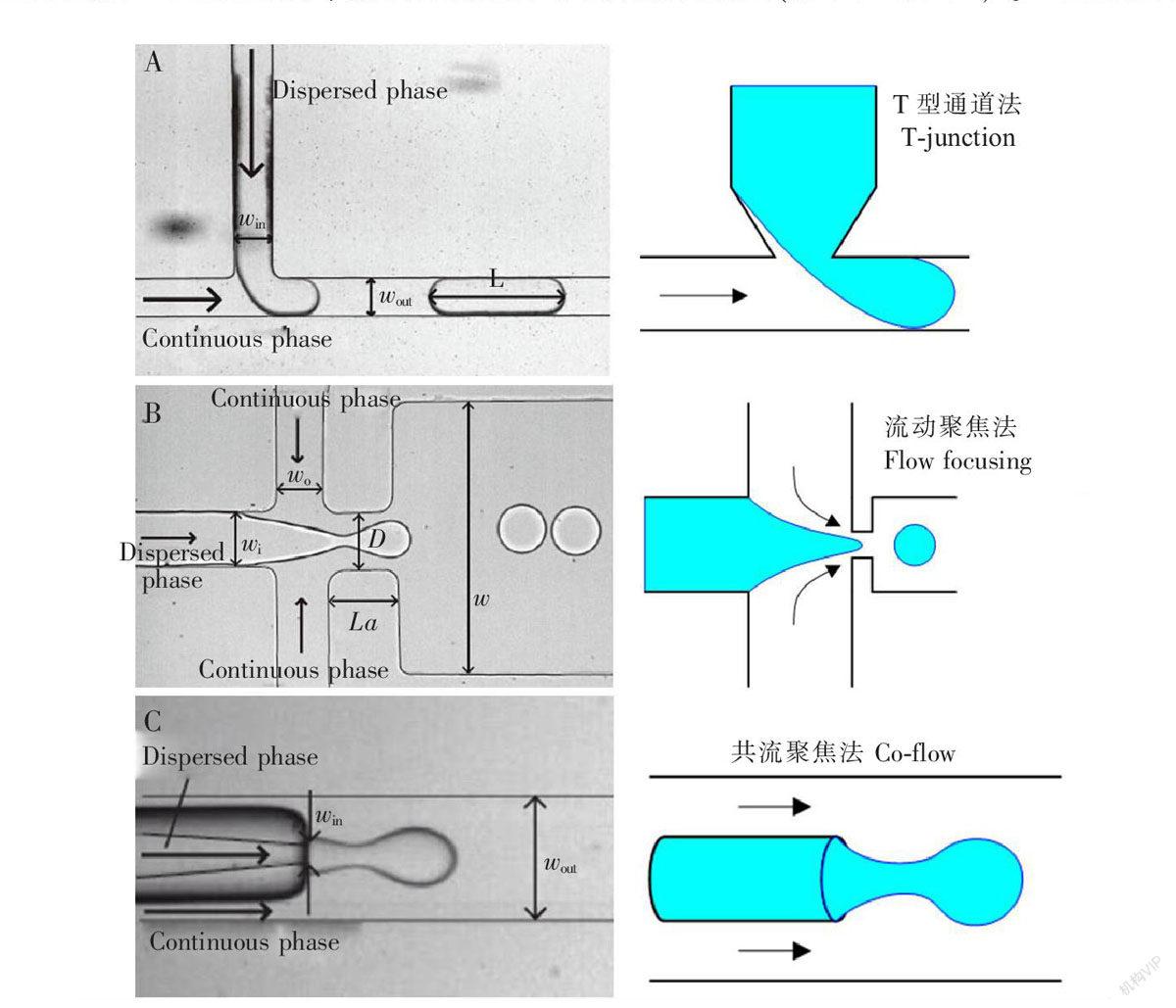
被动法主要包括T型通道法、流动聚焦法和共轴流聚焦法(如图1所示)。T型通道法是产生微流
图1 3种被动产生微液滴的方法[33]
Fig.1 Three passive methods for generating microdroplets [33]
(A) T型通道微流控芯片液滴发生方法;(B) 流动聚焦微流控芯片液滴发生方法;(C) 共轴流微流控芯片液滴发生方法。右侧为对应方法的原理示意图[34]。其中有色部分为分散相,箭头所指方向为连续相流动方向。
(A) Tjunction microfluidic chip droplet formation method;(B) Flowfocusing microfluidic chip droplet formation method;(C) Coflowing streams of microfluidic chip droplet formation method. The right parts are schematic illustrations of relative methods [34]. The colored area indicates the dispersed phase, and the arrow indicates the flow direction of the continuous phase, respectively.
控液滴最常用的方法之一,由Thorsen等[29]最先提出。在T型通道法中,两相不相溶的流体在垂直的T型管道交叉口处相遇,在压力和剪切力的作用之下,流动相截断分散相,从而形成液滴。流动聚焦法由Anna等[30]和Dreyfus等[31]最先提出。在流动聚焦法中,三条流路聚焦一个管道中,分散相和流动相汇合于十字交叉管处,上下对称的流动相同时挤压分散相使其断裂,从而形成液滴。共轴流聚焦法是Cramer等[32]最早用来制备微液滴的。在共轴流聚焦法中,孔道中心轴内插入尖嘴的毛细管,分散相和连续相处在管道内平行流动,分散相在进入连续相管道时,在连续相流体的剪切力作用下, 被挤压断裂形成液滴。
主动法包括电驱动法和光驱动法等。常见电驱动法主要有介电泳法和电润湿法[35,36]。介电泳法是从储液室中将液体拉出以形成液滴。生成液滴的大小与施加电场的大小和频率有关[37,38]。电润湿法是用外加电场来改变流体与其接触面间的界面自由能,使液体浸润表面,电场关闭后,表面变疏水,之前浸润在表面的液体从储液池断裂,形成液滴[39]。光驱动法是用强汇聚的光束产生两相微液滴的一种方法[40,41]。Park等[42]利用光驱动法将激光脉冲作用于水相,激光脉冲产生的能量促使水分子分解产生急剧膨胀的气体,从而在水油两相界面处形成气穴,截断水相进入到油相中形成液滴,这种方法能以每秒10000个的速度产生1~150 pL大小的液滴。
3 液滴微流控在生物医学中的应用
3.1 在分析检测中的应用
由于液滴的诸多特点,液滴微流控在取代笨重的生化实验室进行分析检测方面已展现出其独特的优势。它可以精确地对反应中的微液滴进行操控,并能够减少反应试剂的用量[43]。同时在液滴中可以使用各种技术进行定性分析,液滴微流控体系已经在分析检测中得以应用。这种分析检测技术涉及到成像分析、激光光谱学、电化学、毛细管电泳、质谱、核磁共振谱、化学发光法检测等[44]。
将液滴微流控系统和荧光偏振免疫分析相结合,可以从生物样品中快速检测和定量分析蛋白质标记物的特性,液滴微流控荧光偏振免疫分析平台成为用于分子检测中的一种新型工具,以此可用来控制食品或环境样品中的品质。相比于荧光共振能量转移方法(FRET),荧光偏振方法只需要对相互作用的双方之一进行标记,而且不需要将生物大分子分析物从样品中纯化和分离即可对其进行检测[45]。Choi等[46]利用液滴快速而精确地在奶牛的生鲜奶液中检测和量化牛血管生成素,并将被分析液的体积减小到1 nL以下,这比传统的荧光偏振免疫分析所需体积量减少了5个数量级(如图2A所示)。
同时液滴微流控在单分子检测中,不仅应用于生物大分子的检测,还有DNA中基因信息的提取,利用蛋白质标记可以在很低的复合样品浓度下检测机体健康与否。Zeng等[47]研究了一系列微型乳液生成阵列装置(MEGA),引出许多列平行的液滴生成器集成在一起。这种MEGA芯片用一个集成的气动泵驱动液滴的生成,这96个通道可以保证每小时生成3.4×106 nL的液滴(如图2B所示)。这样的模型使得驱动泵可以精确、可编程化的控制液滴的生成,从而确保了在单细胞和单分子检测中液滴的高定量数字化计算[48]。此外,液滴微流控还被应用在葡萄糖、醌类、β半乳糖苷酶等分析检测中[49~52]。
图2 液滴微流控应用于分子检测
Fig.2 Applications of dropletbased microfluidics in molecular detection
(A) 运用气动微泵装置快速检测和定量蛋白质标记的液滴微流控荧光偏振免疫分析平台(dFPIA)原理图[46]。(B) 96通道的微型乳液生成阵列(MEGA)装置[47]。其中每个重复单元由4个T型收缩口组成。同时所有液滴产生装置由3个同轴环状气动阀门驱动。
(A) Schematic illustration of dropletbased fluorescence polarization immunoassay (dFPIA) using the integrated pneumatic micropumps for the rapid detection and quantitation of protein biomarkers [46]. (B) 96channel microfluidic emulsion generator array (MEGA) devices [47]. Each repeating unit is composed of 4 Tshaped nozzles. Meanwhile, all the droplet generators are actuated by three coaxial ringshaped pneumatic valves.
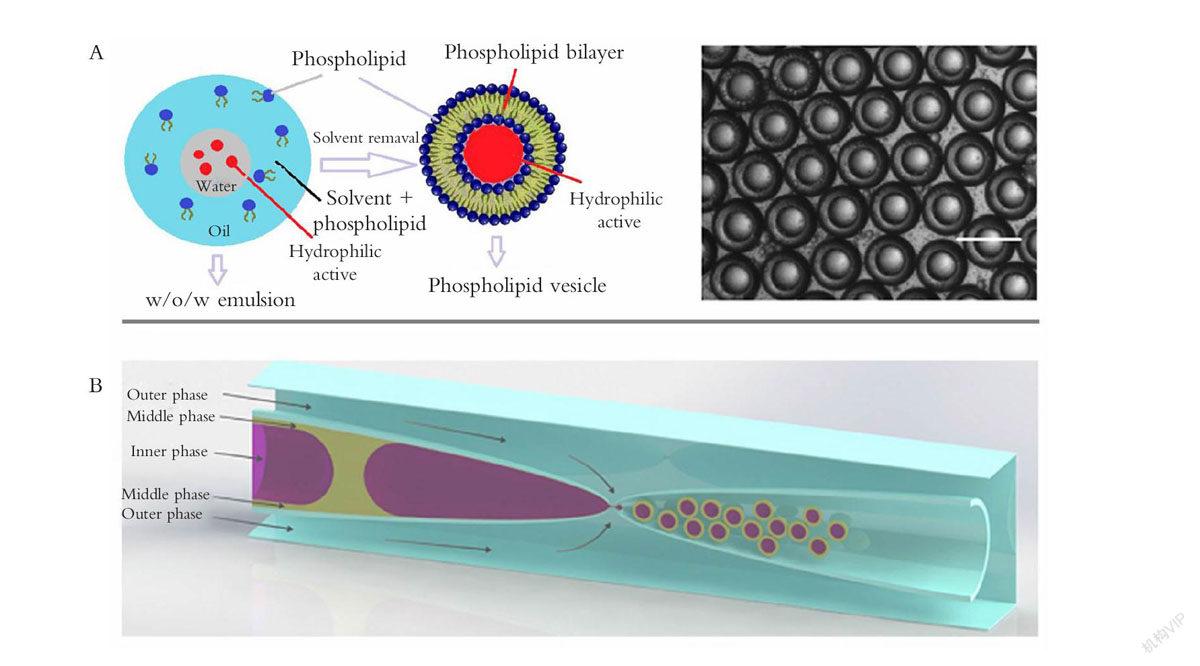
(A)W/O/W乳液液滴。原理示意图及48 h后被收集的W/O/W乳液液滴(比例尺150 μm)[55]。(B) 左侧为内部中间流动相,伸展的毛细管插入圆柱形管内,内部流动相在油相中形成水相大液滴,带有超薄壳的液滴移入右边的采集管内,形成带有外部流动相的双乳液[53]。
(A)W/O/W emulsion droplets. Schematic illustration and optical microscopic images of collected W/O/W emulsion droplets after 48 h (scale bar: 150 μm) [55]. (B) Inner and middle phases flow in cylindrical capillary on the left. Stretched capillary is inserted into this cylindrical capillary and the inner phase flows through it, forming large droplets of water phase into the oil phase. This forms droplets with ultrathin shells as the phases move to the collection capillary (on the right) and form a double emulsion with the outer phase flowing from the square capillary [53].
3.2 在药物递送和释放中的应用
在医药应用方面,药物载体系统的基本要求包括:(1)过程固定;(2)抑制药物降解;(3)改善药物的稳定性;(4)控制药物的递送行为[43,54]。液滴微流控为药物的递送和释放建立了一个强有力的平台,提供了新的研究方向。液滴中使用药物载体系统的典型例子就是蛋白质和缩氨酸治疗,它们在进入血液前在肠胃中的生物药效率很低[53]。
Kong等[55]将亲水性抗癌药物封装在单分散的生物相容性磷脂囊泡中,形成了核壳结构的W/O/W型双乳液模型,双乳液液滴大小可根据不同流速控制在50~200 μm之间。这种结构克服了饱和磷脂在溶解性方面的限制和不饱和磷脂转换温度过低的问题,与直接置于水溶液中的药物相比展现出持久的药物释放作用(如图3A所示)。Sarkar等[56]使用液滴微流控技术来评估乳腺癌细胞中的药物摄取、消逝与细胞毒性,并在单细胞和多细胞的相互作用中建立了适合药物筛选的液滴微流控平台。Pessi等[53]还将液滴微流控应用在蛋白质药物的治疗中(如图3B所示)。通过微流控技术制作出W/O/W型超薄壳双乳液液滴,在内部相中装1%的牛血清蛋白,外部用聚乙烯醇、聚已酸内酯和聚乙二醇包裹,所有微粒的粒径都在23~47 μm之间,而且这种通过液滴微流控方法做出的微胶囊是单分散且无渗透的,药稳定性可达4周之久,微胶囊能在168 h内稳定释放30%的牛血清蛋白。
4 总结与展望
本文综述了液滴微流控的主要特点以及制备方法,并对其近年来在生物医学中的应用进行了简要的概述。液滴微流控平台作为近年来快速发展的分析技术,由于其试剂用量少、分析速度快、单分散性良好等特点,已逐渐在生物医学等方面展现出独特的优势。由于制备条件简单,易实现等原因,目前大多数研究仍以被动法产生液滴为主[57]。与主动法相比,被动法制备液滴往往具有速度快,通量高和操作简单等优势。但是,同样存在难以精确操作和可控性较差等缺陷。主动法通过光、电、声或气等方法可以有效地产生微液滴并实现对液滴较为精确的下游操控[58],但是往往由于制备工艺复杂,外部设备要求高等原因不适宜于大多数研究。
从目前液滴微流控芯片的发展趋势来看,生物医学领域内液滴微流控平台的应用还处于初期阶段,随着不断复杂的多功能化、集成化和智能化手段的应用,液滴微流控将在未来的生物医学领域得到更加深入的研究。当然,液滴微流控目前仍存在诸多挑战[59,60],主要在于以下几个方面:(1)芯片材质与加工工艺。目前聚二甲基硅氧烷(PDMS)和软光刻技术被广泛应用于微流控芯片的制备,但是为了进一步实现商业化生产和临床应用,更低廉,稳定的芯片制作材料,以及更简单便捷的芯片加工工艺也需要进一步的研究和探索。(2)高效灵敏的检测技术。由于液滴微流控的特点就是体积微小,液滴产生速度快,数量多,如何实现对大量微液滴进行快速检测分析也是未来液滴微流控应用推广的一个难点。(3)模块化芯片单元的大规模集成。大规模集成是微流控芯片的一个显著优势,但是如何将模块化的液滴微流控单元与上下游功能单元大规模集成于一个多功能的微流控平台并实现自动化智能操作,仍然需要进一步的努力和研究。虽然这些困难客观存在,但是基于当前微流控技术快速发展的趋势,我们有理由相信,液滴微流控未来将会克服这些困难,并在更多领域取得更大的发展。
References
1 Pit A M, Duits M H G, Mugele F. Sensor. Actuat. BChem., 1990, 1(16): 244-248
2 Di Carlo D, Aghdam N, Lee L P. Anal. Chem., 2006, 78(14): 4925-4930
3 Weigl B, Domingo G, LaBarre P, Gerlach J. Lab Chip, 2008, 8(12): 1999-2014
4 Rios A, Zougagh M, Avila M. Anal. Chim. Acta, 2012, 740: 1-11
5 Yan Y J, Boey D, Ng L T, Gruber J, Bettiol A, Thakor N V, Chen C H. Biosens. Bioelectron., 2016, 77: 428-434
6 LI SongJing, ZENG Wen. Chin. Hydrau. Pneu., 2013, (6): 13-23
李松晶, 曾 文. 液压与气动, 2013, (6): 13-23
7 SONG WenBin, DONG ZhaoQing, REN JiCun. J. Anal. Sci., 2011, 27(1): 106-112
宋文斌, 董朝青, 任吉存. 分析科学学报, 2011, 27(1): 106-112
8 Somaweera H, Ibraguimov A, Pappas D. Anal. Chim. Acta, 2016, 907: 7-17
9 Leman M, Abouakil F, Griffiths A D, Tabeling P. Lab Chip, 2015, 15(3): 753-765
10 Kasule J S, Maddala J, Mobed P, Rengaswamy R. Comput. Chem. Eng., 2016, 85: 94-104
11 Chen A F, Huang H X. J. Phys. Chem. C., 2016, 120(3): 1556-1561
12 Du G S, Fang Q, Den Toonder J M J. Anal. Chim. Acta, 2016, 903: 36-50
13 Choi K, Im M, Choi J M, Choi Y K. Microfluid. Nanofluid., 2012, 12(6): 821-827
14 Huebner A M, Abell C, Huck W T S, Baroud C N, Hollfelder F. Anal. Chem., 2011, 83(4): 1462-1468
15 Elani Y, deMello A J, Niu X Z, Ces O. Lab Chip, 2012, 12(18): 3514-3520
16 Rosenfeld L, Lin T, Derda R, Tang S K Y. Microfluid. Nanofluid., 2014, 16(5): 921-939
17 Miller O J, El Harrak A, Mangeat T, Baret J C, Frenz L, El Debs B, Mayot E, Samuels M L, Rooney E K, Dieu P, Galvan M, Link D R, Griffiths A D. P. Natl. Acad. Sci. USA, 2012, 109(2): 378-383
18 Liu Y G, Banerjee A, Papautsky I. Microfluid. Nanofluid, 2014, 17(2): 295-303
19 Joensson H N, Svahn H A. Angew. Chem. Int. Ed., 2012, 51(49): 12176-12192
20 JIA PengFei, JIANG KeMing, LIU Cong, ZHOU WuPing, ZHANG Tao, ZHANG ZhiQiang, LI HaiWen. Chem. Res. Appl., 2015, 27(8): 1097-1103
贾朋飞, 蒋克明, 刘 聪, 周武平, 张 涛, 张志强, 黎海文. 化学研究与应用, 2015, 27(8): 1097-1103
21 Huebner A, Sharma S, SrisaArt M, Hollfelder F, Edel J B, Demello A J. Lab Chip, 2008, 8(8): 1244-1254
22 Rakszewska A, Tel J, Chokkalingam V, Huck W T S. Npg. Asia. Mater., 2014, 6: e133
23 Wang Y L, Zhao L, Tian C, Ma C, Wang J Y. Anal. MethodsUK, 2015, 7(23): 10040-10051
24 Song H, Tice J D, Ismagilov R F. Angew. Chem. Int. Ed., 2003, 42(7): 768-772
25 Kaler K V I S, Prakash R. SensorsBasel, 2014, 14(12): 23283-23306
26 ZHAO ShuFang, BAI Lin, FU YuHang, JIN Yong, CHENG Yi. Chem. Ind. Eng. Pro., 2015, 34(3): 593-616
赵述芳, 白 琳, 付宇航, 金涌, 程 易. 化工进展, 2015, 34(3): 593-616
27 Gu H, Duits M H G, Mugele F. Int. J. Mol. Sci., 2011, 12(4): 2572-2597
28 Beatus T, BarZiv R H, Tlusty T. Phys. REP., 2012, 516(3): 103-145
29 Thorsen T, Roberts R W, Arnold F H, Quake S R. Phys. Rev. Lett., 2001, 86(18): 4163-4166
30 Anna S L, Bontoux N, Stone H A. Appl. Phys. Lett., 2003, 82(3): 364-366
31 Dreyfus R, Tabeling P, Willaime H. Phys. Rev. Lett., 2003, 90(14): 14505
32 Cramer C, Fischer P, Windhab E J. Chem. Eng. Sci., 2004, 59(15): 3045-3058
33 Baroud C N, Gallaire F, Dangla R. Lab Chip, 2010, 10(16): 2032-2045
34 Pit A M, Duits M H G, Mugele F. MicromachinesBasel, 2015, 6(11): 1768-1793
35 Fan S K, Hsieh T H, Lin D Y. Lab Chip, 2009, 9(9): 1236-1242
36 Fan S K, Hsu Y W, Chen C H. Lab Chip, 2011, 1(15): 2500-2508
37 Brown C V, McHale G, Trabi C L. Langmuir, 2015, 31(3): 1011-1016
38 Nejad H, Hoorfar M. Microfluid Nanofluid , 2015, 18(3): 483-492
39 Banerjee A, Noh J H, Liu Y G, Rack P D, Papautsky I. MicromachinesBasel, 2015, 6(2): 172-185
40 MacDonald M P, Spalding G C, Dholakia K. Nature, 2003, 426(6965): 421-424
41 Chen K Y, Lee A T, Hung C C, Huang J S, Yang Y T. Nano. Lett., 2013, 13(9): 4118-4122
42 Park S Y, Wu T H, Chen Y, Teitell M A, Chiou P Y. Lab Chip, 2011, 11(6): 1010-1012
43 Chou W L, Lee P Y, Yang C L, Huang W Y, Lin Y S. MicromachinesBasel, 2015, 6(9): 1249-1271
44 Zhu Y, Fang Q. Anal. Chim. Acta, 2013, 787: 24-35
45 MA Chao, SHEN ShaoFei, ZHAO Lei, WANG JinYi. J. Instr. Anal., 2015, 34(3): 246-256
马 超, 申少斐, 赵 磊, 王进义. 分析测试学报, 2015, 34(3): 246-256
46 Choi J W, Kim G J, Lee S, Kim J, deMello A J, Chang S I. Biosens. Bioelectron., 2015, 67: 497-502
47 Zeng Y, Novak R, Shuga J, Smith M T, Mathies R A. Anal. Chem., 2010, 82(8): 3183-3190
48 Zeng Y, Wang T Y. Anal. Bioanal. Chem., 2013, 405(17): 5743-5758
49 Kim J, Khan M, Park S Y. ACS. Appl. Mater. Inter., 2013, 5(24): 13135-13139
50 Piao Y X, Han D J, Azad M R, Park M, Seo T S. Biosens. Bioelectron., 2015, 65: 220-225
51 Wu S Z, Zhou Z Y, Xu L R, Su B, Fang Q. Biosens. Bioelectron., 2014, 53: 148-153
52 Witters D, Knez K, Ceyssens F, Puers R, Lammertyn J. Lab Chip, 2013, 13(11): 2047-2054
53 Pessi J, Santos H A, Miroshnyk I, Yliruusi J, Weitz D A, Mirza S. Int. J. Pharm., 2014, 472(12): 82-87
54 GananCalvo A M, Montanero J M, MartinBanderas L, FloresMosquera M. Adv. Drug. Deliver. Rev., 2013, 65(1112): 1447-1469
55 Kong F, Zhang X, Hai M T. Langmuir, 2014, 30(13): 3905-3912
56 Sarkar S, Cohen N, Sabhachandani P, Konry T. Lab Chip, 2015, 15(23): 4441-4450
57 CHEN JiuSheng, JIANG JiaHuan. Chinese J. Anal. Chem., 2012, 40(8): 1293-1300
陈九生, 蒋稼欢. 分析化学, 2012, 40(8): 1293-1300
58 SHEN Feng, LI Yi, LIU ZhaoMiao, CAO RenTuo, WANG GuiRen. Chinese J. Anal. Chem., 2015, 43(12): 1942-1954
申 峰, 李 易, 刘赵淼, 曹刃拓, 王贵人. 分析化学, 2015, 43(12): 1942-1954
59 LIU WenMing, LI Li, REN Li, WANG JianChun, TU Qin, WANG XueQin, WANG JinYi. Chin. J. Anal. Chem., 2012, 40(1): 24-31
刘文明, 李 立, 任 丽, 王建春, 涂 琴, 王雪琴, 王进义. 分析化学, 2012, 40(1): 24-31
60 CAI YaMei, HONG ZhanYing, ZHU ZhenYu, CHAI YiFeng. Chin. J. Pharm. Anal., 2013, 33(11): 2013-2018
蔡亚梅, 洪战英, 朱臻宇, 柴逸峰. 药物分析杂志, 2013, 33(11): 2013-2018
Application Progress of Dropletbased
Microfluidics in Biomedicine
YAN JiaHang1, ZHAO Lei2, SHEN ShaoFei1, MA Chao2, WANG JinYi*1,2
1(College of Science, Northwest A & F University, Yangling 712100, China)
2(College of Veterinary Medicine, Northwest A & F University, Yangling 712100, China)
Abstract Dropletbased microfluidics is one of the important branches of microfluidics. On account of its various unique advantages, it has been extensively applied and studied. In this review, we introduced the characteristics and the fundamentals of the dropletbased microfluidics. Meanwhile, its recent applications in biomedicine were reviewed. At last, the development of the dropletbased microfluidics was prospected.
Keywords Microfluidics; Droplet; Drugdelivery; Review
(Received 18 February 2016; accepted 8 March 2016)
This work was supported by the National Natural Science Foundation of China (Nos. 21375106, 21175107)
