不同厂家小柴胡汤丸的溶出度研究Δ
2016-11-19唐富山张晓慧王玉和遵义医学院药学院临床药学教研室贵州遵义563003遵义医学院附属医院药剂科贵州遵义563003
唐富山,张晓慧,兰 雪,孟 翠,王玉和(.遵义医学院药学院临床药学教研室,贵州遵义 563003;2.遵义医学院附属医院药剂科,贵州遵义 563003)
不同厂家小柴胡汤丸的溶出度研究Δ
唐富山1*,张晓慧1,兰 雪1,孟 翠1,王玉和2#(1.遵义医学院药学院临床药学教研室,贵州遵义 563003;2.遵义医学院附属医院药剂科,贵州遵义 563003)
目的:建立小柴胡汤丸溶出度的测定方法,并比较不同厂家制剂的差异。方法:以0.1 mol/L盐酸为溶出介质,采用转篮法测定制剂的溶出度;采用高效液相色谱法测定制剂中黄芩苷的含量:色谱柱为TSKgel ODS C18,流动相为甲醇-水-磷酸(65∶35∶0.7,V/V/V),流速为1 ml/min,检测波长为280 nm,柱温为30℃,进样量为5µl。结果:黄芩苷检测质量浓度线性范围为0.488~124.8 mg/L(r=0.999 9);精密度、稳定性、重复性试验的RSD<2.0%;加样回收率试验为100.14%~104.78%(RSD=1.58%,n=9)。小柴胡汤丸中黄芩苷50%溶出时间(t50)平均值为85.81 min。结论:该方法操作简便,精密度、稳定性、重复性较好,可用于小柴胡汤丸溶出度的测定。不同厂家小柴胡汤丸溶出差异较大,制剂制备和临床用药中均需重视固体制剂的溶出状况。
小柴胡汤丸;黄芩苷;溶出度
小柴胡汤始载于《伤寒杂病论》中,常为治疗少阳病的主方[1-2]。现代药理研究表明,小柴胡汤对细胞免疫有一定的调节机制,具有解热、保肝、抗病毒等作用[3]。在现有的文献报道中,对小柴胡汤[4-5]和颗粒[6-7]中黄芩苷等成分的分析研究较多,但只有少数学者对小柴胡汤丸中黄芩苷的含量进行研究[8],而小柴胡汤丸的体外溶出度研究和不同产家制剂间溶出度的比较尚未见文献报道。
溶出度系指药物从片剂、胶囊或颗粒等固体制剂在规定条件下溶出的速率和程度[9]。目前,溶出度测定已被作为评价制剂质量、生产工艺及生物利用度的参考依据。对市售小柴胡汤固体剂型的溶出度进行测定不仅可以反映其在体内的吸收和药效情况,还可以为不同厂家相同剂型之间或不同剂型之间的体内生物利用度评价提供参考。
2015年版《中国药典》(一部)规定,小柴胡片、小柴胡泡腾片、小柴胡胶囊和小柴胡颗粒均以黄芩苷含量为质控指标[10],而对汤丸尚无含量测定的质量控制项目。本试验拟对市售不同厂家间小柴胡汤丸的体外溶出度进行研究,用Excel程序分析比较溶出参数,即50%溶出时间(t50)、63.2%溶出时间(td)、斜率或形状参数(m)[11-13],以期为小柴胡汤丸的质量控制和内在质量评价提供一定借鉴,并可为小柴胡汤固体制剂临床合理使用及基础研究提供一定参考。
1 材料
1.1 仪器
1260型高效液相色谱(HPLC)仪,包括G1329B进样器、G1311C四元泵、G1315C二极管阵列检测器(美国Agilent公司);ERS-8GD型智能溶出仪(天津市天大天发科技有限公司);FA2004N型电子分析天平(上海菁海仪器有限公司)。
1.2 药品与试剂
小柴胡汤丸(兰州太宝制药有限公司,批号:61150304;兰州佛慈制药股份有限公司,批号:12M18;甘肃天水岐黄药业有限责任公司,批号:140506;甘肃省众友药业制药有限责任公司,批号:142701;河南省宛西制药有限公司,批号:150101,规格均为每8丸相当于原药材3 g);黄芩苷对照品(贵州迪大生物科技有限责任公司,批号:GZDD-0037,纯度:98.17%);甲醇、盐酸为色谱纯,其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 色谱条件
色谱柱:TSKgel ODS C18(250 mm×4.6 mm,5µm);流动相:甲醇-水-磷酸(65∶35∶0.7,V/V/V),流速:1 ml/min;检测波长:280 nm;柱温:30℃;进样量:5µl。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取黄芩苷对照品12 mg,置于10 ml量瓶中,加甲醇溶解并定容,摇匀,用0.22µm微孔滤膜滤过,取中段滤液,即得。
2.2.2 供试品溶液 取本品2粒溶解于500 ml 0.1 mol/L盐酸中,用0.22µm微孔滤膜滤过,取中段滤液,即得。
2.3 专属性试验
取“2.2.1”项下对照品溶液适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。在黄芩苷对照品色谱峰相应的位置上,供试品色谱图中显示相同保留时间的色谱峰,色谱峰形状几乎一致;理论板数按黄芩苷峰计约为4 000。结果表明,供试品溶液中其他成分不干扰黄芩苷测定,方法专属性良好。

图1 高效液相色谱图A.对照品;B.供试品;1.黄芩苷Fig 1 HPLC chromatograms A.reference substance;B.test sample;1.baicalin
2.4 线性关系考察
分别量取“2.2.1”项下对照品溶液适量,分别置于10 ml量瓶中,加流动相定容,制成质量浓度分别为0.488、0.975、1.95、31.2、62.4、124.8 mg/L的系列对照品溶液。精密量取上述系列对照品溶液各10 μl,按“2.1”项下色谱条件进样测定,记录峰面积。以黄芩苷质量浓度(x,mg/L)为横坐标、峰面积(y)为纵坐标进行线性回归,得黄芩苷回归方程为y=13 593x-23.922(r=0.999 9)。结果表明,黄芩苷检测质量浓度线性范围为0.488~124.8 mg/L。
2.5 精密度试验
②说到“互补”,我们可以借鉴与功能语言学同属功能主义阵营的认知语言学的研究(比如丛迎旭,王红阳2013;杨波 2013;刘婷婷,张奕2014等),不妨将语法隐喻视为在共同的语义基础(即相同的待识解和表征的世界图景或经验)上从一致式向隐喻式的转化过程,该过程的实质是认知识解方式的转变和认知域(这里的认知域应是及物系统的不同过程类、级阶和性状)之间的跨越或者映射。
取“2.2.1”项下对照品溶液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,黄芩苷峰面积的RSD= 0.65%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取“2.2.2”项下供试品溶液(批号:140506)适量,分别于室温下放置0、1、3、5、7、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,黄芩苷峰面积的RSD=1.98%(n=7),表明供试品溶液在24 h内基本稳定。
2.7 重复性试验
精密称取同一批样品(批号:140506)适量,按“2.2.2”项下方法制备供试品溶液,共6份,再按“2.1”项下色谱条件进样测定,记录峰面积。结果,黄芩苷峰面积的RSD=0.80%(n=6),表明本方法重复性良好。
2.8 加样回收率试验
取已知含量样品(批号:140506)适量,共6份,每份1.0 g,分别加入低、中、高质量的黄芩苷对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。

表1 加样回收率试验结果(n=9)Tab 1 Results of recovery test(n=9)
2.9.1 溶出介质的制备 精密量取8.6 ml盐酸,用已烧至沸腾并冷却后的蒸馏水定容至1 000 ml,摇匀,即得浓度为0.1 mol/L的盐酸溶液。
2.9.2 小柴胡汤丸的溶出度测定 取本品12粒,每2丸精密称定质量后分别置于智能溶出仪的6个转篮内,按2015年版《中国药典》(四部)溶出度测定法(转篮法)[9]项下操作。以500 ml 0.1 mol/L盐酸为溶出介质,温度为(37.0±0.5)℃,转速为100 r/min。分别于20、40、60、90、120、150 min时用注射器抽出3 ml溶出液,并补充等量的溶出介质,若150 min内本品未溶解完全,延长取样时间,直至溶解完全。
2.9.3 样品溶出度计算 将不同时刻抽取的溶出液用0.22 µm的微孔滤膜滤过后,进样检测。以不同时间黄芩苷溶出量除以溶出样品中黄芩苷含量得该时刻小柴胡汤丸中黄芩苷的累积溶出度。将溶出液的取样时间(t)和溶出度F(t)(用小数表示)分别置于Excel表格中,分别用公式求出ln(t),ln[1/1-F(t)],lnln[1/1-F(t)],以lnln[1/1-F(t)]对ln(t)进行correl、slope、intercept函数计算,分别求出相关系数、m、截距,得出线性方程;反对数计算出不同厂家制剂相应t50、td。结果表明,样品t50平均为85.81 min,不同产家生产的小柴胡汤丸中黄芩苷的溶出时间差异明显,详见表2。
表2 样品中黄芩苷溶出度检测结果(±s,n=6)Tab 2 Results of dissolution detection of baicalin in samples(±s,n=6)
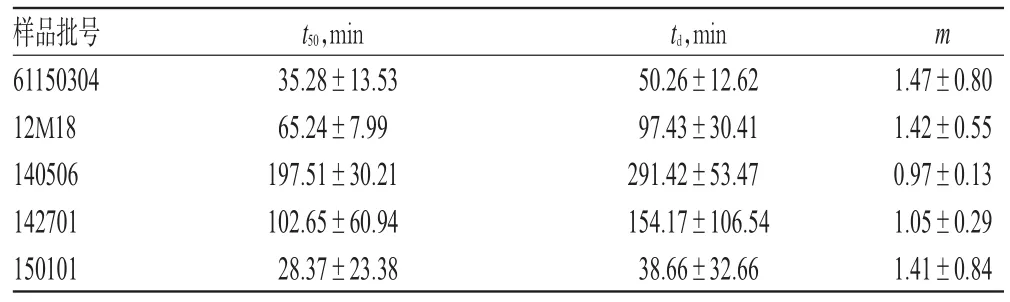
表2 样品中黄芩苷溶出度检测结果(±s,n=6)Tab 2 Results of dissolution detection of baicalin in samples(±s,n=6)
样品批号61150304 12M18 140506 142701 150101 t50,min 35.28±13.53 65.24±7.99 197.51±30.21 102.65±60.94 28.37±23.38 td,min 50.26±12.62 97.43±30.41 291.42±53.47 154.17±106.54 38.66±32.66 m 1.47±0.80 1.42±0.55 0.97±0.13 1.05±0.29 1.41±0.84
3 讨论
溶出过程可以反映药物的体内吸收状况,由于剂型不同,药物在体内的吸收速度与程度也会存在差异。一般情况下,药物的溶出越快,其在人体的吸收速度也相对较快,体内的起效时间也相对较快;相同的溶出时间,药物的溶出量越大,其作用强度也相对较大。因此,溶出度研究可为相同药物的不同产品之间的临床生物等效性评价提供参考[14]。
丸剂是粉体浓缩成丸后的剂型,口服后在胃肠道内要经历崩解-溶解-吸收的过程,其中崩解过程与制剂过程加入的辅料类型和生产工艺有很大的关系,因而丸剂中药效成分溶出相对其他固体剂型较慢。不同厂家生产的小柴胡汤丸中黄芩苷的溶出情况差异较大,这可能与处方、制备工艺差异有关。在药物制备成型过程中,应充分考虑赋形剂与主药的关系,优化处方设计及制备工艺,保证药物效应成分在人体中得到最大限度的吸收和利用[15-17]。源自不同厂家的相同药品,药物吸收并作用于机体的时间可能各异,因而其作用可能出现差异。临床用药中,若给患者更换不同产家的药品时,应注意药物效应和不良反应的变化,防止疗效的强烈波动或不良反应发生率的增加。
本试验参照2015年版《中国药典》(一部)中小柴胡汤相关制剂含量测定方法[10],以及黄芩苷含量测定的相关文献[4,6,8],对测定黄芩苷的色谱条件进行了改进,所建立的分析方法具有出峰时间较短的特点,测定简便易行,不仅可用于小柴胡汤丸及类似制剂的溶出度研究,对其含量测定也是有益的参考。
[1]姚洁琼,李宜放.《伤寒杂病论》大小成对命名方剂探析[J].中医药导报,2016,22(7):11.
[2]徐睿瑶,李宏远.小柴胡汤在日本的应用与发展概况[J].世界中西医结合杂志,2016,11(7):1 021.
[3]王金叶,巴艳东.小柴胡汤临床应用进展[J].卫生职业教育,2015,33(10):155.
[4]兰雪,唐富山,陈曾妮,等.HPLC法测定小柴胡汤剂中黄芩苷的含量[J].遵义医学院学报,2015,38(4):78.
[5]王德强,常凤鸣,王宇辉,等.小柴胡颗粒的多波长HPLC图谱及药材-制剂谱峰匹配分析[J].中药材,2016,39(4):810.
[6]栗建明,莫结丽,隆颖.小柴胡颗粒中黄芩苷含量测定的不确定度评定[J].中国民族民间医药,2015(11):11.
[7]徐辰琛.HPLC法测定小柴胡汤中各有效成分含量[J].亚太传统医药,2015,11(24):39.
[8]石莹.HPLC测定小柴胡汤丸中黄芩苷的含量[J].中成药,2007,29(7):23.
[9]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:122.
[10]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:574.
[11]于香安,蔡怀友.用电子计算器求算片剂溶出度溶出参数的运算程序[J].中国药房,1995,6(4):21.
[12]苗爱东,王彦宗,阚秀燕,等.Excel 2010在药物溶出曲线相似性比较中的应用[J].中国医药科学,2011,1(10):11.
[13]刘红,张关敏,张艳华.不同厂家枸橼酸他莫昔芬片的体外溶出度考察[J].中国医院药学杂志,2012,32(6):436.
[14]刘维,杨丽,Benet LZ,等.基于药物体内处置的生物药剂学分类系统(BDDCS)简介[J].中国新药与临床杂志,2013,32(4):265.
[15]刘卫红.小柴胡汤不同制法对黄芩苷含量的影响[J].中国药房,2008,19(12):921.
[16]蒋苏贞,黄小兵,陈春丽,等.HPLC测定生姜对小柴胡汤中柴胡皂苷a和黄芩苷溶出的影响[J].中华中医药学刊,2014,32(7):1 652.
[17]刘俊红,张淑坤,李棣华,等.HPLC法同时测定加减小柴胡方中8种成分的含量[J].中华中医药杂志,2016,31(3):979.
Study on the Dissolution of Xiaocaihu Pill from Different Manufacturers
TANG Fushan1,ZHANG Xiaohui1,LAN Xue1,MENG Cui1,WANG Yuhe(21.Dept.of Clinical Pharmacy,School of Pharmacy,Zunyi Medical University,Guizhou Zunyi 563003,China;2.Dept.of Pharmacy,the Affiliated Hospital of Zunyi Medical University,Guizhou Zunyi 563003,China)
OBJECTIVE:To establish a method for the determination of dissolution of Xiaocaihu pill,and compare the difference of preparation from different manufacturers.METHODS:Using 0.1 mol/L HCl as dissolution medium,rotating basket method was used to determine the dissolution of preparations.HPLC was adopted to determine the content of baicalin:column was TSKgel ODS C18with mobile phase of methanol-water-phosphoric acid(65∶35∶0.7,V/V/V)at a flow rate of 1 ml/min,detection wavelength was 280 nm,column temperature was 30℃,and injection volume was 5 μl.RESULTS:The linear range of baicalin was 0.488-124.8 mg/L(r=0.999 9);RSDs of precision,stability and reproducibility tests were lower than 2.0%;recovery was 100.14%-104.78%(RSD=1.58%,n=9).The average t50(50%dissolution time)of baicalin was 85.81 min.CONCLUSIONS:The method is simple with good precision,stability and reproducibility,and can be used for the dissolution determination of Xiaocaihu pill.Xiaocaihu pill from different manufacturers shows great differences,both preparation formulation and clinical use should attach importance to the dissolution of solid preparations.
Xiaochaihu pill;Baicalin;Dissolution
R945
A
1001-0408(2016)30-4272-03
2016-07-01
2016-08-11)
(编辑:张 静)
贵州省科学技术基金项目(No.黔科合J字〔2013〕2323号);贵州省科技合作专项资金项目(No.省市科合〔2015〕53号);遵义医学院临床药学新兴扶持学科
*副教授,硕士生导师,博士。研究方向:临床药学与药剂学。电话:0851-28642337。E-mail:fushantang@qq.com
#通信作者:主任药师,教授,硕士生导师。研究方向:医院药学、临床药学和药物经济学。E-mail:wangyuhe11@163.com
DOI 10.6039/j.issn.1001-0408.2016.30.31
