甘蓝型油菜BnMPK3的序列分析及其对环境信号的响应
2016-11-16方和娣李冠英谭小力张志燕
陈 婷,方和娣,李 霄,李冠英,谭小力,张志燕,王 政
(江苏大学 生命科学研究院,江苏 镇江 212013)
甘蓝型油菜BnMPK3的序列分析及其对环境信号的响应
陈 婷,方和娣,李 霄,李冠英,谭小力,张志燕,王 政
(江苏大学 生命科学研究院,江苏 镇江 212013)
为了分析油菜MAP激酶3对各种环境胁迫信号的表达响应,以甘蓝型油菜中双9号为试材,采用同源克隆法克隆了甘蓝型油菜MAP激酶3基因(BnMPK3)的cDNA序列。序列分析表明,BnMPK3编码一条370个氨基酸残基的蛋白序列,这个序列含有1个高度保守的TEY磷酸化位点和一个CD锚定区域,与AtMPK3的序列相似性达到94%。烟草瞬时表达分析显示,BnMPK3是1个细胞核定位蛋白;荧光定量PCR分析显示,BnMPK3在茎以及花和叶组织器官中特异性表达,并且对NaCl溶液、4 ℃低温、PEG溶液和K2Cr2O7溶液以及甲基茉莉酸(MeJA)和乙烯前体(ACC)等的处理显著上调表达。结果表明,BnMPK3是高盐、低温、干旱、重金属以及JA和ET等各种环境胁迫因子的响应基因,建议BnMPK3可能在调控油菜对各种环境胁迫防御的过程中位于JA和ET相关的信号网络中,数据将为进一步研究BnMPK3在油菜抗逆中的功能及其机制提供理论线索。
甘蓝型油菜;BnMPK3;表达响应;环境胁迫
在外界环境的胁迫压力下,植物进化发展出了一系列信号应答系统来感知环境信号并做出反应,其中,丝裂原激活蛋白激酶(Mitogen-activited protein kinases,MAPKs)在植物对各种环境信号进行应答的过程中起着重要的作用[1]。MAPKs是一类丝氨酸/苏氨酸类蛋白激酶,在各种真核生物中广泛存在,与上游的MAPKK和MAPKKK等激酶组成MAPK级联途径(MAPK cascades),参与激素反应、胁迫应答、细胞分化和发育等生物学过程[2-3],在应对冷、干旱、盐、环境污染以及病原体侵害等多种非生物和生物胁迫方面具有重要作用[4]。
全基因组测序发现,模式生物拟南芥基因组含有20个MAPKs。根据保守的氨基酸结构域TxY(MAPKKs磷酸化MAPKs的位点),这20个MAPKs可被分为A~D 4组,其中,A、B和C 3组为TEY亚型,D组为TDY亚型[5-6]。研究显示,包含有拟南芥AtMPK3和AtMPK6及其直系同源物的A组MAPKs,主要参与一些环境和激素反应。如烟草的SIPK作为AtMPK6的同源物被证明是一种水杨酸诱导的蛋白激酶,在环境胁迫的压力反应中可以被激活[7];苜蓿的SIMK也参与对环境胁迫的反应[8];MPK3及其同源物同样也可被环境压力诱导表达。如,拟南芥AtMPK3蛋白可被氧化胁迫激活[9],而其烟草同源物WIPK参与伤信号的转导[7],在苜蓿中,其同源物SAMK参与各种生物和非生物胁迫反应[10]。B组的MAPKs以拟南芥的MPK4和MPK11为代表,主要参与对病原菌的防御以及一些非生物逆境的响应[11-13];目前有关C、D组的研究还比较少。
油菜(BrassicanapusL.)作为我国最重要的油料作物在种植过程中经常受到各种外界环境胁迫的影响,从而严重地影响油菜的生产。本试验以我国长江中下游油菜主产区广泛种植的具有优良抗逆特点的甘蓝型油菜品种中双9号为试材,采用分子克隆的方法克隆获得了1个油菜MAPK-BnMPK3基因序列,然后探究这个基因的蛋白亚细胞定位及其组织特异性表达,最后调查这个基因在各种环境胁迫和激素处理条件下的表达响应情况。
1 材料和方法
1.1 材料与试剂
甘蓝型油菜品种中双9号、本氏烟草(Nicotianatabacumcv.Xanthinc)、农杆菌(Agrobacteriumtumefaciens) 菌株LBA4404、大肠杆菌(Escherichiacoli)菌株DH5α均来自江苏大学生命科学研究院503实验室。
水杨酸(Salicylic acid,SA)购于华东化玻有限公司(CAS No:616-76-2);甲基茉莉酸(Methyl jasmonate,MeJA) 购于Sigma-Aldrich 公司(cat No.39,270-7);脱落酸(Abscisic acid,ABA)购于Sigma-Aldrich公司(Cat.No.A4906);乙烯前体ACC(1-Aminocyclopropane carboxylic acid,ACC)购于Adamas Reagent公司(CAS No:22059-21-8);2×SYBR® Premix Ex TaqTMⅡ试剂盒购于TaKaRa宝生物工程(大连)有限公司。
1.2 植株培养
油菜和烟草培养在温室条件下,光周期为光照条件(25 ℃)16 h,黑暗条件(20 ℃)8 h,相对湿度60%~90%。
1.3 总RNA 的提取及cDNA的制备选取
取少量植物叶片(不超过1 g),在液氮中研磨充分后加入到装有1 mL TRIzol试剂的无菌EP管中,叶片总RNA提取按照TRIzol试剂盒说明书上的步骤进行操作。提取得到的总RNA溶于20 μL DEPC处理过的无菌水中,从中取出0.2 μL溶于5 μL DEPC水中进行1%的琼脂糖凝胶电泳检测RNA的完整性,RNA浓度测定使用OneDrop OD-1000+分光光度计。RNA的逆转录先用DNase Ⅰ 去除基因组DNA,然后按照RevertAid First Strand cDNA Synthesis Kit试剂盒进行反转录合成cDNA,最后得到总体积21 μL的cDNA溶液,分装后置于-70 ℃冰箱中保存备用。
1.4 序列克隆
根据NCBI上公布的甘蓝(BrassicaoleraceaL.)MPK3(BoMPK3,Gene ID:106334002)的序列设计引物进行克隆,PCR引物序列为:F:5′-GGTACCTCTT CTCATTTCAGTCCCTCA-3′ 和R:5′-GGATCCGGATA TTTAGCCATTCATTCG-3′。扩增条件为:94 ℃ 10 min;然后94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min 30 s,最后72 ℃延伸10 min,扩增40个循环。扩增得到的目的片段使用GenClean 柱式琼脂糖凝胶DNA回收试剂盒回收后连接到pMD19-T Vector上,转化大肠杆菌。PCR鉴定平板上的单菌落,将鉴定得到的阳性菌株提取质粒后送往上海生工进行测序,测序成功后命名为pMD19T-BnMPK3。
1.5 序列分析和比对
ProtParam工具(http://web.expasy.org/protparam/) 用于分析上述扩增得到的序列的蛋白质等电点(pI)和分子质量;使用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)[14]预测蛋白质的亚细胞定位情况;GeneDoc软件用于多序列比对分析。
1.6 农杆菌介导的烟草叶片瞬时转化
1.6.1 用于亚细胞定位载体的构建 以上述构建的pMD19T-BnMPK3载体提取的质粒作为模板,设计PCR引物F:5′-GGTACCTCTTCTCATTTCAGTCCC TCA-3′ 和R:5′-GGATCCGGATATTTAGCCATTCAT TCG-3′,扩增完成后收集去除终止子的目的条带。按Gate-way试剂盒操作说明,取一定量的目的片段与pENTRY载体反应,得到入门克隆,转化大肠杆菌后用含有50 mg/L卡那霉素的LB固体培养基筛选,选取平板上长出的单菌落接种于LB液体培养基中扩大培养,菌液PCR鉴定目的片段是否与pENTRY载体连接成功。取测序成功的菌液提取质粒,与植物表达载体pK7FWG2.0-eGFP的质粒进行LR反应,该过程依据Gateway LR反应试剂盒程序操作,LR反应完成后转化大肠杆菌,PCR鉴定单菌落,将得到的阳性克隆命名为pK7FWG2.0-BnMPK3-eGFP。将该阳性克隆扩大培养后提取的质粒取适量导入农杆菌中。菌种置于-70 ℃冰箱保存备用。
1.6.2 烟草叶片的瞬时转化 分别培养含有P19 (一种抑制基因沉默的蛋白质)、PCX-IND-DsRed (携带红色荧光蛋白的核定位Marker基因构成的载体) 和pK7FWG2.0-BnMPK3-eGFP的农杆菌,培养至OD600值为0.6时收集菌体,用MAA溶液洗2次,最后调节其OD600值为1.2,28 ℃诱导2~4 h。使用去掉针头的无菌注射器吸取菌液,紧贴烟草叶片下表皮将菌液缓慢注入叶片,直到整片叶片都充满菌液为止。将烟草置于不透光的密封箱内,保湿培养一昼夜,然后置于光下培养5 d后观察。以空载体pK7FWG2.0-eGFP、PCX-IND-DsRed和P19的混合菌液为对照。该试验重复3次。
1.6.3 荧光共聚焦显微镜的观察 叶片注射5 d后,用荧光共聚焦显微镜(Leica TCS SP5)观察并检测荧光信号。绿色荧光GFP的激发光波长为488 nm,红色荧光DsRED的激发光波长为543 nm,2种荧光的发射波长分别为510~540 nm,580~584 nm。
1.7 模拟环境胁迫和激素的化学处理
选用油菜四叶一心期的油菜幼苗,将幼苗从土壤中取出后用水洗干净,再将其转移至1/2 MS培养基中进行培养,并在黑暗条件下48 h后进行不同环境胁迫模拟处理。
干旱胁迫处理:用聚乙二醇(Polyethylene glycol,PEG)溶液模拟干旱,将预处理的油菜置于配置好的浓度15%的PEG4000溶液,黑暗下20 ℃培养;盐胁迫处理:将预处理的油菜置于配置的400 mmol/L的NaCl溶液中黑暗培养;重金属(铬)胁迫处理:将预处理的油菜置于配置好的500 μmol/L的K2Cr2O7溶液中20 ℃黑暗培养;低温胁迫处理:取预处理的油菜置于另一100 mL 1/2 MS培养基,将其置于4 ℃冰箱中黑暗条件下进行培养。激素的化学处理:取预处理后的大小基本相同的叶片,等量放入4个不同的塑料密封箱中,整齐铺开后分别用1 mmol/L SA (水杨酸)、0.1 mmol/L MeJA(甲基茉莉酸)、0.05 mmol/L ABA(脱落酸)和0.1 mmol/L ACC(乙烯前体)溶液喷洒叶片,对照喷洒灭菌双蒸水,置于不透光的密封箱内保湿处理,处理0,3,6,9,12 h后分别将叶片取出装袋,标记好后迅速置于液氮中,随后立即转移至-70 ℃冰箱冻存。上述每种处理均需进行3次生物学重复。
1.8 定量RT-PCR
采用2×SYBR® Premix Ex TaqTMⅡ(TaKaRa)试剂盒,内参基因选用B.napusUBC21(BnUBC21,油菜数据库登录号:Bra009857),设计的引物为:F:5′-CCTCTGCAGCCTCCTCAAGT-3′;R:5′-CATATCTC CCCTGTCTTGAAATGC-3′;BnMPK3基因荧光定量PCR的引物序列为:F:5′-ACCAGGGCTTGTCTGAG GA-3′和R:5′-AATCGCAGTTGGCGTTCA-3′。荧光定量反应体系根据2×SYBR® Premix Ex TaqTMⅡ(TaKaRa)试剂盒的说明书配置。扩增条件中设置退火温度为60 ℃,反应40个循环;在每个循环的72 ℃复性末端收集荧光信号,通过每一个循环荧光信号的变化得到扩增产物的熔解曲线。每组试验均要进行3个生物学重复,同时每个生物学重复至少需要进行3次技术重复。数据处理:根据数据输出后得到的BnUBC21和BnMPK3的Ct值,用2-ΔΔCt计算法将Ct值转化为基因的相对表达量,将0 h(未处理时)或根(Roots)的表达量转换为1,进而计算其相对于对照的表达量变化[15]。
2 结果与分析
2.1 甘蓝型油菜BnMPK3的克隆及其序列分析
同源克隆根据甘蓝MPK3(BrassicaoleraceaMPK3,BoMPK3)的核苷酸序列CDS区的外侧设计上下游引物,以油菜品种中双9号的cDNA为模板进行PCR扩增,获得单一的1 299 bp的扩增片段。该序列中ORF框从起始密码子ATG到终止密码子TAG,长1 113 bp,编码的蛋白质含有370个氨基酸残基(图1);使用MeGa 5软件进行多种氨基酸序列的比对发现,这个目的条带与双子叶植物甘蓝、拟南芥、烟草、苜蓿和单子叶植物玉米、水稻、小麦等7个物种的MAPK在氨基酸水平上有很高的同源性,与AtMPK3的一致性达到94%(图2)。与其他植物的MPK3类似,BnMPK3作为一类MAPKs含有1个保守的氨基酸基序TEY,是MAPKKs对其磷酸化的位点,并且在BnMPK3的碳末端区域含有1个MAPKKs锚定位点的保守结构域。因此,这个基因是MPK3在油菜中的同源基因即BrassicanapusMPK3(BnMPK3)。
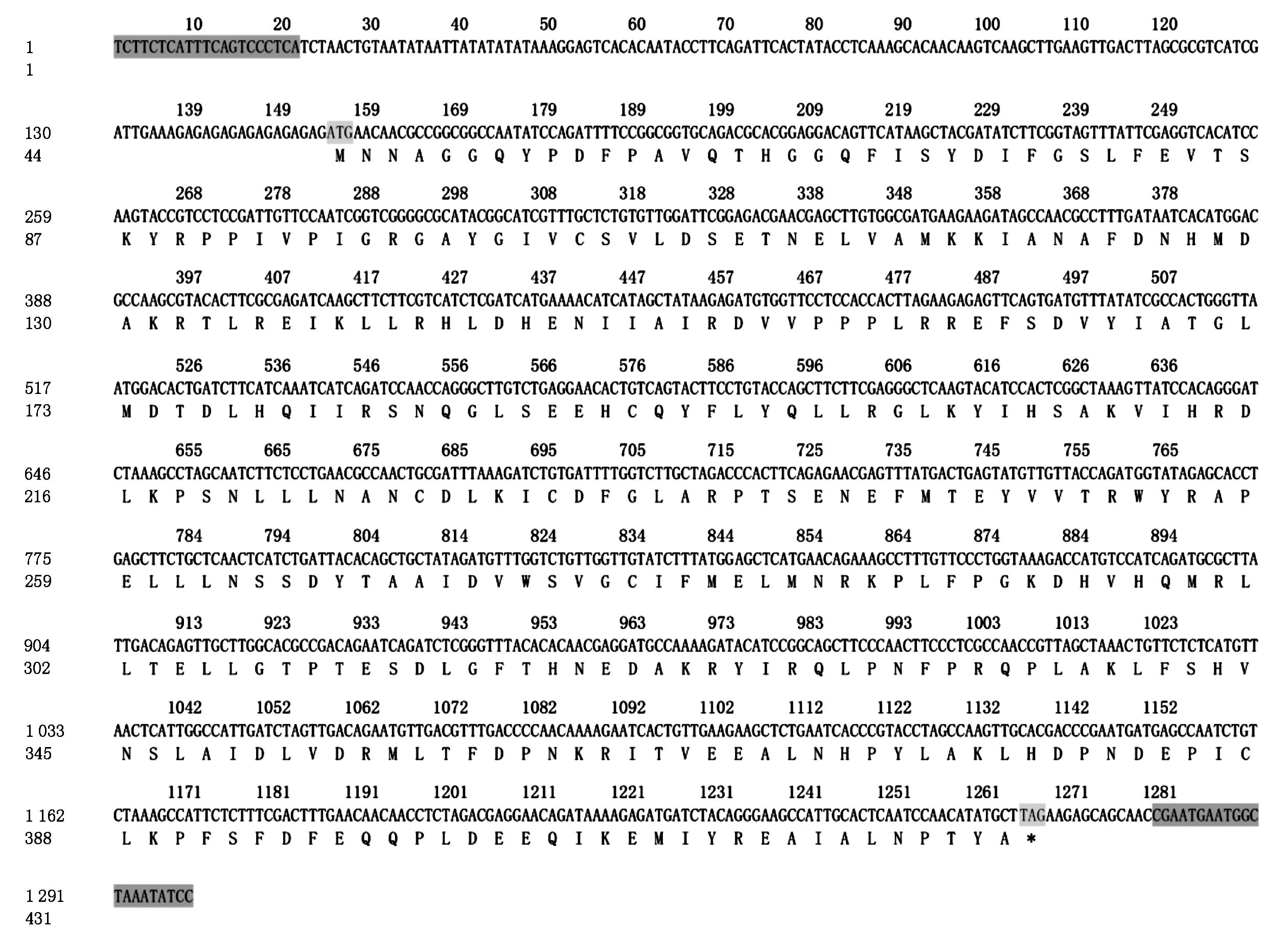
黑色阴影标记为扩增序列所用的上下游引物;灰色表示起始密码子和终止密码子。
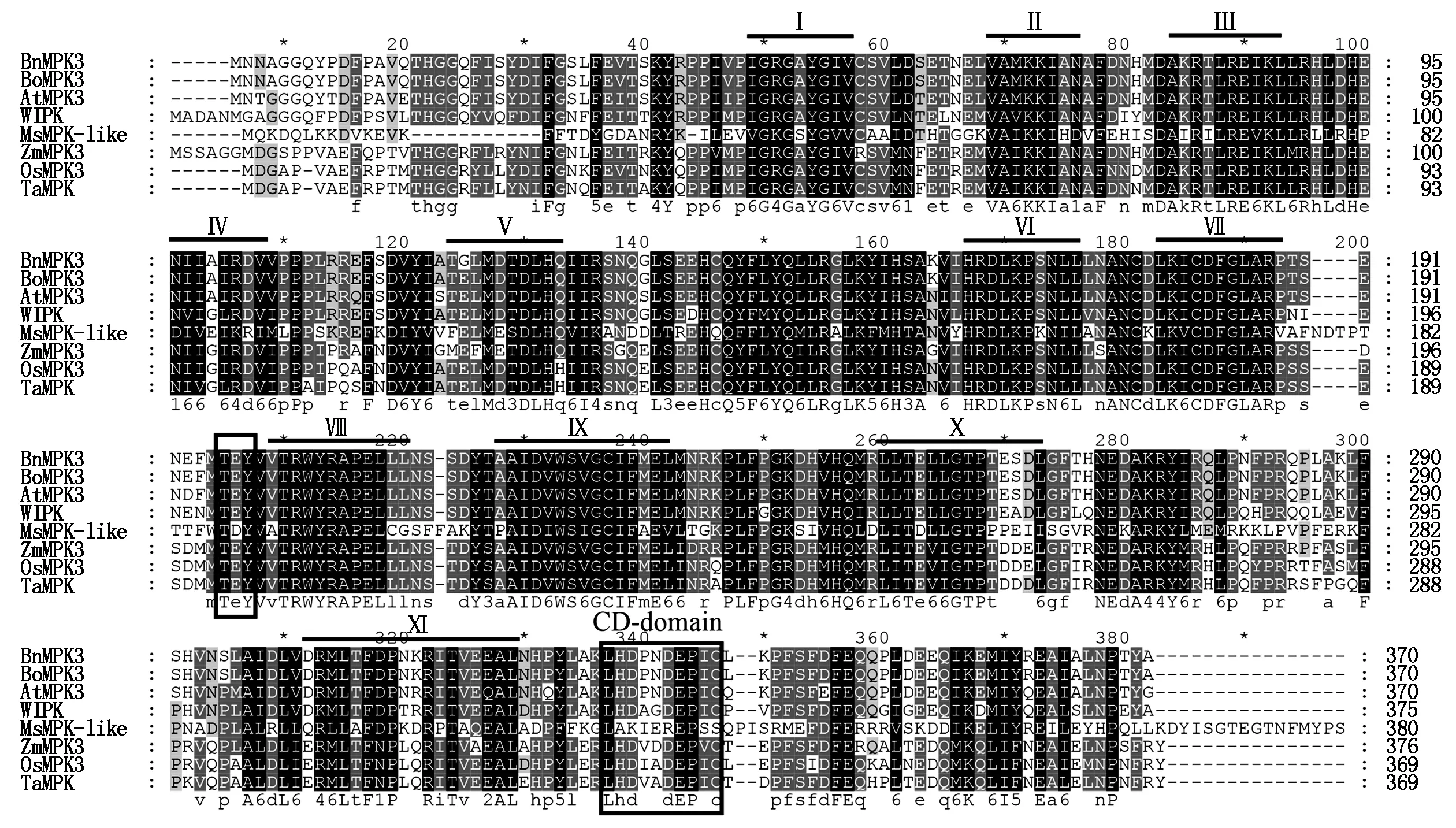
Bn.油菜;Bo.甘蓝;At.拟南芥;WIPK.烟草伤诱导蛋白激酶;Ms.苜蓿;Zm.玉米;Os.水稻;Ta.小麦;Ⅰ~Ⅺ表示11个保守结构域;TEY为保守的TEY磷酸化位点;CD-domain表示CD锚定区。
Bn.Brassicanapus;Bo.Brassicaoleracea;At.Arabidopsisthaliana;WIPK.Wound-induced protein kinase;Ms.Medicagosativa;Zm.Zeamays;Os.Oryzasativa;Ta.Triticumaestivum。Ⅰ-Ⅺ represents eleven conserved domains;TEY means conserved TEY phosphorylation site;CD-domain represents CD anchorage zone.
图2 BnMPK3与其他物种的氨基酸序列比对及其序列分析
Fig.2 Sequence analysis of BnMPK3 and multiple sequence alignment
2.2 BnMPK3的亚细胞定位和组织特异性表达
农杆菌介导的烟草瞬时表达系统使BnMPK3蛋白在烟草中得以快速高效表达,用于探究BnMPK3的亚细胞定位情况。结果显示(图3-A),转化pK7FWG2.0-BnMPK3-eGFP的烟草叶片的细胞在绿色荧光激发下细胞核显示为绿色,而在红色激发光下转化PCX-IND-DsRed(融合RFP的细胞核定位标志基因)的细胞核显红色,当2个视野重叠后则显黄色,这一结果表明BnMPK3定位于细胞核中。
为了调查BnMPK3的组织特异性表达,使用qRT-PCR技术分析BnMPK3在根、茎、叶、花、种子等组织器官中的相对表达情况。结果表明,BnMPK3在根、茎、叶、花、种子中都有表达,但在茎中表达最为显著,在叶和花中次之,在根和种子中表达最少(图3-B)。
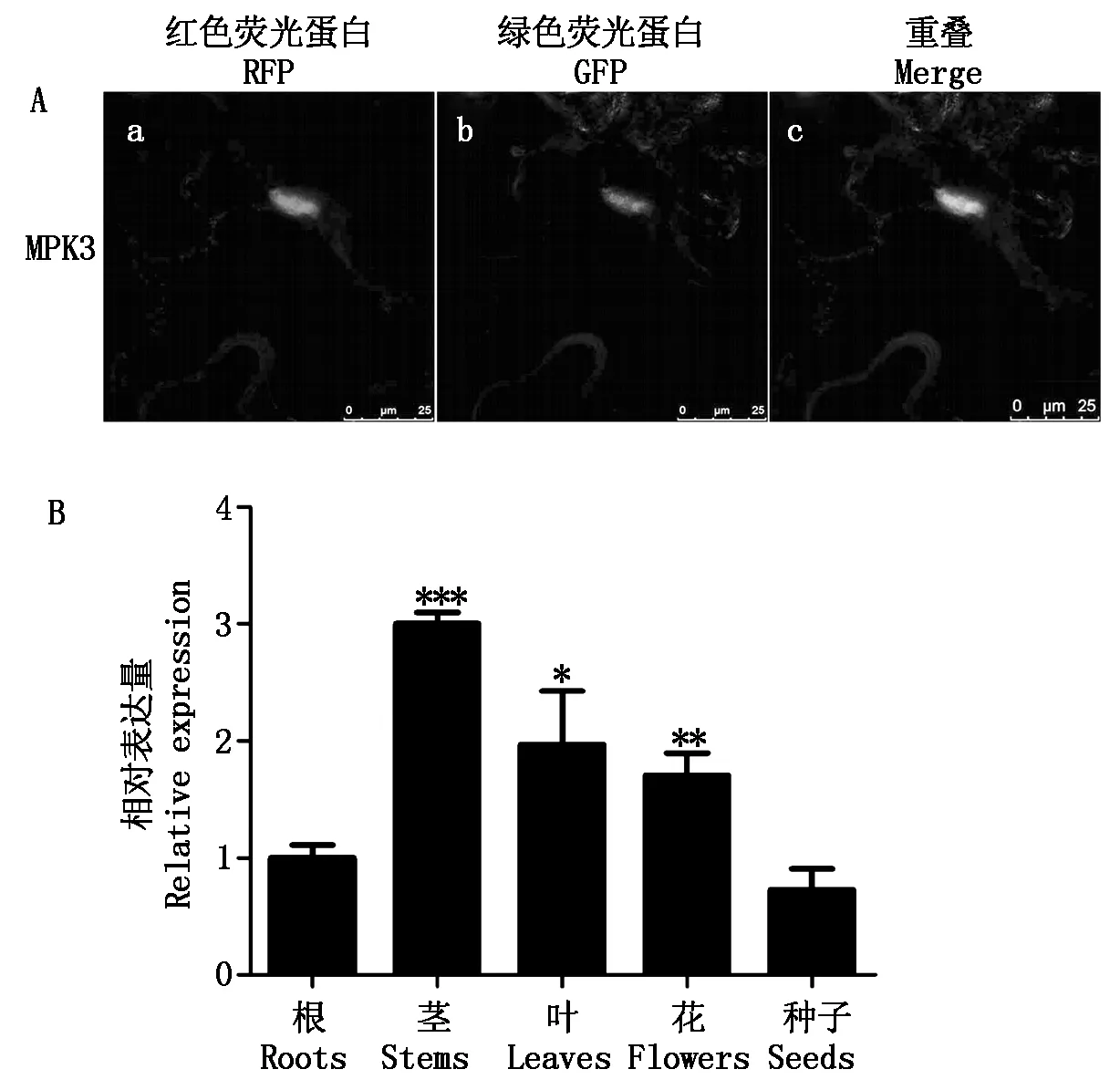
a.核定位标志基因蛋白质融合红色荧光蛋白RFP;b.BnMPK3融合绿色荧光蛋白GFP;c.a和b重叠。每个时间点和0 h之间的表达差异程度用*(P<0.05)、**(P<0.01)、***(P<0.001)表示。
a.Nuclear localization marker gene protein fused with red fluorescent protein;b.BnMPK3 fused with green fluorescent protein;c.Overlap of a and b.The level of expression differences between each time point and 0 h used*(P<0.05),**(P<0.01),***(P<0.001) to represent.
图3BnMPK3的亚细胞定位和组织特异性表达 (A.亚细胞定位;B.组织特异性表达)
Fig.3 Subcellular localization and tissue-specific expression ofBnMPK3(A.Subcellular localization;B.Tissue-specific expression)
2.3 各种环境因子对BnMPK3表达的影响
为了调查BnMPK3在高盐、低温、干旱、重金属各种环境胁迫下的表达情况,分别用NaCl溶液、4 ℃低温、PEG溶液(模拟干旱)和K2Cr2O7溶液处理甘蓝型油菜中双9号。qRT-PCR分析显示(图4),在NaCl溶液处理1 h时BnMPK3的表达量达到处理前的4.67倍;在4 ℃低温处理下BnMPK3的表达也快速上调。同时,在PEG溶液和K2Cr2O7溶液处理的条件下,BnMPK3的表达也出现上调改变。这些结果表明,BnMPK3是高盐、低温、干旱、重金属等各种环境胁迫因子的响应基因。

hpt.处理后小时数。每个时间点和0 h之间的显著性差异程度用***(P<0.001)、**(P<0.01)和*(P<0.05)表示。图5同。
hpt.Hours post treatment;The level of expression differences between each time point and 0 h used***(P<0.001),**(P<0.01)和*(P<0.05) to represent.The same as Fig.5.
图4BnMPK3对各种环境胁迫因子的表达响应
Fig.4 Expression responses ofBnMPK3 to various environmental stress factors
2.4 各种植物激素对BnMPK3表达的影响
大量的研究显示,水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)、乙烯(ET)等植物激素在调控植物防御各种环境胁迫中起着重要的作用。在用这些植物激素或其类似物处理甘蓝型油菜中双9号后,qRT-PCR分析结果显示,MeJA和ACC(ET的前体)处理后BnMPK3的表达量有显著变化;而SA和ABA处理后,BnMPK3没有显著响应表达(图5)。试验结果表明,BnMPK3是激素JA和ET的响应因子,建议BnMPK3可能在调控植物防御各种环境胁迫中,参与到JA和ET相关的信号网络中。
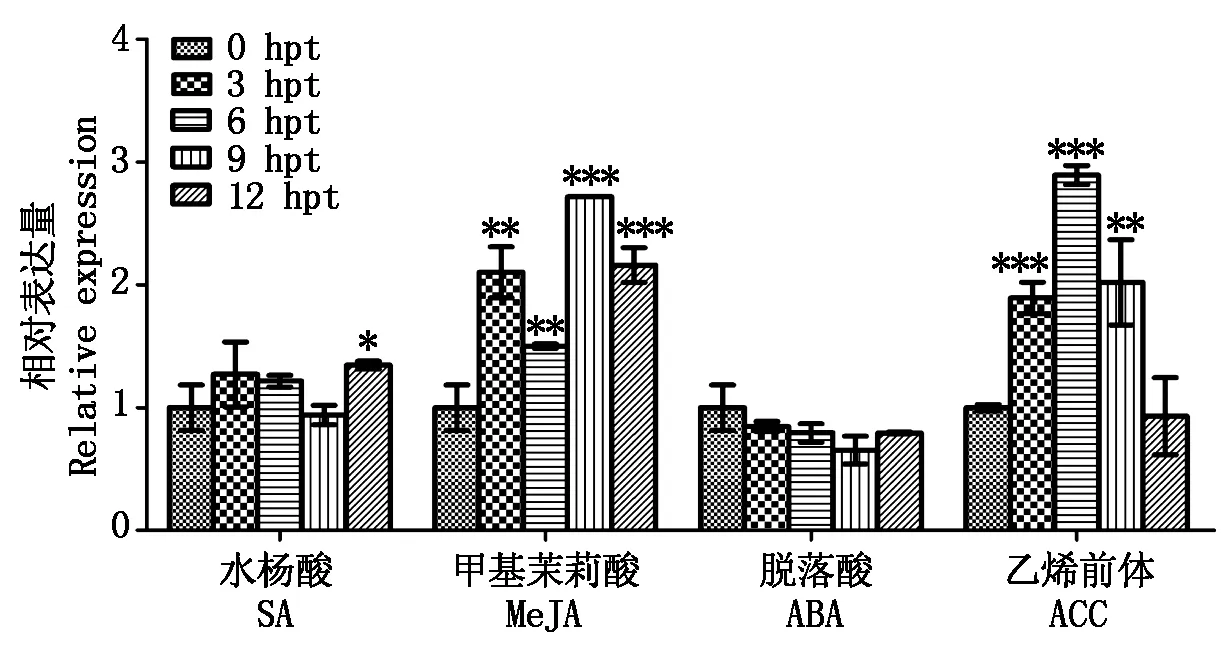
图5 BnMPK3对各种激素处理的表达响应
3 讨论
油菜是我国主要的油料作物,在种植过程中会受到各种环境胁迫的影响,严重影响油菜的生产。大量的研究表明,MAPK级联系统在植物感受胞外环境胁迫刺激从而在胞内启动防卫反应的过程中起着重要的介导作用[11,16]。然而,在甘蓝型油菜中,关于MAPK在植物抗逆过程中的参与情况及其重要性仍然未被充分阐述。本试验以我国长江中下游油菜主产区广泛种植的具有优良抗逆特点的甘蓝型油菜品种中双9号为试材,克隆了1个重要的MAP激酶基因-BnMPK3,并系统地分析了其在各种环境因子胁迫下的表达响应,鉴定出BnMPK3是高盐、低温、干旱、重金属以及JA和ET等各种环境胁迫因子的响应基因。
目前,各种MPK3同源基因已经从其他多种植物中克隆,并且对其展开了环境胁迫响应表达研究。在拟南芥中,AtMAPK3可以被低温和高盐激活[17];在花生(Arachishypogaea)中,低温胁迫可以显著诱导AhMPK3 的表达[18];而在棉花(Gossypiumbarbadense)中,GbMPK3除了可以被低温、高热(42 ℃)和脱水诱导表达之外,对高盐却表现出极端响应[19]。在试验中,进行系统地调查数据显示,BnMPK3不仅是低温、干旱等环境因子的响应基因,而且当用高盐处理时,BnMPK3做出快速响应,1 h内其表达量达到处理前的4.67倍。这些研究结果共同指出MPK3是各种环境胁迫因子的响应基因,表明在生物学功能上这些MPK3同源基因具有一定的保守性。另外,本研究首次调查了MPK3对镉离子(Cr3+)污染的响应表达,并且显示出,BnMPK3是Cr3+胁迫的响应基因,这为进一步研究植物对重金属污染的防卫策略提供了线索。
植物对外界环境胁迫的防卫反应信号的调控机制是复杂的。脱落酸(ABA)被认为是植物对非生物胁迫(如干旱)做出反应的关键信号分子[20-21],然而,最近的研究显示,表现为提高干旱耐受性的GbMPK3过表达转基因烟草,在模拟干旱处理时,体内ABA的含量并不提高,建议GbMPK3在介导烟草抵御干旱胁迫的过程中独立于ABA信号途径[19];在本研究中,BnMPK3在ABA以及SA处理时并无显著的表达响应,而是对JA和ET的处理强烈表达响应;与本研究结论类似的是,在水稻中,OsMPK3可以被JA处理诱导表达但是对SA处理没有显著表达响应,进而这个基因的沉默降低了JA的积累[22]。同样,在长春花(Catharanthusroseus)植物中,MeJA(甲基茉莉酸)处理显著诱导CrMPK3的表达[23]。因此,建议BnMPK3在调控植物对各种环境胁迫防御的过程中可能位于JA和ET相关的信号网络中,本研究的数据将为进一步研究BnMPK3在油菜抗逆中的功能及其机制提供试验线索。
[1] MAPK Group.Mitogen-activated protein kinase cascades in plants:a new nomenclature[J].Trends in Plant Science,2002,7(7):301-308.
[2] 赵琳琳,徐启江,姜 勇,等.生物和非生物胁迫下的植物细胞中丝裂原活化蛋白激酶(MAPK)信号转导[J].植物生理学通讯,2008,44(1):169-174.
[3] Jonak C,Okrész L,Bögre L,et al.Complexity,cross talk and integration of plant MAP kinase signalling[J].Current Opinion in Plant Biology,2002,5(5):415-424.
[4] 张腾国,Liu Y B,夏小慧.植物MAP激酶级联途径研究进展[J].西北植物学报,2008,28(8):1704-1714.
[5] 梁湾湾.油菜与拟南芥中MAPK级联途径应答逆境的分子机制研究[D].杨凌:西北农林科技大学,2014.
[6] Hamel L P,Nicole M C,Sritubtim S,et al.Ancient signals:comparative genomics of plant MAPK and MAPKK gene families[J].Trends in Plant Science,2006,11(4):192-198.
[7] Matern S,Peskan-Berghoefer T,Gromes R,et al.Imposed glutathione-mediated redox Switch modulates the tobacco wound-induced protein kinase and salicylic acid-induced protein kinase activation state and impacts on defence againstPseudomonassyringae[J].Journal of Experimental Botany,2015,66(7):1935-1950.
[8] Kiegerl S,Cardinale F,Siligan C,et al.SIMKK,a mitogen-activated protein kinase (MAPK) kinase,is a specific activator of the salt stress-induced MAPK,SIMK[J].The Plant Cell,2000,12(11):2247-2258.
[9] Xu J,Xie J,Yan C,et al.A chemical genetic approach demonstrates that MPK3/MPK6 activation and NADPH oxidase-mediated oxidative burst are two independent signaling events in plant immunity[J].The Plant Journal:for Cell and Molecular Biology,2014,77(2):222-234.
[10] Meskiene I,Baudouin E,Schweighofer A,et al.Stress-induced protein phosphatase 2C is a negative regulator of a mitogen-activated protein kinase[J].The Journal of Biological Chemistry,2003,278(21):18945-18952.
[11] Zhang S,Klessig D F.MAPK cascades in plant defense signaling[J].Trends in Plant Science,2001,6(11):520-527.
[12] Zeng Q,Chen J G,Ellis B E.AtMPK4 is required for male-specific meiotic cytokinesis inArabidopsis[J].The Plant Journal:for Cell and Molecular Biology,2011,67(5):895-906.
[13] Bethke G,Pecher P,Eschen-Lippold L,et al.Activation of theArabidopsisthalianamitogen-activated protein kinase MPK11 by the flagellin-derived elicitor peptide,flg22[J].Molecular Plant-microbe Interactions,2012,25(4):471-480.
[14] Chou K C,Shen H B.Plant-mPLoc:a top-down strategy to augment the power for predicting plant protein subcellular localization[J].PLoS One,2010,5(6):e11335.
[15] Wang Z,Chen Y,Fang H,et al.Selection of reference genes for quantitative reverse-transcription polymerase chain reaction normalization inBrassicanapusunder various stress conditions[J].Molecular Genetics and Genomics,2014,289(5):1023-1035.
[16] Pitzschke A,Schikora A,Hirt H.MAPK cascade signalling networks in plant defence[J].Current Opinion in Plant Biology,2009,12(4):421-426.
[17] Mizoguchi T,Irie K,Hirayama T,et al.A gene encoding a mitogen-activated protein kinase kinase kinase is induced simultaneously with genes for a mitogen-activated protein kinase and an S6 ribosomal protein kinase by touch,cold,and water stress inArabidopsisthaliana[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(2):765-769.
[18] Kumar K R,Srinivasan T,Kirti P B.A mitogen-activated protein kinase gene,AhMPK3 of peanut:molecular cloning,genomic organization,and heterologous expression conferring resistance againstSpodopteraliturain tobacco[J].Molecular Genetics and Genomics,2009,282(1):65-81.
[19] Long L,Gao W,Xu L,et al.GbMPK3,a mitogen-activated protein kinase from cotton,enhances drought and oxidative stress tolerance in tobacco[J].Plant Cell,Tissue and Organ Culture,2014,116(2):153-162.
[20] Sirichandra C,Wasilewska A,Vlad F,et al.The guard cell as a single-cell model towards understanding drought tolerance and abscisic acid action[J].Journal of Experimental Botany,2009,60(5):1439-1463.
[21] Wang P,Song C P.Guard-cell signalling for Hydrogen peroxide and abscisic acid[J].The New Phytologist,2008,178(4):703-718.
[22] Wang Q,Li J,Hu L,et al.OsMPK3 positively regulates the JA signaling pathway and plant resistance to a chewing herbivore in rice[J].Plant Cell Reports,2013,32(7):1075-1084.
[23] Raina S K,Wankhede D P,Jaggi M,et al.CrMPK3,a mitogen activated protein kinase fromCatharanthusroseusand its possible role in stress induced biosynthesis of monoterpenoid indole alkaloids[J].BMC Plant Biology,2012,12(4):134.
Sequence Analysis ofBrassicanapusMAP Kinase 3 and It′s Expression Responses to Environmental Signals
CHEN Ting,FANG Hedi,LI Xiao,LI Guanying,TAN Xiaoli,ZHANG Zhiyan,WANG Zheng
(Institute of Life Sciences,Jiangsu University,Zhenjiang 212013,China)
In order to explore the effect of environment signals on the expression of MPK3 in oilseed rape,a full length cDNA ofBrassicanapusMPK3 (BnMPK3) was cloned from the cv.Zhongshuang No.9 by homology cloning approach.Sequence analysis showed that BnMPK3 contained a highly conserved motif TEY and a CD domain (common docking domain) and was consisted of 370 amino acid residues exhibiting 94% identity with AtMPK3.Transient expression assays in tobacco showed that BnMPK3 is localized in nuclei.Quantitative RT-PCR analysis showed thatBnMPK3 was especially expressed in stems,flowers and leaves and revealed that its expression was significantly up-regulated by the treatments with NaCl solution,4 ℃,PEG4000 solution,K2Cr2O7solution or MeJA,ACC solution.The results demonstrated thatBnMPK3 was a response gene involved in responses to various environmental stresses including high-salinity,low temperature,drought and heavy metal pollution and to signaling molecules JA and ET,suggesting thatBnMPK3 may involve in JA and ET signaling pathways in defense response against various environmental stresses in oilseed rape,which will provide useful information in further in-depth functional analysis ofBnMPK3 in defense to environmental stresses.
Brassicanapus;BnMPK3;Expression responses;Environmental stresses
2016-07-22
国家自然科学基金面上项目(31071672);江苏大学高级专业人才科研启动基金项目(09JDG061)
陈 婷(1991-),女,江苏苏州人,在读硕士,主要从事油菜功能基因组学研究。
王 政(1974-),男,内蒙古包头人,副研究员,博士,主要从事油菜功能基因组学研究。
S565.4;Q78
A
1000-7091(2016)05-0094-07
10.7668/hbnxb.2016.05.014
