金黄色葡萄球菌对小尾寒羊乳腺组织TLR2表达的影响
2016-11-16马小军陈富强张小丽李发弟宋晓育
马小军,陈富强,张小丽,李发弟,唐 然,张 晨,宋晓育,张 欣
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2.甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070;3.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070)
金黄色葡萄球菌对小尾寒羊乳腺组织TLR2表达的影响
马小军1,2,陈富强1,张小丽1,李发弟3,唐 然1,张 晨1,宋晓育1,张 欣1
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2.甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070;3.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070)
Toll样受体能够识别细菌等病原微生物及介导炎症反应信号通路,在先天免疫和获得性免疫中发挥着重要作用。为了解Toll样受体2(TLR2) 在小尾寒羊正常乳腺组织及由金黄色葡萄球菌引起的乳腺炎乳腺组织中的表达情况,探讨TLR2在金黄色葡萄球菌乳腺炎致病过程中的作用机制及乳腺上皮细胞在乳腺免疫防御中所起的作用,采用qRT-PCR技术和免疫组织化学染色(IHC)法检测了正常小尾寒羊及金黄色葡萄球菌乳腺炎病理模型小尾寒羊乳腺组织中TLR2基因mRNA及其蛋白的表达情况。结果显示,小尾寒羊正常乳腺组织、金黄色葡萄球菌感染乳腺组织均有TLR2 mRNA及其蛋白表达;但金黄色葡萄球菌感染后乳腺组织中TLR2基因及TLR2蛋白显著高于正常乳腺组织,且感染后48 hTLR2 mRNA和TLR2蛋白相对表达量最高(P<0.05),96 hTLR2 mRNA和蛋白相对表达量较48 h显著降低(P<0.05),正常对照组TLR2的相对表达量最低。通过免疫组织化学染色发现,正常乳腺组织中TLR2蛋白主要定位于乳腺腺泡上皮,而感染金黄色葡萄球菌后乳腺组织中TLR2蛋白主要表达在乳腺腺泡腔中脱落的乳腺上皮细胞和以淋巴细胞为主的炎性细胞上。结果表明,乳腺感染金黄色葡萄球菌后,乳腺上皮细胞是病原菌作用的靶标,通过上调表达TLR2识别病原菌,激发先天免疫。
金黄色葡萄球菌;小尾寒羊;乳腺炎;Toll样受体2基因(TLR2)
金黄色葡萄球菌(Staphyloccocusaureus)是一种典型的革兰氏阳性病原菌,可引起多种严重感染,也是引起动物慢性、亚临床型及临床型乳腺炎的重要病原菌之一。小尾寒羊(Small-tail han sheep)是我国肉裘兼用型绵羊品种,以其多胎、多羔、生长快、体格大、遗传性稳定和适应性强等优点,成为我国发展肉羊生产或培育杂交肉羊品种的优良母本素材[1]。但目前的舍饲条件基础设施薄弱、饲养密度较高、经营管理粗放,很容易导致乳腺炎的产生。乳腺炎能造成饲料的浪费和药费的增加,影响羔羊健康、生长发育,给养羊业带来巨大的经济损失。Toll样受体(Toll-like receptors,TLRs)是1997年 Medzhitov等[2]率先报道的人类一种同源于果蝇Toll的蛋白分子,属于Ⅰ型跨膜蛋白,是在许多感染性疾病中识别入侵病原微生物、介导固有免疫细胞活化的重要模式识别受体(Pattern recognition receptors,PRRs),是固有免疫系统的重要组成部分[3-4]。TLRs作为模式识别受体,可识别病原体相关分子模式(Pathogen associated molecular patterns,PAMPs),激活细胞信号传导途径,触发天然免疫,并通过提供刺激分子和诱导T细胞分化的细胞因子建立获得性免疫[5]。目前,研究者已经发现人类 Toll样受体家族至少有11个成员,已经鉴定出绵羊有10种TLR(TLR1~TLR10)[6-7]。TLRs与天然免疫应答关系的研究中,倍受关注的是TLR2和TLR4。其中Toll样受体2(Toll-like receptor,TLR2)具有相对广泛的配体特异性,包括G+菌的肽聚糖(PGN)和脂磷壁酸(LAT)、G-菌的类脂A、G-菌脂蛋白(BLP)、酵母细胞壁等[8]。
近年来,Toll样受体在人和鼠上的研究已经取得了较大的进展,虽然家畜TLRs对病原的天然免疫识别及其信号转导已成为一个研究热点,但目前对于家畜TLRs的研究大多集中在TLRs基因的克隆及序列分析、TLRs基因多态性与疾病相关性的研究、TLRs在组织中的分布等方面[9-10],而对TLRs在家畜疾病中作用机制的研究尚处于起步阶段,尤其是对TLRs在牛、羊乳腺炎发病过程中的作用机制的研究更少。本试验通过金黄色葡萄球菌人工感染小尾寒羊建立乳腺炎病理模型,利用实时荧光定量PCR和免疫组织化学法检测小尾寒羊正常乳腺组织和感染金黄色葡萄球菌后不同时间乳腺组织中TLR2在mRNA水平和蛋白水平的表达情况及TLR2的表达部位,为深入探究金黄色葡萄球菌与小尾寒羊乳腺细胞的相互作用以及葡萄球菌引起的乳腺炎在分子水平上的发病机理奠定理论基础。
1 材料和方法
1.1 主要试剂和仪器
TRIzol(Invitrogen,美国)、反转录试剂盒(Promega,美国)、实时荧光定量PCR试剂盒(Roche,瑞士),免疫组化所用Rabbit Anti-TLR2多克隆抗体和SP-0023通用型二步法免疫组织化学检测试剂盒购自北京博奥森生物技术有限公司,HRP标记的山羊抗兔IgG和APES防脱玻片(ZLI-9502)从北京中杉金桥生物技术有限公司购买。常规试剂为国产分析纯。荧光定量PCR仪为Funglyn Biotech FTC-3000,显微照相装置(DP71)为日本Olympus公司产品。
1.2 试验材料
将正处于泌乳中期的健康小尾寒羊(年龄2~3岁,体重36~40 kg)9只随机分为3组,正常对照组和试验Ⅰ组(感染48 h)和试验Ⅱ组(感染96 h),每组3只,试验组小尾寒羊一侧乳头管中注入0.5 mL(3×106cfu/mL)金黄色葡萄球菌(甘肃农业大学兽医微生物与免疫学课题组以从患临床型乳腺炎的哺乳期绵羊乳汁中分离并鉴定保存)菌悬液,灌注后轻柔按摩,使其分布均匀;对照组注射等量的生理盐水,成功建立小尾寒羊乳腺炎模型。于接菌后48,96 h每只羊分别无菌手术采集乳腺组织各2份,一份浸泡于福尔马林溶液中供组织切片制作,一份立即放入液氮后于-80 ℃冰箱中保存供RNA提取。
1.3 引物的设计与合成
从GenBank选取绵羊TLR2基因和内参基因β-actin的mRNA序列,采用Primer Premier 5.0软件自行设计引物(表1)。
1.4 乳腺组织总RNA提取
小尾寒羊乳腺组织总RNA提取按照TRIzol试剂说明书操作步骤进行,采用琼脂糖凝胶电泳和超微量紫外分光光度计检测提取的总RNA质量和纯度,保存于-80 ℃备用。

表1 qRT-PCR引物基本信息
1.5 RT-PCR扩增
根据RT-PCR试剂盒说明书操作要求进行逆转录合成cDNA第一链,采用20 μL反应体系:总RNA 2.0 μL,Oligo(dT)15Primer 1.5 μL,Random Primer 1.5 μL,70 ℃ 5 min后立即放置冰上至少5 min后,加入GoScriptTM5X Reaction Buffer 4.0 μL,MgCl23.0 μL,PCR Nucleotide Mix 1.0 μL,Recombinant RNasin®Ribonuclease Inhibitor 0.5 μL,GoScriptTMReverse Transcriptase 1.0 μL,Nuclease-Free Water 5.5 μL,25 ℃反应5 min,42 ℃温浴1 h;以反转录反应产物为模板,用设计的特异性引物扩增目的基因,采用25 μL反应体系:2×TaqPCR MasterMix 12.5 μL,RT反应产物2 μL,上、下游引物(10 μmol/L)各1.0 μL,去离子水8.5 μL;PCR反应条件:94 ℃ 5 min预变性;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸10 min。同时将PCR产物进行凝胶电泳,进行成像分析。
1.6 qRT-PCR检测TLR2的表达
以反转录合成的cDNA(2 μL)为模板进行定量PCR扩增,每个时间的样品做3个重复,PCR反应体系(20 μL)如下:FastStart SYBR Green Master 10 μL,上、下游引物各0.5 μL,去离子水7 μL;PCR扩增按三步法反应条件进行:50 ℃ 2 min,95 ℃预变性10 min;95 ℃变性15 s,55 ℃ 60 s,72 ℃ 60 s,40个循环,同时记录扩增曲线和溶解曲线。内参基因为β-actin,重复次数n=3,采用2-ΔΔCt分析TLR2基因相对表达量,其中ΔΔCt=(Ct目的基因-Ct内参基因)试验组-(Ct目的基因-Ct内参基因)对照组。
1.7 乳腺组织免疫组织化学染色
采集的乳腺组织标本用4%中性福尔马林溶液固定后,进行石蜡包埋,制备4 μm厚的切片备用。组织切片用60 ℃烘烤2 h后进行免疫组化学SP染色,再进行脱蜡、酒精梯度分化;切片经30 g/L H2O2水溶液封闭过氧化物酶10 min、健康羊血清白蛋白孵育15 min后,滴加50 μL Rabbit Anti-TLR2多克隆抗体(稀释度1∶200),37 ℃孵育2 h,用PBS洗涤后滴加50 μL生物素标记山羊抗兔IgG工作液,再加50 μL HRP标记链酶卵白素工作液,37 ℃孵育;滴加配制DAB显色液,脱水透明、封片。用显微照相系统照相观察。每张组织切片随机选取5个视野(400倍),用Image-Pro Plus 6.0软件进行分析,测定获得TLR2蛋白阳性反应物的平均光密度值。
1.8 数据分析
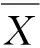
2 结果与分析
2.1 乳腺组织总RNA提取结果
提取的乳腺组织总RNA,用微量紫外分光光度计(波长260,280 nm)检测其的质量和纯度,各乳腺组织总RNA的A260/280在1.9~2.0,表明提取的RNA纯度较高;经1.0%琼脂糖凝胶电泳检测,乳腺组织总RNA的28S rRNA、18S rRNA和5S rRNA 3条带完整,可用于下一步反应(图1)。
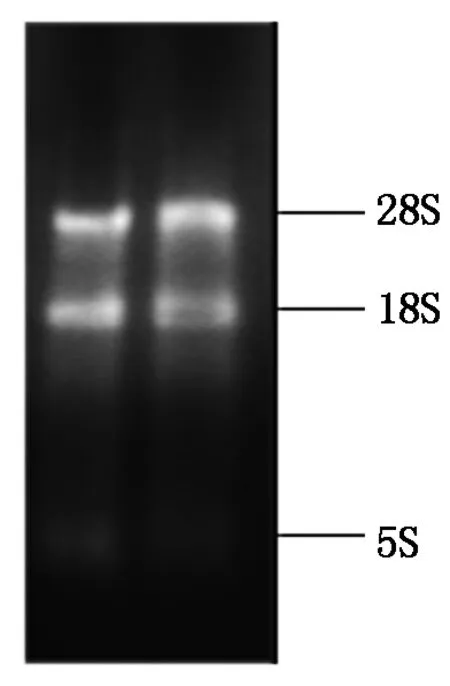
图1 乳腺组织总RNA
M.DNA分子质量标准;1.β-actin的RT-PCR扩增
2.2 RT-PCR检测结果
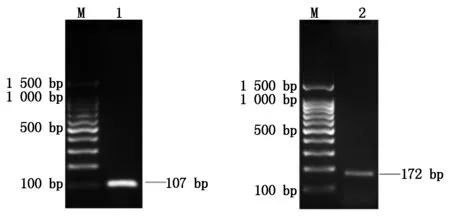
RT-PCR扩增内参基因β-actin和TLR2基因,对PCR产物进行1.5% 琼脂糖凝胶电泳检测,结果分别在107,172 bp左右处出现明显的条带,获得预期分子量电泳条带(图2)。
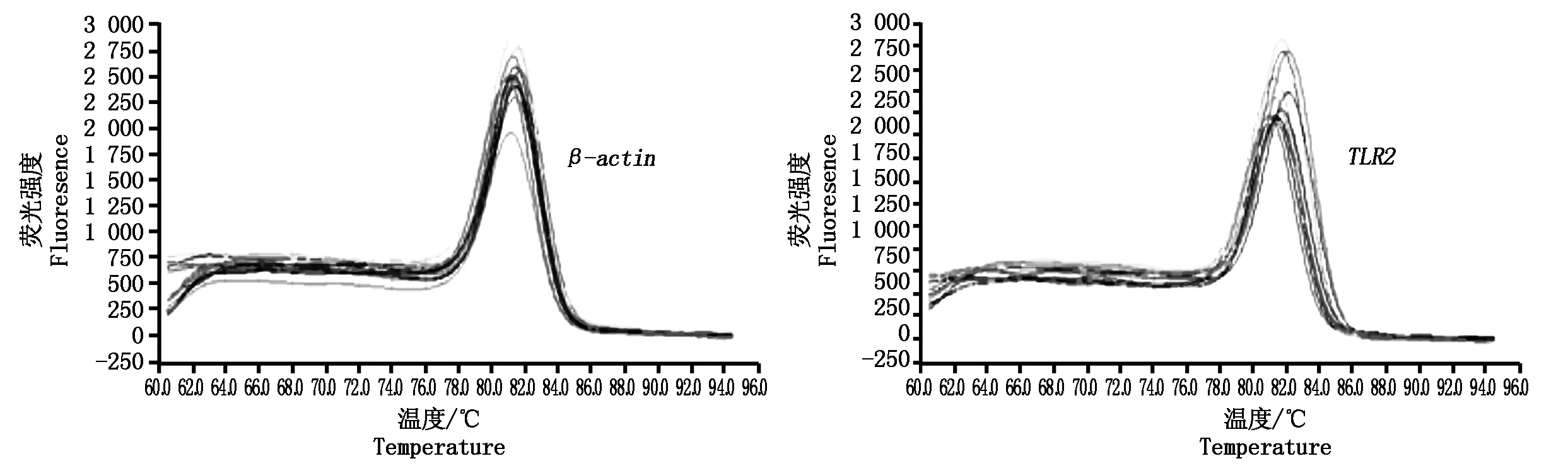
图3 内参基因β-actin和TLR2基因荧光定量溶解曲线
2.3 qRT-PCR检测TLR2基因在小尾寒羊乳腺组织中的表达
利用Funglyn Biotech FTC-300荧光定量PCR系统对TLR2基因和β-actin内参基因进行扩增,qRT-PCR扩增40个循环后,根据扩增效率曲线判断扩增效果良好,通过溶解曲线分析,内参基因β-actin和TLR2基因分别在81.4,81.8 ℃出现单一产物峰(图3),均与设计的引物预期产物温度接近。
结果显示,与正常对照组相比,小尾寒羊乳房感染金黄色葡萄球菌48,96 h后其乳腺组织中TLR2 mRNA相对表达量均显著增高(图4)。在感染后48 h时乳腺组织中TLR2 mRNA相对表达量最高;感染后96 h时TLR2 mRNA相对表达量较48 h显著下降,但仍然显著高于对照组。以上结果表明,小尾寒
羊感染金黄色葡萄球菌后,其乳腺组织中TLR2基因 mRNA的表达量明显上调。
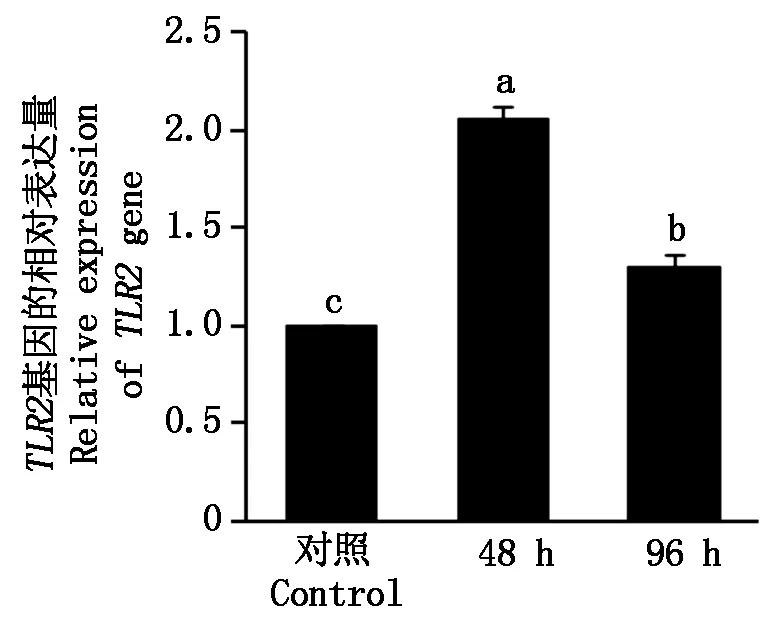
不同字母表示差异显著(P<0.05)。表2同。

A、B、C、a、b、c.免疫组织化学染色,其中a、b、c分别为图A、B和C的阴性对照;A、a.正常对照组;B、b.感染后48 h组;C、c.感染后96 h组;△.TLR2阳性表达;免疫组织化学染色阳性产物呈棕褐色表达,表示有该蛋白的分布。
A,B,C,a,b and c are immunohistochemistry staining photos and a,b and c as negative controls of A,B and C;A,a.Normal control;B,b.After infection 48 h group;C,c.After infection 96 h group;△.TLR2 positive expression;The positive expression of immunohistochemical staining is brown which repre-sents the distribution of the protein.
图5 免疫组织化学检测乳腺组织中TLR2的表达(×400)
Fig.5 The expression ofTLR2 in breast tissue by immunohistochemistry magnification(×400)
2.4 TLR2蛋白在小尾寒羊乳腺组织中的表达及分布检测
小尾寒羊乳腺组织免疫组织化学染色发现阳性产物呈棕褐色,试验结果显示,正常乳腺组织中TLR2蛋白主要定位于乳腺腺泡上皮,感染金黄色葡萄球菌后的乳腺组织中TLR2蛋白主要表达在乳腺腺泡腔中脱落的乳腺上皮细胞和以淋巴细胞为主的炎性细胞上(图5)。
乳腺组织中TLR2的阳性表达用图像分析软件进行分析,测定出其平均光密度值。结果表明,感染金黄色葡萄球菌后48 h组小尾寒羊乳腺组织中TLR2蛋白阳性表达最强烈,并且与对照组和感染后96 h组相比,其阳性表达量显著增强;感染后96 h组小尾寒羊乳腺组织中TLR2蛋白表达量较感染后48h组显著降低,但与对照组相比,感染后96 h组TLR2蛋白的表达增加量不显著(表2)。
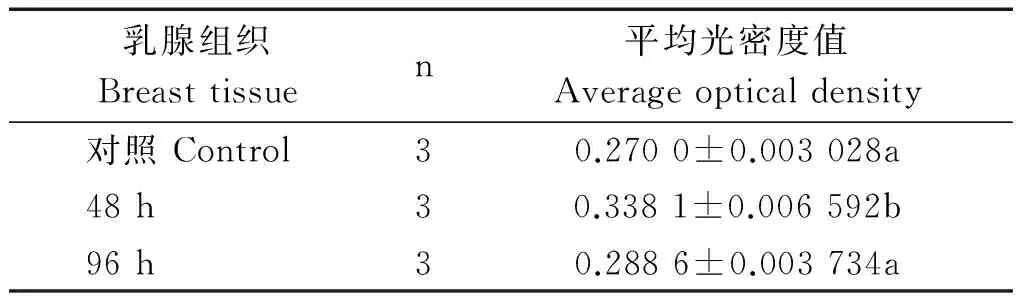
表2 乳腺组织中TLR2阳性反应的平均光密度
3 讨论
TLRs为哺乳动物免疫提供关键组分,是最早应答感染的免疫监视机制的一部分[5],对乳腺的先天性免疫具有重要的作用。金黄色葡萄球菌的感染可能会导致严重的乳腺炎等疾病,其细胞壁成份,如脂蛋白(Lipoproteins,LPS)、肽聚糖(PGN)、脂磷壁酸(LTA)等都可以被TLR2所识别,激活TLR2级联信号,触发先天性免疫,进而激活获得性免疫反应[11]。TLR2 作为激动剂可以调节动物的免疫反应并平衡 Th1/Th2 的表达[12]。TLR2 是奶牛乳腺炎抗性的候选基因,马腾壑等[13]研究结果显示,牛TLR2基因第2外显子T到G的突变与其乳腺炎体细胞评分显著相关。从而提示TLR2可能在宿主对乳房内感染免疫应答中起重要作用,但是具体的机制还不清楚,有待进一步深入研究。
TLR2 在动物的多个组织和器官表达,表达水平在不同组织有所不同。TLR2 分布在单核细胞、巨噬细胞、中性粒细胞、树突状细胞等细胞,也在肺泡上皮细胞、口腔上皮细胞、肠上皮细胞表达,在外周血的白细胞中高表达[14-15]。Tirumurugaan等[16]研究发现,TLR1~TLR10在山羊淋巴结表达量高,TLR1~TLR9在外周血单个核细胞、肺脏表达量高,外周血单个核细胞、淋巴结、脾脏、空肠中TLR2的表达量较高,而在子宫、肺和皮肤细胞中TLR2表达量较低而TLR6表达量较高。最近的研究表明,TLR2、TLR4 和其下游信号通路的组分都能表达于牛乳腺上皮细胞中,乳腺上皮细胞能够通过 Toll 样受体途径介导引发先天免疫反应,并对革兰氏阳性菌和革兰氏阴性菌做出免疫反应[ 17-19]。当奶牛患有隐型和临床型乳腺炎,其血液白细胞TLR2表达量显著高于健康奶牛[20]。Goldammer 等[21]发现,牛患病乳区TLR2基因mRNA的表达量高于不患病乳区[21]。茹坤[22]研究发现,用热灭活的金黄色葡萄球菌对萨能奶山羊乳腺上皮细胞进行刺激,6 h后TNF-α、IL-1α、IL-1β、IL-8、TLR2 和 TLR4 表达量升高,与对照组相比差异显著(P<0.05)。本试验研究结果表明,在正常小尾寒羊乳腺腺泡上皮细胞上就有少量TLR2蛋白表达,当金黄色葡萄球菌感染时,小尾寒羊乳腺组织中TLR2蛋白的表达量显著上调,且TLR2主要表达在乳腺腺泡腔中脱落的乳腺上皮细胞和以淋巴细胞为主的炎性细胞上。上述研究结果说明金黄色葡萄球菌感染后,TLR2在局部的乳腺免疫应答过程中起着重要的作用,除了免疫细胞与入侵细菌直接相互作用外,乳腺上皮细胞在识别病原菌及其细胞壁成分,激发先天免疫的过程中起着重要的作用。
本试验的研究结果还表明,虽然小尾寒羊乳腺组织中的TLR2基因及其产物的表达量在金黄色葡萄球菌感染后明显上调,但感染后48 h组小尾寒羊的TLR2 mRNA及TLR2的表达量均显著高于对照组和感染后96 h组,说明金黄色葡萄球菌刺激小尾寒羊乳腺上皮细胞TLR2基因及其产物表达变化具有时间的依赖性,这为进一步探讨金黄色葡萄球菌乳腺炎发生时乳腺上皮细胞TLR2基因及其表达产物的变化规律提供了研究基础,也为进一步探讨金黄色葡萄球菌乳腺炎致病机理,研究乳腺上皮细胞在奶牛乳腺免疫防御中所起的作用提供了参考依据。
[1] 王金文,张果平,王德芹,等.杜泊羊、萨福克羊、无角陶赛特羊与小尾寒羊杂交优势利用研究[J].中国草食动物,2006,26(5):63-65.
[2] Medzhitov R,Preston-hurlburt P,Janeway C A.A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
[3] Randall L P,Cooles S W,Osborn M K,et al.Antibiotic resistance genes,integrons and multiple antibiotic resistance in thirty-five serotypes ofSalmonellaentericaisolated from humans and animals in the UK[J].The Journal of Antimicrobial Chemotherapy,2004,53(2):208-216.
[4] Guerra B,Junker E,Schroeter A,et al.Phenotypic and genotypic characterization of antimicrobial resistance in GermanEscherichiacoliisolates from cattle,swine and poultry[J].The Journal of Antimicrobial Chemotherapy,2003,52(3):489-492.
[5] Parker L C,Prince L R,Sabroe I.Translational mini-review series on Toll-like receptors:Networks regulated by Toll-like receptors mediate innate and adaptive immunity[J].Clinical and Experimental Immunology,2007,147(2):199-207.
[6] Muzio M,Bosisio D,Polentarutti N,et al.Differential expression and regulation of toll-like receptors(TLR)in human leukocytes:selective expression of TLR3 in dendritic cells[J].The Journal of Immunology,2000,164(11):5998-6004.
[7] Chang J S,Russell G C,Jann O,et al.Molecular cloning and characterization of Toll-like receptors 1-10 in sheep[J].Veterinary Immunology and Immunopathology,2009,127(1-2):94-105.
[8] Vives-pi M,Somoza N,Fernandez-alvarez J,et al.Evidence of expression of endotoxin receptors CD14,Toll-like receptors TLR4 and TLR2 and associated molecule MD-2 and of sensitivity to endotoxin(LPS)in islet beta cells[J].Clinical & Experimental Immunology,2003,133(2):208-218.
[9] Gilbert F B,Cunha P,Jensen K,et al.Differential response of bovine mammary epithelial cells toStaphylococcusaureusorEscherichiacoliagonists of the innate immune system[J].Veterinary Research,2013,44(8):4012-4017.
[10] Menzies M,Ingham A.Identification and expression of Toll-like receptors 1-10 in selected bovine and ovine tissues[J].Veterinary Immunology and Immunopathology,2006,109(1-2):23-30.
[11] Bai Jie,Lin Jiapeng,Li Wenrong,et al.Association of toll-like receptor 2 polymorphisms with somatic cell score in Xinjiang Brown cattle[J].Animal Science Journal,2012,83(1):23-30.
[12] Li Qiong,Kumar A,Gui Jianfang,et al.Staphylococcusaureuslipoproteins trigger human corneal epithelial innate response through toll-like receptor-2[J].Microbial Pathogenesis,2008,44(5):426-434.
[13] 马腾壑,许尚忠,王兴平,等.奶牛TLR2基因遗传变异与乳腺炎体细胞评分的相关研究[J].畜牧兽医学报,2007,38(4):332-336.
[14] Famakin B M,Mou Yongshan,Ruetzler C A,et al.Disruption of downstream MyD88 or TRIF Toll-like receptor signaling does not protect against cerebral ischemia[J].Brain Research,2011,1388(4):148-156.
[15] Armstrong L,Medford A R,Uppington K M,et al.Expression of functional toll-like receptor-2 and-4 on alveolar epithelial cells[J].American Journal of Respiratory Cell and Molecular Biology,2004,31(2,1):241-245.
[16] Tirumurugaan K G,Dhanasekaran S,Raj G D,et al.Differential expression of toll-like receptor mRNA in selected tissues of goat (Caprahircus)[J].Veterinary Immunology and Immunopathology,2010,133(2/4):296-301.
[17] Rainard P,Riollet C.Innate immunity of the bovine mammary gland[J].Veterinary Research,2006,37(3):369-400.
[18] Wellnitz O,Bruckmaier R M.The innate immune response of the bovine mammary gland to bacterial infection[J].Veterinary Journal,2012,192(2):148-152.
[19] Miao J,Zheng L,Zhang J,et al.The effect of taurine on the toll-like receptors/nuclear factor kappa B (TLRs/NF-kappaB) signaling pathway inStreptococcusuberisinducedmastitis in rats[J].International Immunopharmacology,2011,11 (11):1740-17466.
[20] Swain D K,Kushwah M S,Kaur M,et al.Formation of NET,phagocytic activity,surface architecture,apoptosis and expression of toll like receptors 2 and 4 (TLR2 and TLR4) in neutrophils of mastitic cows[J].Veterinary Research Communications,2014,38(3):209-219.
[21] Goldammer T,Zerbe H,M O M,et al.Masitfs increases mammary mRNA abundance of 3-defensin 5,Toll-like receptor 2(TLR2),and TLR4 but not TLR9 in cattle[J].Clinical and Diagnostic Laboratory Immunology,2004,11(1):174-185.
[22] 茹 坤.山羊乳腺上皮细胞细菌诱导型基因的筛选及其启动子活性分析[D].杨凌:西北农林科技大学,2014.
Effect ofStaphyloccocusaureusonTLR2 Expression in Mammary Glands of Small-tail Han Sheep
MA Xiaojun1,2,CHEN Fuqiang1,ZHANG Xiaoli1,LI Fadi3,TANG Ran1,ZHANG Chen1,SONG Xiaoyu1,ZHANG Xin1
(1.College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Province Key Laboratory of Herbivorous Animal Biotechnology,Lanzhou 730070,China;3.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China)
Toll-like receptor (TLR) family plays a key role in innate immunity and various inflammatory responses,for recognizing the bacterial pathogen and mediated the signal path of inflammation.To investigate the expressions ofTLR2 in mammary glands of Small-tail han sheep were infected withStaphylococcusaureu, and to explore the mechanism of TLR2 in mastitis,the qRT-PCR and IHC technology was used to detect the expression ofTLR2 mRNA and TLR2 protein in the mammary gland of control and experimental groups.The results showed that theTLR2 mRNAs and protein were expressed in all mammary glands of Small-tail han sheep in control and experimental groups.The levels ofTLR2 mRNA and protein was lowest in control group,was highest at 48 h afterStaphylococcusaureuinfusion,significantly higher than that of control and 96 h group(P<0.05).After infected 96 h,the levels ofTLR2 mRNA and protein was significantly reduced than that of 48 h group(P<0.05).The protein of TLR2 were located in the epithelial cell of mammary gland acinus,were expressed in epithelial cell of mammary gland acinus dropped and inflammatory cells as lymphocytes after effectedStaphylococcusaureu.The results implied that the expression of TLR2 in the epithelial cell of mammary gland was up-regulated to recognize pathogenic bacteria,arouse the innate immunity.
Staphylococcusaureu;Small-tail han sheep;Mastitis;Toll-like receptors 2(TLR2)
2016-06-16
甘肃省高等学校基本科研业务费项目;甘肃省农业生物技术研究与应用与开发项目(GNSW-2011-22);甘肃农业大学动物医学院教研产学创新基金项目(GYCX-KX010)
马小军(1972-),男,甘肃泾川人,副教授,博士,硕士生导师,主要从事动物免疫与抗病研究。
张小丽(1971-),女,甘肃定西人,副教授,博士,硕士生导师,主要从事动物微生物免疫与抗病研究。
Q78
A
1000-7091(2016)05-0050-06
10.7668/hbnxb.2016.05.008
