转水稻OsSIK1基因玉米植株的获得及抗旱性分析
2016-11-16郝曜山张欢欢杜建中王亦学
郝曜山,张欢欢,杜建中,王亦学,孙 毅
(山西省农业科学院 生物技术研究中心,山西 太原 030031)
转水稻OsSIK1基因玉米植株的获得及抗旱性分析
郝曜山,张欢欢,杜建中,王亦学,孙 毅
(山西省农业科学院 生物技术研究中心,山西 太原 030031)
类受体激酶基因OsSIK1具有通过激活抗氧化系统,增强水稻对于干旱和盐胁迫抗性的作用。为了丰富可利用的作物抗旱基因,获得具有较高抗旱水平的玉米新种质,通过超声波辅助花粉介导法,将水稻类受体激酶基因OsSIK1导入玉米自交系郑58中,并对转化株进行卡那霉素筛选及T1、T2、T3的PCR及Southern Blotting杂交等分子检测,获得转化植株并在T3获得转基因纯合株系。对T3转基因玉米和非转基因玉米对照以16.1%的PEG模拟水分胁迫进行抗旱性分析。结果表明,与对照相比,在水分胁迫处理下,转基因玉米株系叶片相对含水量提高了7.4%~19.8%,叶绿素含量提高了11.3%~106.9%,SOD活性上升45.8%~93.4%,而转基因玉米叶片的相对电导率下降了35.4%~58.1%,MDA含量下降了25.7%~50.4%,说明转OsSIK1基因玉米植株抗旱性得到提高,其中,5个转化株系与对照在抗旱性方面有显著差异,且生长状况明显优于对照。综上所述,研究最终获得5个转OsSIK1基因玉米株系,并证明导入水稻OsSIK1基因可以提高玉米植株的抗旱性。
OsSIK1基因;花粉介导转化;转基因玉米;抗旱性
我国是世界第二大玉米生产国,2015年玉米种植面积3 811万hm2,总产2.25亿t[1];同时,我国也是玉米的消费大国,其作为饲料、粮食和工业原料的需求量正在迅速增长,玉米消费量从2001年的1.14亿t上升至2014年的1.97亿t[2]。然而,在我国,干旱这个普遍存在的非生物胁迫原因却成为制约玉米产量的重要因素之一,旱灾面积约占全年成灾面积的50%[3],对国家玉米的安全生产威胁极大。因此,培育抗旱的玉米新品种十分重要。但玉米的抗旱性状是多基因控制的数量性状,生产上可利用的抗旱种质资源相对匮乏[4-5]。因此,玉米抗旱育种一直以来研究进展相对缓慢。
目前,随着植物抗旱生理生化和分子机制研究的不断突破,有关学者确定了一部分与抗旱有关的重要基因,通过转基因方法导入抗旱基因,已成为增强玉米抗旱性、获得抗旱新种质的重要途径[6]。Liu等[7]使玉米磷脂酰肌醇合成酶基因在玉米中进行过表达,结果表明,干旱处理后玉米体内的磷脂和半乳糖脂含量显著增加,使得转基因玉米的抗旱性显著高于非转基因对照;石薇等[8]将ZmPti1、ZmPti1-1、ZmCIPK2 这3种蛋白激酶基因植物表达载体分别导入玉米自交系吉444,结果表明,转基因植株与非转基因植株对干旱的敏感性不同,初步认为,转基因植株具有抗旱性,说明蛋白激酶能够提高玉米的耐旱性;He等[9]首次把来自细菌Aphanothecehalophytica的渗透调节物质和甜菜碱合成的2个关键酶基因ApGSMT2以及ApDMT2转入玉米,结果表明,在干旱条件下,转基因植株比非转基因植株糖类和游离氨基酸的积累量增加,显示出较强的抗旱性;杨政伟等[10]将源于小麦的氨基酸合成酶类的SAMS基因导入玉米,结果使其抗旱性增加;Zhang等[11]则把盐芥的转录因子TsCBF1基因转入玉米,结果表明,植株的耐旱性明显提高,单株籽粒产量明显高于对照。Nguyen等[12]通过研究发现,转HAV1基因的玉米植株,其叶片相对含水量高于非转基因植株,且能在15 d完全干旱的条件下存活。
有研究表明,类受体激酶在植物生长、发育和对环境因素的应激方面有重要作用。到目前为止,国内外在进行转类受体激酶基因提高农作物的耐旱性培育方面的报道还不是很多[13]。
本试验将水稻类受体激酶OsSIK1基因,通过山西省农业科学院生物技术研究中心发明的超声波辅助花粉介导转化的方法,对玉米自交系郑58进行遗传转化,并对其后代进行分子检测及抗旱性相关形态指标、生理生化指标的验证分析,最终获得了抗旱性增强的转基因新株系,旨在为提高玉米品种抗旱性提供科学理论依据。
1 材料和方法
1.1 植物转化受体材料及供体质粒
本试验植物转化受体材料为玉米自交系郑58,由山西省强盛种业有限公司提供。
供体质粒pBin438-OsSIK1的大肠杆菌菌株DH5α,由中国科学院遗传与发育生物学研究所陈受宜教授提供。目的基因OsSIK1从水稻中克隆,是一个RLK类基因[10],该质粒载体中包括2个35S启动子、1个NPTⅡ基因以及整合在限制性内切酶BamHⅠ和KpnⅠ酶切位点之间的 2 449 bp的OsSIK1基因cDNA片段。pBin438-OsSIK1质粒图谱如图1所示。
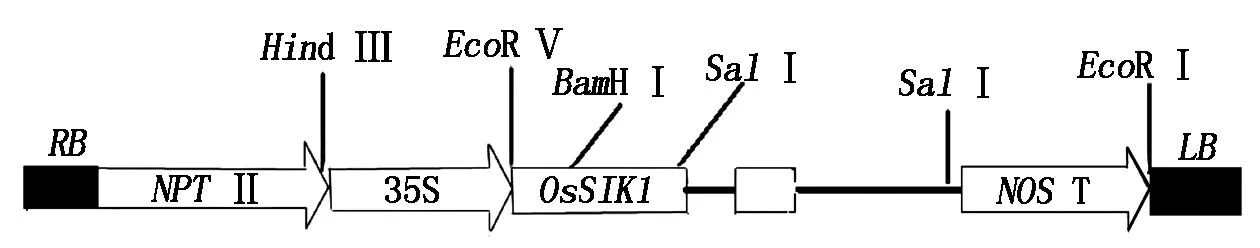
图1 植物表达载体pBin438-OsSIK1示意图谱
1.2 转化方法
转化方法采用花粉介导法:将供试玉米自交系郑58于5月上旬播种,待7月上、中旬开花抽丝前,将雌穗套袋隔离。盛花期当天收集10:00左右开花的玉米花粉,悬浮于15%~20%的蔗糖溶液中,超声波处理后,加入质粒DNA(质粒与花粉粒的混合比例大约为1∶20 000,m/m),再次进行超声波处理(超声波处理参数为:声强200 W,工作时间5 s,间隔10 s,工作次数6次)[14]。处理后的花粉略经沉淀后倒掉上清液,涂抹于套袋隔离的玉米花丝上,并将雌穗套袋,秋季收获T0种子。于翌年种植并进行分子检测。
1.3 转化株的筛选及分子检测
1.3.1 T0种子卡那霉素抗性筛选 将T0种子用清水浸泡24 h至种子萌动,换用350 mg/L卡那霉素溶液浸泡10 h,将处理过的种子播种于潮湿的苗床内,出芽后选择生长健壮的非白化苗(T1植株)移栽到温室,对该疑似转化株进行分子检测。
1.3.2 T1、T2、T3植株的DNA提取及PCR检测 T1、T2、T3株(T1植株PCR检测阳性植株自交种子于翌年播种获得T2植株,以此类推)生长到五-六叶期时,取其嫩叶提取总DNA(采用CTAB 法[15],参考《植物基因工程》[16]进行)。
PCR 扩增时以未转化玉米植株基因组DNA为阴性对照,以无菌水为空白对照,以质粒为阳性对照。基因序列设计特异引物,其序列如下(引物合成由上海生工生物工程公司完成)。
OsSIK1基因上游引物(5′-ATGGCGGCGGCGA GGGCGCC-3′);下游引物(5′-TCCCTGTGAGATTGT TTCCC-3′),扩增片段大小为701 bp。扩增采用20 μL体系:模板 DNA(50~200 ng/μL) 0.8 μL,10×PCR Buffer(含 Mg2+)2 μL,dNTP(10 mmol/L)0.4 μL,Primer Ⅰ(10 μmol/L)0.8 μL,Primer Ⅱ(10 μmol/L)0.8 μL,TaqDNA 聚合酶(5 U/μL)0.2 μL,ddH2O 15 μL。 PCR 扩增程序为95 ℃预变性5 min;94 ℃变性 30 s,59 ℃退火1 min,72 ℃延伸 2 min,35个循环;72 ℃终延伸10 min。PCR 产物于1.0%琼脂糖凝胶电泳检测分析。
1.3.3 转基因植株Southern Blotting检测 将PCR检测T3呈阳性植株的转OsSIK1基因玉米作为提取总DNA的待测样品,以非转基因玉米DNA为阴性对照、质粒DNA为阳性对照,用HindⅢ酶对检测样品进行酶切,再将酶切产物于1.2%琼脂糖凝胶上电泳分离后,进行Southern Blotting杂交检测。DNA 探针使用外源OsSIK1基因部分序列700 bp设计。(Southern Blotting试验按照Roche公司的DIG DNA Labeling and Detection Kit试剂盒的说明书进行。具体试验如DNA 变性、转移及杂交方法,杂交后用X-光片自显影曝光参照《分子克隆》[17]进行)。
1.4 转基因玉米后代的抗旱性指标测定
取T3分子检测阳性株系和未转化玉米自交系郑58玉米种子,种植到花盆中,浇Hoagland′s营养液培养至五-六叶期,选取长势基本一致的各转基因玉米株系和非转基因玉米各10株,将其根部浸泡在16.1% PEG-6000 Hoagland′s溶液中,处理24 h进行模拟水分胁迫。之后立即对处理后的各转化株系进行抗旱性生理生化指标的测定,测定指标包括:叶片相对含水量、叶绿素含量(采用丙酮浸提法测定)、SOD活性(采用氮蓝四唑光化还原法测定)、细胞膜透性(采用电导法测定)、MDA含量(采用硫代巴比妥酸法测定),具体试验步骤参考文献[18]的方法进行。
1.5 统计分析
对所取得的数据采用Microsoft Excel 2003及SPSS软件进行统计分析,显著水平为0.05。
2 结果与分析
2.1 花粉处理后转OsSIK1基因玉米T0种子的获得
经过超声波辅助花粉介导法处理,将OsSIK1基因导入受体材料玉米自交系郑58中,共转化572株玉米,由于处理后的花粉萌发率很低,每株获得的种子数1~10粒不等,最终共获得T0种子1 103 粒。
2.2 T0转化株卡那霉素抗性初筛结果
将T0种子进行卡那霉素溶液浸泡处理后,播种获得T1植株,淘汰白化苗,共获得抗性苗296株(图2),即为卡那霉素抗性植株。

图2 T1 植株卡那霉素筛选
2.3 T1、T2、T3转化植株PCR分子检测
将卡那霉素抗性初筛为阳性的幼苗移栽于大田,待幼苗长至5~6片叶时,全部取样,提取总DNA进行PCR分子检测,结果显示,初筛获得的抗性苗296株中只有26株检测结果为阳性,即转化株与质粒DNA阳性对照均扩增出701 bp的目的片段,同时阴性对照植株PCR未扩增出目的条带。初步确定,这26株转化植株含有水稻类受体激酶OsSIK1基因,转化率为2.4%(以收获的T0种子为基数)。
将通过PCR扩增呈阳性的T1转化株套袋自交收获种子,翌年按穗播种得到T2株系,每穗种植2行,每行25~28株,全部取样进行OsSIK1基因PCR检测,结果显示,T2的26个株系中有19个株系的玉米植株能够继续检测出目的基因片段。同时,在这19个株系中阳性植株检出率达45%~90%不等(图3),表明转入玉米植株的外源基因可以遗传给后代,并在这一代发生了基因分离(表1)。

M.DL2000 Marker;P.质粒;-.阴性对照;1~11.转化植株。
将T2植株同T1植株处理,获得了T3植株。在T3植株检测中,由于其均是T2的PCR 阳性后代,其群体中存在目的基因纯合型和杂合型2种基因型,但是表现为同样的显性性状,若将转化的外源基因以单拷贝形式整合到受体玉米基因组中,按孟德尔分离规律,其后代整个群体中阳性检出分离比率应为5∶1。在实际观察中,其结果与预期比率其中有11个株系与理论相拟合,如株系H2、H27、H29、H102等;有7个株系比率高于预期比率,如株系H20,有1个株系未检测出阳性植株,如H76(表1)。这可能与转化时整合的外源基因为多拷贝和假阳性有关[19]。
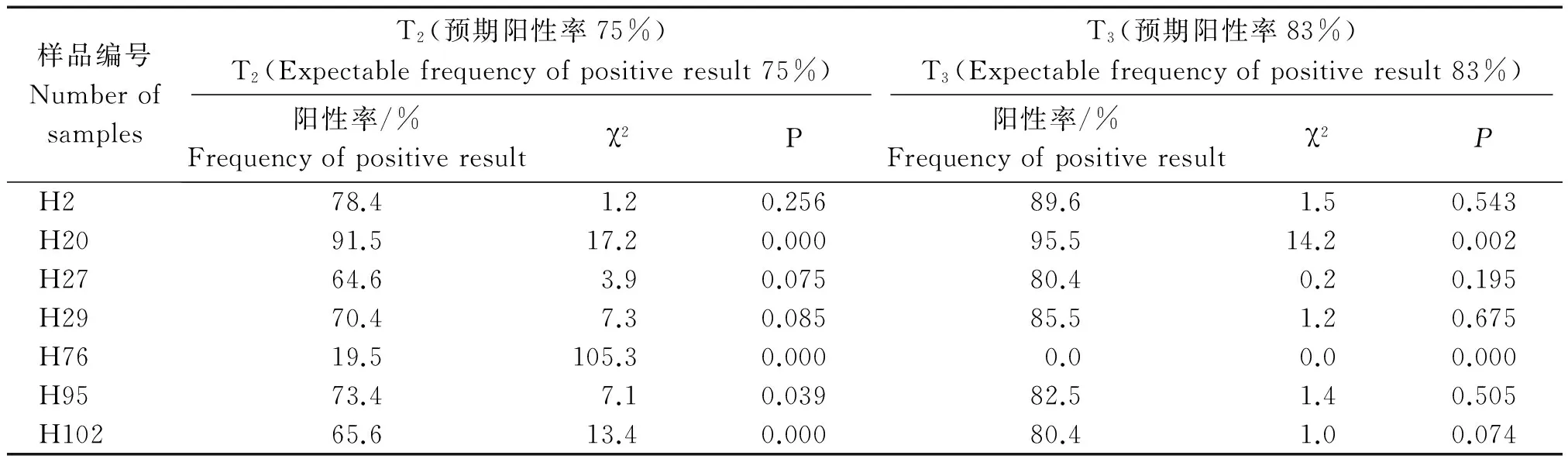
表1 转OsSIK1基因玉米植株T2和T3的PCR检测结果
2.4 T3转基因玉米植株Southern Blotting分析
对T3的PCR 阳性植株取样,进行Southern Blotting分析,杂交结果显示,上述株系转化株出现特异性杂交信号(图4),再次说明,外源基因已成功整合到部分受体玉米植株的染色体基因组上。但在T3的PCR检测为阳性的株系中,也有部分材料在Southern Blotting杂交检测中并未出现阳性条带,说明T3转基因植株中仍存在假阳性植株,如株系H76。
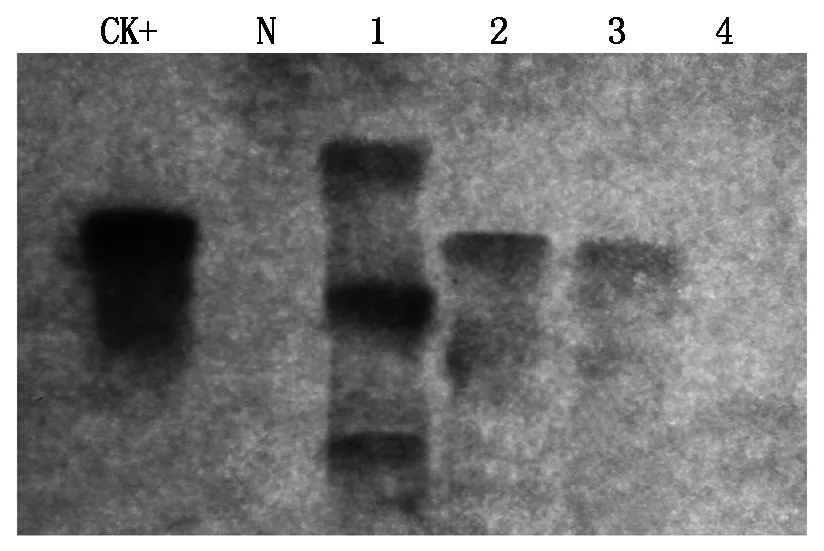
CK+.质粒;N.阴性对照;1~4.分别为T3株系
2.5 转OsSIK1基因玉米抗旱性分析
玉米叶片的相对含水量、叶绿素含量、SOD活性、细胞膜透性指标和MDA含量是反映玉米抗旱性的生理生化重要指标。试验中以16.1%的PEG-6000 Hoagland′s溶液对T3分子检测呈阳性株系和非转基因玉米植株进行24 h水分胁迫处理,之后立即对其进行抗旱性生理生化指标测定,试验结果发现,所获得的各T3转基因株系生理生化指标与非转基因对照均表现出明显差异。研究结合田间抗旱生理生化指标表现最终获得了5个转OsSIK1基因玉米株系,并证明导入水稻OsSIK1基因可以提高玉米植株的抗旱性。
由图5可知,在水分胁迫处理后,各转基因玉米株系的叶片相对含水量比非转基因玉米对照高7.4%~19.8%,且差异显著。表明转基因玉米植株受到水分胁迫的影响较小。

小写字母表示同样的处理在不同试材间
植物的光合作用在干旱胁迫下相关的酶合成受阻,导致其叶绿素减少,以致对植物生长发育产生严重影响。由图6可知,转OsSIK1基因玉米各株系的叶绿素含量平均值为1.15~2.11 mg/g,显著高于对照平均值1.02 mg/g,其中,叶绿素含量提高了11.3%~106.9%,转基因株系H102的叶绿素含量平均比对照高106.9%,且差异显著。表明OsSIK1基因转入玉米,在干旱胁迫下可以使光合系统受到较小的伤害。
超氧化物歧化酶(SOD)是生物体内重要的抗氧化酶,广泛分布于各种生物体内,其具有特殊的生理活性,是生物体内清除自由基的首要物质[20]。由图7可知,干旱胁迫下,各转化株系玉米的超氧化物歧化酶活性为255.38~338.75 U/g,非转基因株系为175.12 U/g,转化株比对照高45.8%~93.4%。说明在干旱胁迫下,OsSIK1基因的导入可使SOD活性大幅度提高。
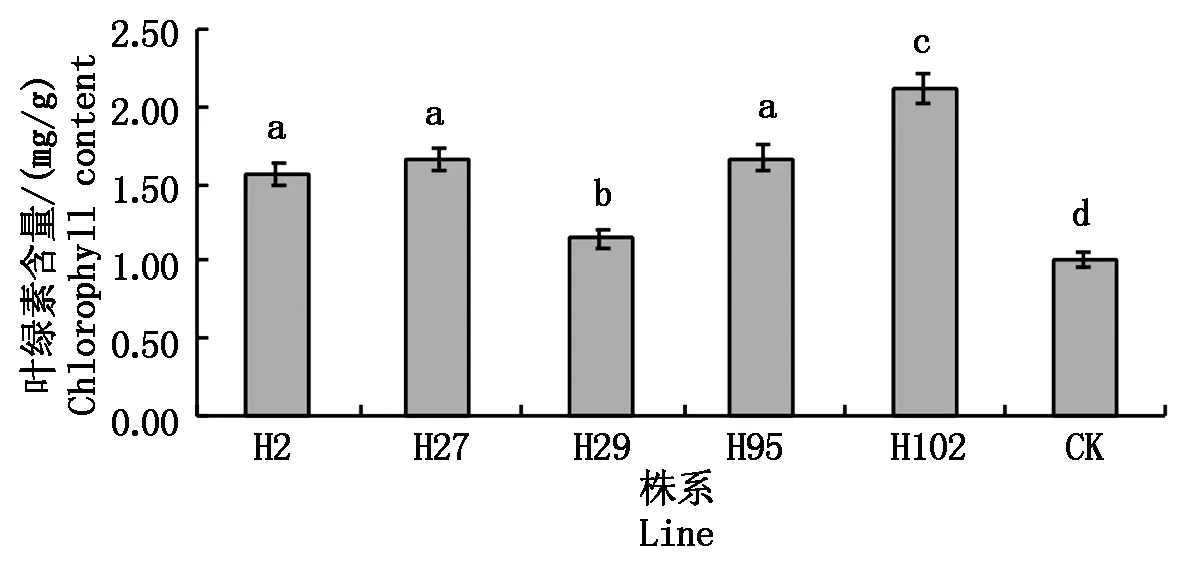
图6 模拟水分胁迫下叶绿素含量

图7 模拟水分胁迫下SOD含量
植物细胞膜透性指标也是反映玉米抗旱性生理生化的重要指标。由图8可知,当玉米植株受到干旱胁迫时,其细胞膜选择透性会降低,使得细胞内溶质外渗,引起组织浸泡液相对电导率变化。在本试验中,各玉米转化株系相对电导率的平均值为20%~31%,而对照相对电导率平均值为48%,转基因玉米叶片相对电导率下降了35.4%~58.1%,说明转化株抗逆性要远远好于对照。
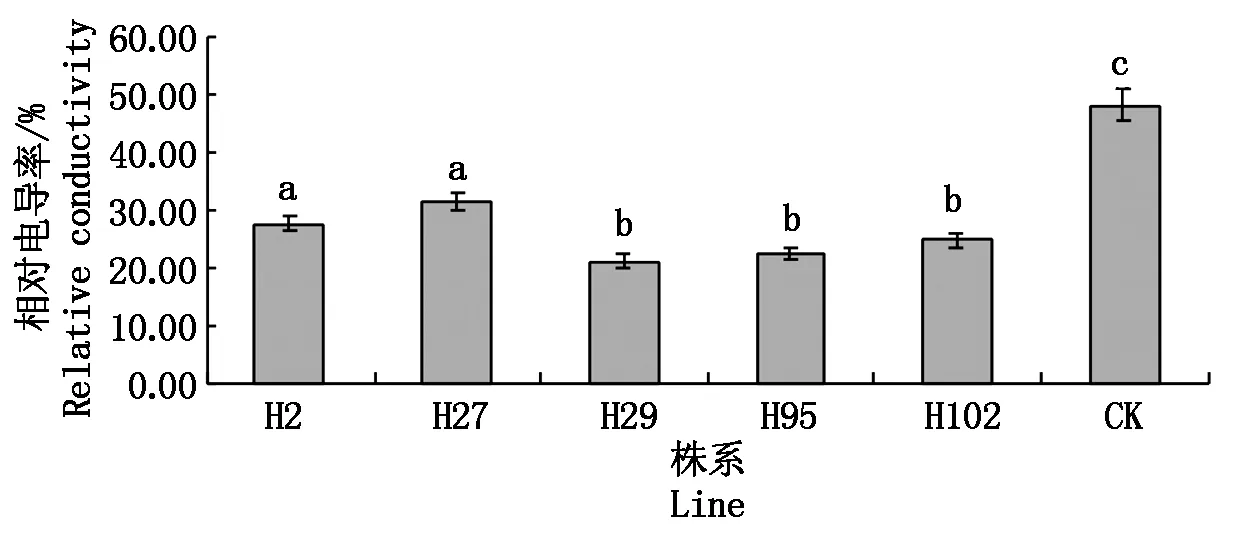
图8 模拟水分胁迫下叶片相对电导率
丙二醛(MDA)在植物中含量的高低,可有效地反映细胞膜脂过氧化程度和对逆境胁迫反应的强弱。由图9可知,经干旱胁迫后,各转基因株系的丙二醛含量平均值为22.4~33.6 μmol/g,与非转基因对照的平均值45.2 μmol/g间有显著性差异,各转基因株系MDA的含量下降了25.7%~50.4%,其中,转基因株系H102的丙二醛含量平均值仅为对照的49.6%,且差异显著。说明OsSIK1基因在玉米中表达的水稻类受体激酶对于细胞膜透性有一定的调节作用,使膜脂抗氧化能力提高。

图9 模拟水分胁迫下MDA含量
3 结论与讨论
本试验采用超声波辅助花粉介导法成功地将水稻类受体激酶OsSIK1基因导入玉米优良自交系郑58中,经过多代的分子检测及选择,获得了外源基因稳定遗传的高代材料,其生理生化指标的检测结果表明,其与原受体试材相比,抗旱性明显提高。原受体玉米自交系郑58作为玉米育种的核心基础材料,其植株形态和农艺性状稳定,具有较高的一般配合力。以郑58为母本、昌7-2 为父本的杂交种郑单958则以高产、稳产、多抗等突出的优点,被广泛推广种植[21]。因此,将水稻类受体激酶OsSIK1基因导入该玉米自交系,提高了品种抗旱性,使其种植范围更广、适应性更强,在玉米种质创新、新品种选育与应用和产生更大的经济社会效益等方面意义重大。
类受体激酶在植物生长、发育和对环境因素的应激方面具有重要作用。OsSIK1基因过量表达的转基因水稻植株则在干旱胁迫下表现出更好的耐盐和抗旱能力,且其过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性都有大幅度提高。本试验首次将来源于水稻的OsSIK1基因转入玉米,对其外源基因稳定遗传的高代材料进行生理生化检测时发现,转基因株系叶片的相对含水量比对照非转基因玉米高7.4%~19.8%,叶绿素含量平均比对照高11.3%~106.9%、SOD活性明显高于对照45.8%~93.4%,且差异显著;转基因玉米叶片相对电导率下降了35.4%~58.1%,MDA含量则比非转基因对照平均值MDA含量下降了25.7%~50.4%,且差异显著。试验结果很明确地暗示了来源于水稻的OsSIK1基因在玉米中依然可以通过激活抗氧化系统[12],增强玉米对于干旱胁迫的抗性。
外源基因能否在转基因玉米材料中稳定遗传对转基因玉米品种的选育至关重要。本试验在利用超声波介导花粉转化法转化水稻OsSIK1基因获得了转化株系,并经过分子检测与田间调查统计时分析发现,外源基因转入受体玉米自交系后,其在转基因玉米后代中的遗传大致分3种情况:第1种是外源基因以单拷贝方式插入受体玉米植株,外源基因基本以孟德尔定律在后代群体中分离,并在3~4代后获得基本纯合的株系;第2种是转化株在T2时分子检测其阳性率就远远高于常规分离比率,后经Southern Blotting杂交检测这种类型转化株外源基因多以多拷贝方式整合;第3种情况是T1的PCR分子检测呈阳性,但T2时为阴性,后经Southern Blotting杂交检测未发现外源基因条带,应确定为假阳性事件,在本试验中,该种事件发生占总转化事件的26%。说明用花粉介导法进行基因转化时,虽然转化率较高,但转化假阳率的发生概率也较高。
此外,外源基因在转基因植株中能否正常遗传表达,对转基因品种的选育具有重要意义。研究表明,对转基因作物而言,目的基因在其遗传和表达上存在不稳定现象,整合到植物基因组上的外源基因由于被修饰或整合位点不活跃而不表达[22];目的基因可能在植物细胞减数分裂时出现遗传分离或丢失。虽然没有进行Northern和Western杂交分析,但本试验在对转基因植株抗旱性生理生化检测时发现,不同来源的转化事件在生理生化指标检测时,存在其测量平均值与对照相比存在无差异或差异显著以及转化株彼此间差异显著等多种情况。这些情况的发生可能是由转基因植株中目的基因在转录和翻译水平上的差异及基因沉默等现象所造成。当然,转基因玉米的实际抗旱能力也不仅仅与抗旱生理生化指标相关,本试验只是对转基因玉米苗期生理生化指标进行了检测,也只是反映了该时期干旱胁迫发生时转OsSIK1基因玉米新品系与原受体玉米自交系在生理上应激反应确实有了改变,且差异显著。而转基因玉米抽雄期、灌浆期等生育期抗旱性鉴定及外源基因蛋白表达的测定则对于生产更具有指导意义[23],其还有待于进行进一步的深入研究。
[1] 国家统计局.国家统计局关于2015年粮食产量的公告[EB/OL].[ 2015-12-08].http://www.yumi.com.cn/html/2015/12/20151208165617184726.html.
[2] 韦正乙,张玉英,王云鹏,等.基因工程在玉米抗旱育种中的应用[J].玉米科学,2014,22(4):1-7.
[3] 徐 蕊,王启柏,张春庆,等.玉米自交系抗旱性评价指标体系的建立[J].中国农业科学,2009,42(1):72-84.
[4] 王小丽,杜建中,郝曜山,等.转BADH基因玉米植株的获得及其耐盐性分析[J].作物学报,2014,40(11):1973-1979.
[5] 王小丽,赵欣梅,张欢欢,等.盐胁迫对转TaNHX2基因玉米幼苗生长的影响[J].华北农学报,2014,29(2):165-169.
[6] 程继东,安玉麟,孙瑞芬,等.抗旱、耐盐基因类型及其机理的研究进展[J].华北农学报,2006,21(专辑):116-120.
[7] Liu X X,Zhai S M,Zhao Y J,et al.Over expression of the phosphatidylinositol synthase gene(ZmPIS) conferring drought stress tolerance by altering membrane lipid composition and increasing ABA synthesis in maize[J].Plant Cell and Environment,2013,36(5):1037-1055.
[8] 石 薇,黄丛林,张秀海,等.采用花粉管通道法将蛋白激酶基因导入玉米自交系的研究[J].华北农学报,2011,21(4):46-49.
[9] He C M,He Y,Liu Q,et al.Co-expression of genesApGSMT2 andApDMT2 for glycinebetaine synthesis in maize enhances the drought tolerance of plants [J].Mol Breeding,2013,31(3):559-573.
[10] 杨政伟,胡银岗,王 琨,等.转SAMS基因玉米自交系获得及抗旱性分析[J].西北植物学报,2011,31(6):1084-1089.
[11] Zhang S J,Li N,Gao F,et al.Over-expression ofTsCBF1 gene confers improved drought tolerance in transgenic maize [J].Molecular Breeding,2010,26:455-465.
[12] Nguyen T X,Sticklen M.BarleyHVA1 gene confers drought and salt tolerance in transgeic maize(ZeamayL.)[J].Advances in Crop Science and Technology,2013,1(1):105.
[13] Ouyang S Q.Receptor-like kinaseOsSIKlimproves drought and salt stress tolerance in rice(Oryzasativa) plants[J].The Plant Journal,2010,62(2):316-329.
[14] 张婷婷,王 铭,杜建中,等.花粉介导法将水稻OsSIK1 基因导入玉米自交系的研究[J].山西农业科学,2011,39(5):395-399.
[15] 杨慧珍,车 丽,任志强,等.抗草丁膦转基因玉米不同DNA 提取方法及PCR 检测[J].山西农业科学,2011,39(9):925-927,1028.
[16] 王关林,方宏筠.植物基因工程 [M].2 版.北京:科学出版社,2004:742-744.
[17] Huang P T,Wang H L,Zhou X W,et al.Molecular cloning:a laboratory manual [M].3rded.Beijing:Science Press,2002:212-219.
[18] 高俊凤.植物生理学实验指导[M].西安:世界地图出版社,2000.
[19] 郝曜山,孙 毅,杜建中,等.转双价抗虫基因BmkIT-Chitinase玉米株系的获得[J].分子植物育种,2012,10(2):147-154.
[20] 姚正培,孟 君,李 冠.玉米自交系芽苗期耐盐性的鉴定与筛选[J].华北农学报,2007,22(5):27-30.
[21] 王彦玲,卫文星,铁双贵,等.郑58和掖478玉米自交系基因组差异性分析[J].玉米科学,2010,18(3):57-60.
[22] 任小燕,杜建中,孙 毅.转AhCMO基因玉米后代的获得及耐盐性鉴定[J].分子植物育种,2013,11(3):332-338.
[23] 柳斌辉,张文英,栗雨勤.玉米耐盐性的鉴定评价[J].华北农学报,2012,27(S1):101-105.
Analysis on Obtaintion of Transgenic Maize Plants Transferred withOsSIK1 Gene and Their Drought Resistance
HAO Yaoshan,ZHANG Huanhuan,DU Jianzhong,WANG Yixue,SUN Yi
(Biotechnology Research Center,Shanxi Academy of Agriculture Sciences,Taiyuan 030031,China)
A Receptor-like kinase(RLK)gene,OsSIK1,plays important roles in drought stress-tolerance in rice,through the activation of the antioxidative system.To make maize plants have much more drought resistance genes and further to obtain drought tolerance maize germplasm.In this study,OsSIK1 gene of rice was transformated into maize inbred Zheng 58 plants by pollen-mediated method.First,transgenic plants in T1,T2and T3were detected by Kanamycin resistance screening,PCR and Southern Blotting,transgenic plants were obtained from T1and pure transgenic lines was obtained from T3.Next,drought resistance analysis to transgenic maize plants and non-transformation control plants were conducted under the condition of 16.1% PEG drought stress.The results showed that compared with non-transgenic plants,the seedling leaf relative water content,chlorophyll content and SOD activity of transgenic plants were increased by 7.4%-19.8%,11.3%-106.9% and 45.8%-93.4%,respectively;furthermore,the relative conductivity and MDA content were decreased by 35.4%-58.1%,and 25.7%-50.4%,respectively.All the physiological indexes under the drought stress proved that transgenicOsSIK1 gene improved the drought resistance of transgenic maize plants,further analysis found that there were significant differences on drought tolerance between 5 transformed lines and their control groups,and their performance of field were superior to that of non-transgenic maize seedlings.At last,5 transgenic maize inbred lines were obtained,which suggested that genetically modified maize has improved the drought resistance by introducing foreignOsSIK1 gene of rice.
OsSIK1 gene;Pollen mediated transformation;Transgenic maize;Drought resistance
2016-06-28
国家转基因生物新品种培育重大专项(2016ZX08003001-002-003);山西省农业科学院科技攻关项目(2013gg21)
郝曜山(1979-),男,山西清徐人,助理研究员,硕士,主要从事植物基因工程和作物遗传育种研究。
孙 毅(1953-),男,黑龙江哈尔滨人,研究员,博士,主要从事植物基因工程和分子生物学研究。
S511
A
1000-7091(2016)05-0001-06
10.7668/hbnxb.2016.05.001
