台盼蓝在全白或过熟期白内障手术连续环形撕囊前的应用观察
2016-11-16张纯涛贾俊
张纯涛,何 媛,贾俊
·临床报告·
台盼蓝在全白或过熟期白内障手术连续环形撕囊前的应用观察
张纯涛,何 媛,贾俊
Department of Ophthalmology,the Second Affiliated Hospital of Xi'an Medical University,the Clinic Medicine Research Center of Ophthalmic Diseases in Shaanxi,Project for Advanced Discipline in ShaanxiCollegesandUniversities,Xi'an710038,Shaanxi Province,China
Correspondenceto:Chun-TaoZhang.Departmentof Ophthalmology,the Second Affiliated Hospital of Xi'an Medical University,the Clinic Medicine Research Center of Ophthalmic Diseases in Shaanxi,Project for Advanced Discipline in Shaanxi Colleges and Universities,Xi'an 710038,Shaanxi Province,China. 17113490@qq.com
·AIM:To discuss the application of trypan blue before continuous curvilinear capsulorhexis(CCC)during the surgery for all white or over ripe stage cataract.
·METHODS:Forty-two eyes in 42 patients with cataract in all white or over ripe stage were selected.During the operations,0.2mL trypan blue(0.6mg/mL)was injected into the anterior chambers of all the 42 eyes.The anterior capsule was stained to light blue.Then the CCC was conducted.The density of corneal endothelial cells and the percentage of corneal endothelial cells with hexagonal shape were recorded before and at 1wk and 1mo after operations.Repetitive measure analysis of variance was used in analyzing the recording results at different time points.
·RESULTS:After stained with trypan blue,CCC was successfullyperformedinalltheoperations,which identified a successful basis for the following surgery. There was no significant difference in the density of corneal endothelial cells before and after operations,so astheproportionofcornealendothelialcellswith hexagonal shape.
·CONCLUSION:After stained with trypan blue,CCC is more feasible and safer for all white and other difficult-totreat cataract.
目的:探讨台盼蓝在全白或过熟期白内障手术连续环形撕囊前的应用观察。
方法:选取近3a在我院眼科住院手术的全白或过熟期白内障患者42例42眼,术中均于前房内注入0.6mg/mL台盼蓝约0.2mL,使前囊膜着色成淡淡的蓝色,后进行连续环形撕囊。记录术前,术后1wk,1mo不同时段角膜内皮细胞密度及角膜内皮六角形细胞比例,并对其进行重复测定方差分析。
结果:台盼蓝染色后,所有术眼均顺利完成连续环形撕囊,为下一步手术鉴定了成功的基础。术前,术后1wk,1mo不同时段记录的角膜内皮细胞密度和角膜内皮六角形细胞比例差异无统计学意义。
结论:对于过熟期及全白等难度较大的白内障手术,用台盼蓝染色前囊膜后,连续环形撕囊更易行、更安全。
台盼蓝;白内障;连续环形撕囊;角膜内皮细胞
引用:张纯涛,何媛,贾俊.台盼蓝在全白或过熟期白内障手术连续环形撕囊前的应用观察.国际眼科杂志2016;16(3):543-546
0 引言
连续环形撕囊(continuous curvilinear capsulorhexis,CCC)由Gimbel等[1]在1990年首次提出,使白内障手术得到了跨越式发展,但是对于全白及过熟期等难治性白内障患者,较难分清撕开囊膜瓣的走向及边界,这些因素均增加了白内障的手术难度。台盼蓝经过美国FDA认证已超过10a[2],它能够特异性地使晶状体前囊膜的基底膜着色,增加了撕囊步骤中前囊膜的可视性,而环形撕囊这个步骤是白内障手术成功与否至关重要的一步。角膜内皮细胞损伤后只能通过邻近细胞的变形扩张来代偿修复。因此记录白内障手术前后的角膜内皮细胞密度、六角形细胞比例,可以评估角膜内皮细胞的损伤程度。选取我院近3a全白或过熟期等难度较大的白内障患者术中使用台盼蓝染色前囊膜后进行连续环形撕囊患者,将不同时间段的角膜内皮细胞密度及六角形细胞比例进行比较分析,以评价角膜内皮细胞的损伤程度,报告如下。
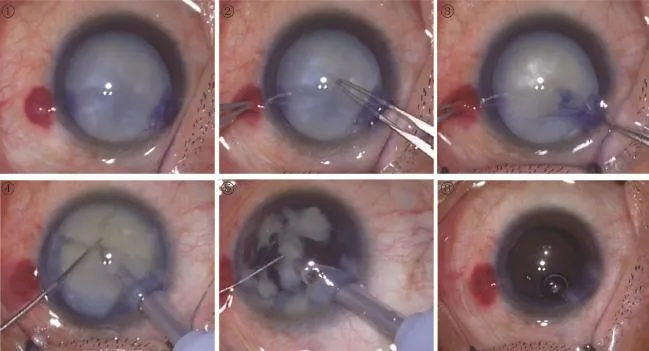
图1 台盼蓝将晶状体前囊膜着色成淡蓝色。 图2 开始连续环形撕囊。图3 连续环形撕囊结束。 图4 将晶状体核劈成数瓣以便于超声乳化。图5 超声乳化。 图6 植入人工晶状体。
1 对象和方法
1.1对象 选取2012-09/2015-09在我院眼科住院手术的全白或过熟期等难度较大的白内障患者42例42眼,男20例20眼,女22例22眼,年龄44~87(平均68)岁,所有患者均无眼底红光反射,均未合并眼部其他并发症,进行白内障超声乳化+人工晶状体植入术,术中应用台盼蓝染色晶状体前囊膜。因伦理学原因,所有白色或过熟期等难度较大的白内障患者均使用台盼蓝染色晶状体前囊膜,未设对照组;同时因过熟期白内障与膨胀期、成熟期白内障无可比性,亦未设对照组。
1.2方法 所有手术均由同一医生完成,使用同样的设备,手术步骤基本相同。白内障超声乳化+人工晶状体植入术手术步骤:(1)切口:用15°刀做透明角膜辅助切口。(2)染色:由辅助切口向前房内注入约0.2mL原包装无菌、非炎性、无热原0.6mg/mL台盼蓝,使前囊膜着色成淡淡的蓝色(图1)。(3)由辅助切口向前房注入黏弹剂,以稳定前房,加深前房深度,保护角膜内皮细胞。(4)用3.2mm前房穿刺刀做透明角膜板层主切口。(5)连续环形撕囊术(图2、3)。(6)水分离。(7)超声乳化:用超乳头释放的能量将晶状体核逐块击碎成乳糜状,并吸出(图4、5)。(8)清除皮质。(9)植入人工晶状体(图6)。分别于术前,术后1wk,1mo记录所有患者的视力、眼压、角膜内皮细胞密度及六角形细胞比例。
统计学分析:采用SPSS 13.0软件使用重复测定方差分析对角膜内皮细胞密度、六角形细胞比例在术前,术后1wk,1mo进行比较,以P<0.05为差异有统计学意义。
表1 手术前后眼压和角膜内皮细胞及角膜内皮六角形细胞比例情况比较±s
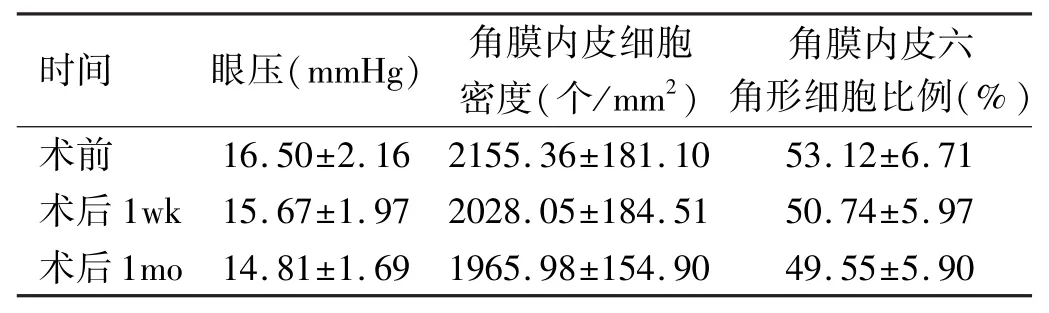
表1 手术前后眼压和角膜内皮细胞及角膜内皮六角形细胞比例情况比较±s
注:该表中所记录眼压值为非接触式眼压计测量出的三个眼压实值中的最小数;角膜内皮细胞密度及六角形细胞比例为角膜内皮细胞计数仪测量得出的具体值。
时间眼压(mmHg)角膜内皮细胞密度(个/mm2)角膜内皮六角形细胞比例(%)术前1mo14.81±1.691965.98±154.9049.55±5.90 16.50±2.162155.36±181.1053.12±6.71术后1wk15.67±1.972028.05±184.5150.74±5.97术后
2 结果
2.1术后视力恢复情况 所有患者术前视力≤0.3,术后视力均有不同程度提高,术后矫正视力≥0.8者26眼(62%);>0.3~<0.8者14眼(33%);≤0.3者2眼(5%),其中1眼合并干性年龄相关性黄斑变性,另1眼术后1mo时合并特发性黄斑板层裂孔。
2.2术后角膜恢复情况 术后1d角膜明显水肿患者4眼,角膜轻度水肿患者13眼,给予高糖滴眼液(配法:50%葡萄糖注射液3mL+维生素C注射液2mL+肌苷注射液1mL+三磷酸腺苷二钠注射液2mL)点术眼,每10min 1次,术后4d角膜水肿消失。所有患者术后前房均未见纤维素性渗出物,术后1d前房闪辉(+)38眼,前房闪辉(++)4眼,该4眼晶状体核硬,故超声能量大,时间长,通过妥布霉素地塞米松滴眼液、双氯芬酸钠滴眼液、左氧氟沙星滴眼液局部点眼,4次/d,术后7d,所有患者的前房闪辉(-)。术前,术后1wk,1mo不同时段的眼压及角膜内皮细胞情况比较,见表1。
手术前后角膜内皮细胞密度比较:对患者实施白内障手术前后的角膜内皮细胞密度进行重复测定方差分析,术前、术后1wk与术后1mo不同时段角膜内皮细胞密度进行比较,差异无统计学差异(F=67.315,P=0.737),表明白内障术中使用台盼蓝染色晶状体前囊膜,对角膜内皮细胞密度无明显损伤。
对患者实施白内障手术前后的角膜内皮细胞六角形细胞比例进行重复测定方差分析,结果显示:术前、术后1wk与术后1mo不同时段角膜内皮细胞六角形细胞比例进行比较,差异无统计学差异(F=134.162,P=0.667),表明白内障术中使用台盼蓝染色晶状体前囊膜,对角膜内皮细胞六角形细胞比例无明显损伤。
2.3术后不良反应 所有患者均术中Ⅰ期植入人工晶状体,其中41眼术中将人工晶状体植入囊袋内,仅1眼因术中囊袋不稳将人工晶状体植入睫状沟,注入少量卡巴胆碱缩瞳,见瞳孔圆,嘱患者术后平卧位休息。术后1mo复查时所有患者均无不良反应发生。
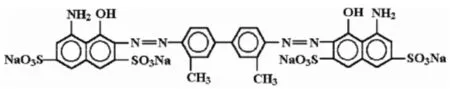
图7 台盼蓝的结构式。
3 讨论
连续环形撕囊是白内障手术成功与否至关重要的一步。全白或过熟期等难度较大白内障缺乏眼底红光反射,晶状体皮质发白,部分患者晶状体皮质液化,在环形撕囊时较难分清撕开囊膜瓣的走向及边界,因此晶状体前囊膜边缘的可视性对于连续环形撕囊及后面的手术步骤非常重要。
已有的晶状体前囊膜染色剂包括荧光素钠、亚甲蓝、龙胆紫、台盼蓝、吲哚菁绿等。动物实验表明低浓度的吲哚菁绿即可损伤角膜内皮细胞,并产生毒性[3]。龙胆紫和亚甲蓝可导致角膜水肿和内皮失代偿[4-5]。早在1998年Fritz公布在成熟的白内障病例中有使用荧光素钠染色晶状体前囊膜的报告,不幸的是小分子的荧光素钠并不能局限于前房而是扩散到玻璃体[6]。Melles等[4]采用标准的毒性研究培养成纤维细胞,以评估四个不同的染色剂:台盼蓝、吲哚菁绿、亚甲基和龙胆紫,结果表明台盼蓝具有最低细胞毒性[7-11]。
台盼蓝是一种双偶氮染料,分子量960.8D,它是一个对称分子,经验式是:C34H23N6O14S4Na4(图7),为水溶性的,含有酸基,其pH值适合前房内使用[12]。
因为台盼蓝属于双偶氮染料,更容易与水合不佳组织结合,不易与水合良好组织结合[13]。与脱细胞基底膜相比较,由晶状体纤维组成的晶状体皮质含有更多水分,这将解释为什么基底膜着色,而晶状体皮质无显著染色[14],且其分子量较大,不会渗漏到玻璃体腔。台盼蓝在晶状体前囊膜的染色大多集中在邻近上皮细胞的基底膜层[2],晶状体皮质不着色,不染色正常的角膜内皮细胞,降低了术中角膜内皮损伤的风险。Chung等[11]报道1.0%浓度的台盼蓝对角膜内皮细胞计数、眼内压及眼前节炎症无损伤。
Melles等[4]于1999年首先在白内障超声乳化术中应用台盼蓝染色晶状体前囊膜,并获得较成功的临床效果。术后长时间随访发现术中使用台盼蓝安全、无毒性[15-17]。许多前瞻性、对比研究发现术中使用台盼蓝染色组与不染色组比较,角膜内皮细胞形态及计数无统计学差异[17-19]。Portes等[20]使用透射电镜检查发现台盼蓝染色组与未染色组比较,晶状体前囊膜厚度无统计学差异。台盼蓝可使猪晶状体囊膜染色成淡蓝色,其染色强度在1h内无明显减弱[21],从而保证了在临床数秒的环形撕囊操作中囊膜不褪色。Wollensak等[22]还发现台盼蓝染色后晶状体前囊膜的弹性减小,韧性增加[23],从生物力学角度而言,撕囊变得更加容易。Ryan等[24]用机械化拉伸强度模型进行实验研究,发现与23只对照眼比较,10只台盼蓝染色眼晶状体前囊膜的抗扯强度无减弱。
选取近3a在我院眼科住院手术的全白及过熟期等难度较大的白内障患者42例42眼,因晶状体皮质发白或全混浊,使得眼底红光反射不清或完全看不到,部分患者晶状体皮质融解,手术难度大,术中极可能损伤角膜内皮细胞。由于台盼蓝的安全、易行、使模糊目标组织可见,术中使用台盼蓝染色晶状体前囊膜后,见图2、3,可以较清晰分辨撕开囊膜瓣的走向及边界,医生在完全可视下手术,提高了完全性,为下一步手术操作鉴定了成功的基础;所有术眼均顺利完成连续环形撕囊,见图4、5,并成功完成手术。
角膜作为屈光系统中最重要的组织,其透明性的维持很大程度上取决于角膜内皮细胞的功能。白内障手术最容易损伤角膜内皮细胞,角膜内皮细胞为单层六角形细胞,其屏障和主动液泵功能对于角膜保持正常厚度和透明性极其重要,其密度随年龄增大而减低,眼球手术、外伤、药物毒性、炎症、高眼压和其他病理性刺激均可使角膜内皮细胞大量死亡,而死亡后不能再生,只能通过邻近细胞的变形扩张来代偿完成,即通过增大或变形细胞、减低细胞密度来代偿完成,细胞数量不增加。因此通过比较分析术前、术后角膜内皮细胞密度和六角形细胞比例情况,可以评估角膜内皮细胞的损伤情况。
因此,我们在白内障术中使用台盼蓝染色晶状体前囊膜,将术前、术后1wk、1mo不同时段角膜内皮细胞密度和角膜内皮细胞六角形细胞比例进行比较无统计学差异。表明白内障术中使用台盼蓝染色晶状体前囊膜,对角膜内皮细胞密度、六角形细胞比例无明显损伤,即台盼蓝对角膜内皮细胞无明显损伤,具有安全性。我们的临床实践进一步表明,白内障术中使用台盼蓝染色晶状体前囊膜后,连续环形撕囊更易行更安全,可扩展其临床应用。
1 Gimbel HV,Neuhann T.Development,advantages,and methods of continuous circular capsulorhexis technique.J Cataract Refract Surg 1990;16(1):31-37
2 Singh AJ,Sarodia UA,Brown L,et al.A histological analysis of lens capsulesstainedwithtrypanblueforcapsulorrhexisin phacoemulsification cataract surgery.Eye 2003;17(5):567-570
3Chang YS,Tseng SY,Tseng SH,et al.Comparison of dyes for cataract surgery.Part 1:cytotoxicity to corneal endothelial cells in a rabbit model. J Cataract Refract Surg 2005;31(4):792-798
4Melles GRJ,Waard PWTD,Pameyer JH,et al.Trypan blue capsulestaining to visualize the capsulorhexis in cataract surgery.J Cataract Refrect Surg 1999;25(1):7-9
5 Horiguchi M,Miyake K,Ohta I,et al.Staining of the lens capsule for circular continuous capsulorhexis in eyes with white cataract.Arch Ophthalmol 1998;116(4):535-537
6 Fritz W.Fluorescein blue light-assisted capsulorhexis for mature or hypermature cataract.J Cataract Refract Surg 1998;24(1):19-20
7 Chang YS,Tseng SY,Tseng SH,et al.Comparison of dyes for cataract surgery.Part 1:cytotoxicity to corneal endothelial cells in a rabbit model.J Cataract Refract Surg 2005;31(4):792-798
8 Chang YS,Tseng SY,Tseng SH.Comparison of dyes for cataract surgery.Part 2:efficacy of capsule staining in a rabbit model.J Cataract Refract Surg 2005;31(4):799-804
9 Satofuka S,Nakamura K,Negishi K,et al.Time course of lens capsule staining using trypan blue and indocyanine green;in vitro study in porcine eyes.J Cataract Refract Surg 2004;30(8):1751-1754
10 Yetik H,Devranoglu K,Ozkan S.Determining the lowest trypan blue concentration that satisfactorily stains the anterior capsule.J Cataract Refract Surg 2002;28(6):988-991
11 Chung CF,Liang CC,Lai JSM,et al.Safety of trypan blue 1%and indocyanine green 0.5%in assisting visualization of anterior capsule during phacoemulsification in mature cataract.J Cataract Refract Surg 2005;31(5):938-942
12 Skowronek M,Roterman I,Konieczny L,et al.The conformational characteristics of congo red,evans blue and trypan blue.Comput Chem 2000;24(3):429-450
13 Bancroft JD,Stevens A.4th edn.Churchill Livingstone:Edinburgh 1996:81-98
14 Bron AJ,Tripathi RC,Tripathi BJ.The lens and zonules.London: Chapman&Hall Medical 1997:411-442
15 Jhanji V,Chan E,Das S,et al.Trypan blue dye for anterior segment surgeries.Eye(Lond)2011;25(9):1113-1120
16 Veekeneer M,Van Overdam K,Monzer J.Ocular toxicity study of trypan blue injected into the vitreous cavity of rabbit eyes.Graefes Arch Clin Exp Ophthalmol 2001;239(9):698-704
17 Norn MS.Per operative trypan blue vital staining of corneal endothelium.Eight years'follow up.Acta Ophthalmol(Copenh)1980;58(4):550-555
18 Van Dooren BT,Waard PW,Poort-van Nouhuys H,et al,Melles GR.Corneal endothelial cell density after trypan blue capsule staining in cataract surgery[letter].J Cataract Refract Surg 2002;28(4):574-575
19 Stocker FW,King EH,Lucas DO,et al.Clinical test for evaluating donor corneas.Arch Ophthalmol 1970;84(7):2-7
20 Portes AL,Almeida AC,Allodi S,et al.Trypan blue staining for capsulorhexis:ultrastructural effect on lens epithelial cells and capsules. J Cataract Refract Surg 2010;36(4):582-587
21 Satofuka S,Nakamura K,Negishi K.Time course of lens capsule staining using trypan blue and indocyanine green:in vitro study in porcine eyes.J Cataract Refract Surg 2004;30(8):1751-1754
22 Wollensak G,Sporl E,Pham DT.Biomechanical changes in the anterior lens capsule after trypan blue staining.J Cataract Refract Surg 2004;30(7):1526-1530
23 Dick HB,Aliyeva SE,Hengerer F.Effect of trypan blue on the elasticity of the human anterior lens capsule.J Cataract Refract Surg 2008;34(8):1367-1373
24 Ryan J,Liliana W,Stan F,et al.Comparison of capsulorhexis resistance to tearing with and without trypan blue dye using a mechanized tensile strength model.J Cataract Refract Surg 2012,38(3):507-512
Applicationoftrypanbluebefore continuous curvilinear capsulorhexis in the surgeryforallwhiteoroverripe stage cataract
Chun-Tao Zhang,Yuan He,Jun Jia
2015-10-29 Accepted:2016-02-16
trypan blue;cataract;continuous curvilinear capsulorhexis;corneal endothelial cells
(710038)中国陕西省西安市,西安医学院第二附属医院眼科陕西省眼科疾病临床医学研究中心陕西省高等学校优势学科项目资助
张纯涛,硕士研究生,主治医师,研究方向:眼表疾病、白内障、青光眼。
张纯涛.17113490@qq.com
2015-10-29
2016-02-16
Zhang CT,He Y,Jia J.Application of trypan blue before continuous curvilinear capsulorhexis in the surgery for all white or over ripe stage cataract.Guoji Yanke Zazhi(Int Eye Sci)2016;16(3):543-546
10.3980/j.issn.1672-5123.2016.3.39
