BMP-2在C57BL/6小鼠形觉剥夺性近视眼巩膜中表达的变化
2016-11-16姜丽萍刘桂波王双双
张 玉,杨 先,姜丽萍,刘桂波,王双双
·实验论著·
BMP-2在C57BL/6小鼠形觉剥夺性近视眼巩膜中表达的变化
张 玉,杨 先,姜丽萍,刘桂波,王双双
Department of Ophthalmology,the Affiliated Hospital of Qingdao University,Qingdao 266003,Shangdong Province,China
Correspondence to:Xian Yang.Department of Ophthalmology,the AffiliatedHospitalofQingdaoUniversity,Qingdao266003,Shangdong Province,China.yangxian_zhao@126.com
·AIM:Toidentifythepresencechangeofbone morphogenetic protein-2(BMP-2)in sclera of form deprivation myopic(FDM)eyes in C57BL/6 mice and to investigate its role in sclera remodeling.
·METHODS:A total of 64 C57BL/6 mice which were 3~4wk were randomized into FDM-21d group(n=16),a normal control group(n=16);FDM-28d group(n=16)and a normal control group(n=16).FDM models were established by sutured 0.5mL PCR plastic caps to the skin surrounding the right eye for 21 days and 28 days in experimental group,and the fellow eyes served as the self-control eyes.Diopter and axial length of all eyes was tested by retinoscopy optometry and vernier calipers before and after the form deprivation.As the models established,the sclera of the mice were obtained and hematoxylin and eosin(H-E)staining were used for observingthemorphologicalchangeinthetissue. Immunohistochemicalstainingandfluorescence quantificational real-timepolymerasechainreaction(QRT-PCR)were applied to investigate the expression of BMP-2 protein and mRNA.
·RESULTS:After 21 and 28d,the diopter of the deprived eyes was-1.60±1.03D and-3.10±1.19D and the axial length wasprolongedby 16±12μmand 21±13μm respectively.The differences were statistically significant,compared to self-control eyes and to normal control groups(P<0.05).After stained by H-E,the sclera from the deprived eyes became thinner and the sequence of collagenous fiberdisappeared.Theresultsfromthe immunohistochemical staining and QRT-PCR showed that mRNA and protein of BMP-2 decreased significantly,and the differences were statistically significant,compared to self-control eyes and to normal control groups(P<0.05). ·CONCLUSION:The expressions of the BMP-2 in sclera down-regulate significantly in FDM eyes,which suggests that BMP-2mayplayanimportantroleinsclera remodeling during myopia development.
目的:观察C57BL/6小鼠形觉剥夺性近视(formdeprivation myopia,FDM)巩膜中BMP-2表达的变化,研究其在巩膜重塑中发挥的作用。
方法:选择3~4周龄的C57BL/6小鼠64只,以随机数字表法随机分为形觉剥夺21d组(16只)、同龄对照组(16只);形觉剥夺28d组(16只)、同龄对照组(16只)。形觉剥夺前后对所有小鼠进行带状光剪影验光检测小鼠眼球的屈光状态,游标卡尺测量小鼠的眼轴长度,造模后分别于21d和28d取小鼠的巩膜组织,苏木素-伊红(HE)染色观察小鼠巩膜组织形态学变化,用荧光定量RT-PCR和免疫组织化学检测各组小鼠巩膜BMP-2 mRNA和其蛋白的表达水平。
结果:小鼠形觉剥夺21d和28d后,剥夺眼分别诱导出-1.60±1.03D和-3.10±1.19D的相对近视,眼轴分别拉长16±12μm和21±13μm,与自身对照组和正常对照相比较,差异有统计学意义(P<0.05)。HE染色行巩膜形态学观察,可观察到剥夺眼巩膜变薄,胶原纤维排列紊乱。荧光定量RT-PCR和免疫组织化学结果显示实验眼BMP-2 mRNA和蛋白的表达明显下调,与自身对照和正常对照组相比差异有统计学意义(P<0.05)。
结论:C57BL/6小鼠形觉剥夺眼巩膜中BMP-2呈下调趋势,BMP-2可能参与了近视发展过程中的巩膜重塑作用,其具体机制有待进一步研究。
C57BL/6小鼠;骨形态发生蛋白;形觉剥夺性近视;巩膜
引用:张玉,杨先,姜丽萍,等.BMP-2在C57BL/6小鼠形觉剥夺性近视眼巩膜中表达的变化.国际眼科杂志2016;16(3): 423-427
0 引言
目前普遍认为,近视的发生受遗传和环境等多因素的综合影响[1],但确切的发病机制仍不清楚。在近视的发展过程中,巩膜胶原聚集减少,降解增加,这些改变导致巩膜干重的下降,以及巩膜后极部胶原纤维平均直径变小,胶原纤维分布紊乱[2]。关于巩膜细胞外基质(extracellar matrix,ECM)的改变已经有了相关的研究,McBrien[3]发现BMP/TGF-β信号通路有调控巩膜ECM的作用。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是转化生长因子-β(transforming growth factor-β,TGF-β)超家族中的一员。BMPs超家族在细胞的许多功能当中发挥着重要的调节作用,其与多种组织的形态发育和细胞外基质重塑相关,被称为“体形态发生蛋白”。研究证明,BMP-2可以促进体外培养的人类巩膜成纤维细胞(human scleral fibroblasts,HSFs)中ECM的合成[4]。王青等[5]发现豚鼠近视模型中,14d后近视眼巩膜中BMP-2的表达明显下降。Liu等[6]发现BMP2K基因异常与高度近视密切相关,说明BMP-2与近视的发生发展密切相关。本文通过建立C57BL/6小鼠形觉剥夺性近视模型,研究BMP-2在巩膜中的变化,探讨其在巩膜重塑中的作用。
1 材料和方法
1.1材料
1.1.1实验动物 选用3~4周龄C57BL/6雄性小鼠64只(购自常州卡文斯实验动物有限公司,由青岛大学医学院实验中心饲养),体质量10~13g,排除患有眼疾及双眼屈光参差<1.5D的小鼠,每笼4只,室温控制在20℃~25℃,光照/黑暗周期为14h/10h,室内控制照明调节在250~350Lu。给予小鼠专用饲料,并每日给予新鲜蔬菜水果,自由饮水,动物的饲养及处理经青岛大学医学院动物伦理委员会审批通过。
1.1.2主要试剂与仪器 带状光剪影镜(苏州六六)、兔抗鼠多克隆抗体BMP-2(BA0585-1)购于武汉博奥森公司,SP试剂盒购于北京中杉金桥生物技术有限公司,Ver.3.0型RNA PCR试剂盒(100次量)购于大连宝生物试剂公司,SYBY(日本,TaKaRa)、实时荧光定量PCR仪(德国Eppendorf),PCR引物由大连宝生物工程有限公司合成。
1.2方法
1.2.1小鼠形觉剥夺性近视模型的建立 64只3~4周龄雄性近交系C57BL/6小鼠,随机分为形觉剥夺组(n=32)和正常对照组(n=32):(1)形觉剥夺组选取右眼为剥夺眼,佩戴0.5mL EP管盖子,左眼作为自身对照眼,依据形觉剥夺时间21d、28d不同时间建立近视动物模型。(2)正常对照组,在颈部佩戴塑料项圈,双眼不做任何处理,年龄与实验组相同。小鼠用5%枸橼酸芬太尼注射液以4mg/kg麻醉后,将0.5mL EP管盖子用5-0缝线缝4~6针在小鼠眼周,被遮眼能瞬目,不压迫眼球,颈部佩戴项圈,防止小鼠将眼罩抓脱。每天用棉签擦拭小鼠对侧眼及眼周,防止感染,每天3次检查小鼠眼罩是否掉针,脱落,以保证小鼠被遮眼一直处于被遮状态。诱导21d和28d后,分别检查所有动物的屈光度和眼轴长度,并取巩膜组织进行检测。
1.2.2屈光度及眼轴长度的测量 小鼠在清醒的状态下,用复方托吡卡胺散瞳,每5min 1次,连续3次后,验光由有经验的验光师在暗室条件下,手持带状光检影镜检测屈光度,每只小鼠测3次,取平均值并记录屈光值(D)。脱颈法处死小鼠后,迅速取出眼球,在显微镜下去除多余筋膜及肌肉组织,用生理盐水冲洗后,用电子游标卡尺测量眼轴的长度(角膜的前顶点到眼球后极部之间的直线距离),精确到0.01mm,测量3次后取平均值并记录。
1.2.3标本的处理 所有操作均在显微镜观察下在冰床上进行,取出眼球后,用眼科镊和眼科剪剥离眼球周围筋膜,沿角膜缘将眼球剪开,去除眼球内的玻璃体,并将视网膜和脉络膜分离,取巩膜组织,随机各组取6只小鼠眼球置于4%甲醛固定48h,行常规HE染色及免疫组织化学染色,各组另10只小鼠眼球的巩膜组织置于500mL Trizolz液中,并立即震荡充分裂解后,保存于-80℃以提取RNA,进行实时荧光定量PCR反应。
1.2.4HE染色观察小鼠巩膜组织形态学变化和免疫组织化学染色法检测BMP-2蛋白的表达 在各个实验组中取6只小鼠眼球,予以常规石蜡包埋,所有组织块于后极部以3μm的厚度连续切片4张,一张用于苏木素-伊红(HE)染色,1张用做阴性对照,2张用于免疫组织化学染色:(1)石蜡切片置于60℃温箱中烤片过夜;(2)行常规梯度酒精脱蜡至水;(3)高压抗原修复:0.01mol/L柠檬钠溶液500mL于高压锅中煮沸后,放入石蜡切片,中火至冒气,再改为小火2min,然后冷却至室温,蒸馏水冲洗3遍;(4)3%H2O2室温孵育15min,蒸馏水冲洗,PBS漂洗3min ×3次;(5)正常山羊血清工作液封闭,室温孵育15min,倾去血清,勿洗,滴加1∶100稀释兔抗鼠多克隆抗体BMP-2单克隆抗体工作液,37℃湿盒孵育2h;(6)滴加生物素化二抗工作液,室温孵育15min,PBS漂洗5min×3次;(7)滴加PV-6001工作液,室温孵育15min,PBS漂洗5min×3次;(8)DAB显色5min,在显微镜下掌握染色程度,自来水冲洗终止染色;苏木素复染细胞核10s,1%盐酸酒精分化脱色,自来水洗1遍;(9)60℃温箱中烤干后,树胶封固,显微镜下观察、拍片。光镜下分别观察各组标本中BMP-2的显色程度、分布范围及密度,以细胞核或细胞浆然染成棕黄色为阳性。使用Image-Pro Plus 6.0软件分析检测图像,用平均光密度值表示BMP-2的相对蛋白表达量。以PBS代替一抗为阴性对照。
1.2.5实时荧光定量PCR检测小鼠巩膜中BMP-2 mRNA表达 提取总RNA:从-80℃冰箱内取出冻存的小鼠巩膜组织,用Trizol法提取总RNA。目的基因应用primer design基因分析软件设计引物,并由TaKaRa生物公司合成。BMP-2上下游引物分别为:5'-TGACTGGATCGTGGCACCTC-3',5'-CAGAGTCTGCACTATGGCATGGTTA-3',产物片段长为156bp;内参β-action上、下游引物分别为:5'-GATTACTGCTCTGGCTCCTAGC-3',5'-GACTCATCGTACTCCTGCTTGC-3',产物长度301bp。常规提取总RNA,采用紫外分光光度计分别测定光密度OD260与OD280,OD260与OD280比值在1.8~2.0之间,表明提取的RNA蛋白污染少,纯度较好。逆转录获得cDNA,以cDNA为模板扩增BMP-2目的基因,Syber Green荧光定量PCR检测:PCR热循环参数为95℃30s,95℃5s,然后第二步反应60℃30s,95℃15s,进行40个循环,于每个循环的第二步(95℃15s)收集荧光信号。扩增结束后,进入分析结果界面,以β-actin作为内参照基因,与对照组相比较得到目的基因的相对定量值RQ(RQ=2-△△Ct)。
统计学分析:应用统计学SPSS 17.0软件对结果进行统计学分析,计量资料以±s表示,实验眼与自身对照眼相比采用配对样本t检验,实验眼及自身对照眼与正常对照组相比采用独立样本t检验。以P<0.05为差异有统计学意义。
表1 各组小鼠FDM后屈光度和眼轴长度的变化±s

表1 各组小鼠FDM后屈光度和眼轴长度的变化±s
注:aP<0.01,bP<0.01 vs自身对照眼;cP<0.05,eP<0.05 vs正常对照眼。
时间组别眼数屈光度(D)眼轴长度(mm)FDM21d正常对照眼163.04±0.533.134±0.032自身对照眼163.01±1.263.137±0.028实验眼161.45±1.15a,c3.155±0.032a,cFDM28d正常对照眼162.48±0.673.241±0.041自身对照眼162.45±0.543.243±0.038实验眼16-0.57±0.28b,e3.271±0.041b,e
表2 正常对照组与FDM自身对照眼及实验眼小鼠巩膜BMP-2平均光密度值±s
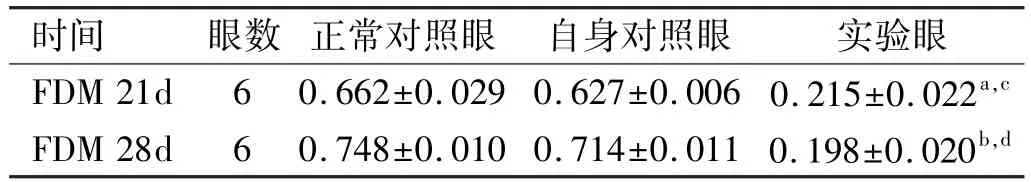
表2 正常对照组与FDM自身对照眼及实验眼小鼠巩膜BMP-2平均光密度值±s
注:aP<0.05 vs自身对照眼;cP<0.05 vs正常对照眼;bP<0.01 vs自身对照眼;dP<0.01 vs正常对照眼。
时间眼数正常对照眼自身对照眼实验眼FDM 21d60.662±0.029 0.627±0.006 0.215±0.022a,cFDM 28d60.748±0.010 0.714±0.011 0.198±0.020b,d
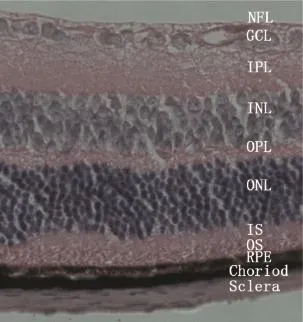
图1 小鼠正常眼后极部各层结构HE染色(×400) 从上到下依次为:NFL:神经纤维层(nerve fibre layer);GCL:神经节细胞层(ganglon cell layer);IPL:内丛状层(inner plexiform layer);INL:内核层(inner nuclear layer);OPL:外丛状层(outer plexiform layer);ONL:外核层(outer nuclear layer);IS:内节(inner segment);OS:外节(out segment);RPE:视网膜色素上皮层(retinal pigment epithelium);Choriod:脉络膜;Sclera:巩膜。
2 结果
2.1各组小鼠屈光度和眼轴长度结果 实验前,正常对照组、自身对照组以及实验组的平均屈光度数为4.31± 1.35、3.71±1.14、4.22±1.47D,实验前屈光度均无统计学差异(P>0.05)。形觉剥夺21d后,实验眼较自身对照眼偏向近视方向-1.50D,与自身对照和正常对照眼屈光度比较,差异均有统计学意义(t=-12.275,P=0.000;t= -13.971,P=0.000),实验眼的眼轴也较自身对照眼和正常眼明显延长,差异均有统计学意义(t=5.723,P= 0.011;t=6.118,P=0.007)。随着形觉剥夺时间的延长,剥夺28d后,实验眼相对自身对照眼偏向近视约-3.0D,实验眼与自身对照眼(t=-14.832,P=0.000)及正常对照眼(t=-16.123,P=0.000)相比均产生明显的近视。眼轴长度增长了21±13μm,实验眼与自身对照及正常对照相比组间差异有统计学意义(t=5.437,P=0.012;t=7.812,P=0.002)。形觉剥夺前后各组的实验眼、自身对照眼和正常对照眼屈光状态和眼轴长度的变化见表1。
2.2各组小鼠光镜下巩膜的改变 小鼠正常眼后极部各层组织HE染色见图1,可以观察到小鼠巩膜成纤维细胞核染成蓝紫色,呈长梭型,细胞外基质为粉红色,对照眼巩膜自赤道部向后极部巩膜逐渐增厚,而实验眼缺乏这种特征。各组小鼠眼后极部结构见图2,形觉剥夺21d时,可以观察到实验眼分别与自身对照眼及正常眼相比较巩膜变薄,成纤维细胞排列紊乱;形觉剥夺28d后,实验眼分别与自身对照眼及正常眼相比较可以观察到巩膜变薄,胶原纤维紊乱、粗细不均,成纤维细胞之间的间隙变大。
2.3各组小鼠免疫组织化学染色结果 BMP-2阳性蛋白表达于正常小鼠视网膜神经节细胞、内核细胞层、外核细胞层、内外节细胞及巩膜细胞的胞浆中,呈棕黄色颗粒状,胞核呈现蓝色。成纤维阳性细胞内胞浆染成深棕色,染色明显。在小鼠形觉剥夺21d后BMP-2表达逐渐下调,胞浆着色减弱;形觉剥夺28d后,成纤维细胞着色最浅。用图像分析软件Image proplus6.0检测BMP-2蛋白表达的强度,用平均光密度值表示(表2),其值越大说明染色越深,BMP-2蛋白表达越高;反之表示染色越浅,说明BMP-2蛋白表达量小。形觉剥夺21d实验眼分别与自身对照眼及正常对照眼相比差异有统计学意义(t=-4.461,P= 0.012;t=-5.521,P=0.007),随着形觉剥夺时间的延长,形觉剥夺28d实验眼染色越浅,与自身对照眼及正常眼相比,差异有统计学意义(t=-9.907,P=0.000;t=-8.025,P= 0.000,图3)。
2.4各组小鼠巩膜BMP-2 mRNA的表达 根据荧光定量RT-PCR结果显示,各组巩膜组织均有BMP-2 mRNA的表达。形觉剥夺21d后,可观察到实验眼BMP-2 mRNA的表达量为0.432±0.041,与自身对照组(0.872± 0.032)和正常对照组(0.913±0.026)相比,BMP-2 mRNA的表达呈下调趋势,差异有统计学意义(t=-4.465,P= 0.016;t=-4.827,P=0.011)。近视诱导28d时,实验眼BMP-2 mRNA表达量为0.376±0.025,与自身对照组(0.926±0.013)和正常对照组(0.972±0.016)相比明显减少,差异有统计学意义(t=-5.179,P=0.009;t=-7.016,P= 0.002;图4)。3讨论
在眼球正常发育过程中,巩膜成纤维细胞及其分泌的I型胶原等细胞外基质成分共同构成细胞外壁,维持眼球组织完整并决定眼轴长度[7]。在以往的研究中发现,哺乳动物模型眼典型的巩膜改变是厚度变薄,这种减少主要是胶原蛋白I合成减少、蛋白聚糖降解增加共同造成的,Ⅲ型胶原和Ⅳ型胶原的含量并不受影响,这种改变导致巩膜胶原纤维组成成分的改变,而后者直接影响胶原纤维直径,是小直径的胶原纤维增加的原因,本研究发现形觉剥夺后巩膜较对侧眼变薄,胶原纤维排列紊乱,粗细不均,间隙变大,以形觉剥夺4wk尤为明显,可能由于FDM眼胶原纤维合成的紊乱而新的胶原纤维又尚未生成,成纤维细胞密度降低,巩膜变薄,引起巩膜生物力学特性的改变,最终导致眼轴的延长。
以往大量的研究证明,近视的发生是大量异常信息的作用下,视网膜上的信号直接到达巩膜,发生近视,然而胡诞宁等[8]将已知有关近视的生长因子、激素和神经传递因子同人类视网膜色素上皮细胞和脉络膜黑色素细胞的研究中发现,上述细胞含有几乎所有的受体,据此可以推测是由视网膜将信号传递给色素上皮和脉络膜,由其再产生下一级活性物质(二级信号),再作用于巩膜。
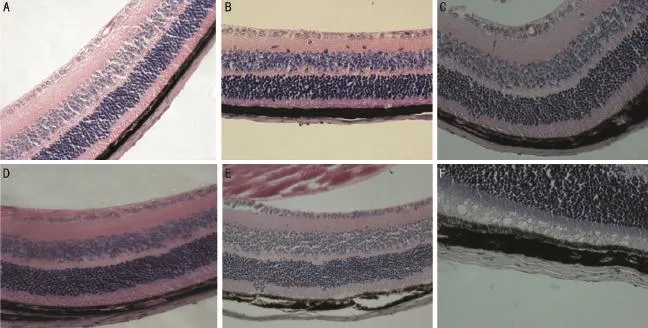
图2 各组小鼠巩膜HE染色图片(×400) A:形觉剥夺21d自身对照眼;B:形觉剥夺21d实验眼;C:21d正常对照眼;D:形觉剥夺28d自身对照眼;E:形觉剥夺28d实验眼;F:28d正常对照眼。
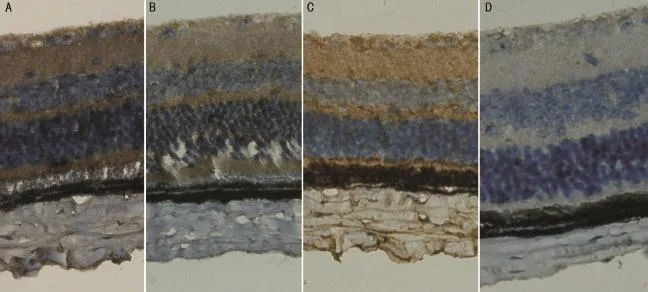
图3 各组小鼠免疫组织化学染色图片(×400) A:FDM 21d组自身对照眼;B:FDM 21d组实验眼;C:FDM 28d组自身对照眼;D:FDM 28d组实验眼。

图4 各组C57BL/6小鼠巩膜中BMP-2 mRNA的表达 实验眼分别与自身对照眼及正常眼比较,P<0.05。
现认为,TGF-β介导的巩膜成纤维细胞的激活是发生巩膜重塑的重要原因[9-11]。而BMPs是转化生长因子-β(TGF-β)超家族最大的成员,能够调节多种细胞功能,是TGF-β家族中多效的调节因子,本研究发现B6小鼠视网膜和巩膜中均存在BMP-2,FDM眼视网膜和巩膜中BMP-2表达量明显下降,表明BMP-2在巩膜重塑过程中起到重要作用。
BMP-2是肝素结合型细胞因子,在角膜中能调节成纤维细胞的凋亡[12],在体外细胞培养中,BMP-2能促进巩膜成纤维细胞增殖,并呈剂量依赖性[13]。王青等[14]发现BMP-2在豚鼠的后巩膜中有表达,并且FDM眼后巩膜部的BMP-2表达明显下降。本研究发现BMP-2在C57BL/6小鼠的视网膜和巩膜中均有表达,并呈下降趋势。提示BMP-2可能是近视的相关信号因子,参与了巩膜重塑的过程。本实验与其他实验不同的是:本实验首次验证了小鼠的视网膜和巩膜中存在BMP-2,而且采用小鼠作为近视模型,最大的优点是小鼠的基因表达谱明确,和人类基因有90%基因同源,其眼球的cDNA文库同人类的极其相似,这就为今后在分子和基因水平研究近视提供了模型基础。
本实验中,我们参考Wu等[15]的实验方法,采用给小鼠佩戴眼罩的方法诱导近视模型,用离体测量的方法测量小鼠的眼轴长度,褚仁远等已经用离体测量眼轴长度的方法说明了形觉剥夺眼眼轴随着遮盖时间的延长而延长,证明了小鼠眼轴长度离体测量的可行性[16-18]。对于本实验过程中出现的剥夺眼和自身对照眼均趋向近视方向发展,我们认为可能是由于长时间的光照引起的,Zhou等[19]将B6小鼠给予不同的光照时间,结果发现光照时间最长的小鼠更易发生轴性近视。吴晓敏等用13d的C57BL/6小鼠按照黑暗/光照周期分为18/6,12/12,6/12组,结果发现随着光照时间的延长,小鼠眼球向近视方向发展,晶状体变薄,玻璃体腔变长,后极部巩膜直径变小,又将小鼠分别置于光照强度为125、250、375Lu条件下饲养14d后发现,光照强度不会影响小鼠眼球正常的屈光发育,然而这与国外学者的研究不相符。Karouta等[20]研究发现,形觉剥夺近视小鸡分别用15 000Lu和500Lu照射,近视程度呈明显降低趋势。目前光照的强度和屈光状态之间的关系目前仍不确定,有待进一步的研究。
另外,在本研究发现以往小鼠造模过程中,大多采用8%水合氯醛(40mg/kg)麻醉小鼠。然而水合氯醛可以引起小鼠晶状体混浊,这种混浊可能与小鼠眼球外突、眼睑不能闭合和角膜干燥有关[21],然而在近视造模的整个阶段,需要晶状体和角膜保持透明,以检测小鼠剥夺前和剥夺后双眼的屈光状态,因此水合氯醛不适合用于小鼠近视模型的制备。而枸橼酸芬太尼具有镇痛的作用[22],我们采用5%枸橼酸芬太尼注射液以4mg/kg麻醉小鼠后,可以达到较好的效果,能够顺利完成小鼠造模过程,并且不会引起小鼠晶状体混浊、角膜干燥等。
总之,本研究发现C57BL/6小鼠视网膜和巩膜中均存在BMP-2,并且小鼠形觉剥夺眼中巩膜BMP-2呈下降趋势,提示BMP-2可能参与了FDM后巩膜重塑过程,但其信号通路的具体机制仍需进一步研究。
1 Goldschmidt E,Jacksen N.Genetic and environmental effects on myopia development and progression.Eye(Lond)2014;28(2): 126-133
2杨蓓,刘桂香.豚鼠短期形觉剥夺行近视屈光度眼轴及巩膜改变.国际眼科杂志2009;9(10):1871-1875
3 McBrien NA.Regulation of scleral metabolism in myopia and the role of transforming growth factor-beta.Exp Eye Res 2013;114(9):128-140
4 Hu J,Cui D,Yang X,et al.Bone morphogenetic protein-2:a potential regulator in scleral remodeling.Mol Vis 2008;14(12): 2373-2380
5王青,刘筱楠,薛美兰,等.骨形态发生蛋白在形觉剥夺性近视眼后巩膜中的表达变化.中华实验眼科杂志2013;(12):1105-1109
6 Liu HP,Lin YJ,Lin WY,et al.A novel genetic variant of BMP2K contributes to high myopia.J Clin Lab Anal 2009;23(6):362-367
7 McBrien NA,Gentle A.Role of the sclera in the development and pathological complications of myopia.Prog Retin Eye Res 2003;22(3): 307-338
8胡诞宁,McCo SA.视网膜色素上皮-脉络膜在近视发病中的作用.眼视光学杂志2000;02(4):197-200
9 Rada JA,Johnson JM,Achen VR,et al.Inhibition of scleral proteoglycan synthesis blocks deprivation.Induced axial elongation in chicks.Exp Eye Res 2002;74(2):205-215
10陈博宇,王超英,马景学,等.转化生长因子-β2对实验性近视眼后极部巩膜成纤维细胞力学特性的影响.中华实验眼科杂志2011;29(4):296-301
11 Jobling AI,Gentle A,Metlapally R,et al.Regulation of scleral cell contraction by transforming growth factor.beta and stress:competingroles in myopic eye growth.J Biol Chem 2009;284(4):2072-2079
12 Kim WJ,Mohan RR,Mohan RR,et al.Effect of PDGF,IL-1 alpha,and BMP2/4 on corneal fibroblast chemotaxis:expression of the platelet.Derived growth factor system in the cornea.Invest Ophthalmol Vis Sci 1999;40(7):1364-1372
13 Hu J,Cui D,Yang X,et al.Bone morphogenetic protein-2:a potential regulator in scleral remodeling.Mol Vis 2008;14(12): 2373-2380
14王青,刘筱楠,薛美兰,等.骨形态发生蛋白在形觉剥夺性近视眼后巩膜中表达的变化.中华实验眼科杂志2013;31(12):1105-1109 15 Wu PC,Tsai CL,Gordon GM.Chondrogenesis in scleral stem/ progenitor cells and its association with form-deprived myopia in mice. Mol Vis 2015;21(2):138-147
16潘红卫,曾骏文.TGF-β在形觉剥夺性近视巩膜内表达.广东医学2006;27(10):1448-1450
17钱宜珊,褚仁远.小鼠形觉剥夺性近视眼模型Sonichedgehog信号通路的表达及干预研究.复旦大学博士学位论文2008
18忽俊,周晓东,龚红华.提前光刺激与形觉剥夺诱导近视模型的形态及超微结构比较.中华眼科杂志2005;41(10):896-899
19 Zhou X,An J,Wu X,et al.Relative axial myopia induced by prolonged light exposure in C57BL/6 mice.Photochem Photoboil 2010;86(1):131-137
20 Karouta C,Ashby RS.Correlation between light levels and the development of deprivation myopia.Invest Ophthalmol Vis Sci 2014;56(1):299-309
21曹研群,于慧敏,尚蕾.麻醉诱导的小鼠晶状体突发性浑浊.解剖学杂志2013;36(3):279-281
22 Minami K,HaseqawaM,NakamuraA,etal.Morphine,oxycodone,and fentanyl exhibit different analgesic profiles in mouse pain models.J Pharmacol Sci 2009;111(1):60-72
Role of bone morphogenetic protein-2 in scleraremodelingofformdeprivation myopic eyes in C57BL/6 mice
Yu Zhang,Xian Yang,Li-Ping Jiang,Gui-Bo Liu,Shuang-Shuang Wang
s:the National Natural Science Foundation of China(Youth Foundation,No.81300790);Natural Science Foundation of Shangdong Province(No.BS2010SF009)
2015-12-11 Accepted:2016-02-25
C57BL/6mice;bonemorphogenetic protein-2;form-depriviation myopia;sclera
国家自然科学基金青年科学基金项目(No. 81300790);山东省自然基金项目(No.BS2010SF009)
(266003)中国山东省青岛市,青岛大学附属医院眼科作者简介:张玉,女,在读硕士研究生,研究方向:小儿斜视与弱视。
杨先,博士,副教授,副主任医师,硕士研究生导师,研究方向:视光学与斜视弱视.yangxian_zhao@126.com
2015-12-11
2016-02-25
Zhang Y,Yang X,Jiang LP,et al.Role of bone morphogenetic protein-2 in sclera remodeling of form deprivation myopic eyes in C57BL/6 mice.Guoji Yanke Zazhi(Int Eye Sci)2016;16(3):423-427
10.3980/j.issn.1672-5123.2016.3.05
猜你喜欢
杂志排行
国际眼科杂志的其它文章
- Glaucomatous changes in macular ganglion cell detected byspectraldomainopticalcoherencetomography: comparison with peripapillary retinal nerve fiber layer
- 个性化人工晶状体选择方案治疗年龄相关性白内障的临床研究
- Work-related ocular injuries in Johor Bahru,Malaysia
- Research of serum total and high-molecular-weight adiponectin levels in patients with type 2diabetic retinopathy
- 玻璃酸钠滴眼液治疗青少年近视患者配戴硬性透气性角膜接触镜相关性干眼
- PSP对STZ诱导的糖尿病大鼠眼保护作用的临床动态观察
