两个烟草Nup96基因的分子克隆及其表达分析
2016-11-16林世锋王仁刚史跃伟张孝廉邹颉任学良余婧
林世锋,王仁刚,史跃伟,张孝廉,邹颉,任学良,余婧
贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵州贵阳龙滩坝路29号 550081
两个烟草Nup96基因的分子克隆及其表达分析
林世锋,王仁刚,史跃伟,张孝廉,邹颉,任学良,余婧
贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵州贵阳龙滩坝路29号 550081
为研究烟草低温早花的分子机理,采用RT-PCR结合RACE法,从烟草品种NC82中克隆到2个Nup96基因cDNA全长序列,分别命名为NtNup96a和NtNup96b,GenBank登陆号分别为KU558693和KU558694。序列分析表明2个基因均编码1037个氨基酸残基的蛋白,氨基酸序列一致性为97%,与拟南芥Nup96蛋白(NP_178183)的序列一致性为60%;2个基因编码蛋白具有典型的植物Nup96结构特性,包含1个Nup96结构域和1个自酶解结构域。荧光定量PCR分析表明:在正常的生长条件下,NtNup96a和NtNup96b在烟草各组织中均有表达,在叶片中的表达量较弱,且随着植株生长其表达量显著下降;在
12℃处理10天后,在烟草叶片中2基因的表达都出现了明显的下调,这一结果提示Nup96可能是烟草开花时间调控的抑制因子,其受低温诱导下调表达可能与NC82低温敏感,易早花特性相关。
烟草;Nup96;基因克隆;表达分析
烟草是一种喜温的叶用经济作物,在烟叶生产过程中时常发生早花现象,烟草早花会造成烟叶产量和品质的严重下降。低温是导致烟草早花的主要原因之一,早花发生规律研究结果说法不一,其确切的分子机制尚不明了[1]。
近些年,随着拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)等模式植物全基因组序列测定完成,植物成花诱导分子机制研究也取得了一定进展[2]。植物成花过程受温度、光和激素等许多因素影响,已明确高等植物的7条成花诱导途径,即春化途径、温敏途径、光周期途径、赤霉素(gibberellin,GA)途径、自主途径、成花抑制途径和年龄途径[2]。拟南芥核膜孔蛋白Nup96,又称为SUA41/MOS3/SAR3[3],通过调节mRNA等物质的核输出,参与拟南芥的基本防御和组成型抗性反应[4],并且在植物激素信号传导和植物发育中发挥重要作用[5-6],突变体具有显著早花表型[7]。2013年,黄国文等[8]研究表明,Nup96作为开花抑制因子,参与调节拟南芥开花关键基因的表达,在开花自主途径和温敏途径中起作用,并且在温敏途径的功能更明显。目前,有关植物Nup96的研究仅在拟南芥中有相关报导,其它植物中尚未见研究报道。本研究克隆了烟草的两个Nup96基因NtNup96a和NtNup96b,并分析了两个基因在低温处理条件下的表达,为进一步研究它们在烟草低温早花发生过程中的分子调控机制打下基础。
1 材料与方法
1.1 材料
以对低温敏感的烟草品种NC82(Nicotiana tabacumL. cv. NC82)为材料,采用漂浮育苗,烟苗3~4片真叶时移栽至花盆中培养。烟株生根期和旺长期分别采集烟株根、茎、叶,液氮速冻,-80℃保存备用。对于低温处理实验的幼苗,待8片真叶期选取6株生长一致的烟苗移入智能人工气候箱中(光周期12 h/12 h,湿度60%),其中3株进行12℃低温处理10d,另外3株不做低温处理,分别采集低温处理和未低温处理烟苗叶片,液氮速冻,-80℃保存备用。
1.2 方法
1.2.1 RNA提取和cDNA合成
采用Invitrogen公司的Trizol试剂盒提取总RNA。cDNA第一链的合成按照TaKaRa公司的PrimeScriptTMⅡ 1 st strand cDNA Synthesis Kit说明书进行操作。
1.2.2 Nup96全长cDNA的克隆
以拟南芥Nup96蛋白氨基酸序列(登陆号:NP_178183)为探针,在烟草EST数据库中进行同源搜寻,发现与之相似的烟草EST,经拼接获得重叠群。依据上述信息设计基因3′和5′ RACE反应的特异性引物(表1)。 采用SMARTTMRACE cDNA Ampli fi cation Kit(TaKaRa公司)扩增基因的3′和5′末端。将3′和5′末端测序结果与EST重叠群序列进行比对拼接,得到基因全长cDNA序列信息,设计全长引物(表1),以cDNA为模板进行扩增和测序验证。
1.2.3 Nup96基因组序列克隆
烟草基因组DNA采用CTAB法[9]提取。利用全长引物对基因组DNA进行PCR扩增、克隆和测序。

表1 引物序列和扩增片段长度Tab.1 Sequence of primers and preproduction length
1.2.4 生物信息学分析
在http://www.ncbi.nlm.nih.gov上利用BLAST工具和ORF Finder工具对全长cDNA序列进行序列比对和开放阅读框(Open Reading Frame,ORF)预测;采用DNAMAN 6.0软件进行多重序列比对和基因结构分析,并利用ClustalX 2.0及MEGA4.0软件包的Neighbor-Joining方法构建系统进化树。
1.2.5 荧光定量PCR
根据NtNup96a和NtNup96b的cDNA序列设计PCR引 物N1-rF和N1-rR、N2-rF和N2-rR, 以 烟草β-actin作为内参基因[10],PCR引物Actin-rF和Aactin-rR序列见表1。按照TaKaRa公司Taqman探针试剂盒说明书,利用ABI Stepone Plus实时荧光定量PCR仪进行扩增,分析NtNup96a和NtNup96b在烟草不同时期、不同组织及低温处理条件下的表达。
2 结果与分析
2.1 NtNup96a和NtNup96b全长cDNA克隆及分析
以NP_178183为探针序列,在烟草EST库中进行电子延伸,得到2个基因重叠群。通过3′和5′RACE,获得2个基因3′和5′末端序列(图1扩增条带6和5)。通过测序拼接,RT-PCR扩增获得2个基因全长cDNA序列(图1扩增条带3和7),分别命名为NtNup96a和NtNup96b,GenBank注册号为KU558693和 KU558694。NtNup96a基 因 cDNA全长3635 bp(不包含多聚腺苷酸尾),编码区长3114 bp,编码1037个氨基酸,预测分子量约为117.732 kDa,等电点为4.99;NtNup96b基因cDNA全长3545 bp,编码区长3114 bp,编码1037个氨基酸,预测分子量约为117.590 kDa,等电点为4.88(图2)。

图1 烟草NtNup96a/b基因的PCR扩增结果Fig.1 PCR ampli fi cation results of NtNup96a/b from Nicotiana tabacum

图2 烟草中NtNup96a和NtNup96b氨基酸序列比较Fig. 2 Amino acid sequence alignment of the NtNup96a/b proteins
同源性分析表明,烟草NtNup96a和NtNup96b2个基因之间的氨基酸序列一致性为97%,它们与已报道的拟南芥AtNup96基因(NP_178183)的氨基酸序列一致性为60%。与其它植物同类基因的氨基酸序列一致,除具有典型的Nup96结构域之外,在其N端还有一个脊椎动物Nup98蛋白特有的“自酶解结构域”(Autoproteolytic domain,APD),见图2。
系统发生树分析表明(图3),同科植物在进化树上基本处于同一分支。NtNup96a与绒毛状烟草的亲缘关系最近,NtNup96b与林烟草的亲缘关系最近,绒毛状烟草和林烟草是栽培烟草的两个祖先种,推测NtNup96a源于绒毛状烟草基因组,NtNup96b源于林烟草基因组,绒毛状烟草和林烟草杂交加倍的过程中各贡献了1个Nup96基因同源拷贝,栽培烟草基因组中有两个拷贝发挥着生物学功能。
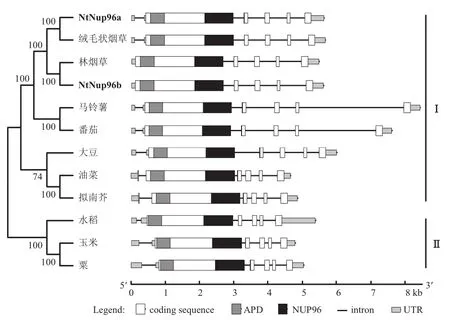
图3 植物 Nup96蛋白的聚类及基因结构比较Fig. 3 Phylogenetic structure of Nup96 protein in plants
2.2 NtNup96a和NtNup96b基因组序列分析
采用NtNup96a和NtNup96b的全长扩增引物从烟草基因组中克隆到了NtNup96a和NtNup96b对应的基因组序列,并将序列提交到NCBI,获得GenBank登陆号分别为KU558695和KU558696。NtNup96a和NtNup96bDNA全长分别为5593 bp和5546 bp。将DNA序列与基因cDNA序列进行比对,结果表明,NtNup96a含有5个内含子,NtNup96b含有4个内含子,这些内含子均符合标准的GT-AG剪切规则。由图3可知,Nup96基因在高等植物中具有相似的结构特征,在编码区外显子基本一致,内含子的相对位置也是保守的,只是长度有所变化,推测可能是由于内含子在进化上高度活跃所致。
2.3 NtNup96a和NtNup96b基因的时空表达模式分析
通过实时荧光定量PCR检测NtNup96a和NtNup96b基因的时空表达模式,发现2个基因在不同发育时期的烟草根、茎、叶等器官中都有表达,其中叶片的表达量略低,且表达量在叶片生长过程的变化幅度较大(图4)。

图4 荧光定量PCR分析NtNup96a和NtNup96b基因时空表达特性Fig. 4 Temporal-spatial expression analysis of NtNup96a and NtNup96b by real-time PCR
与对照相比,12℃低温处理10 d的烟草叶片2个基因的表达量明显下调(图5),下调倍数分别为5.43和3.64,说明NtNup96a和NtNup96b基因可能参与了烟草幼苗低温胁迫应答反应。
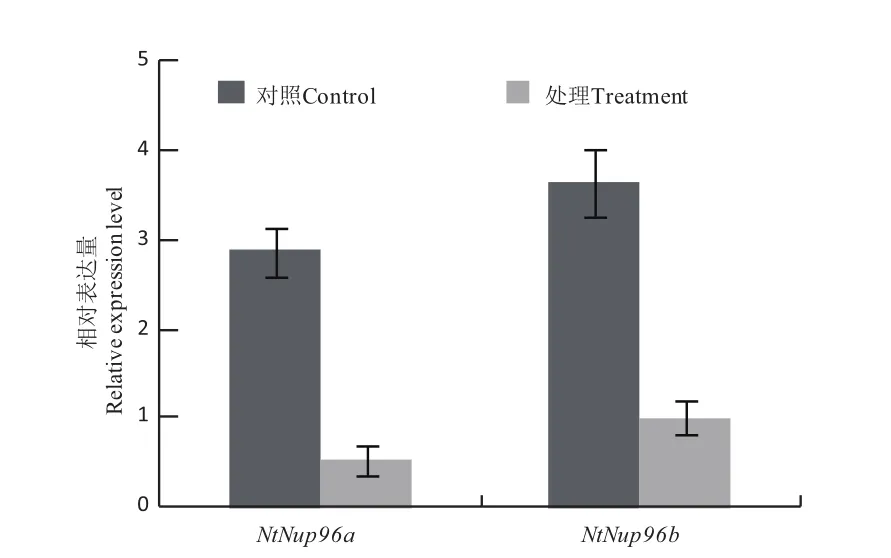
图5 低温处理对NtNup96a和NtNup96b基因表达水平的影响Fig. 5 Effect of low temperature on expression of NtNup96a and NtNup96b
3 结论与讨论
通过RT-PCR结合RACE技术,克隆了2个烟草Nup96基因的全长cDNA,根据核苷酸序列推导出的氨基酸序列与已报到的拟南芥Nup96基因的氨基酸序列一致性为60%。基因结构分析表明,NtNup96a和NtNup96b基因在编码区由1大4小的5个外显子组成,其编码的氨基酸序列具有植物Nup96典型的结构特点,如Nup96结构域、N端保守的APD结构域及其C末端保守的酶切位点氨基酸残基。因此推测2个基因编码的蛋白属于Nup96蛋白家族成员。
温度是影响植物开花的重要环境因素,对于外界温度的诱导,植物不同物种的开花时间表现不同,体现了不同植物对自然环境的特殊适应性,例如将模式植物拟南芥的生长温度从16 ℃提高到23 ℃,会诱导其早开花,这种高温诱导开花与其成花素基因FT的表达上调一致[11-13]。与这种现象相反,高温抑制菊花(Chrysanthemummorifolium)开花,当夏季平均温度大于20 ℃时会导致菊花晚开花,这种晚开花的现象和菊花在高温度条件下FT同源基因的表达削弱有直接的关系[14-15]。可以看出,温度对拟南芥和菊花开花时间的作用效果相反,FT基因作为开花促进因子在两种植物中受高温诱导表现出相反的表达趋势。黄国文等[7]研究表明,与22 ℃相比,16 ℃低温显著诱导拟南芥Nup96基因的上调表达,确定Nup96是拟南芥开花时间调控中的抑制因子,抑制拟南芥开花。就烟草而言,低温诱导烟草早花,本研究根据以往研究结果[16-18],选择12 ℃ 10 d低温处理8叶期的NC82烟苗,采用定量PCR方法分析温度对烟草Nup96基因表达水平的影响,结果显示12 ℃低温处理显著诱导烟草Nup96基因的下调表达,表现出与拟南芥完全相反的变化趋势。鉴于温度对拟南芥和烟草开花时间的作用效果相反,推测Nup96是烟草开花时间调控的抑制因子,其受低温诱导下调表达可能与NC82低温敏感,易早花特性相关。
[1]金磊,晋艳,周冀衡,等.烟草早花机理及控制的研究进展[J].中国烟草学报,2008,14(1):58-62.JIN Lei, JIN Yan, ZHOU Jiheng, et al. Advances in research into mechanism and control ofN.tabacumpremature fl owering [J]. Acta Tabacaria Sinica, 2008, 14(1): 58-62.
[2]宋杨,窦连登,张红军.高等植物成花诱导调控的分子和遗传机制[J].植物生理学报,2014,50(10):1459-1468.SONG Yang, DOU Liandeng, ZHANG Hongjun. Molecular and genetic mechanisms of control of floral induction in higher plants [J]. Plant Physiology Journal, 2014, 50(14):1459-1468.
[3]郭敏霞.拟南芥SUA41蛋白的功能域分析[D].中国农业科学院硕士论文,2013.GUO Minxia. Analysis of functional domains of AtSUA41[D]. Chinese Academy of Agricultural Sciences, Master Dissertation, 2013.
[4]ZHANG Yuelin, LI Xin. A putative nucleoporin 96 is requried for both basal defense and constitutive resistance responses mediated by suppressor of nprl-1, constitutive1[J]. The Plant Cell, 2005, 17(4): 1306-1316.
[5]Parry G, Ward S, Cernac A, et al. TheArabidopsisSUPPRESSOR OF AUXIN RESISTANCE proteins are nucleoporins with an important role in hormone signaling and development [J]. The Plant Cell, 2006, 18(7): 1590-1603.
[6]黄国文.环境条件对sua41突变体表型的影响[J].湖南科技学院学报,2014,35(5):92-96.HUANG Guowen. Effect of environmental conditions on the phenotype ofsua41mutants [J]. Journal of Hunan University of Science and Engineering, 2014, 35(5): 92-96.
[7]Cernac A, Lincoln C, Lammer D, et al.TheSAR1gene ofArabidopsisacts downstream of theAXR1gene in auxin response [J]. Development, 1997, 124(8): 1583-1591.
[8]黄国文,韩玉珍,傅永福.拟南芥SUA41基因的表达和功能分析[J].遗传,2013,35(1): 93-100.HUANG Guowen, HAN Yuzhen, FU Yongfu. Expression and functional analysis ofSUA41gene inArabidopsis thaliana[J]. Hereditas, 2013, 35(1): 93-100.
[9]Porebskis, Bailey G, Baumb B R. Modification of CTAB DNA extraction protocol for plant s containing high polysaccharide and polyphend components [J]. Plant Molecular Biology Reporter, 1997, 15(1): 8-15.
[10]林世锋,元野,任学良,等.烟草半胱氨酸蛋白酶抑制剂(CPI)基因家族的克隆及组织表达谱分析[J].中国烟草学报,2014,20(4):79-87.LIN Shifeng, YUAN Ye, REN Xueliang, et al. Cloning and tissue expression analysis of cysteine proteinase inhibitor(CPI) gene family in tobacco (Nicotiana tabacumL.). Acta Tabacaria Sinica, 2014, 20(4): 79-87.
[11]Blazquez M A, Ahn J H, Weigel D. A thermosensory pathway controlling fl owering time inArabidopsis thaliana[J]. Nature Genetics, 2003, 33(2): 168-171.
[12]Balasubramanian S, Sureshkumar S, Lempe J, et al. Potent induction of Arabidopsis thaliana flowering by elevated growth temperature [J]. PLoS Genetics, 2006, 2(7): e106.
[13]Balasubramanian S, Weigel D. Temperature induced flowering inArabidopsis thaliana[J]. Plant Signaling &Behavior, 2006, 1(5): 227-228.
[14]Nakano Y, Higuchi Y, Sumitomo K, et al.Flowering retardation by high temperature in chrysanthemums: involvement ofFLOWERING LOCUS T-like 3gene repression [J]. Journal of Experimental Botany, 2013, 64(4): 909-920.
[15]Oda A, Narumi T, Li T, et al. CsFTL3, a chrysanthemum FLOWERING LOCUS T-like gene, is a key regulator of photoperiodic fl owering in chrysanthemums [J]. Journal of Experimental Botany, 2012, 63(3): 1461-1477.
[16]刘丹,蔡高磊,张允政,等.烟草早花原因及其防治对策[J].农业灾害研究,2013,3(6):9-10.LIU Dan, CAI Gaolei, ZHANG Yunzheng, et al. Early flowering causes and prevention countermeasures of tobacco [J]. Journal of Agricultural Catastrophology, 2013,3(6): 9-10.
[17]文家仁.烤烟早花发生的原因及预防措施[J].云南农业科技,1990(6):7.WEN Jiaren. Causes and preventive measures of premature fl owering in tobacco [J]. Yunnan Agricultural Science and Technology, 1990(6): 7.
[18]岳彩鹏,韩锦峰,陈卫华.烟草开花研究进展[J].烟草科技,2001(9):36-40.YUE Caipeng, HAN Jinfeng, CHEN Weihua. Recent advances on tobacco flowering [J]. Tobacco Science &Technology, 2001(9): 36-40.
Molecular cloning and expression analysis of twoNup96genes inNicotiana tabacumL.
LIN Shifeng, WANG Rengang, SHI Yuewei, ZHANG Xiaolian, ZOU Jie, REN Xueliang, YU Jing
Guizhou Academy of Tobacco Science, Key Laboratory of Molecular Genetics, China National Tobacco Corporation,Guiyang 550081, China
Two full-length cDNAs encoding di ff erent Nup96s were cloned fromNicotiana tabacumL. cv. NC82 by RT-PCR and SMART RACE technology, and were designated asNtNup96a(GenBank accession Number KU558693) andNtNup96b(GenBank accession Number KU558694), respectively. Sequencing analysis indicated that they were 97% identical to each other at the amino acid sequence level and shared 60% identity withArabidopsis thalianaNup96 (NP_178183), respectively. The predicted proteins of them shared typical characteristic of Nup96 in plants, containing a conserved Nup96 domain and a conserved autoproteolytic domain. Expression analysis showed thatNtNup96aandNtNup96b were detected in all tissues, and their expressions were the lowest in leaves and decreased with the increase of plant age. After cold treatment at 12 ℃ for 10d, the expression of both genes declined signi fi cantly in leaves, which suggested thatNtNup96aandNtNup96bmight be inhibitory factors in the regulation of fl owering time in tobacco and were involved in low temperature response and early fl owering of cold-sensitive tobacco NC82.
Nicotiana tabacumL.; Nup96; gene cloning; expression analysis
林世锋,王仁刚,史跃伟,等. 两个烟草Nup96基因的分子克隆及其表达分析[J]. 中国烟草学报,2016, 22(4)
中国烟草总公司重点项目(110201302004);中国烟草总公司贵州省公司科技项目(2011-3047);烟草行业分子遗传重点实验室专项经费课题(110201403018)
林世锋(1978—),博士,副研究员,主要研究方向为烟草遗传育种与分子生物学,Tel:0851-84116968,Email:linshifeng1978@163.com
余婧(1983—),硕士,助理研究员,主要研究方向为烟草分子生物学,Tel:0851-84116968,Email:yujingbio@126.com
2016-03-22
:LIN Shifeng, WANG Rengang, SHI Yuewei, et al. Molecular cloning and expression analysis of twoNup96genes inNicotiana tabacumL. [J]. Acta Tabacaria Sinica, 2016,22(4)
