高温介导N基因对TMV免疫丧失的代谢轮廓分析
2016-11-16刘旭王耀峰余广宏宋玉川王杰申莉莉王凤龙杨金广
刘旭,王耀峰,余广宏,宋玉川,王杰,申莉莉,王凤龙,杨金广
1 中国农业科学院烟草研究所烟草行业烟草病虫害监测与综合治理重点开放实验室,山东青岛 266101;2 中国农业科学院研究生院,北京 100081;3 甘肃省烟草公司庆阳市公司,西峰 745000;4云南香料烟有限责任公司,保山 678000
生物技术
高温介导N基因对TMV免疫丧失的代谢轮廓分析
刘旭1,2,王耀峰3,余广宏4,宋玉川4,王杰1,申莉莉1,王凤龙1,杨金广1
1 中国农业科学院烟草研究所烟草行业烟草病虫害监测与综合治理重点开放实验室,山东青岛 266101;2 中国农业科学院研究生院,北京 100081;3 甘肃省烟草公司庆阳市公司,西峰 745000;4云南香料烟有限责任公司,保山 678000
高温(>28℃)可引起含N基因的免疫寄主对TMV抗性丧失,导致TMV系统侵染。本研究以枯斑三生(Nicotiana tabacumvar. Samsun NN) 烟草为研究材料,采用代谢组学方法,系统研究25℃和31℃条件下,TMV未侵染和TMV侵染12 h、24 h和48 h枯斑三生烟草的代谢差异。应用气相色谱与质谱联用(GC-MS)技术,结合主成分分析(PCA)和正交偏最小二乘-判别分析法(OPLS-DA)对不同温度下代谢产物的差异性进行分析。结果表明:GC-MS技术共检测到49种代谢物包括氨基酸类、糖类、有机酸类、脂肪酸类、醇类以及多胺类等。在25℃常温条件下,TMV侵染枯斑三生烟引起苹果酸、水杨酸、γ -氨基丁酸、脯氨酸和乙醇胺等代谢物含量上调,而在31℃高温处理N基因失活后,TMV侵染导致组织蔗糖和肌醇含量下调、葡萄糖和果糖含量上调以及伴随氨基酸类含量普遍上调。
TMV;代谢;N基因
在植物与病虫害相互作用、长期协同进化过程中,植物为了抵御病虫害的侵袭,常依赖其自身的天然免疫来抵御有害生物侵袭,并形成了完善的免疫机制。烟草花叶病毒(Tobacco mosaic virus, TMV)与具有N基因寄主的互作是最早也是研究最多的植物—病原菌互作的模型之一[1]。寄主的抗性基因N基因与TMV复制酶中的p50能够特异性识别并产生过敏性坏死反应(HR-PCD),从而将TMV限制在侵染位点内形成枯斑[2]。N基因编码蛋白的TIR、NBS、LRR 结构域可识别TMV配体的蛋白复合物,激发信号传导途径诱导防御反应[3]。Kiraly 等研究表明高温导致含有N基因的寄主NADPH氧化酶和过氧化物酶的降低,从而导致寄主对TMV免疫的减弱[4]。N基因具有温度敏感性,当环境温度高于28℃,TMV侵染含有N基因的烟草,植物失去发生过敏反应(HR)的能力,导致TMV在系统中扩散侵染[5]。因此,N基因对于TMV侵染引起的病害的防治是一把双刃剑,环境温度的骤变,特别是全球温度的升高和我国西南烟区的持续高温干旱,使种植含有N基因的烤烟品种系统性坏死病害趋于严重,甚至造成烟叶绝产。
在植物机体中,代谢产物是细胞调控过程的终产物,其种类和数量的变化是生物系统对环境(生物或非生物胁迫)或基因修饰的最终响应[6]。而代谢组学正是对细胞或者组织内所有代谢产物进行定性的定量研究的一门科学[7-8]。因此,比较感病植株与对照植株的代谢轮廓差异,是一个解开多因素参与的生化途径的强大工具[9-10]。已有的研究大多集中在研究TMV侵染烟草所引起的代谢差异,但是对于在抗性品种中温度和时间综合影响代谢物变化的研究较少。
本研究以TMV和含有N基因的枯斑三生烟(Nicotiana tabacumcv. Samsun)为研究材料,分析TMV侵染枯斑三生烟在不同温度条件下(25℃和31℃)代谢产物的差异,在个体水平上探讨不同温度条件下对TMV侵染枯斑三生烟应答的代谢轮廓,结合多元数据分析手段,揭示寄主的天然免疫与TMV致病相关的代谢物和代谢途径的变化,为探讨植物天然免疫的稳定性和病毒的致病机理提供理论依据。
1 材料和方法
1.1 实验材料
烟草材料:TMV普通株系(TMV-U1)毒源以及寄主材料枯斑三生烟均为中国农业科学院烟草研究所保存。
主要试剂和仪器:核糖醇、N-甲基三甲基硅基三氟乙酰均购自上海TCI化成工业发展有限公司;甲氧基胺盐酸盐购于成都西亚化工股份有限公司;正十八烷购自上海江莱生物科技有限公司;甲醇、氯仿、吡啶均为分析纯,购于上海国药化学试剂有限公司;恒温混匀仪购自杭州奥盛仪器有限公司;Agilent 7890A/5975C气相色谱-质谱联用仪购自Agilent公司。
1.2 试验方法
1.2.1 烟草生长条件,病毒侵染和取样
在室温下,将枯斑三生烟种子在25 cm×15 cm的育苗盘内育苗,待烟苗长至3片真叶时,将其假植在50孔聚乙烯塑料盘(55 cm×28 cm,圆锥形孔上部直径5 cm,孔高5 cm)内,当烟苗长至4片真叶时,移栽于直径10 cm的花盆内。将烟苗分为两组,分别放入25℃和31℃的光照培养箱内,待长至7叶期时用于试验。
采用摩擦接种法,取TMV毒源新鲜病叶按照(1:40)与灭菌后的0.1 mol/L的PBS缓冲液混合置于灭菌的研钵中,研磨成匀浆,灭菌纱布过滤为接种液,轻轻摩擦接种叶片上,接种后无菌水洗去叶片上的残留液,将烟株置于14 h光周期的光照培养箱。
选取长势基本一致的烟株,以不接种TMV取样作为对照,分别在接种后12 h、24 h、48 h取样,每组6个重复,各个时间点的取样部位分别一致。用灭菌后的剪刀迅速剪取叶基部,将样品用锡箔纸包裹迅速置于液氮中,在处理之前于-80℃冰箱中保存备用。
1.2.2 烟草代谢产物的提取
代谢产物的提取方法按照Jan等[11],方法略有修改。用液氮在研钵中研磨烟草叶片;加入1 mL甲醇(-20℃预冷),继续研磨片刻;将植物匀浆装入2.0 mL离心管中,再加入甲醇直至1.4 mL,涡旋10 s;加入60 µL核糖醇,涡旋10 s;70℃,230 rpm,混摇15 min;12000 g,离心10 min;转移上层液加入750 µL氯仿(-20℃预冷),加入1.5 mL去离子水,涡旋10 s;2200 g,离心15 min;取上层液,在真空浓缩仪中浓缩;加入40 µL鲜制的甲氧基胺盐酸盐溶液,37℃ 250 rpm振荡120 min;加入70 µLN-甲基三甲基硅基三氟乙酰溶液;37℃ 250 rpm振荡30 min;转入GC-MS玻璃小瓶;待进一步进行GC-MS分析。
1.2.3 GC/MS分析
毛细管色谱柱为Agilent J&W Scienti fi c公司的HP -5ms (30 m × 0.25 mm × 0.25 μm)。仪器参数设定为进样口温度280℃,EI离子源温度为230℃,四级杆温度为150℃,高纯氮气(纯度大于99.999%)作为载气,载气流速为6 mL/min,不分流进样,进样量为1 µL。升温程序为:初始温度70℃,维持2 min,6℃/min的速度升至160℃,再以10℃/min的速度升至240℃,最后以20℃/min的速度升至300℃并维持6 min。采用全扫描模式进行质谱检测,质谱检测范围为50~600(m/z)。采用随机顺序进行连续样本分析,避免因仪器信号波动而造成的影响。
1.2.4 数据处理
在R软件平台下采用自写的程序代码进行数据预处理,包括基线过滤、峰识别、积分、保留时间校正、峰对齐和质谱碎片归属分析,最后在EXCEL2010软件中进行后期编辑,包括来自于柱流失和样本制备造成的杂质峰的剔除和定量离子选择等,将最终结果组织为二维数据矩阵,包括变量(rt-mz,即保留时间-质荷比)、观察量(样本)和积分面积。然后将所有数据归一化到总信号积分。对代谢物信息进行中心化和归一化(Par)处理后,将数据矩阵导入Simca-P软件(版本12.0),分别进行主成分分析(PCA)和正交偏最小二乘方判别分析(OPLS-DA)。应用DPS软件对差异性代谢物矩阵进行显著性检验。
2 结果与分析
2.1 GC-MS检测代谢物的鉴定
对不同温度和不同侵染时期的48个烟草叶片样品进行GC-MS衍生化分析,得到样品的总离子流图如图1所示,采用AMDIS软件的默认参数对样本的原始仪器数据文件进行反卷积分析,单次分析共检测到117种代谢物,搜索自建的标准物质数据库(42种植物中常见的糖类、醇类、氨基酸类和酸类物质)和NIST商业数据库,初步定性了49种化合物,包含13种氨基酸(苏氨酸、γ-氨基丁酸、异亮氨酸、赖氨酸、丙氨酸、酪氨酸、谷氨酰胺、缬氨酸、丝氨酸、蛋氨酸、脯氨酸、天冬氨酸、天冬酰胺),13种糖类(景天庚酮糖、D-果糖、D-葡萄糖、蔗糖、β-龙胆二糖、D-(+)-海藻糖、6-磷酸果糖、6-磷酸葡糖、麦芽糖、核糖、鼠李糖、阿洛糖、D-(-)-赤藓糖),9种有机酸(苹果酸、甘油酸、葡糖酸、酒石酸、延胡索酸、琥珀酸、α-酮戊二酸、莽草酸、水杨酸),4种醇类(山梨糖醇、赤藓糖醇、菜油甾醇、木糖醇),3种脂肪酸(硬脂酸、α-亚麻酸、肉豆蔻酸),以及7种其他类物质(棕榈酰胺、琥珀酰酐、肌醇、烟酸、脱氢抗坏血酸、维生素E、乙醇胺)。

图1 提取代谢物的总离子流图Fig.1 Total ion chromatogram of metabolites
2.2 不同温度下TMV侵染枯斑三生烟引起的代谢差异
利用Simca-P软件分别对25℃和31℃条件下,TMV未侵染(TMV-free)和TMV侵染后12 h、24 h、48 h的样品数据进行主成分分析。图2所示模型前两个主成分累积解释率R2X=0.617,图3所示模型累积解释率R2X=0.622,都能较好的解释不同处理结果之间的差异性,且分散度较好。PCA图显示,在25℃和31℃条件下,TMV-free和TMV侵染12 h、24 h、48 h后代谢物存在明显变化。
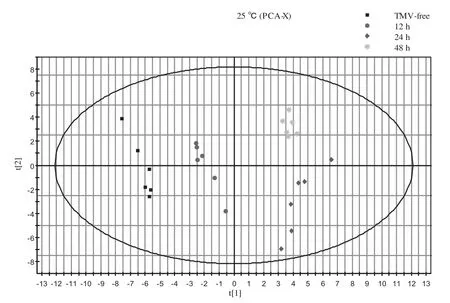
图2 25℃下TMV未侵染和不同侵染时间点样品的PCA得分图Fig. 2 PCA scores plots of TMV-free and TMV infected samples at different time at 25℃

图3 31℃下TMV未侵染和不同侵染时间的PCA得分图Fig.3 PCA scores plots of TMV-free and TMV infected samples at different time at 31℃
2.3 不同温度下TMV侵染枯斑三生烟差异性代谢物的变化
对GC-MS数据进行OPLS-DA分析。图4显示,在25℃条件下与对照(TMV-free)相比,TMV侵染后12 h、24 h、48 h的模型累积解释率分别为0.665、0.831、0.898,得分率分别为0.92、0.972、0.972,模型可靠。提取OPLS-DA模型中VIP>1的物质变量,这些物质在载荷图中距原点距离较大,说明这些物质在TMV侵染后12 h、24 h、48 h后代谢途径有了较大的变化。由表1可知,与对照相比,TMV侵染后12 h引起蔗糖、甘油酸、肌醇含量的显著下调,糖类(葡萄糖和果糖)、有机酸类(苹果酸和水杨酸)、氨基酸类(γ-氨基丁酸GABA和脯氨酸)以及肌醇与乙醇胺含量的显著上调; TMV侵染24 h与12 h变化基本相同,而在24 h葡萄糖和肌醇未发生显著变化,同时延胡索酸的含量显著下调;TMV侵染48 h,蔗糖、甘油酸、延胡索酸、肌醇含量的显著下调,同时果糖和核糖、苹果酸和水杨酸、GABA与乙醇胺含量的显著上调。
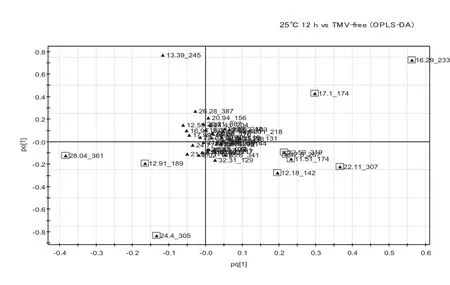
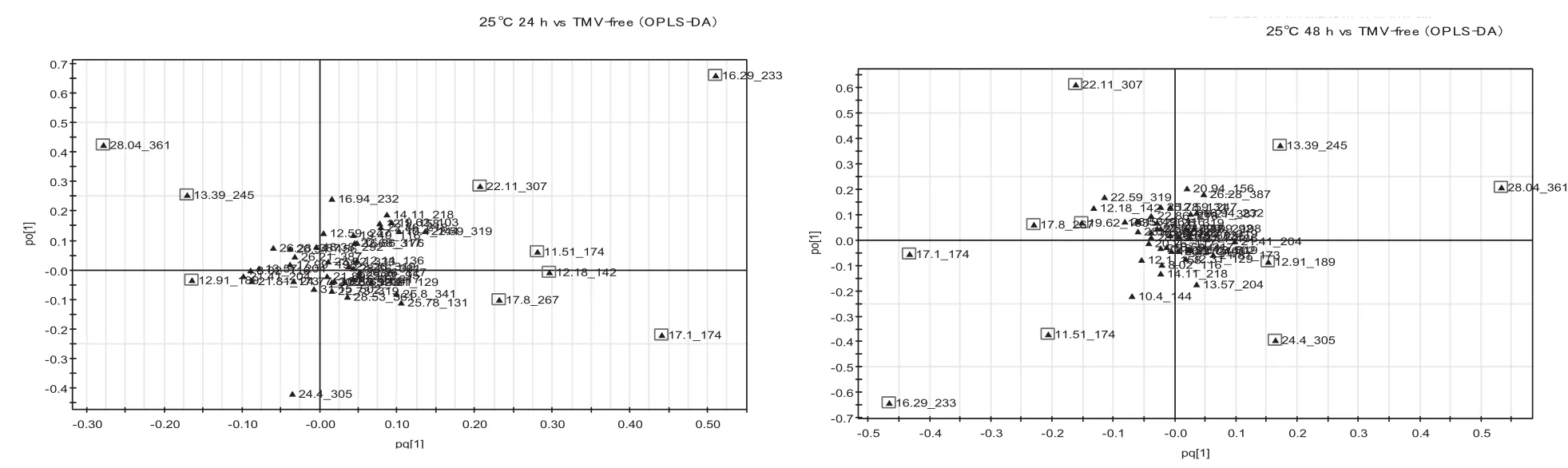
图4 25℃条件下各个侵染时间点的OPLS-DA荷载图Fig. 4 Loading plots of each infection time by OPLS-DA at 25℃
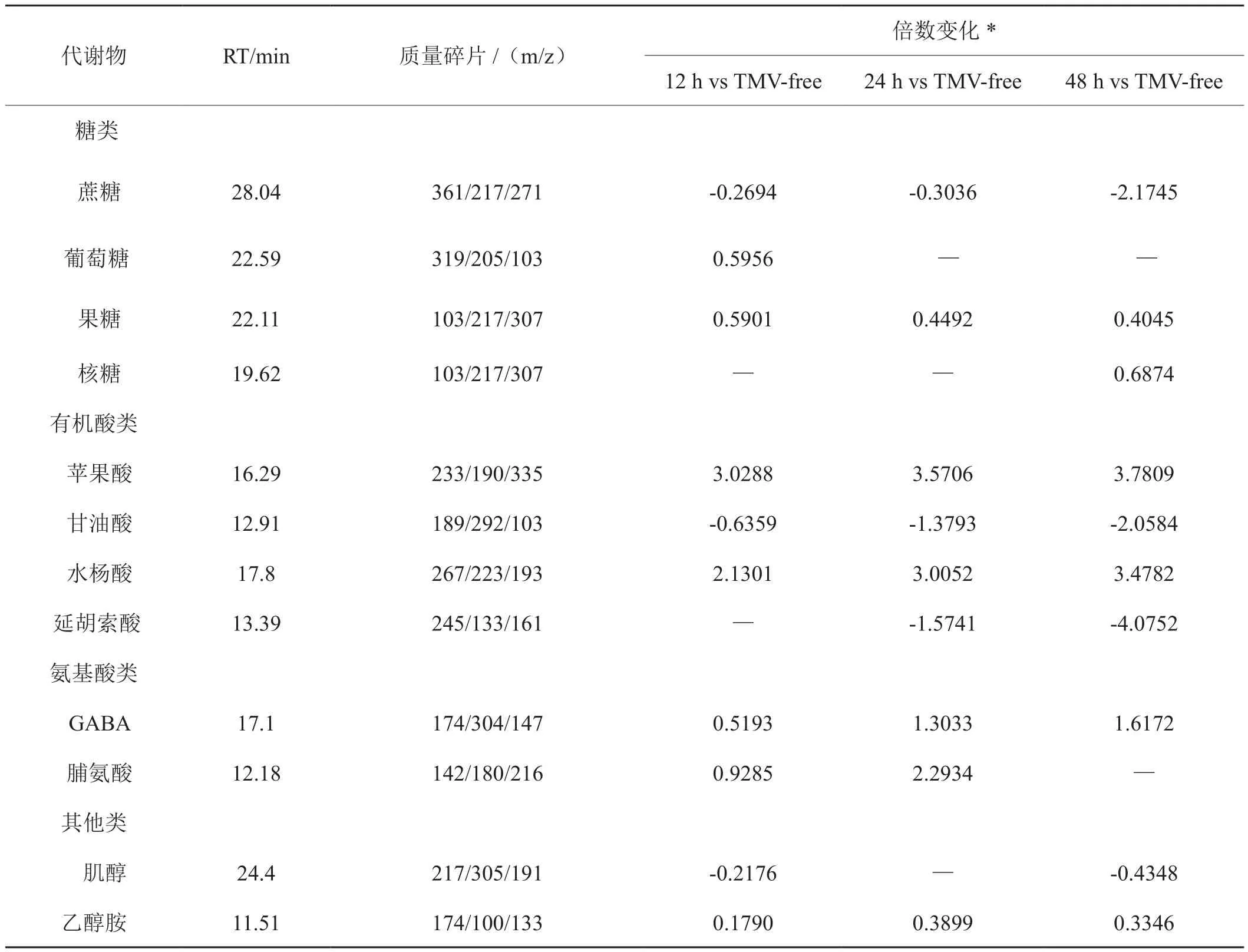
表1 25℃条件下侵染各时间点差异性代谢物的变化Tab.1 Changes of metabolites at different infection time at 25℃
图5显示在31℃条件下,各侵染时间点与对照相比的差异性代谢物。TMV侵染后12 h、24 h、48 h的模型累积解释率分别为0.779、0.848、0.894,得分率分别为0.987、0.983、0.993。表2显示,与对照相比,TMV侵染12 h,蔗糖、甘油酸、天冬氨酸、GABA、肌醇含量显著下调,糖类(葡萄糖、果糖和核糖)、苹果酸、缬氨酸、脯氨酸与硬脂酸含量显著上调;TMV侵染后24 h,蔗糖、天冬氨酸、乙醇胺、肌醇含量与对照相比显著下调,而葡萄糖和果糖、苹果酸和一些氨基酸类(天冬酰胺、GABA、缬氨酸、异亮氨酸、酪氨酸)含量则显著上调;在TMV侵染后48 h,糖类变化与侵染后24 h类似,苹果酸含量上调、甘油酸含量下调,氨基酸类(GABA、缬氨酸、异亮氨酸、酪氨酸)含量显著上调。
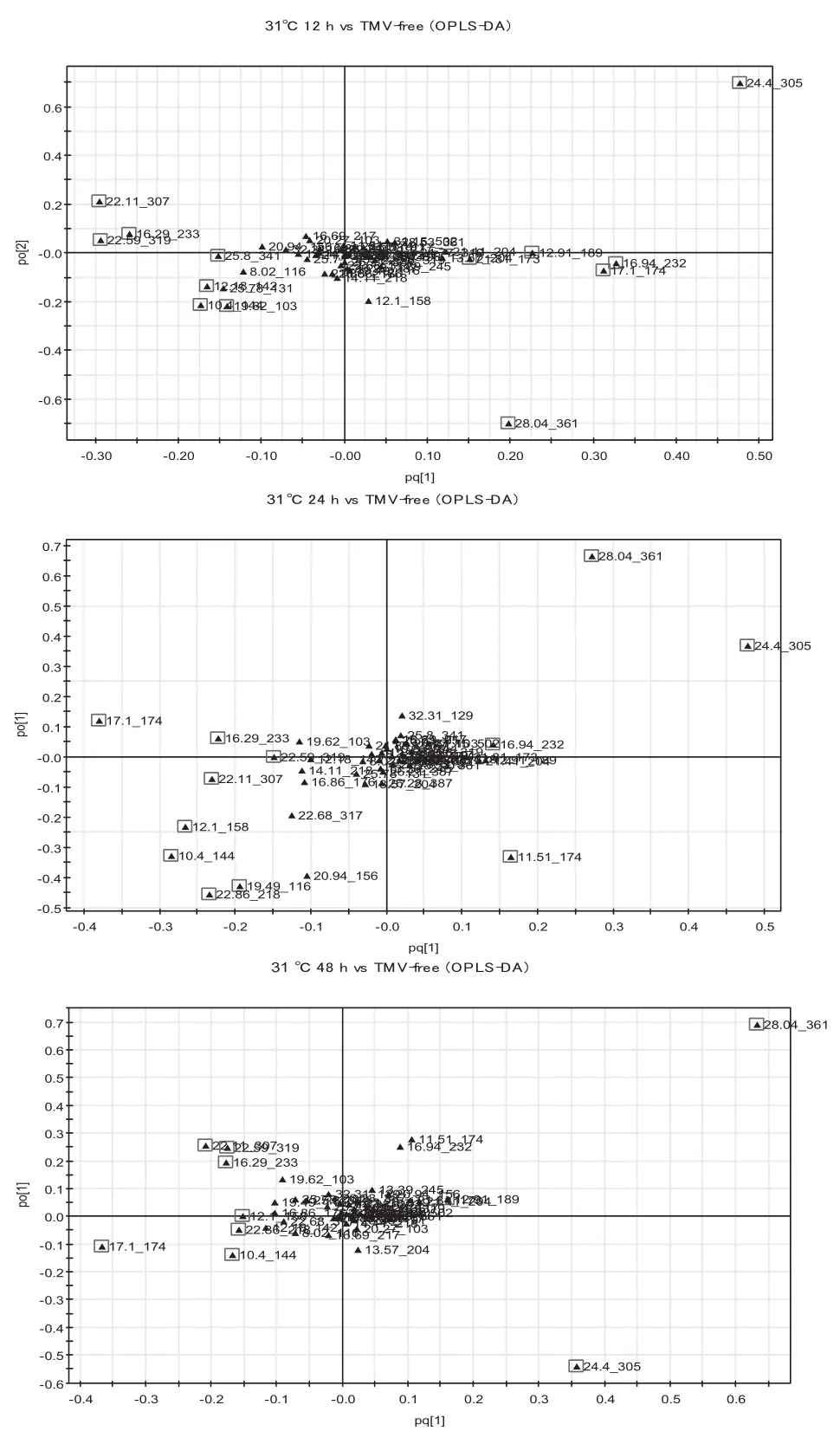
图5 31℃条件下各个侵染时间点的OPLS-DA荷载图Fig.5 Loading plots at each infection time by OPLS-DA at 31℃
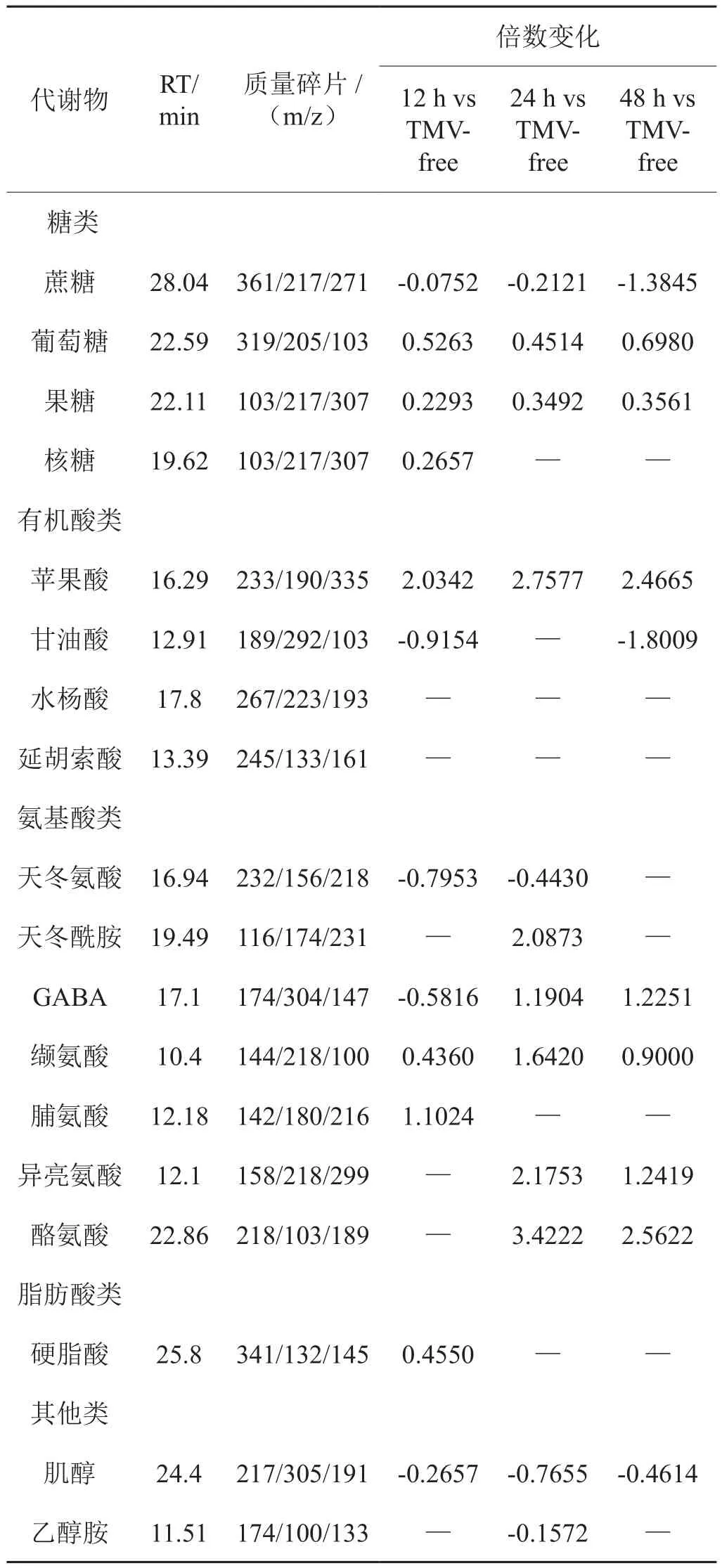
表2 31℃条件下侵染各时间点差异性代谢物的变化Tab.2 Changes of metabolites at different infection time at 31℃
由两个温度下的组内分析可知,糖类的变化基本一致,蔗糖含量下调伴随果糖和葡萄糖含量上调。有机酸类中苹果酸含量上调而甘油酸含量下调,在25℃条件下,还伴随水杨酸含量显著上调。氨基酸类中GABA和脯氨酸在25℃中都明显上调,而在31℃中氨基酸类在24 h以后含量普遍上调。肌醇的变化也基本一致,都显著下调,而乙醇胺在25℃变化明显为显著上调。
为了进一步明确在25℃和31℃条件下TMV侵染所造成的代谢差异,进行了组间的OPLS-DA分析。得分图图6显示,模型的累积解释率为R2X=0.936,第一主成分可以显著区分不同温度的代谢差异。图7对组间各个时间点进行差异物质的筛选和比较,不同温度下侵染12 h、24 h、48 h的累积解释率分别为0.819、0.794和0.92。
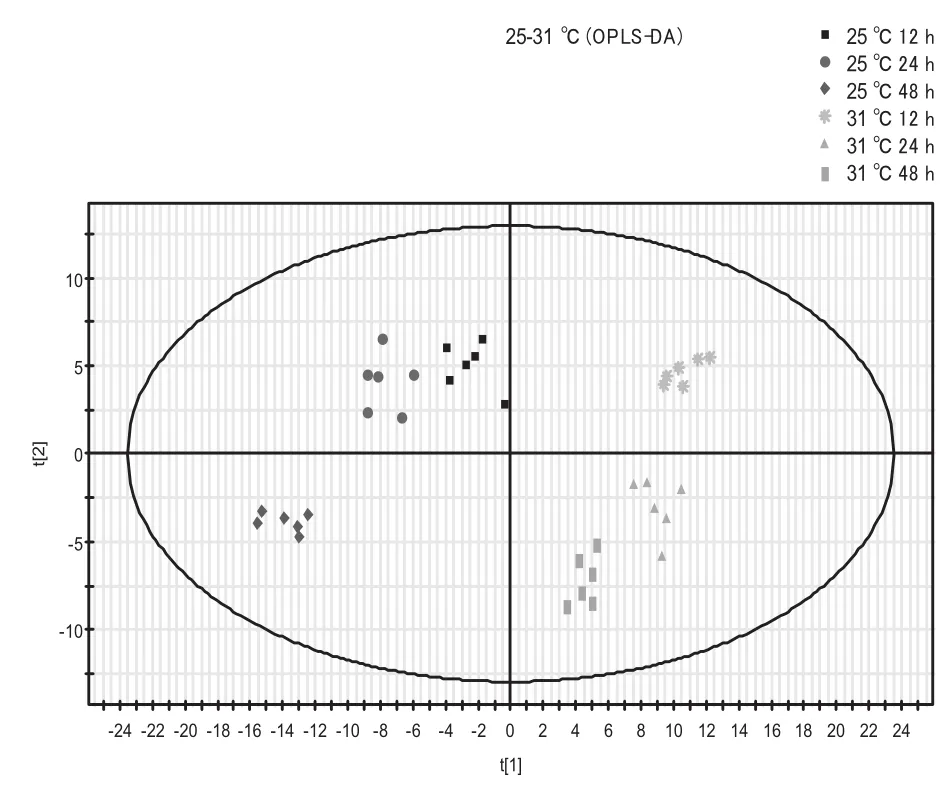
图6 25℃和31℃条件下各侵染时间点总OPLS-DA得分图Fig. 6 OPLS-DA scores plots of samples at different infection time at 25℃ and 31℃
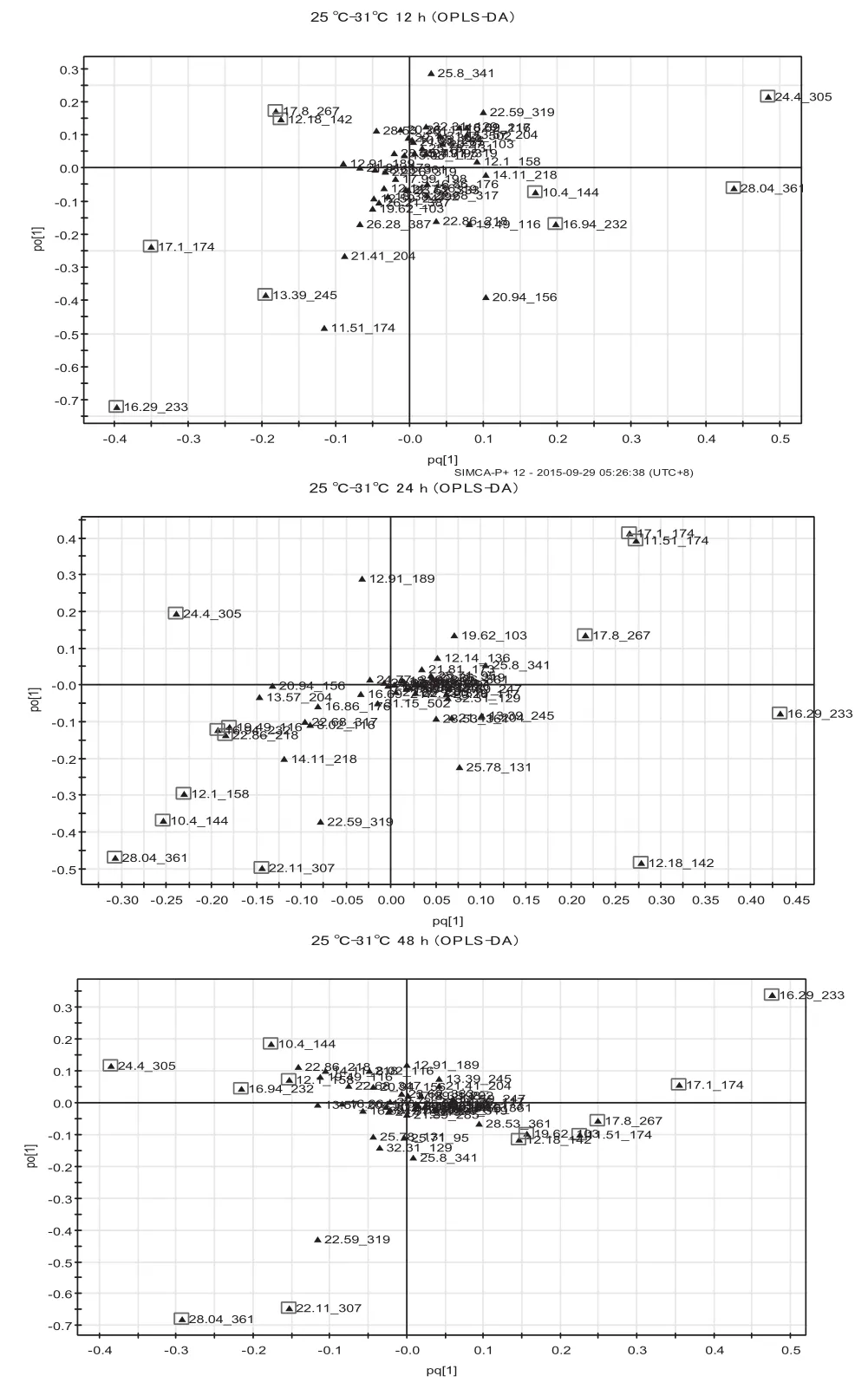
图7 25℃和31℃条件下各个侵染时间点的OPLS-DA载荷图Fig. 7 OPLS-DA loading plots at different infection time at 25℃and 31℃

表3 25℃和31℃条件下各侵染时间点差异性化合物的变化Tab.3 Changes of metabolites at different infection time at 25℃ vs 31℃

续表3
表3显示,31℃条件下对比25℃条件下,侵染12 h时,蔗糖、氨基酸类(天冬氨酸和缬氨酸)、肌醇含量显著升高,而有机酸类、GABA和脯氨酸显著下降;侵染24 h时,糖类(蔗糖和果糖)、一些氨基酸类(天冬氨酸、天冬酰胺、缬氨酸、异亮氨酸、酪氨酸)、肌醇含量升高,苹果酸、水杨酸、GABA、脯氨酸含量显著下降;在侵染48 h时,蔗糖、果糖、天冬氨酸、缬氨酸、异亮氨酸、肌醇含量显著升高,而核糖、水杨酸、苹果酸、GABA、脯氨酸、乙醇胺含量显著下降。
通过组间比较,在25℃条件下,TMV侵染显著影响了有机酸类(苹果酸和水杨酸)、氨基酸类(GABA和脯氨酸)、乙醇胺等物质的代谢。而在31℃条件下,N基因失活后,TMV侵染使糖类(蔗糖、葡萄糖、果糖)、氨基酸类(天冬氨酸、天冬酰胺、缬氨酸、异亮氨酸、酪氨酸)、肌醇的变化更为显著。各个物质在25℃和31℃条件下随时间的变化情况见表1和表2。
通过组内与组间比较综合来看,25℃条件下,TMV侵染引起苹果酸、水杨酸、GABA、脯氨酸和乙醇胺等代谢物含量上调,而31℃条件下即高温N基因失活后,TMV侵染引起蔗糖和肌醇含量的下调,而果糖、葡萄糖和氨基酸类含量普遍上调。
3 结论与讨论
TMV在不同温度下侵染枯斑三生烟,引起了代谢物质的变化。运用GC-MS技术,结合PCA、OPLS-DA等分析手段,寻找到不同温度下引起代谢差异的关键性物质,并初步分析了其含量变化。分析可知,在N基因正常表达时TMV侵染引起苹果酸、水杨酸、GABA、脯氨酸和乙醇胺等代谢物含量上调即影响了TCA循环、水杨酸代谢、GABA旁路及多胺类等相关的代谢产物,而在高温引起N基因失活后,TMV侵染枯斑三生烟表现为蔗糖和肌醇含量的下调,而果糖、葡萄糖和氨基酸类含量普遍上调,即影响了耗能反应的糖代谢、氨基酸代谢和肌醇的变化。
3.1 TMV侵染引起的有机酸类在寄主中的代谢变化
苹果酸作为三羧酸循环的重要组成部分,在植物代谢中起着重要作用。受到病原菌侵染,组织中苹果酸会迅速累积,并作为NADP-苹果酸脱氢酶的底物产生活性氧(reactive oxygen species,ROS),特别是产生H2O2,这是一种重要的调节分子[12]。H2O2能够直接杀死病原菌,还可以诱导细胞壁结构蛋白的变化来阻止病菌的侵入[13],并通过激活水杨酸的合成来诱导N基因的表达,产生系统获得性抗性。寄主通过蔗糖的降解、苹果酸合成、糖酵解等途径来保证苹果酸的积累,增强植株防御反应。表1和表2显示TMV侵染在两个温度下,苹果酸的含量与对照相比都有积累,而在表3显示在25℃条件下含量显著高于31℃,这可能与N基因调控的过敏反应有关。
水杨酸作为重要的信号分子可通过介导寄主过敏反应从而诱导植株产生系统获得抗性(SAR)。当TMV侵染后,侵染点处水杨酸(SA)含量升高,进而植物其他部位SA含量升高,从而获得系统抗性[14]。结合表1分析,在25℃的水杨酸含量变化非常明显,在侵染的48 h内的3个时间段含量依次升高,而在31℃条件下水杨酸的含量没有发生明显改变。
甘油酸是光合代谢途径磷酸甘油酸的前体物质。在25℃和31℃条件下,甘油酸含量都有所下降,推测可能与TMV侵染导致光合作用下降有关。
3.2 TMV侵染引起的GABA旁路的变化
GABA代谢途径作为三羧酸循环的一个旁路在逆境胁迫中起了重要作用,可以调节与逆境胁迫相关的基因合成或蛋白表达,从而增强植物抗逆性[15]。GABA富集在生物和非生物胁迫中起了重要作用,可以有效的消除活性氧引起的细胞毒性[16-17]。外源GABA可以显著提高超氧化物歧化酶(SOD)、过氧化氢酶(POD)和过氧化氢酶(CAT)这3种抗氧化酶的活性。Park等研究表明,GABA在植物与假单胞菌的互作中发挥重要作用,通过内源含量的提高来增强植物抗病性[18]。在本实验中在25℃和31℃下GABA都有富集,但在25℃下含量显著高于31℃,推测GABA旁路的变化可能与增强了枯三生的抗病性有关。
3.3 TMV侵染引起的糖类的变化
糖类在植物的生长、发育和代谢中发挥重要作用,糖类是光合作用的产物也是呼吸作用的底物,为植物生长提供能量并增强植物的抗逆性,糖代谢处于整个生物代谢的核心,沟通了蛋白质代谢、脂质代谢、核酸代谢及次生物代谢[19]。在两个温度下,TMV侵染后蔗糖降解都伴随着葡萄糖和果糖的积累,在N基因失活下,病毒的系统侵染导致了植株需要产生更多的能量来抵御病毒的扩散。
3.4 TMV侵染引起的氨基酸类的变化
脯氨酸是植物体内重要的渗透调节物质,在稳定细胞结构、维持细胞渗透平衡和增强抗逆性方面发挥着重要的作用[20]。在本研究中25℃条件下,处理植株脯氨酸的含量与对照相比上调,说明植物抗逆性增强。在31℃条件下,各种氨基酸的变化规律有所不同,一些可能与阻止氨过量引起细胞毒性的转氨作用有关,如将天冬氨酸转化为天冬酰胺。而其他一些氨基酸含量的上调可能与TMV病毒复制的外壳蛋白的物质储备有关。
3.5 TMV侵染引起的其他物质变化
在25℃下乙醇胺的代谢变化明显,与对照相比含量上升,乙醇胺属于多胺类物质,多胺类在抗逆中可以维持膜的稳定性,调节细胞内外阴阳离子的平衡[21]等来增强植株的抗性。肌醇在TMV侵染叶片后,可能参与细胞壁的生物合成,磷脂信号通路或调节细胞骨架[22-24]。研究表明肌醇含量下降导致了渗透压失衡,影响了碳水化合物分配和运输[25]。且磷酸肌醇直接参与调控植物对病害等逆境胁迫的抗性[26]。Andersson等的研究显示丁香假单胞菌侵染植物时,肌醇的浓度下降[27]。表1和表2显示在25℃和31℃条件下TMV侵染均引起肌醇含量下调,表3显示在31℃条件下侵染位点肌醇水平高于25℃, 推测肌醇含量改变与病毒侵染有关。
本文对不同温度下TMV侵染枯斑三生的代谢轮廓进行了分析,明确了25℃和31℃条件下TMV侵染枯斑三生烟株代谢物质的差异,对代谢物变化原因进行了初步分析,为探讨高温介导枯斑三生对TMV天然免疫反应丧失的机理提供了前期的研究基础。在该研究中也存在代谢组学的普遍问题,如样本代谢组变化快、稳定性较差、数据处理模式不够成熟等,这有赖于分析技术和数据处理技术的不断完善。在今后的研究中,代谢组的研究结果可以同蛋白质组学与转录组学相结合,利用代谢通路分析软件和基因编辑的技术对部分特异性代谢途径进行定点定向敲除,从而进一步揭示N基因在高温下失活的机理。
[1] Holmes F O. Inheritance of resistance to tobacco-mosaic disease in tobacco[J]. Phytopathology, 1938, 28(8):553-561.
[2] Marathe R, Liu R A, Dinesh-Kumar S P. The tobacco mosaic virus resistance gene, N[J]. Molecular Plant Pathology, 2002, 3(3):167-72.
[3] 张玉, 罗成刚, 殷英, 等. 烟草N基因及其在烤烟遗传育种中的应用[J]. 中国农学通报, 2013(19):89-92.Zhang Yu, Luo Chenggang, Yin Ying, et al. TobaccoNgene and its application in genetic breeding [J]. Chinese Agricultural Science Bulletin, 2013, 29(19): 89-92. (in Chinese)
[4] L. Király, Y. M. Hafez, J. Fodor, et al. Suppression of tobacco mosaic virus-induced hypersensitive-type necrotization in tobacco at high temperature is associated with down regulation of NADPH oxidase and superoxide and stimulation of dehydroascorbate reductase[J]. Journal of General Virology, 2008, 89(3):799-808.
[5] SAMUEL, GEOFFREY. Some Experiments On Inoculating Methods With Plant Viruses, And On Local Lesions[J].Annals of Applied Biology, 2008, 18(4):494-507.
[6] Rochfort SJ; Trenerry VC; Imsic M; Panozzo J;Jones R. Class targeted metabolomics: ESI ion trap screening methods for glucosinolates based on MS(n)fragmentation[J]. Phytochemistry, 2008, 69(8):1671–1679.
[7] Fiehn O, Weckwerth W. Deciphering metabolic networks[J].Febs Journal, 2003, 270(4):579-88.
[8] Rochfort S. Metabolomics Reviewed: A New “Omics”Platform Technology for Systems Biology and Implications for Natural Products Research[J].The Journal of Natural Products, 2005, 68(12):1813-1820.
[9] Yonekurasakakibara K, Saito K. Functional genomics for plant natural product biosynthesis.[J]. Natural Product Reports, 2009, 26(11):1466-87.
[10] Bazzini A A, Manacorda C A, Takayuki T, et al.Metabolic and miRNA profiling of TMV infected plants reveals biphasic temporal changes.[J]. Plos One, 2011,6(12):e28466.
[11] Lisec J, Schauer N, Kopka J, et al. Gas chromatography mass spectrometry-based metabolite pro fi ling in plants[J].Nature Protocols, 2006,1(1):387-396.
[12] Casati P, Ncovich M F, Edwards G E, et al. Malate metabolism by NADP-malic enzyme in plant defense[J].Photosynthesis Research, 1999, 61(2):99-105.
[13] Leon J, Lawton M A, Raskin I. Hydrogen Peroxide Stimulates Salicylic Acid Biosynthesis in Tobacco[J]. Plant Physiology, 1995, 108(4):1673-1678.
[14] Murphy A M, Carr J P. Salicylic acid has cell-specific e ff ects on Tobacco mosaic virus replication and cell-to-cell movement[J]. Plant Physiology, 2002, 128(2):552-563.
[15] Hugues R, Abdelhak E A, Ravishankar P, et al. GABA Accumulation Causes Cell Elongation Defects and a Decrease in Expression of Genes Encoding Secreted and Cell Wall-Related Proteins in Arabidopsis thaliana[J]. Plant& Cell Physiology, 2011, 52(5):894-908.
[16] Bouché N, Fromm H. GABA in plants: just a metabolite[J].Trends in Plant Science, 2004, 9(3):110-5.
[17] Fait A, Fromm H, Walter D, et al. Highway or byway: the metabolic role of the GABA shunt in plants[J]. Trends in Plant Science, 2008, 13(1):14-19.
[18] Park D H, Mirabella R, Bronstein P A, et al. Mutations in γ-aminobutyric acid (GABA) transaminase genes in plants or Pseudomonas syringae reduce bacterial virulence[J].Plant Journal, 2010, 64(2):318-330.
[19] 罗玉. 植物中的糖代谢及其相关酶[J]. 文山师范高等专科学校学报, 2004, 17(2):155-159.Luo Yu. The sugar metabolism and the relational enzymes in plants[J]. Journal of Wenshanteachers College, 2004,17(2):155-159. (in Chinese)
[20] 王丽媛, 丁国华, 黎莉. 脯氨酸代谢的研究进展[J]. 哈尔滨师范大学自然科学学报, 2010, 26(2):84-89.Wang Liyuan, Ding Guohua, Li Li. Progress in synthesis and metabolism of proline[J]. Natural Sciences Journal of Harbin Normal University, 2010, 26(2):84-89. (in Chinese)
[21] Bouchereau A, Aziz A, Larher F, et al. Polyamines and environmental challenges: recent development[J]. Plant Science, 1999, 140(98):103-125.
[22] Gawer M, Norberg P, Chervin D, et al. Phosphoinositides and stress-induced changes in lipid metabolism of tobacco cells[J]. Plant Science, 1999, 141(98):117-127.
[23] Staiger C J, Goodbody K C, Hussey P J, et al. The pro fi lin multigene family of maize: di ff erential expression of three isoforms[J]. Plant Journal, 1993, 4(4):631-641.
[24] Yang W, Burkhart W, Cavallius J, et al. Purification and characterization of a phosphatidylinositol-4-kinase activator in carrot cells[J]. Journal of Biological Chemistry, 1993,268(268):392-8.
[25] Sheveleva E V, Marquez S, Chmara W, et al. Sorbitol-6-Phosphate Dehydrogenase Expression in Transgenic Tobacco: High Amounts of Sorbitol Lead to Necrotic Lesions[J]. Plant Physiology, 1998, 117(3):831-839.
[26] Gillaspy G E. The cellular language of myo-inositol signaling[J]. New Phytologist, 2011, 192(4): 823-839.
[27] Andersson M X, Kourtchenko O, Dangl J L, et al.Phospholipase‐dependent signalling during the AvrRpm1‐and AvrRpt2‐induced disease resistance responses in Arabidopsis thaliana[J]. The Plant Journal,2006, 47(6): 947-959.
Metabolic pro fi ling analysis of immune de fi ciency of TMV by high temperature mediated geneN
LIU Xu1,2, WANG Yaofeng3, YU Guanghong4, SONG Yuchuan4, WANG Jie1, SHEN Lili1, WANG Fenglong1, YANG Jinguang1
1 Key Laboratory of Tobacco Pest Monitoring, Controlling & Integrated Management, Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, Shandong, China;2 Graduate School, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3 Gansu Qingyang Municipal Tobacco Company, Xifeng 745000, Gansu, China;4 Yunnan Oriental Tobacco Company, Baoshan 678000, Yunnan, China
High temperature above 28℃ may cause geneNto lose its resistance to TMV infection. This research studied the metabolic di ff erences between TMV-free and TMV-infectedNicotiana tabacumvar. Samsun NN 12h, 24h and 48h after infection at 25℃ and 31℃respectively. Gas chromatography–mass spectrometry and PCA and OPLS-DA were used to determine di ff erent metabolites. By using GCMS, 49 kinds of metabolites were detectable, containing amino acids, sugars, organic acids, organic acids, and polyamine. It was concluded that TMV infectedN. tabacumvar. Samsun NN cause the rise of malic acid, salicylic acid, γ-aminobutyric acid, proline and ethanolamine at 25℃ whileN. tabacumvar. Samsun NN lose its function of geneNwith the decrease of sucrose and inositol and the rise of glucose,fructose and amino acids at 31℃.
TMV; metabolite; geneN
刘旭,王耀峰,余广宏,等. 高温介导N基因对TMV免疫丧失的代谢轮廓分析 [J]. 中国烟草学报,2016,22(2)
山东省自然科学基金(ZR2014CQ025);国家烟草专卖局创新平台项目自助(023201305)
刘 旭(1991—),硕士,研究方向为植物病理学,Email: daisyliuxu@163.com
杨金广(1979—),博士,副研究员,研究方向为植物病毒学,Tel:0532-88703236,Email: yangjinguang@caas.cn
2015-08-26
: LIU Xu, WANG Yaofeng, YU Guanghong, et al. Metabolic pro fi ling analysis of immune de fi ciency of TMV by high temperature mediated geneN[J]. Acta Tabacaria Sinica, 2016,22(2)
