马铃薯PVY和PLRV病毒的TC-RT-PCR检测
2016-11-16郑叶叶迟胜起张剑峰
郑叶叶,韩 磊,迟胜起,张剑峰
(青岛农业大学农学与植物保护学院,山东 青岛 266109)
病虫防治
马铃薯PVY和PLRV病毒的TC-RT-PCR检测
郑叶叶,韩 磊,迟胜起*,张剑峰*
(青岛农业大学农学与植物保护学院,山东 青岛 266109)
传统的RT-PCR技术检测病毒需提取总RNA,RNA容易降解。利用试管捕捉反转录扩增(Tube capture RT-PCR,TC-RT-PCR)方法检测了PVY和PLRV 2种病毒,实现了不需提取总RNA也可在同一反应中同时检测2种病毒。根据已报道的引物用TC-RT-PCR的方法对PVY和PLRV的外壳蛋白基因进行了检测。结果表明,TC-RT-PCR能够成功的检测出感染PVY或PLRV以及2种病毒共同侵染的样品,扩增产物序列长度均与设计片段的长度相符,分别为781和364 bp,2种病毒扩增产物的测序结果同GeneBank中已知的序列比对后的同源性均高达97%以上。该技术为单独或复合感染的马铃薯病毒的检测提供了更加方便、高效的方法。同时测得试验PVY病毒样本属于PVYNW株系。
PVY;PLRV;试管捕捉RT-PCR
病毒病是引起马铃薯退化的主要原因,可造成的产量损失高达80%[1]。已发现的马铃薯病毒多达40余种[2],而马铃薯Y病毒和马铃薯卷叶病毒最为常见、危害最为严重。解决马铃薯退化减产的主要对策是培育和种植脱毒种薯,但仍有大量的马铃薯种薯并非脱毒薯,而且脱毒种薯经常发生病毒复侵染,生产中马铃薯病毒的检测是保障马铃薯品质和产量的重要基础,所以成为需要解决的重要问题[3],由于田间经常发生多种马铃薯病毒的复合侵染[4],每个材料就单一病毒检测需要多次操作,增加检测成本,国内外已有多人对马铃薯病毒进行了单重多重RT-PCR检测[3-5],并已应用在病毒检测中。
试管捕捉RT-PCR(TubecaptureRT-PCR,TC-RT-PCR是在普通RT-PCR的基础上建立的1种新方法。其不需提取RNA,而是利用病毒颗粒外壳蛋白与试管非特异性结合和RT-PCR扩增结合起来的1种病毒检测和基因克隆的技术,避免了RNA的降解,可以和普通RT-PCR得到同样的结果[6],该技术已经应用于一些植物病毒的检测中[7,8]。马铃薯Y病毒(Potato virus Y,PVY)具有明显的株系分化现象。目前已被广泛认同的株系类型有PVYO株系、PVYN株系、PVYC株系、PVYNTN株系、PVYNW株系、PVYN:O株系和PVYNA-NTN株系等。通过对PVY不同株系试验,建立不同株系的相同检测方法也非常重要。
本研究建立的双重TC-RT-PCR分子检测方法能够一步诊断生产中单独或复合感染马铃薯病毒的材料,大大提高了试验的效率和成功率,同时初步鉴定出该PVY的株系类型。
1 材料与方法
1.1 试验材料及试剂
材料:健康马铃薯‘Shepody’脱毒苗和同时携带PVY和马铃薯卷叶病毒(Potato leafroll virus,PLRV)的马铃薯‘Shepody’材料保存于青岛农业大学植物病毒学实验室。
试剂:PLRV、PVY抗体试剂包购自英国Adgen公司;RNAiso Plus、Ribonuclease inhibitor、M-MLV反转录酶、dNTPs、MgCl2、Taq DNA聚合酶等均购自宝生物工程(大连)有限公司(Takara);引物由生工生物(上海)有限公司(Sangon)合成;DNA Fragment Quick Purification/Recover Kit购自北京鼎国生物技术有限责任公司;其他化学试剂均为国产分析纯。
1.2 引物设计
采用张华鹏等[9]设计的引物YS/YA及RS/RA(表1)分别检测PVY和PLRV的CP基因,扩增片段长度分别为781和364 bp。采用Rigotti和Gugerli[10]设计的引物PVYc3/f、PVY3+/3-及CP2+/1-(表1),用于鉴定PVY株系。
1.3 PVY和PLRV的普通RT-PCR
RNA提取:选取带毒或健康马铃薯的茎叶及芽,用RNAiso Plus(Takara)试剂提取PVY和PLRV总RNA,具体操作见试剂盒说明。提取的RNA通过琼脂糖凝胶电泳进行检测,用紫外法测定其RNA含量。

表1 引物信息Table 1 Primer information
以PVY和PLRV总RNA为模板,分别用对应的引物对(YS,YA)和(RS,RA)进行RT-PCR;对照为健康马铃薯材料。
cDNA合成:10 μL反转录体系:RNA模板1 μL,3'端引物(10 μmo/L 0.5 μL,补ddH2O至5.5 μL,70℃水浴10 min后立即置于冰上冷却2 min,加入5×RTBuffer2μL,dNTPs(2.5mmol/L)2μL,M-MLV 0.25 μL,Ribonuclease inhibitor 0.25 μL。反应条件:42℃延伸1 h,70℃变性15 min,4℃反应5 min。
PCR扩增:50 μL体系:反转录产物10 μL,5'端引物(10 μmol/L)0.5 μL,MgCl23 μL,Taq酶0.25μL,10×PCRBuffer5μL,补加ddH2O至50μL。反应条件:94℃预变性4 min,94℃变性30 s,56℃退火30 s,72℃延伸30 s,共进行30个循环;72℃延伸10 min。PCR反应结束后,取2 μL PCR产物用1.0%琼脂糖凝胶进行电泳,经Goldview染色后观察结果。
1.4 样品的制备
样品制备如下:称取2 g病叶或病芽,加少许液氮研碎后按1∶10(W/V)加入GEB充分研磨后,4℃、10 000 r/min离心10 min,取上清,用于TC-RT-PCR检测。
1.5 PVY和PLRV的单重TC-RT-PCR
包被:取病毒提取液100包被0.2 mL PCR管,4℃包被过夜;PBST洗管3次,ddH2O洗2次后,室温放置干燥后备用。
cDNA合成:10μL反转录体系:直接在PCR管中进行反转录。3'端引物(10 μmo/L)0.5 μL,补ddH2O至5.5μL,70℃水浴10 min后立即置于冰上冷却2min,再加入5×RT Buffer 2 μL,dNTPs(2.5 mmol/L)2 μL M-MLV0.25 μL,Ribonuclease inhibitor 0.25 μL。反应条件:42℃延伸1 h,70℃变性15 min,4℃反应5 min。
PCR扩增:步骤同1.3。
1.6 PVY和PLRV的双重TC-RT-PCR
取病毒提取液100包被,具体步骤同1.4。在同一反应体系中,同时加入2种病毒的引物进行双重TC-RT-PCR。对照反应中同时加入健康马铃薯RNA模板和2种病毒的引物。反应条件同单重TC-RT-PCR(步骤1.5)。
1.7 DAS-ELISA检测
称取2 g病叶或病芽,加少许液氮研碎后按1∶10(W/V)加入GEB充分研磨后,4℃、10 000 r/min离心10 min,取上清,用于DAS-ELISA检测。具体步骤见抗体试剂包说明。
1.8 PVY株系的TC-RT-PCR
单引物的PVY株系的TC-RT-PCR具体步骤同1.5,所用引物分别为PVYc3/f、PVY3+/3-和CP2+/1-。
多引物的PVY株系的扩增50 μL体系中引物为PVYc3/f、PVY3+/3-和CP2+/1-,具体步骤同1.3。扩增产物送生工生物(上海)有限公司测序。
2 结果与分析
2.1 普通RT-PCR检测PVY和PLRV
普通RT-PCR、普通双重RT-PCR的扩增产物进行琼脂糖凝胶电泳(图1)。结果显示,普通RT-PCR、普通双重RT-PCR扩增产物长度分别与各自目的片段的大小相符。得到的片段即为要检测的目的基因片段。

图1 PVY和PLRV的普通RT-PCR产物检测电泳Figure 1 RT-PCR product detection electrophoresis of PVY and PLRV
2.2 TC-RT-PCR检测PVY和PLRV
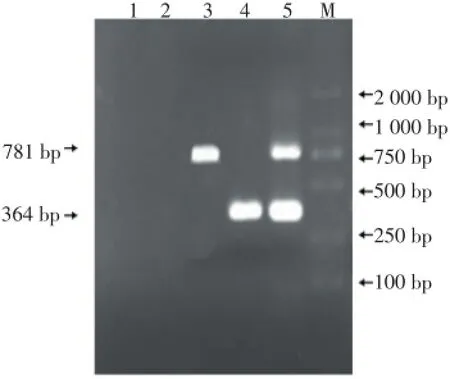
图2 PVY和PLRV的TC-RT-PCR产物检测电泳Figure 2 TC-RT-PCR product detection electrophoresis of PVY and PLRV
单重TC-RT-PCR和双重TC-RT-PCR的扩增产物进行琼脂糖凝胶电泳(图2)。结果显示,单重TC-RT-PCR和双重TC-RT-PCR扩增产物长度分别与各自目的片段的大小相符。得到的片段即为要检测的目的基因片段。
2.3 目的片断验证
所有扩增产物测序结果表明,目的片段序列与PVY和PLRV设计的部分序列相同。
PVY和PLRV扩增序列与发表的CP基因进行同源性比较,显示PVY与S74810(USA)、PVU25672(China)、EU073859(Jordan)和KR816232(Russia)的同源性均大于97%,PLRV与X77322、DQ315385、JQ420904和KC866618的同源性均大于99%,表明检测的株系间具有很高的同源性,属于同种病毒。TC-RT-PCR的检测结果与普通RT-PCR结果完全一致。
2.4 ELISA、普通RT-PCR及TC-RT-PCR方法的检测结果
分别用ELISA、普通RT-PCR及TC-RT-PCR方法检测了22株携带PVY和PLRV的马铃薯植株,结果如下(表2、表3、图3、图4):22株携带病毒的马铃薯植株中,有11株只含PVY,6株只含PLRV,3株含有PVY和PLRV两种病毒,2株不含这2种病毒。3种检测方法结果一致,说明TC-RT-PCR方法有实用性,能检测感染1种病毒植株也可以检测复合侵染的植株。

表2 PVY的ELISA检测结果Table 2 ELISA test results of PVY
表3 PLRV的ELISA检测结果Table 3 ELISA test results of PLRV

图3 PVY和PLRV的普通RT-PCR产物Figure 3 RT-PCR product of PVY and PLRV
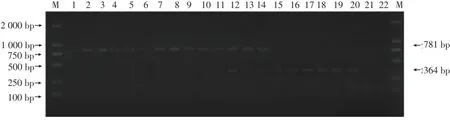
图4 PVY和PLRV的TC-RT-PCR产物Figure 4 TC-RT-PCR product of PVY and PLRV

图5 PVYNW株系的PCR产物Figure 5 PCR product of PVYNW
2.5 PVY株系的鉴定
采用引物PVYc3/f、PVY3+/3-及CP2+/1-进行PVY株系的TC-RT-PCR,扩增产物只有1条带,大小为530 bp,扩增产物测序结果显示其长度与目的片段相符(图4)。测序结果,与PVYNW株系进行同源性比较也得到证实,表明该PVY株系与Z70238的同源性为98.51%,说明该PVY病毒属于PVYNW株系(图5)。
3 讨论
传统RT-PCR(Reverse Transcription-PCR)技术已被成功应用在病毒检测上,国内外研究者在RT-PCR检测方法上进行了多次改良[11-13],该方法不仅快速,且特异性强、灵敏度高。但这些方法都存在病毒RNA的提取,不仅步骤繁琐且RNA极易受外界因素干扰而降解,并且本身组织中含有的酚类、多糖和蛋白质等干扰因素,导致很难获得高质量RNA。一般认为提取高质量RNA是RT-PCR反应的关键[14],因此该技术对RNA提取过程的要求较为严格。TC-RT-PCR不需要提取RNA,而是利用试管非特异性捕捉病毒粒体,既简化了操作程序、降低了操作要求又减少了成本。本研究用试管捕捉的方法,直接在试管中进行反转录扩增,并应用到马铃薯病毒PVY和PLRV检测中。
马铃薯常有多种病毒的复合侵染,单重检测已不能满足当前的需要,采用双重或多重TC-RT-PCR检测病毒的复合侵染,将会进一步降低检测成本,更加高效。
建立对同种病毒不同株系的通用检测方法,将为检测简单化提供更多的帮助,本研究初步分析了所测定的PVY病毒所属的株系类型,也为PVY病毒株系分型打下基础。
[1]王中康.植物疫害生物分子检验检疫技术研究与固相化检测试剂盒研制[D].重庆:重庆大学,2006.
[2]Palukaitis P.Resistance to viruses of potato and their vectors[J]. The Plant Pathology Journal.2012,28(3):248-258.
[3]Hadidi A,Montasser M S,Levy L.Detection of potato leafroll and straw berry mild yellow-edge luteo virus by RT-PCR[J].Plant Disease,1993,77(6):595-601.
[4]王中康,夏玉先,袁青,等.马铃薯种苗复合感染病毒多重RT-PCR同步快速检测[J].植物病理学报,2005,35(2):109-115.
[5]庞博,刘秀丽,张金文,等.马铃薯4种病毒多重PCR检测体系的建立[J].植物保护,2015,41(2):102-107.
[6]沈建国,林双庆,蔡伟,等.TC/IC-RT-PCR检测黄瓜绿斑驳花叶病毒[J].福建农林大学学报:自然科学版,2012,41(1):13-17.
[7]邓晓云,洪霓,胡红菊,等.检测砂梨潜隐病毒的IC-RT-PCR和TC-RT-PCR的研究[J].果树学报,2004,21(6):569-572.
[8]黄妍妍,陈小飞,朱天生.库尔勒香梨上苹果茎沟病毒的三种分子生物学检测技术比较研究[J].塔里木大学学报,2014,26(3): 10-15.
[9]张华鹏,张剑峰,刘俊莹,等.马铃薯上PVY、PVS和PLRV的三重RT-PCR检测[J].华北农学报,2011,26(5):40-45.
[10]Rigotti S,Gugerli P.Rapid identification of potato virus Y strains by one-step triplex RT-PCR[J].Journal of Virological Methods. 2007,140(1-2):90-94.
[11]James D.A simple and reliable protocol for the detection of apple stem grooving virus by RT-PCR and in a multiplex PCR assay[J]. Journal of Virological Methods,1999,83:1-9.
[12]Bakker D,Bruinsma M,Dekter R W,et al.Detection of PSTVd and TCDVd in seeds of tomato using real-time RT-PCR [J]. EPPO Bulletin,2015,45(1):14-21.
[13]Achachi A,Jijakli M H,Fahime E E,et al.Detection of citrus psorosis virus using an improved one-step RT-PCR[J].Arabian Journal for Science and Engineering,2015,40(1):7-13.
[14]Cieslinska M,Malinowski T,Zawadzha B J.Studies on several strains of apple chlorotic leaf spot virus(ACLSV)isolated from different fruit tree species[J].Acta Hort,1995,386:63-71.
Detection of Potato Virus Y and Potato Leafroll Virus Using Tube Capture RT-PCR
ZHENG Yeye,HAN Lei,CHI Shengqi*,ZHANG Jianfeng*
(College of Agronomy and Plant Protection,Qingdao Agricultural University,Qingdao,Shandong 266109,China)
To detect the virus using traditional RT-PCR technique needs extraction of RNA which degrades easily. Using tube capture reverse transcription amplification(Tube capture RT-PCR,TC-RT-PCR)method to detect two viruses,potato virus Y(PVY),and potato leafroll virus(PLRV),can be done in the same reaction system without extraction of total RNA.According to the reported primers,PVY and PLRV coat protein genes were detected with the method of TC-RT-PCR.The results showed that TC-RT-PCR successfully detected the samples infected with PVY or PLRV alone and coinfected with the two viruses,and the length of the amplified PVY and PLRV products was consistent with the length of the design fragments,781 bp and 364 bp,respectively.Sequencing of the two virus products with the sequence alignment in GeneBank homology were above 97%.The technique would provide a more convenient and efficient method for detecting potatoes for simple or complex virus infection.At the same time,the experiment found that the resulting PVY virus samples belonged to PVYNWstrain.
PVY;PLRV;tube capture RT-PCR
S532
A
1672-3635(2016)05-0296-06
2015-12-22
山东现代农业产业技术体系薯类创新团队项目(SDAIT-16-06);国家科技支撑计划项目(2011BAD32B03-3)。
郑叶叶(1989-),女,硕士研究生,主要从事马铃薯病毒研究。
张剑峰,教授,主要从事马铃薯病毒病害研究,E-mail:qauzjf@163.com;迟胜起,副教授,主要从事马铃薯病毒病害研究,E-mail:chishq@163.com。
