IgA肾病患者外周血单个核细胞Toll样受体4的表达及血清炎症趋化因子的水平
2016-11-15刘秀英蒋更如
龙 泉, 朱 淳, 邹 军, 刘秀英, 蒋更如
(1. 上海国际医学中心 肾脏内科, 上海, 201318;2. 上海交通大学医学院附属新华医院崇明分院 肾脏内科, 上海, 202150;3. 上海交通大学医学院附属新华医院 肾脏内科, 上海, 200092)
IgA肾病患者外周血单个核细胞Toll样受体4的表达及血清炎症趋化因子的水平
龙泉1, 朱淳2, 3, 邹军3, 刘秀英3, 蒋更如3
(1. 上海国际医学中心 肾脏内科, 上海, 201318;2. 上海交通大学医学院附属新华医院崇明分院 肾脏内科, 上海, 202150;3. 上海交通大学医学院附属新华医院 肾脏内科, 上海, 200092)
目的研究IgA肾病(IgAN)患者外周血单个核细胞Toll样受体4(TLR4)的表达及血清中趋化因子MCP-1和炎症因子IL-6的水平,探讨TLR4在IgAN发病中可能的作用。方法将在本科经肾组织活检确诊为IgAN的60例患者(排除继发性和遗传性IgAN)根据蛋白尿程度进行分组,分为轻度蛋白尿组(24 h尿蛋白定量≤1.0 g), 中度蛋白尿组(24 h尿蛋白定量1.0~3.0 g)和重度蛋白尿组(24 h尿蛋白定量≥3.0 g)。另取年龄性别相匹配的健康志愿者20例作为健康对照组。分别使用流式细胞仪和Realtime-PCR方法检测外周血单个核细胞(PBMC)中TLR4蛋白和基因的表达, ELISA法检测血清中趋化因子MCP-1和炎症因子IL-6的水平。结果IgAN组患者PBMC中TLR4的蛋白和基因表达水平以及血清中MCP-1和IL-6的浓度均较健康对照组显著增加(P均<0.05)。PBMC中TLR4的蛋白和基因表达水平随着蛋白尿的严重程度而逐渐增高。直线相关分析提示PBMC中TLR4 mRNA的表达水平与24 h尿蛋白定量呈显著正相关(r=0.855,P<0.05), 而与GFR呈负相关(r= -0.735,P<0.05)。MCP-1和IL-6的水平与PBMC中TLR4 mRNA的表达水平呈显著正相关(r=0.746、0.821,P<0.05)。结论IgAN患者PBMC中存在TLR4的表达水平上调,与蛋白尿程度和肾功能水平密切相关。血清中趋化因子MCP-1和炎症因子IL-6的水平也随着PBMC中TLR4的表达水平升高而升高。TLR4可能通过调节机体趋化因子和炎症因子的释放介导了IgA肾病中的炎症损伤。
IgA肾病; Toll样受体4; 单核细胞趋化因子-1; 白介素-6; 固有免疫
免疫球蛋白A肾病(IgAN)是亚洲人群最常见的肾小球疾病,也是导致终末期肾病的重要病因[1]。IgAN的确切发病机制不明,遗传、环境、免疫失调等多种因素参与其中。Toll样受体4(TLR4)是一种重要的模式识别受体,通过识别多种外源性和内源性配体激活细胞内核转录因子从而释放多种炎症因子,是病原体感染后连接机体固有免疫和获得性免疫的重要桥梁[2]。临床上发现黏膜系统(如呼吸道、消化道、泌尿道)的感染(如细菌、病毒、不典型病原体等)往往能诱发或加重IgAN,因此作者推测TLR4可能参与了IgAN的发生。本研究通过观察IgAN患者外周血单个核细胞(PBMC)中TLR4的表达水平及其相应的血清中趋化因子MCP-1和炎症因子IL-6的水平,探讨TLR4在IgAN发病中可能的作用机制。
1 资料与方法
1.1一般资料
选取2012年10月—2014年3月在上海交通大学医学院附属新华医院肾脏科行肾穿刺活检确诊的IgAN患者60例(男36例,女24例)作为病例组。患者同时需符合以下条件: ① 肾活检前3个月内未使用过激素和免疫抑制剂; ② 除外紫癜性肾炎、狼疮性肾炎、乙肝/丙肝病毒相关性肾炎等继发性IgAN以及家族遗传性IgAN; ③ 无活动性感染性疾病; ④ 年龄18~60岁。根据24 h尿蛋白定量结果将IgAN患者分为3组: 轻度蛋白尿组(24 h尿蛋白定量≤1.0 g), 中度蛋白尿组(24 h尿蛋白定量1.0~3.0 g)和重度蛋白尿组(24 h尿蛋白定量≥3.0 g)。另选取20例(男10例,女10例)年龄性别相匹配的健康志愿者(既往无糖尿病,高血压,心脑血管疾病、肝脏疾病、肾脏疾病的疾患)作为对照组。所有患者均签署知情同意书,经医院伦理委员会批准。
1.2研究方法
所有IgAN患者和健康对照者于晨起空腹采静脉血,用德国Bayer公司生产的全自动生化仪检测血糖、肾功能(包括尿素氮,肌酐和血尿酸)、血清IgA、补体C3等生化指标。用酶联免疫吸附(ELISA)法检测MCP-1和IL-6的水平(试剂盒购于北京晶美生物工程有限公司)。留取24 h尿液计算24 h尿蛋白定量。99mTc-DTPA核素法测定肾小球滤过率(GFR)。
1.2.1采用聚蔗糖-泛影葡胺密度梯度离心法分离人外周血单个核细胞(PBMC): 抽取患者和健康对照者新鲜静脉血5 mL于肝素抗凝管,加等体积的生理盐水稀释,吸取淋巴细胞分离液5 mL(购于天津灏洋生物制品科技有限责任公司),置于15 mL离心管中,然后小心地将2倍体积的稀释血加在淋巴细胞分离液上, 2 000 r/min离心25 min, 小心吸出分层液与血浆交界处的灰白色浑浊层即为PBMC, PBS洗涤2次,台盼蓝拒染法测得活细胞>95%。
1.2.2流式细胞仪检测PBMC中TLR4的表达: 取新鲜肝素抗凝全血各100 μL, 按试剂说明书,分别加入20 μL单克隆抗体CD14-FITC/TLR4-PE及相应的同型阴性对照小鼠抗人IgG1-FITC(荧光标记抗体购自美国Beckman Coulter公司),混匀后室温下避光反应15 min后,加入1 mL红细胞溶解素(购自北京晶美基因谷科技有限公司), 37 ℃水浴约10 min, 待完全溶血后,立即上流式细胞仪检测。在Ex-po32ADC软件下检测和分析数据。
1.2.3PBMC中TLR4 mRNA的测定: 参照说明书用Trizol试剂从分离的细胞中抽提约5×106个PBMCs的总RNA。以无模板的PCR产物为阴性对照。Trizol试剂、dNTP Mix、Rnasin、逆转录酶及缓冲系统、Taq DNA聚合酶及缓冲系统均购自美国Sigma公司。引物设计参照文献, TLR4上游引物为: 5′-AAGTGTCTGAACTCCCTCCA-3′; 下游引物为: 5′-TCATTCCTTAC CCAGTCCTC-3′; 扩增片段452 bp。β-actin上游引物为: 5′-CCGCGAGAAGATGACCCAGA-3′; 下游引物为: 5′-GCCGTGGTGGTGAAGCTGTA-3′, 扩增片段269 bp。引物由上海生工生物工程技术服务有限公司合成。
1.2.4相关性分析: 将IgAN患者PBMC中TLR4mRNA的表达水平与24 h尿蛋白定量和GFR进行相关性分析。将血清中MCP-1和IL-6的水平与PBMC中TLR4mRNA的表达水平进行Pearson相关性分析。
1.3统计学方法
所有数据采用平均数±标准差表示,两组资料的比较采用t检验,多组间比较采用方差分析。相关性采用Pearson相关分析。由SPSS 10.0版软件进行统计学分析,P<0.05表示差异具有统计学意义。
2 结 果
2.1各组间临床指标的比较
各组患者的年龄、性别无显著差异。IgAN组较健康对照组24 h尿蛋白定量水平显著升高(P均<0.05)。根据不同蛋白尿水平进行分组,重度蛋白尿组患者与正常对照组以及轻度蛋白尿组患者相比,血压(收缩压和舒张压)和血清IgA/C3水平显著升高,而GFR和血清白蛋白水平显著降低(P均<0.05)。见表1。

表1 各组临床资料和生化指标
与正常对照组比较, △P<0.05; 与轻度蛋白尿组比较, *P<0.05。
2.2PBMC中的TLR4表达水平
流式细胞仪检测的PBMC中TLR4的蛋白表达水平在IgAN组患者中较在健康对照组中显著升高(P均<0.05),见图1。IgAN患者PBMC中TLR4的表达水平随着蛋白尿严重度增加而逐渐升高。流式细胞仪检测的TLR4蛋白的荧光阳性比例: 轻度蛋白尿组(12.38±3.29)%, 中度蛋白尿组(19.52±5.71)%,重度蛋白尿组(30.15±9.25)%。RT-PCR法检测的TLR4 mRNA水平: 轻度蛋白尿组4.04±0.83, 中度蛋白尿组8.49±2.66, 重度蛋白尿组15.89±4.37。见表2。

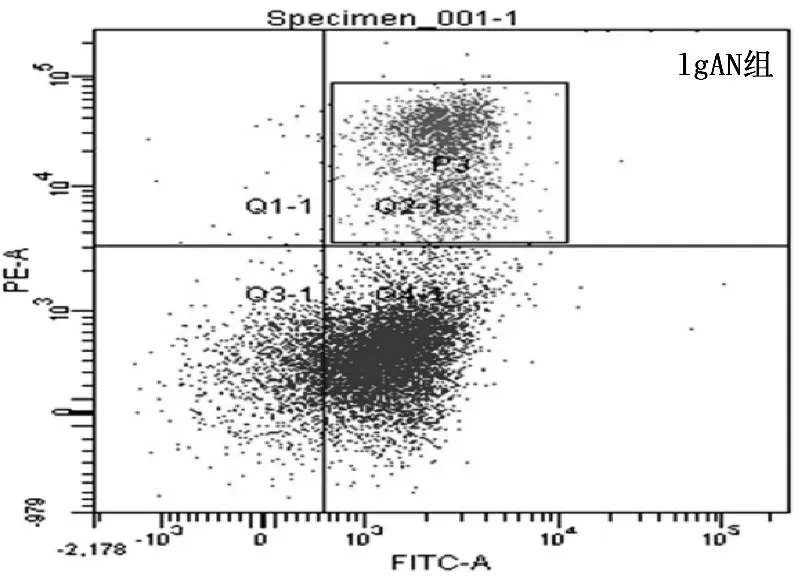

图1 流式细胞仪检测IgAN组和正常对照组患者PBMC中TLR4的表达水平
与正常对照组比较, △P<0.05; 与轻度蛋白尿组比较, *P<0.05; 与中度蛋白尿组比较, #P<0.05。
2.3血清MCP-1和IL-6的浓度
IgAN组患者较健康对照组血清中MCP-1和IL-6的水平显著升高(P均<0.05)。IgAN患者血清中MCP-1和IL-6的浓度随着蛋白尿水平增加而逐渐升高,差异具有统计学意义(P均<0.05)。见表2。
2.4相关性分析
将TLR4的表达水平与24 h尿蛋白定量和GFR水平分别进行相关性分析,结果提示IgAN患者PBMC中TLR4 mRNA的表达水平与24 h尿蛋白定量呈显著正相关(r=0.855,P<0.05), 而与GFR呈负相关(r=-0.735,P<0.05)。将血清MCP-1和IL-6的浓度与PBMC中TLR4 mRNA的表达水平进行相关性分析,结果提示血清MCP-1和IL-6的水平与TLR4mRNA的表达水平呈显著正相关(r=0.746、0.821,P均<0.05)。
3 讨 论
IgAN是亚洲国家最常见的原发性肾小球疾病。由于多种因素参与了IgAN的发生和发展,而其确切的发病机制仍不清楚,因此IgAN的临床表现和病理表现异质性很高。临床研究发现IgAN患者的血清中存在与环境中抗原起反应的IgA, 肾小球中存在与扁桃体起交叉反应的IgA的沉积,且沉积在系膜区的主要是典型的黏膜免疫反应产物多聚体IgA和分泌型IgA[3]。动物研究发现多种病原体(如仙台病毒、流感嗜血杆菌、细小病毒,柯萨奇病毒、金黄色葡萄球菌、巨细胞病毒、EB病毒和幽门螺杆菌等)通过不同途径可以诱发出类似IgAN病理改变的肾脏损伤[4-6]。临床上观察到黏膜感染(尤其是上呼吸道感染和化脓性扁桃体炎)往往是IgAN发生或加重的诱因。这些结果均提示病原体感染与诱发IgAN发病密切相关,但病原体感染后诱发IgAN的具体机制并不清楚。人体内面积约400 m2的黏膜的固有免疫系统是机体抵抗外源性病原体入侵的第一道防线。Toll样受体(TLR)是一种重要的模式识别受体,在抗感染时黏膜的固有免疫中发挥重要作用,也控制着机体由固有免疫向获得性免疫的转变[7-8]。目前至少已经报道了十多种人TLR亚型,而TLR4是TLR家族中的重要成员,通过识别多种外源性配体(如革兰阴性细菌胞壁的脂多糖LPS)和内源性配体(如: 纤维连接蛋白,热休克蛋白、纤维蛋白原等)激活细胞内核转录因子(NF-κB)信号通路,导致粘附分子、炎症因子、趋化因子、促凝血因子和缩血管因子等多种细胞因子的产生和释放,在介导体内的炎症反应中发挥重要作用[9]。已有研究[10-14]发现TLR4激活参与了内毒素诱导的急性肾损伤、肾间质纤维化、肾移植排斥反应、抗体介导的肾小球肾炎、糖尿病肾病等众多肾脏疾病的发病过程,但IgAN的发病机制中是否有TLR4的参与相关报道很少。有体外研究[15-18]发现TLR4被外源性配体细菌LPS激活后,诱导Cosmc(IgA1分子糖基化相关的β-1,3半乳糖转移酶的分子伴侣)甲基化,导致IgA1分子糖基化水平降低。最近又有一项体外研究[16]报道在刺激的系膜细胞中, TLR4mRNA和蛋白表达增加与蛋白激酶信号传导途径有关。
本研究结果显示, IgAN患者外周血单个核细胞中TLR4的蛋白和基因表达水平均较健康对照组显著增加,并且TLR4的表达水平随着蛋白尿的严重程度而逐渐增高,差异具有统计学意义。直线相关分析显示PBMC中TLR4 mRNA的表达水平与24 h尿蛋白定量呈显著正相关,与GFR呈负相关。这些结果提示IgAN患者的血循环中存在TLR4的激活,TLR4的活化程度与蛋白尿的程度和肾功能情况密切相关。由于起病时的血压水平、蛋白尿水平、肾功能以及肾活检的病理评分(牛津分型的MEST评分)是目前公认的决定IgAN患者预后的重要因素,因此检测血循环中的TLR4将来也有望成为判断IgAN严重程度和预后的一个无创性生物标志物。本组资料结果还显示IgAN患者血清中趋化因子MCP-1和炎症因子IL-6的水平均较健康对照组显著增加,IgAN患者血清中MCP-1和IL-6的浓度随着蛋白尿水平增加而逐渐升高,三组之间比较差异具有统计学意义。直线相关分析显示IgAN患者血清MCP-1和IL-6的水平与PBMC中TLR4mRNA的表达水平呈显著正相关。这些结果就提示了IgAN患者血循环中趋化因子和炎症因子的水平与PBMC中TLR4的激活密切相关。由此作者推测病原体感染机体后可能通过激活PBMC中的TLR4引起趋化因子和炎症因子等细胞因子释放,细胞因子随着血循环聚集在肾小球导致系膜区局部的炎症反应继而引起系膜细胞和系膜基质增生。既往有研究证实炎症因子反过来也可能通过激活肾脏固有细胞(肾小球系膜细胞、足细胞和肾小管上皮细胞)上的TLR4进一步加重肾脏局部的炎症反应和肾脏损害,形成恶性循环,由此介导了IgAN的发生发展[19-21]。但本实验由于仅仅检测了外周血中TLR4、MCP-1和IL-6的表达,尚未在体内的肾组织和体外的细胞试验中验证TLR4与炎症反应的细胞因子之间的关系。因此,本课题组下一步拟在肾活检的组织标本中进一步探讨IgAN患者肾组织中TLR4的表达与肾脏局部炎症因子表达之间的关系。
综上所述,本研究结果证实IgAN患者的血循环中存在TLR4的激活, IgAN患者PBMC中TLR4的表达水平与蛋白尿程度和肾功能水平密切相关。血清中炎症反应的相关细胞因子MCP-1和IL-6的水平随着PBMC中TLR4的水平升高而升高。TLR4可能通过调节机体炎症因子的释放介导了IgAN中的炎症反应和肾脏损伤。这为固有免疫在IgAN发病中的作用奠定了一定理论基础。
[1]KN Lai, Joseph Leung, Sydeny Tang. The treatmet of IgA Nephropathy[J]. Kidney Dis, 2015, (1): 19-26.
[2]Xagoraxi A, Chlichlia K. Toll-like receptors and viruses: induction of innate antiviral immune responses[J]. Open Microbiol J, 2008, (2): 49-59.
[3]Oortwijn B D, van der Boog P J, Roos A, et al. A pathogenic role for secretory IgA in IgA nephropathy[J]. Kidney Int, 2006, (7): 1131-1138.
[4]Amore A, Coppo R, Nedrud J G, et al. The role of nasal tolerance in a model of IgA nephropathy induced in mice by Sendai virus[J]. Clin Immunol, 2004, (1): 101-108.
[5]Kawasaki Y, Mitsuaki H, Isome M, et al. Renal effects of Coxsackie B4 virus in hyper-IgA mice[J]. J Am Soc Nephrol, 2006, (10): 2760-2769.
[6]Koyama A, Sharmin S, Sakurai H, et al. Staphylococcus aureus cell envelope antigen is a new candidate for the induction of IgA nephropathy[J]. Kidney Int, 2004, (1): 121-132.
[7]Coppo R, Amore A, Peruzzi L, et al. Innate immunity and IgA nephropathy[J]. J Nephrol, 2010, (6): 626-632.
[8]Brown J, Wang H, Hajishengallis GN, et al. TLR-signaling networks: an integration of adaptor molecules, kinases, and cross-talk[J]. J Dent Res, 2011, (4): 417-427.
[9]O′Neill LA. The interleukin-1 receptor/Toll-like receptor superfamily: 10 years of progress[J]. Immunol Rev, 2008, (226): 10-18.
[10]Cunningham P N, Wang Y, Guo R, et al. Role of Toll-like receptor-4 in endotoxin- induced acute renal failure[J]. J Immunol, 2004, (4): 2629-2635.
[11]Vabulas RM, Braedel S, Hilf N, et al. The endoplasmic reticulum-resident heat shock protein Gp96 activates dendritic cells via the Toll-like receptor 2/4 pathway[J]. J Biol Chem, 2002, (23): 20847-20853.
[12]Ducloux D, Deschamps M, Yannaraki M, et al. Relevance of Toll-like receptor-4 polymorphisms in renal transplantation[J]. Kidney Int, 2005, (6): 2454-2461.
[13]Brown H J, Lock H R, Wolfs T G, et al. Toll-like receptor 4 ligation on intrinsic renal cells contributes to the induction of antibody-mediated glomerulonephritis via CXCL1 and CXCL2[J]. J Am Soc Nephrol, 2007, (6): 1732-1739.
[14]Lin M, Yiu W H, Wu H J, et al. Toll-like receptor 4 promotes tubular inflammation in diabetic nephropathy[J]. J Am Soc Nephrol, 2012, (1): 86-102.
[15]Qin W, Zhong X, Fan J M, et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy[J]. Nephrol Dial Transplant, 2008, (5): 1608-1614.
[16]Gluba A, Banach M, Hannam S, et al. The role of Toll-like receptors in renal disease[J]. Nat Rev Nephrol, 2010, (4): 224-235.
[17]Anders H J, Schlndorff D. Toll-like receptors: emerging concepts in kidney disease[J]. Curr Opin Nephrol Hypertens, 2007, (3): 177-183.
[18]郝成罗, 廖常彬. IgA肾病患者外周血单核细胞含量及肾组织中NF-κB、CTGF、OPN表达量的检测及临床意义[J]. 海南医学院学报, 2016, 22(11): 1079-1081.
[19]刘宝玲, 付彤, 刘冰, 等. 普乐可复对IgA肾病大鼠肾组织中MMP-9和TIMP-1表达水平的影响及其机制[J]. 吉林大学学报: 医学版, 2014, 40(2): 289-293.
[20]方明, 徐颢, 王可平, 等. IgA肾病外周血单个核细胞T-bet GATA-3 ROR-γt和Foxp3 mRNA的表达及其意义研究[J]. 中国实用内科杂志, 2014(9): 892-895.
[21]张丽萍, 闫喆, 杨林, 等. IgA肾病红细胞免疫功能测定与肾小管间质病变研究[J]. 中华全科医师杂志, 2012, 11(8): 628-629.
Expression of Toll-like receptor 4 and level of inflammation cytokine IL-6 and chemokine MCP-1 in peripheral blood mononuclear cells of patients with IgA nephropathy
LONG Quan1, ZHU Chun2, 3, ZOU Jun3, LIU Xiuying3, JIANG Gengru3
(1.DepartmentofNephrology,ShanghaiInternationalMedicalCenter,Shanghai, 201318; 2.DepartmentofNephrology,ChongmingBranchofXinhuaHospitalAffiliatedtoMedicalCollegeofShanghaiJiaotongUniversity,Shanghai, 202150; 3.DepartmentofNephrology,XinhuaHospitalAffiliatedtoMedicalCollegeofShanghaiJiaotongUniversity,Shanghai, 2000920)
ObjectiveTo explore the expression of Toll-like receptor 4 in peripheral blood mononuclear cells (PBMC) and serum concentration of chemokine MCP-1 and inflammation cytokine IL-6 in patients with IgA nephropathy. MethodsA total of 60 patients with IgAN confirmed by renal biopsy were divided into three groups according to 24 h proteinuria, which were mild proteinuria group, morderate proteinuria group and severe proteinuria group. Patients with secondary and hereditary IgAN were excluded. Another 20 healthy volunteers were selected as control group. Protein and gene expression of TLR4 in PBMC were evaluated with flow cytometry and real time-PCR respectively. Levels of MCP-1 and IL-6 were measured by commercial ELISA kit. ResultsExpression of TLR4 in PBMC and levels of MCP-1 and IL-6 in circulation were significantly higher in IgAN group than in
IgA nephropathy; Toll-like receptor 4; MCP-1; IL-6; innate immunity
2016-06-05
上海交通大学医学院附属新华医院科研基金资助(12QYJ06)
朱淳, E-mail: zhuchun26@sina.cn
R 692
A
1672-2353(2016)19-023-05DOI: 10.7619/jcmp.201619007
control group (P<0.05). Protein and gene expression of TLR4 in PBMC increased with the severity of proteinuria (P<0.05). The Pearson correlation coefficient analysis suggested that gene expression of TLR4 in PBMC was positively correlated with 24 h urinary protein excretion (r=0.855,P<0.05), but negatively correlated with GFR (r=-0.735,P<0.05). Serum concentration of MCP-1 and IL-6 were positively correlated with gene expression of TLR4 in PBMC (r=0.746, 0.821,P<0.05). ConclusionExpression of TLR4 in PBMC and levels of MCP-1 and IL-6 in circulation are all up-regulated in patients with IgAN. Expression of TLR4 in PBMC is closely related with the severity of proteinuria and renal function. These findings suggest that TLR4 may mediate inflammatory injury of IgAN by releasing inflammation cytokine and chemokine.
