提取液及固-液分离方法对固态非淀粉多糖酶类活性的影响
2016-11-15齐智利张宏福
廖 睿 赵 峰 齐智利 张宏福
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.华中农业大学动物科技学院,武汉430070)
提取液及固-液分离方法对固态非淀粉多糖酶类活性的影响
廖睿1,2赵峰1*齐智利2*张宏福1
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.华中农业大学动物科技学院,武汉430070)
本试验旨在探讨固态酶制剂评估中酶的适宜提取液及固-液分离方法。采用4×3双因素完全随机设计,其中提取液分别为去离子水、乙酸-乙酸钠缓冲液(0.1 mol/L,pH 5.50)、磷酸盐缓冲液(0.05 mol/L,pH 6.00)和0.9%NaCl溶液;溶液提取后的固-液分离方法分别为不分离、3 000 r/min离心3 min和中速滤纸过滤。每个处理5个重复,每个重复设2个平行,测定各个处理下酶的活性,并考察提取液的类型对酶制剂产品(α-半乳糖苷酶除外)溶解离心后溶液中溶质及蛋白质含量的影响。结果表明,磷酸盐缓冲液溶解木聚糖酶后活性最高(P<0.05);乙酸-乙酸钠缓冲液、磷酸盐缓冲液及0.9%NaCl溶液溶解β-葡聚糖酶后活性相当(P>0.05),且均显著地高于去离子水(P<0.05);去离子水溶解β-甘露聚糖酶后活性最高,其次为乙酸-乙酸钠缓冲液,两者都显著地高于磷酸盐缓冲液和0.9%NaCl溶液(P<0.05)。提取液类型对α-半乳糖苷酶活性无显著影响(P>0.05)。酶制剂溶解后的固-液分离方法对木聚糖酶的测定活性无显著性影响(P>0.05);提取液离心或过滤后β-葡聚糖酶活性最高(P<0.05);提取液离心后β-甘露聚糖酶活性最高(P<0.05);而提取液不分离时α-半乳糖苷酶的活性最高(P<0.05)。提取液的种类和酶制剂溶解后的固-液分离方法对4种非淀粉多糖酶的测定活性有极显著的交互作用(P<0.01)。乙酸-乙酸钠缓冲液对木聚糖酶制剂的溶解度最大(P<0.05),去离子水和0.9%NaCl溶液均对β-葡聚糖酶及β-甘露聚糖酶制剂的溶解度最大(P<0.05)。然而,乙酸-乙酸钠缓冲液溶解木聚糖酶、β-葡聚糖酶、β-甘露聚糖酶后提取液中蛋白质的含量均最低(P<0.05)。上述结果表明,乙酸-乙酸钠缓冲液溶解4种固态酶制剂可以最有效地将酶蛋白提取出来,α-半乳糖苷酶提取后不宜固液分离,而其他3种酶的提取液适宜进行离心分离。
非淀粉多糖酶;提取液;固-液分离;酶活性
国内市场上饲用非淀粉多糖酶制剂产品多以载体吸附发酵酶液的固态形式存在。在评估固态饲用酶制剂产品的酶学特性及其对饲料原料的水解效应中,所有反应均在液相中进行。通过提取液从固态酶制剂中浸出饲用酶是开展酶活性评估首先需要考虑的问题,因此,探讨适合固态饲用酶的提取液及溶解后固-液分离方法非常重要。目前,在饲用非淀粉多糖酶活性的测定中,对固态酶制剂多采用乙酸-乙酸钠缓冲液提取,并通过离心的方法分离提取酶液与不溶物[1]。而在饲用酶制剂效应的体外消化评定中,酶制剂的添加方式有2种:第1种为直接加入饲粮中,适合于少量样品中加入液体酶制剂或批量配制饲粮时添加固态酶制剂[2-3];第2种为通过溶液浸提固态酶制剂后离心取上清液加入反应体系中,适合于在少量饲料样品的条件下均匀地加入饲用酶[4]。然而,从固态酶制剂中浸提饲用酶时,缓冲液的种类、固-液分离方法对测定样品的酶活性均有影响[5-6]。由此可见,在固态酶制剂的评估中,探讨合适的提取液及固-液分离方法非常关键。为此,本研究分别探讨了提取液与经溶液提取后的固-液分离方法对酶活性测定值的影响以及提取液的类型对酶制剂产品溶解后溶液中溶质及蛋白质含量的影响,以筛选适宜的提取液及固-液分离方法,为饲用酶制剂产品评估中的前处理提供参考。
1 材料与方法
1.1饲用酶制剂产品
饲用酶制剂产品由北京某生物技术有限公司提供,其酶学特性列于表1。

表1 饲用酶制剂产品的特性
1.2试验设计
本研究分为2个部分。其中试验1考察饲用酶制剂的提取液及经溶液提取后的固-液分离方法对酶活性测定值的影响。采用4×3双因素完全随机设计,其中提取液设4个处理,分别为去离子水、乙酸-乙酸钠缓冲液(0.1 mol/L,pH 5.50)、磷酸盐缓冲液(0.05 mol/L,pH 6.00)及0.9%NaCl溶液,溶解时间30 min;3种溶液提取后的固-液分离方法分别为不分离、3 000 r/min离心3 min和中速定量滤纸过滤。共计12个处理,每个处理5个重复,每个重复设2个平行,测定各个处理下4种酶制剂的活性。试验2根据试验1的结果,即在3 000 r/min离心3 min分离提取液与酶制剂固体不溶物(α-半乳糖苷酶除外)的条件下,进一步考察提取液的类型对酶制剂产品溶解后溶液中溶质及蛋白质含量的影响,以确定溶液中杂质的含量。提取液设4个处理,分别为去离子水、乙酸-乙酸钠缓冲液(0.1 mol/L,pH 5.50)、磷酸盐缓冲液(0.05 mol/L,pH 6.00)及0.9%NaCl溶液,每个处理5个重复,每个重复设2个平行,测定各个处理下溶液中溶质和蛋白质含量。所有处理中固态酶制剂与提取液按2∶100(质量体积比)溶解。
1.3测定指标及方法
1.3.1酶制剂酶活性的测定
木聚糖酶的活性根据GB/T 23874—2009测定,其活性单位定义为:在37 ℃、pH为5.50的条件下,每分钟从浓度为5 mg/mL的木聚糖(山毛榉材,Sigma X4252)溶液中降解释放1 μmol还原糖所需的酶量为1个酶活单位。
β-葡聚糖酶活性根据NY/T 911—2004测定,其活性单位定义为:在37 ℃、pH为5.50的条件下,每分钟从浓度为4 mg/mL的葡聚糖(大麦,Sigma G6513)溶液中降解释放1 μmol还原糖所需要的酶量为1个酶活单位。
β-甘露聚糖酶采用企业标准方法(Q/HDTZW 0008—2012)测定,其活性单位定义为:在37 ℃、pH为5.50的条件下,每分钟从浓度为3 mg/mL的甘露聚糖(槐豆胶,Sigma G0753)溶液中降解释放1 μmol还原糖所需要的酶量为1个酶活单位。
α-半乳糖苷酶采用企业标准方法(Q/HDTZW 0009—2012)测定,其活性单位定义为:在37 ℃、pH为5.50的条件下,每分钟从浓度为10 mmol/L的对硝基酚-α-D-吡喃半乳糖苷释放1 μmol对硝基酚所需的酶量定义为1个酶活单位。
1.3.2提取液中溶质含量的测定
按0.02 g/mL浓度称取0.8 g酶制剂溶解于40 mL溶解液中,在磁力搅拌器上(4 ℃低温)溶解30 min,然后3 000 r/min离心3 min,取15 mL离心后的上清液,放入称量瓶中,65 ℃烘干至无水痕后,再105 ℃烘干5 h称重。扣除相应溶解液空白溶质含量,然后计算每毫升溶液中溶质的含量(μg/mL)。
1.3.3提取液中蛋白质含量的测定
提取液中蛋白质的含量采用Thermo Scientific蛋白质分析试剂盒(货号:23225)测定。其原理为Cu2+在碱性条件下可以被蛋白质还原形成紫色复合物,在562 nm的吸光度与蛋白质的含量呈线性关系。将待测稀释液25 μL,工作液200 μL加入微孔板密封,在振荡器上震荡30 s。然后在37 ℃孵育30 min后冷却至室温,用酶标仪在562 nm处测吸光值。
1.4数据统计分析
利用SAS 9.0的MEANS模块对基本统计量进行分析。采用PROC GLM模块对试验1进行两因素互作的方差分析,当交互效应显著时,对12个处理进行Duncan氏法多重比较。同样,采用PROC GLM模块对试验2进行单因素方差分析。2个试验中处理间的差异检验均采用Duncan氏法进行多重比较。数据以平均值±标准差表示。
2 结果与分析
2.1提取液及固-液分离方法对非淀粉多糖酶活性的影响
由表2可见,在4种提取液中,木聚糖酶经磷酸盐缓冲液提取后的测定活性最高(P<0.05),而通过其他3种溶液提取后测定的活性稍低。β-葡聚糖酶经去离子水提取后的测定活性最低(P<0.05),而通过其他3种溶液提取后测定的活性稍高。β-甘露聚糖酶经去离子水提取后的测定活性最高(P<0.05),乙酸-乙酸钠缓冲液提取后次之(P<0.05),磷酸盐缓冲液和0.9%NaCl溶液提取后的测定活性最低。酶制剂溶解后的固-液分离方法对木聚糖酶的测定活性无显著性影响(P>0.05)。不分离显著地降低了β-葡聚糖酶的测定活性(P<0.05),而离心或过滤均显著地降低了α-半乳糖苷酶的测定活性(P<0.05)。提取液的种类和酶制剂溶解后的固-液分离方法对4种非淀粉多糖酶的测定活性有极显著的交互作用(P<0.01)。
在木聚糖酶中,去离子水提取后过滤分离的酶活性显著地高于不分离或离心的相应值(P<0.05);乙酸-乙酸钠缓冲液提取后固-液分离方法对酶活性的测定结果无显著性影响(P>0.05);磷酸盐缓冲液提取后不分离的酶活性显著地高于离心及过滤分离的相应值(P<0.05);0.9%NaCl溶液提取后离心或过滤分离的酶活性均显著地高于不分离的相应值(P<0.05)。在β-葡聚糖酶中,去离子水提取后固-液分离方法对酶活性的测定结果无显著性影响(P>0.05);乙酸-乙酸钠缓冲液提取后,离心分离的酶活性显著地低于不分离和过滤的相应值(P<0.05);而磷酸盐缓冲液及0.9%NaCl溶液提取后,离心分离的酶活性均是较高的。在β-甘露聚糖酶中,去离子水提取后不分离或离心的酶活性均显著地高于过滤的相应值(P<0.05);乙酸-乙酸钠缓冲液提取后,离心分离的酶活性显著地高于不分离和过滤的相应值(P<0.05);磷酸盐缓冲液提取后固-液分离方法对酶活性的测定结果无显著性影响(P>0.05);0.9%NaCl溶液提取后过滤的酶活性较低(P<0.05)。在α-半乳糖苷酶中,去离子水、磷酸盐缓冲液、0.9%NaCl溶液提取后离心的酶活性最低(P<0.05),而乙酸-乙酸钠缓冲液提取后过滤或离心的酶活性都是最低的(P<0.05)。
2.2提取液对非淀粉多糖酶溶解度的影响
由于试验1的结果表明离心对α-半乳糖苷酶活性有显著地影响,因此,试验2不开展提取液对α-半乳糖苷酶溶解度影响的测试。提取液对3种固态酶制剂溶解离心后溶液中溶质的含量列于表3。在木聚糖酶中,提取液中溶质含量的高低顺序为:乙酸-乙酸钠缓冲液>去离子水>0.9%NaCl溶液>磷酸盐缓冲液,除去离子水和0.9%NaCl溶液间差异不显著(P>0.05),其他任意2组间有显著差异(P<0.05)。在β-葡聚糖酶中,提取液中溶质含量的高低顺序为:去离子水=0.9%NaCl溶液>磷酸盐缓冲液>乙酸-乙酸钠缓冲液,除去离子水与0.9%NaCl溶液2处理间差异不显著(P>0.05)外,其他任意2组间有显著差异(P<0.05)。在β-甘露聚糖酶中,提取液中溶质含量的高低顺序为:0.9%NaCl溶液>去离子水>乙酸-乙酸钠缓冲液>磷酸盐缓冲液,除去离子水与0.9%NaCl溶液2处理间差异不显著外(P>0.05),其他提取液任意2处理间有显著差异(P<0.05)。
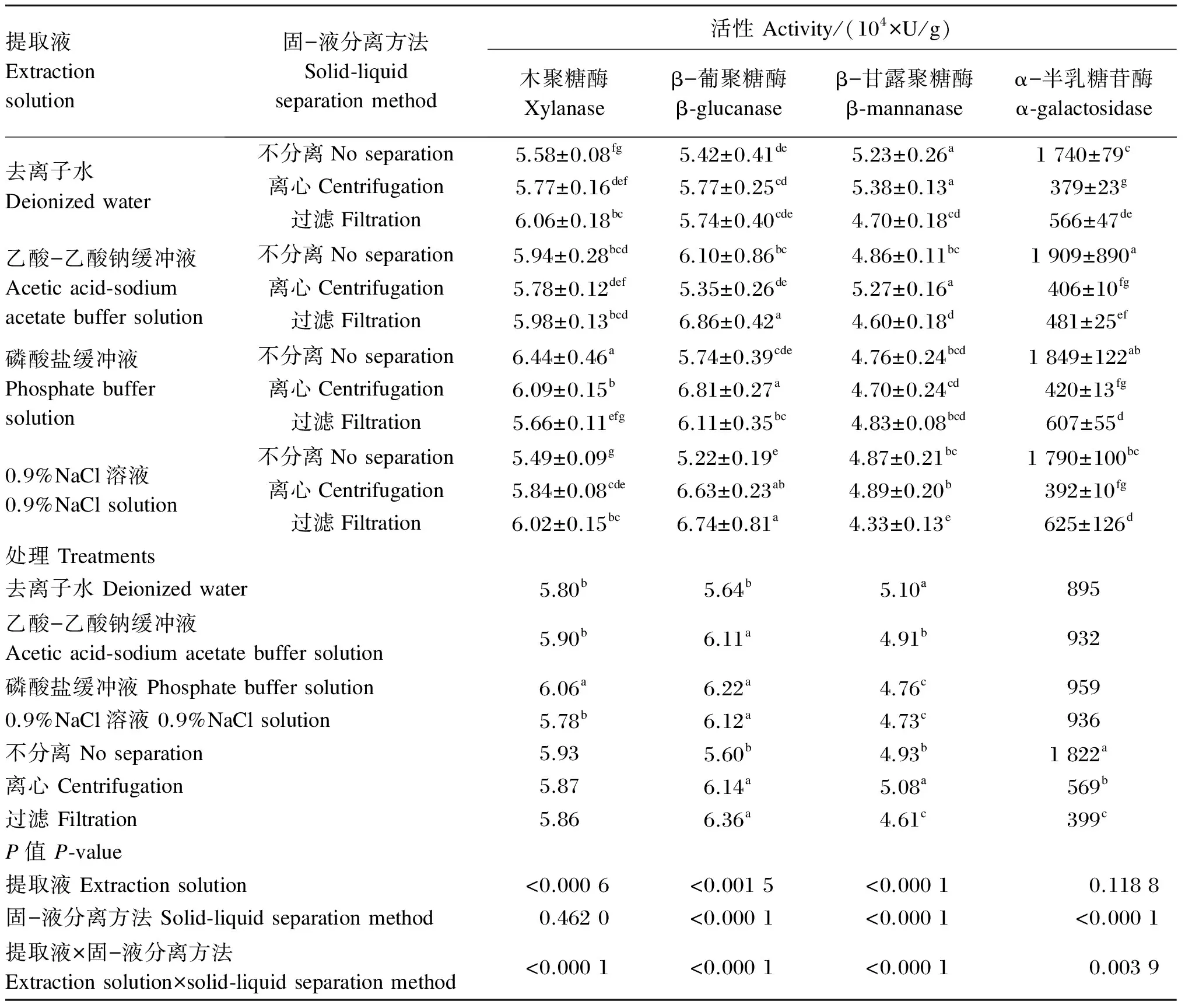
表2 提取液及固-液分离方法对固态非淀粉多糖酶活性的影响
同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same column, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.3提取液对非淀粉多糖酶蛋白质溶解度的影响
提取液对3种固态酶制剂溶解离心后溶液中蛋白质的含量列于表4。在木聚糖酶中,提取液中蛋白质含量的高低顺序为:去离子水>磷酸盐缓冲液>0.9%NaCl溶液>乙酸-乙酸钠缓冲液,除磷酸盐缓冲液与0.9%NaCl溶液2处理间差异不显著(P>0.05)外,其他任意2处理间有显著差异(P<0.05)。在β-葡聚糖酶中,提取液中蛋白质含量的高低顺序为:去离子水>0.9%NaCl溶液>磷酸盐缓冲液>乙酸-乙酸钠缓冲液,且任意2处理间有显著差异(P<0.05)。在β-甘露聚糖酶中,提取液中蛋白质含量的高低顺序为:去离子水>0.9%NaCl溶液>磷酸盐缓冲液>乙酸-乙酸钠缓冲液,乙酸-乙酸钠缓冲液与其他任意处理差异显著(P<0.05)。

表3 提取液对非淀粉多糖酶溶解度的影响
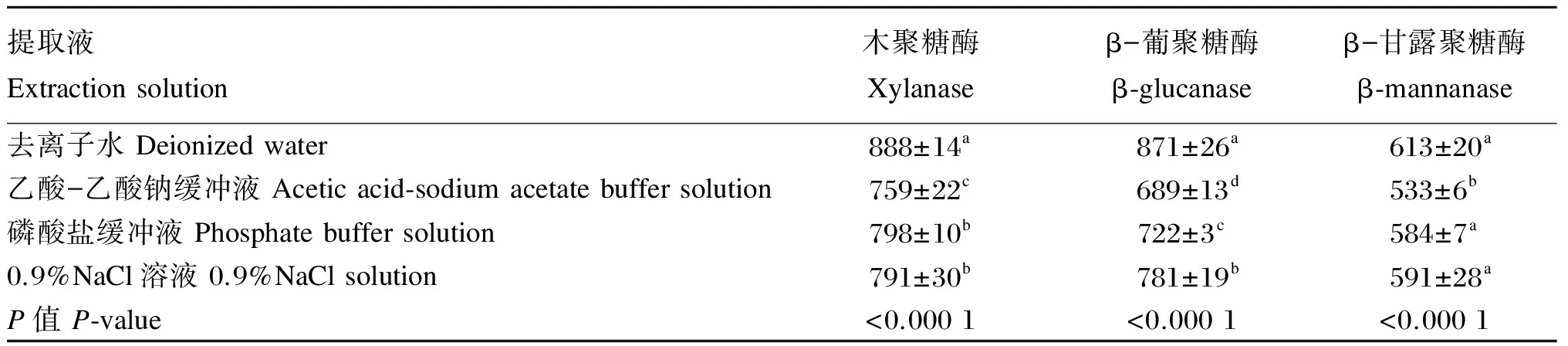
表4 提取液对非淀粉多糖酶蛋白质溶解度的影响
3 讨 论
3.1提取液对固态酶制剂溶解性的影响
饲用酶制剂产品大部分是由微生物发酵后浓缩的酶蛋白吸附在小麦麸、小麦次粉、玉米芯粉及保护剂等载体上[7],呈粉末状。而某些耐高温能力差的饲用酶,为了降低在制粒、膨化过程中酶活性的损失,以绝热材料为载体,将酶制剂包裹在包被材料中[8]。不同生产厂家和不同活性规格的产品,载体的类型及在酶制剂中的含量有较大差异[9-10]。通过提取液溶解固态酶制剂后,溶解液中含有来自发酵浓缩物及载体中的可溶物。其中酶的溶解特性取决于酶蛋白的性质及周围环境的理化性质,如pH、温度、离子强度和介电常数等[11]。因此,不同来源的酶制剂在溶解特性上可能具有较大差异。高玲等[12]的研究表明,不同厂家生产的β-葡聚糖酶需要不同的提取液才能获得最佳的酶抽提效果。然而,在饲用酶制剂活性的测定方法中,爱尔兰Megazyme公司的测定试剂盒及国家标准方法都以测定酶活性所用的乙酸-乙酸钠缓冲液抽提待测酶样品[13-15]。本研究4种缓冲液中,乙酸-乙酸钠缓冲液溶解4种酶制剂后,总体上测定的酶活性较其他提取液高。在溶解后的离心上清液中,4种缓冲液对木聚糖酶、β-葡聚糖酶、β-甘露聚糖酶制剂产品的溶解度呈现了较大的差异,且不同酶制剂达到最大溶解度的提取液并不相同。然而,乙酸-乙酸钠缓冲液溶解的上述3种酶制剂上清液中蛋白质的含量却最低。这表明乙酸-乙酸钠缓冲液溶解酶制剂后,非酶的杂蛋白质含量相对较低。因此,相对于其他3种提取液,乙酸-乙酸钠缓冲液可以最有效地将酶蛋白提取出来。
3.2固-液分离方法对固态酶制剂溶解液中酶活性的影响
非淀粉多糖酶的分子质量大多为2×104~20×104u[8],低离心力(如1 500×g)不会使溶解在溶液中的非淀粉多糖酶沉淀。因此,提取液对固态酶制剂溶解后多采用低速离心的方法分离溶解的酶液与未溶解物[5]。而爱尔兰Megazyme公司的非淀粉多糖酶制剂活性测定试剂盒采用低速离心或过滤的方法获得待测酶液。陆文清等[5]报道酶蛋白可能被过滤介质吸附,且吸附量与分子量大小呈正相关,从而导致滤液测定的酶活性降低。本试验中,固-液不分离使β-葡聚糖酶和β-甘露聚糖酶的活性降低,这可能是仍有少量的酶蛋白仍吸附于载体上未释放,因此,出现了测定酶活性稍低的现象。离心与过滤均使α-半乳糖苷酶的活性大幅降低,这可能是在酶溶液比在2∶100的条件下,α-半乳糖苷酶难以从载体中溶出,分离时大部分酶仍留在载体上,而对这一现象仍需要进一步验证。过滤使β-甘露聚糖酶的活性降低,可能是由于滤纸对β-甘露聚糖具有一定的截留作用。因此,在本试验中α-半乳糖苷酶提取后不宜固液分离,而其他3种酶的提取液适宜进行离心分离。
4 结 论
① 乙酸-乙酸钠缓冲液溶解可以最有效地将4种固态酶制剂的酶蛋白提取出来,发挥酶活性。
② α-半乳糖苷酶提取后不宜通过离心或过滤进行固液分离,而其他3种酶的提取液在本试验条件下适宜进行离心分离。
[1]王在贵,张宏福.饲用木聚糖酶、β-葡聚糖酶活力测定方法的调研[J].饲料广角,2002(15):21-23.
[2]薛梅,史雪萍,张廷荣,等.肉鸡小麦型饲粮4种单酶复配效应的体外法评定[J].动物营养学报,2014,26(12):3747-3756.
[3]DE VRIES S,PUSTJENS A M,SCHOLS H A,et al.Effects of processing technologies combined with cell wall degrading enzymes oninvitrodegradability of barley[J].Journal of Animal Science,2012,90(Suppl.4):331-333.
[4]徐君飞,顾佳佳,刘正初,等.木聚糖酶酶活测定条件的优化[J].农产品加工:学刊,2007(7):7-10.
[5]陆文清,何丽花,曹云鹤.饲料用木聚糖酶活力测定的研究[J].饲料工业,2009,30(4):16-20.
[6]GOMES J E G,DA SILVA NASCIMENTO T C E,DE FRANÇA QUEIROZ A E S,et al.Production,characterization and evaluation ofinvitrodigestion of phytases,xylanases and cellulases for feed industry[J].African Journal of Microbiology Research,2014,8(6):551-558.
[7]熊晓燕,訾乃涛.饲用酶制剂载体的选择和使用[J].饲料工业,2010,31(18):25-28.
[8]BEDFORD M R,PARTRIDGE G G.Enzymes in farm animal nutrition[M].2nd ed.Oxford:CABI Publishing,2010:248-251.
[9]吕艳春.微量饲料添加剂载体的选择和使用[J].中国饲料,2008(12):22-23,28.
[10]叶国清,李海龙.载体和稀释剂的正确选择[J].当代畜牧,2002(10):26-27.
[11]胡小玲,郭小青,管萍,等.在离子液体中蛋白质溶解性和稳定性的研究进展[J].功能材料,2013,44(12):1679-1685,1689.
[12]高玲,刘美玲,孙晓红,等.抽提条件对酶制剂中β-葡聚糖酶活力的影响[J].黑龙江畜牧兽医,2008(12):58-59.
[13]中华人民共和国国家质量监督检验检疫总局.GB/T 23874—2009 饲料添加剂木聚糖酶活力的测定 分光光度法[S].北京:中国标准出版社,2009.
[14]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 18634—2009 饲用植酸酶活性的测定 分光光度法[S].北京:中国标准出版社,2009.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23881—2009 饲用纤维素酶活性的测定 滤纸法[S].北京:中国标准出版社,2009.
(责任编辑田艳明)
Effects of Extraction Solution and Solid-Liquid Separation Method on the Activities of Non-Starch Polysaccharide Enzymes
LIAO Rui1,2ZHAO Feng1*QI Zhili2*ZHANG Hongfu1
(1. State Key Laboratory of Animal Nutrition, Institute of Animal Sciences, Chinese Academy of Agriculture Sciences, Beijing 100193, China; 2. College of Animal Sciences and Technology, Huazhong Agricultural University, Wuhan 430070, China)
This experiment was conducted to investigate appropriate extract solution and solid-liquid separation method for evaluating enzyme in solid feed enzyme product. Extract solution of deionized water, acetic acid-sodium acetate buffer solution (0.1 mol/L, pH 5.50), phosphate buffer solution (0.05 mol/L, pH 6.00) or 0.9% NaCl solution and solid-liquid separation method of no separation, 3 000 r/min of centrifugation for 3 min or filtration were used in a 4×3 factorial arrangement. Each treatment contained 5 replicates with 2 determination in each. The activities of enzymes in the products were determined. Then, the effects of the types of extract solution on the contents of solute and protein were investigated for the enzyme products (excluding α-galactosidase) dissolved and centrifuged. The results showed that the highest determined activity of xylanase was presented in the phosphate buffer solution buffer solution (P<0.05). The similar determined activities of β-glucanase were observed in acetic acid-sodium acetate buffer solution, phosphate solution and 0.9% NaCl solution (P>0.05), and were significantly higher than that in deionized water (P<0.05). The greatest and greater determined activities of β-mannanase were observed in deionized water and acetic acid-sodium acetate buffer solution, respectively, and were significantly greater than those in phosphate solution or 0.9% NaCl solution (P<0.05). The type of extract solution had no significant effect on the determined activity of α-galactosidase (P>0.05). The solid-liquid separation method had no significant effect on the determined activity of xylanase (P>0.05). The greater determined activity of β-glucanase was observed in centrifugation or filtration (P<0.05). The greatest determined activity of β-mannanase was presented in centrifugation (P<0.05). However, the highest determined activity of α-galactosidase product was observed in no separation (P<0.05). There was a significant interaction between the type of extract solution and solid-liquid separation method in the determined activities of 4 enzyme products (P<0.01). The highest dry matter solubility of xylanase product was observed in acetic acid-sodium acetate buffer solution (P<0.05). The highest dry matter solubility of β-glucanase and β-mannanase was presented in deionized water and 0.9% NaCl solution (P<0.05). However, the lowest protein contents of xylanase, β-glucanase and β-mannanase were observed in acetic acid-sodium acetate buffer solution (P<0.05). It is concluded that acetic acid-sodium acetate buffer solution is the most efficient to extract the enzyme protein from the product. After dissolved, the α-galactosidase product is not suitable to separate, but the other enzymes can be separated with centrifugation.[ChineseJournalofAnimalNutrition, 2016, 28(10):3352-3358]
non-starch polysaccharide enzymes; extract solution; solid-liquid separation; enzyme activity
s: ZHAO Feng, associate professor, E-mail: zsummit@iascaas.net.cn; QI Zhili, associate professor, E-mail: zhiliqi@mail.hzau.edu.cn
10.3969/j.issn.1006-267x.2016.10.040
2016-04-01
国家自然科学基金项目(31172215);中国农业科学院科技创新工程(ASTIP-IAS07)
廖睿(1990—),男,湖北鄂州人,硕士研究生,动物营养与饲料科学专业。E-mail: onemoremore@foxmail.com
赵峰,副研究员,硕士生导师,E-mail: zsummit@iascaas.net.cn;齐智利,副教授,硕士生导师,E-mail: zhiliqi@mail.hzau.edu.cn
S816
A
1006-267X(2016)10-3352-07
