不同糖种类及糖水平对松浦镜鲤肠道消化酶活性及肠道和肝脏组织结构的影响
2016-11-15李晋南王常安王连生赵志刚徐奇友
李晋南 王常安 王连生 赵志刚 罗 亮 都 雪 徐奇友
(中国水产科学研究院黑龙江水产研究所,哈尔滨150070)
不同糖种类及糖水平对松浦镜鲤肠道消化酶活性及肠道和肝脏组织结构的影响
李晋南王常安王连生赵志刚罗亮都雪徐奇友*
(中国水产科学研究院黑龙江水产研究所,哈尔滨150070)
本研究旨在探讨不同糖种类及糖水平对松浦镜鲤肠道消化酶活性及肠道和肝脏组织结构的影响。以酪蛋白和鱼粉为主要蛋白质源,鱼油和豆油为脂肪源,葡萄糖和淀粉分别为糖源,配制糖水平分别为25.0%和50.0%的4种等氮等脂的试验饲料。选用初始体重为(8.30±0.15) g的松浦镜鲤420尾,随机分为4组,每组3个重复,每个重复35尾鱼。4组试验鱼饲喂2种糖类型和2种糖水平的4种等氮等脂的试验饲料,分别命名为低淀粉(LS)组、高淀粉(HS)组、低葡萄糖(LG)组和高葡萄糖(HG)组。试验期为60 d。结果表明:HS组的肠道淀粉酶活性显著高于其他各组(P<0.05),蛋白酶活性显著高于HG组和LG组(P<0.05);HG组和LG组的肠道脂肪酶活性显著高于LS组(P<0.05)。HG组的前肠皱襞高度显著低于LG组(P<0.05),中肠皱襞高度显著低于LS组(P<0.05),后肠皱襞高度显著低于其他各组(P<0.05)。各组前肠、中肠和后肠肌层厚度没有显著差异(P>0.05)。HG组的前肠和中肠皱襞宽而短,皱襞密度低于LS组和LG组。HS组和HG组的肝细胞膜破裂,出现空泡现象。综上,含50%淀粉的饲料可增加松浦镜鲤肠道消化酶活性,含50%葡萄糖的饲料则会降低肠道皱襞高度,且饲料糖水平为50%时对松浦镜鲤肝脏组织结构造成了一定程度的负面影响。
松浦镜鲤;葡萄糖;淀粉;肠道形态;肝脏
糖作为一种营养素对鱼类生长具有重要作用[1-4],其既是鱼体热能的主要来源,也是构成体组织的重要物质。饲料糖除提供鱼类活动所需的热能外,多余部分可用于合成糖原(肝糖原和肌糖原),或转化为脂肪存于体内。糖类物质作为饲料中最廉价的能源物质,在饲料中添加适宜水平的糖不但可以节约蛋白质、降低饲料成本,同时可以增加ATP的形成,有利于氨基酸的活化,促进鱼体自身蛋白质的合成,更重要的是可以减少氮、磷的排放,减轻水体污染,实现饲料工业的可持续性发展[5-6]。但是,鱼类摄入高糖饲料后,其生长性能下降、抗病能力下降,同时肝糖原含量增高,容易损害鱼类肝脏的正常功能,使其代谢功能下降[7-9]。
目前,关于不同糖种类或糖水平对不同种类鱼生长性能影响的研究已经很多[10-12],但是对于高糖水平对鱼类肠道和肝脏组织结构影响的研究报道不多。蒋利和等[13]研究表明,饲料糖水平分别为40%和45%时,肝脏组织切片有明显的细胞脂滴空泡状、核偏移和细胞质消失现象。对异育银鲫的研究表明,其可以耐受50%的饲料糖水平,但长期摄食高糖饲料会引起一定程度的肝脏功能和结构的损伤[1]。松浦镜鲤是中国水产科学研究院黑龙江水产研究所在德国镜鲤选育系(F4)的基础上选育的新品种,具有鳞片少、生长速度快、含肉率高、肉质好等特点,具有很高的经济价值。松浦镜鲤作为杂食性鱼类,对糖类物质的利用能力较强,Wilson[9]的研究表明鲤鱼利用淀粉的能力优于葡萄糖,并且能耐受400 g/kg的糖类物质。本试验以松浦镜鲤为研究对象,选用葡萄糖和淀粉2种糖源,设定25.0%低糖水平和50.0%高糖水平,在前期研究了不同糖种类及糖水平对松浦镜鲤生长性能及血液学指标影响[14]的基础上,进一步研究不同糖种类及糖水平对松浦镜鲤肠道消化酶活性及肠道和肝脏组织结构的影响,为更好地理解鱼类糖代谢机制奠定理论基础。
1 材料与方法
1.1试验动物及饲料
松浦镜鲤选自中国水产科学研究院黑龙江水产研究所。以酪蛋白和鱼粉为主要蛋白质源,鱼油和豆油为脂肪源,葡萄糖和淀粉分别为糖源,配制糖水平分别为25.0%和50.0%的4种等氮等脂的试验饲料,其组成及营养水平见表1。饲料原料经粉碎按配比混合均匀,少量的组分采用逐级扩大法混合,然后用颗粒机制成粒径为2 mm的颗粒饲料,置于-20 ℃冰箱中保存待用。

表1 试验饲料组成及营养水平(干物质基础)
维生素预混料和矿物质预混料为每千克饲料提供Vitamin premix and mineral premix provided the following per kg of diets: VA 8 000 IU,VE 70 mg,VB118 mg,VB235 mg,VB618 mg,泛酸 pantothenic acid 60 mg,烟酸 niacin 200 mg,生物素 biotin 2.5 mg,VB120.6 mg,叶酸 folic acid 6 mg,肌醇 1 000 mg,VC 500 mg,VD32 000 IU,VK 7 mg,Zn 65 mg,Fe 75 mg,Cu 3.5 mg,Mn 16 mg,I 0.65 mg,Co 0.1 mg,Se 0.1 mg。
1.2试验设计与饲料管理
试验选择规格一致的初始体重为(8.30±0.15) g的健康松浦镜鲤420尾,预饲2周后按照投喂试验饲料的不同随机分为4组,分别命名为低淀粉(LS)组、高淀粉(HS)组、低葡萄糖(LG)组和高葡萄糖(HG)组。每组设3个重复,每个重复35尾鱼。试验周期为60 d,每天定时投喂4次,每次投喂以饱食无残饵为准。试验在室内控温循环水族箱里进行,温度为(24±1) ℃,24 h不间断供氧,溶氧浓度大于5 mg/L,每日吸污,每周换去水族箱内2/3的水并注入已曝气的水,每日观察记录试验鱼的摄食和死亡情况。
1.3肠道消化酶活性的测定
试验结束后,将试验鱼饥饿24 h,每箱随机选取3尾鱼,置于冰盘上解剖,取肠道组织,去除脂肪和内含物,用冰浴的0.86%生理盐水洗净肠道中的内容物,滤纸吸干水分,称量肠重。按质量体积比1∶9加入生理盐水,以FJ-200CL高速组织匀浆机匀浆,4 ℃条件下4 000 r/min离心10 min,取上清液作为肠道组织粗酶液,分装于1.5 mL离心管中,-20 ℃保存,待测蛋白酶、淀粉酶和脂肪酶活性。蛋白酶、淀粉酶和脂肪酶活性测定方法见参考文献[15]。
1.4肠道和肝脏组织切片制备
试验结束后,每组随机取3尾鱼,置于冰盘上迅速解剖,分别取肝脏组织和前肠、中肠和后肠肠段,以0.86%的生理盐水冲洗干净,固定于Bouin氏液中。固定24 h后,经过乙醇逐级脱水、二甲苯透明、石蜡包埋、切片(厚度5 μm)、苏木精-伊红(HE)染色、脱水、透明、中性树脂封片。用Leica MD 4000B显微镜观察肝脏和肠道组织切片,并拍照分析。图像由Motic Images Plus 2.0软件进行分析,每段肠样测量15个以上完整皱襞高度和肌层厚度,取其平均值作为该样品皱襞高度和肌层厚度的测定结果。
1.5统计分析
试验结果用SPSS 20.0软件进行单因素和双因素方差分析,并采用Duncan氏法进行多重比较,结果用平均值±标准误(mean±SE)表示,显著性水平为P<0.05。
2 结果与分析
2.1不同糖种类及糖水平对松浦镜鲤肠道消化酶活性的影响
各试验组肠道消化酶活性的结果见表2。HS组的肠道蛋白酶活性显著高于HG组和LG组(P<0.05),淀粉酶活性显著高于其他各组(P<0.05);HG组和LG组的肠道脂肪酶活性显著高于LS组(P<0.05)。饲料糖种类和糖水平对松浦镜鲤肠道消化酶活性不存在交互作用(P>0.05)。

表2 不同糖种类及糖水平对松浦镜鲤肠道消化酶活性的影响
CL:糖水平;CT:糖种类。下表同。
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
CL: carbohydrate level; CT: carbohydrate type. The same as below.
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05).
2.2不同糖种类及糖水平对松浦镜鲤肠道形态的影响
由表3可知,前肠、中肠和后肠肌层厚度各组间没有显著差异(P>0.05),且双因素方差分析显示饲料糖种类和糖水平对各肠段肌层厚度不存在交互作用(P>0.05)。HG组的前肠皱襞高度显著低于LG组(P<0.05),中肠皱襞高度显著低于LS组(P<0.05),后肠皱襞高度显著低于其他各组(P<0.05)。饲料糖水平显著影响前肠和中肠肠道皱襞高度(P<0.05),糖种类显著影响后肠皱襞高度(P<0.05),且饲料糖水平和糖种类对松浦镜鲤前肠和后肠的皱襞高度存在交互作用(P<0.05)。

表3 不同糖种类及糖水平对松浦镜鲤肠道形态的影响
同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
In the same column, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05).
2.3肠道组织切片观察
各组松浦镜鲤前肠组织切片见图1。HS组前肠褶皱密度低于LG组,LS组和LG组的皱襞高而细,排列紧密;HG组的前肠皱襞短小,低于LG组。
各组松浦镜鲤中肠组织切片见图2。除HG组外,松浦镜鲤中肠肠道褶皱高且细,排列紧密;HG组中肠表现出肠褶皱宽而短,排列较为稀疏。

FH:皱襞高度 fold height;MT:肌层厚度 muscular thickness。
图1松浦镜鲤前肠组织切片
Fig.1Tissue slices of foregut ofSongpumirror carp (200×)
各组松浦镜鲤后肠组织切片见图3。相较于LS组和LG组,HS组和HG组松浦镜鲤后肠肠道褶皱略显短,但都排列紧密,形态较完整。
2.4肝脏组织切片观察
各组松浦镜鲤肝脏组织切片见图4。与LS组相比,HS组的肝细胞边缘模糊,轮廓不清晰,肝细胞组织结构的网状支架破坏,一些细胞核聚集在一起每组3个试验样本,其发生组织病变的概率为60%~70%,致使一些生化相关指标升高。LG组与HG组相比,肝细胞排列整齐,结构完整,细胞轮廓清晰有序。HG组中有60%左右的试验样本的切片显示,肝细胞边缘模糊,细胞排列不整齐。
3 讨 论
鱼类肠道是机体营养物质消化、吸收的重要场所,其中所含消化酶的活性可以作为衡量鱼类对饲料营养成分消化、吸收和利用的重要指标[16-17]。淀粉酶的分泌量及活性直接决定鱼类对饲料中糖类物质的消化能力[18]。有研究表明淀粉酶活性主要由遗传因素决定[19-20],一些研究认为提高饲料中糖水平能提高淀粉酶活性[21]。李弋等[22]的研究表明饲料中添加淀粉能够提高大黄鱼的肠道淀粉酶活性。本试验的结果显示HS组的肠道淀粉酶活性显著高于葡萄糖组(HG组和LG组)和LS组,同样,肠道蛋白酶活性在HS组中也是最高的,这种消化酶活性的协同作用在方斑东风螺的糖营养代谢研究[23]中也得到同样结果,但葡萄糖组的肠道脂肪酶活性要显著高于LS组。这些结果说明饲料糖种类及糖水平对松浦镜鲤肠道消化酶活性有一定的影响,但具体的机制还有待于进一步的研究。

图2 松浦镜鲤中肠组织切片

图3 松浦镜鲤后肠组织切片
鱼类是较低等的脊椎动物,肠道组织虽与陆生动物相似,但却不及陆生动物发达,因此鱼类的肠道皱襞的密度、高度及排列状态就能反映出鱼类肠道的消化吸收能力[24-25]。肠道的正常发育对鱼类的消化能力有着重要的影响[26]。目前,关于糖类物质对鱼类肠道形态的报道还不多见,本试验的结果表明饲料中以50.0%的葡萄糖作为糖源的组的前肠、中肠、后肠皱襞高度显著降低,而高淀粉饲料对肠道皱襞高度没有产生显著影响,说明高水平的葡萄糖对肠道皱襞高度产生了严重影响,从组织切片上也可以看出,HG组的肠道皱襞高度明显降低,皱襞宽而短,排列稀疏,尤其是前肠和中肠,严重影响了肠道对营养物质的吸收,这与本课题组前期试验得出的高葡萄糖饲料降低了松浦镜鲤的生长性能,HG组的增重率和特定增长率最低,而饲料系数最高,蛋白质效率也显著低于其他各组[14]的结论相印证。
肝脏是鱼类进行糖代谢的重要器官,摄食过高水平糖饲料在组织学上对鱼类会产生一定的营养胁迫,在鱼体肝脏组织学上有明显的表现。成成等[27]研究指出,饲料糖水平分别为15%和30%时,南方鲇幼鱼肝细胞出现较多肿胀和脂滴,部分肝细胞膜破裂,肝细胞核多移至细胞边位。徐祥泰等[28]研究表明,摄食含10%蜡质玉米淀粉、小麦淀粉或木薯淀粉饲粮的大口黑鲈肝细胞的细胞核移至细胞边位,出现空泡化现象。研究表明,分别用含51.7%和42.43%糖的饲料喂养南亚野鲮,其肝细胞均发生肿胀和空泡化[29-30]。有研究认为,细胞肿胀和空泡化可能是由于糖代谢的负担过重而引起的应激或胁迫状态,也可能是糖原积累所导致的[30]。本试验中,HS组和HG组中肝细胞多数出现细胞膜破裂,细胞轮廓不清晰,这些现象说明高糖饲料可以在一定程度上对鱼体肝脏功能造成损害,从而对生长指标、体成分和血清生化指标造成一定的负面影响[14,31]。
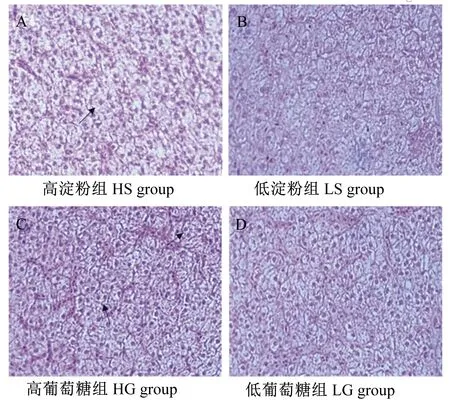
→:细胞膜破裂,细胞轮廓不清晰 The membranes of hepatocyte were ruptured, and the cell contour was not clear。
图4松浦镜鲤肝脏组织切片
Fig.4Tissue slices of liver ofSongpumirror carp (200×)
4 结 论
含50%淀粉的饲料可增加松浦镜鲤肠道消化酶活性,含50%葡萄糖的饲料则会降低肠道皱襞高度,且饲料糖水平为50%时对松浦镜鲤肝脏组织结构造成了一定程度的负面影响。
[1]缪凌鸿,刘波,戈贤平,等.高碳水化合物水平日粮对异育银鲫生长、生理、免疫和肝脏超微结构的影响[J].水产学报,2011,35(2):221-230.
[2]谭肖英,罗智,刘永坚.鱼类对饲料中糖的利用研究进展[J].中国饲料,2007(6):19-23.
[3]蔡春芳,陈立侨,叶元土,等.日粮糖种类和水平对青鱼生长性能和生理指标的影响[J].动物营养学报,2009,21(2):212-218.
[4]ASADUZZAMAN M,WAHAB M A,VERDEGEM M C J,et al.Effects of addition of tilapiaOreochromisniloticusand substrates for periphyton developments on pond ecology and production in C/N-controlled freshwater prawnMacrobrachiumrosenbergiifarming systems[J].Aquaculture,2009,287(3/4):371-380.
[5]ASADUZZAMAN M,WAHAB M A,VERDEGEM M C J,et al.Effects of carbohydrate source for maintaining a high C∶N ratio and fish driven re-suspension on pond ecology and production in periphyton-based freshwater prawn culture systems[J].Aquaculture,2010,301(1/2/3/4):37-46.
[6]LEE S M,KIM K D.Effects of dietary carbohydrate to lipid ratios on growth and body composition of juvenile and grower rockfish,Sebastesschlegeli[J].Aquaculture Research,2009,40(16):1830-1837.
[7]HU Y H,LIU Y J,TIAN L X,et al.Optimal dietary carbohydrate to lipid ratio for juvenile yellowfin seabream (Sparuslatus)[J].Aquaculture Nutrition,2007,13(4):291-297.
[8]MOREIRA I S,PERES H,COUTO A,et al.Temperature and dietary carbohydrate level effects on performance and metabolic utilisation of diets in European sea bass (Dicentrarchuslabrax) juveniles[J].Aquaculture,2008,274(1):153-160.
[9]WILSON R P.Utilization of dietary carbohydrate by fish[J].Aquaculture,1994,124(1/2/3/4):67-80.
[10]ELLIS S C,REIGH R C.Effects of dietary lipid and carbohydrate levels on growth and body composition of juvenile red drum,Sciaenopsocellatus[J].Aquaculture,1991,97(4):383-394.

[12]TIAN L X,LIU Y J,HUNG S S O,et al.Effect of feeding strategy and carbohydrate source on carbohydrate utilization by grass carp (Ctenopharyngodonidella) [J].American Journal of Agricultural and Biological Sciences,2010,5(2):135-142.
[13]蒋利和,吴宏玉,黄凯,等.饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响[J].水产学报,2013,37(2):245-255.
[14]LI J N,XU Q Y,WANG C A,et al.Effects of dietary glucose and starch levels on the growth,haematological indices and hepatic hexokinase and glucokinase mRNA expression of juvenile mirror carp (Cyprinuscarpio)[J].Aquaculture Nutrition,2016,22(3):550-558.
[15]李晋南,徐奇友,王常安,等.谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响[J].动物营养学报,2014,26(5):1347-1352.
[17]刘襄河,叶超霞,郑丽勉,等.饲料糊精水平对暗纹东方鲀幼鱼生长、消化酶活性和血液生化指标的影响[J].水产学报,2013,37(9):1359-1368.
[18]SALZE G,CRAIG S R,SMITH B H,et al.Morphological development of larval cobiaRachycentroncanadumand the influence of dietary taurine supplementation[J].Journal of Fish Biology,2011,78(5):1470-1491.
[19]FANGE R,GROVE D.Digestion[M]//HOAR W S,RANDALL D J,BRETT J T.Fish physiology.Vol.8:bioenergetics and growth.New York:Academic Press,1979:161-260.
[20]UGOLEV A M,EGOROVA V V,KUZ’MINA V V,et al.Comparative-molecular characterization of membrane digestion in fish and mammals[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1983,76(3):627-635.
[21]MOYANO F J,DAZ M,ALARCN F J,et al.Characterization of digestive enzyme activity during larval development of gilthead seabream (Sparusaurata)[J].Fish Physiology and Biochemistry,1996,15(2):121-130.
[22]李弋,周飘苹,邱红,等.饲料中糖源对大黄鱼生长性能及消化酶、糖代谢关键酶活性的影响[J].动物营养学报,2015,27(11):3438-3447.
[23]张丽丽,周歧存,程怡秋,等.不同糖源对方斑东风螺生长、饲料利用和消化酶活性的影响[J].广东海洋大学学报,2009,29(4):14-18.
[24]UDA K,TSUJIKAWA T,FUJIYAMA Y,et al.Rapid absorption of luminal polyamines in a rat small intestineexvivomodel[J].Journal of Gastroenterology and Hepatology,2003,18(5):554-559.
[25]SANG H M,FOTEDAR R.Effects of mannan oligosaccharide dietary supplementation on performances of the tropical spiny lobsters juvenile (Panulirusornatus,Fabricius 1798)[J].Fish & Shellfish Immunology,2010,28(3):483-489.
[26]邓君明,麦康森,艾庆辉,等.大豆低聚糖对牙鲆营养效应的研究:Ⅱ消化率和消化生理[J].水生生物学报,2009,33(3):369-375.
[27]成成,谢小军,罗毅平,等.饲料碳水化合物水平对南方鲇(Silurusmeridionalis)幼鱼肝脏、胰脏和肾脏的组织学影响[J].西南大学学报:自然科学版,2007,29(6):103-108.
[28]徐祥泰,陈乃松,刘子科,等.饲料中不同淀粉源及水平对大口黑鲈肝脏组织学的影响[J].上海海洋大学学报,2016,25(1):61-70.
[29]MOHAPATRA M,SAHU N P,CHAUDHARI A.Utilization of gelatinized carbohydrate in diets ofLabeorohitafry[J].Aquaculture Nutrition,2003,9(3):189-196.
[30]KUMAR S,SAHU N P,PAL A K,et al.Effect of dietary carbohydrate on haematology,respiratory burst activity and histological changes inL.rohitajuveniles[J].Fish & Shellfish Immunology,2005,19(4):331-344.
[31]李晋南,徐奇友,王常安,等.不同糖及糖水平对松浦镜鲤GH/IGF-Ⅰ基因表达和鱼体组成的影响[J].上海海洋大学学报,2015,24(4):489-495.
(责任编辑菅景颖)
Effects of Different Carbohydrate Types and Carbohydrate Levels on Intestinal Digestive Enzyme Activities, Intestinal and Liver Histological Structure ofSongpuMirror Carp (Cyprinuscarpiospecularis)
LI JinnanWANG Chang’anWANG LianshengZHAO ZhigangLUO LiangDU XueXU Qiyou*
(Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China)
This experiment was aimed to study the effects of different carbohydrate types and carbohydrate levels on intestinal digestive enzyme activities, intestinal and liver histological structure ofSongpumirror carp (Cyprinuscarpiospecularis). A total of 420Songpumirror carp with the average body weight of (8.30±0.15) g were randomly divided into 4 groups with 3 replicates and 35 fish per replicate. The fish in 4 groups were fed 4 isonitrogenous and isolipidic experimental diets with two carbohydrate types (starch and glucose) and two carbohydrate levels (25.0% and 50.0%), and the groups were named as low starch (LS) group, high starch (HS) group, low glucose (LG) group and high glucose (HG) group, respectively. The experiment lasted for 60 days. The results showed that the intestinal amylase activity of HS group was significantly higher than that of other groups (P<0.05). The intestinal protease activity of HS group was significantly higher than that of HG and LG groups (P<0.05). The intestinal lipase activity of HG and LG groups was significantly higher than that of LS group (P<0.05). The fold height of foregut of HG group was significantly lower than that of LG group (P<0.05). The fold height of midgut of HG group was significantly lower than that of LS group (P<0.05). The fold height of hindgut of HG group was significantly lower than that of other groups (P<0.05). The muscular thickness of foregut, midgut and hindgut had no significant difference among groups (P>0.05). The folds of foregut and midgut of HG group was wide and short, and the fold density of foregut and midgut was lower than that of LS and LG groups. The membranes of hepatocyte of HS and HG groups were ruptured and demonstrated vacuolation. In conclusion, dietary contained 50% starch can improve intestinal digestive enzyme activities inSongpumirror carp, but dietary contained 50% glucose can decrease the intestine fold height, and 50% dietary carbohydrate level has a negative impact on the histological structure of liver inSongpumirror carp.[ChineseJournalofAnimalNutrition, 2016, 28(10):3217-3224]
Songpumirror carp; glucose; starch; intestinal morphology; liver
, professor, E-mail: xuqiyou@sina.com
10.3969/j.issn.1006-267x.2016.10.025
2016-04-06
中央级公益性科研院所基本科研业务费专项(HSY201306);现代农业产业技术体系建设专项(CARS-46)
李晋南(1983—),女,黑龙江哈尔滨人,助理研究员,博士,研究方向为水产动物营养与饲料。E-mail: lijinnan123@163.com
徐奇友,研究员,硕士生导师,E-mail: xuqiyou@sina.com
S963
A
1006-267X(2016)10-3217-08
