内蒙古锡林郭勒盟地区传统奶油制品中产共轭亚油酸乳酸菌的分离筛选与鉴定
2016-11-14刘春晓李佳宇刘乃齐刘立杰张建丽
刘春晓,李佳宇,刘乃齐,刘立杰,张建丽,白 英*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
内蒙古锡林郭勒盟地区传统奶油制品中产共轭亚油酸乳酸菌的分离筛选与鉴定
刘春晓,李佳宇,刘乃齐,刘立杰,张建丽,白 英*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
本实验从内蒙古锡林郭勒盟地区传统奶油制品中分离筛选共轭亚油酸(conjugated linoleic acid,CLA)高产乳酸菌。采用紫外分光光度法检测菌株发酵液中CLA含量,筛选出高产菌株,分析其菌落特征、细胞形态及生理生化特性,并结合16S rDNA全序列分析以及系统发育树,鉴定其种属。结果表明,从样品中共筛出20 株产CLA菌株,当亚油酸(linoleic acid,LA)添加量为0.06%,接种量为2%时,分离自镶黄旗酸油的11 株产CLA菌株中,菌株HS4产量最高,为23.586 μg/mL,转化率为7.86%,经鉴定其为干酪乳杆菌(Lactobacillus casei);分离自正镶蓝旗稀奶油的9 株产CLA菌株中,菌株LX5产量最高,为20.508 μg/mL,转化率为6.84%,经鉴定其为副干酪乳杆菌(Lactobacillus paracasei)。
共轭亚油酸;传统奶油制品;乳酸菌;筛选;鉴定
共轭亚油酸(conjugated linoleic acid,CLA)是含有顺式或反式共轭双键的十八碳二烯酸,是亚油酸(cis9,cis12-C18∶2,linoleic acid,LA)的一组位置和构象异构体的总称,其中以cis9,trans11-CLA和trans10,cis12-CLA为主。CLA具有抗癌、抗动脉粥样硬化、降低脂肪沉积、提高免疫力、促进生长等生理功能,具有广泛的应用前景[1-2]。天然CLA主要来自反刍动物瘤胃中的溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)对亚油酸的异构化作用,产量较少,且该菌为严格厌氧菌,不易培养,难以实现工业化生产[3]。目前多采用碱性异构化法生产CLA,产量大,效率高,但得到一系列具有位置和几何异构体的CLA混合物,难以人为控制,且食用安全性较低[4]。近年来,人们发现微生物合成的CLA异构体具有组成形式单一、生理活性高、无毒副作用等特点,因此分离筛选出具高产CLA能力的乳酸菌逐步成为研究的热点。
目前多数研究者从酸菜、奶酪、动物瘤胃与肠道中分离产CLA菌株,如张中义等[5]从传统自然发酵酸菜汁中分离出植物乳杆菌(Lactobacillus plantarum)、方丽等[6]从东北传统酸菜汁中分离出鼠李糖乳杆菌(Lactobacillus rhamnosus)、罗玉芬[7]从自制泡菜中筛选出明串珠菌(Leuconostoc sp.)、秦敏江[8]从奶酪中筛选出费氏丙酸杆菌(Propionibacterium freudenreichii)、Gurovica等[9]从鱼肠道中分离出戊糖乳杆菌(Lactobacillus pentosus)、黄翠丽等[10]从内蒙古鄂尔多斯山羊瘤胃中分离出婴儿链球菌(Streptococcus infantarius)。本实验以采集自内蒙古锡林郭勒盟地区的传统奶油制品为原料,利用溴甲酚紫平板进行初筛,以紫外分光光度法检测菌株发酵液中CLA含量的方式进行复筛,筛选出高产菌株,对其菌落特征、细胞形态及生理生化特性进行分析,并结合16S rDNA全序列分析以及系统发育树,鉴定其种属。
1 材料与方法
1.1 材料、培养基与试剂
镶黄旗酸油、正蓝旗稀奶油,均采购于内蒙古锡林郭勒盟锡林浩特市额吉淖尔路察哈尔奶食店。
溴甲酚紫培养基、MRS固体培养基、MRS半固体培养基、MRS液体培养基按照参考文献[7]中的方法配制。
共轭亚油酸标准品(纯度≥99.9%)、亚油酸(纯度≥99.9%) 美国Sigma公司;Ezup柱式细菌基因组DNA抽提试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒(含染料) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
SX-500全自动高压蒸汽灭菌锅 日本Tomy公司;T6新世纪紫外可见分光光度仪 北京普析通用仪器有限责任公司;OLYMPUS BX50型光学显微镜 日本Olympus公司;SW-CJ-1D型超净台 苏州安泰空气技术公司;303-OA型生化培养箱 天津市通利信达仪器厂;LEICA DM4000B型正置智能荧光显微镜 德国徕卡公司;PHS-3C型酸度计 上海佑科仪器有限公司;3730X型测序仪、2720 thermal cycler型PCR仪 美国应用生物系统公司;DYCP-31DN型DNA电泳槽 北京六一仪器厂;FR980型凝胶成像仪 上海复日科技仪器有限公司。
1.3 方法
1.3.1 菌株分离纯化
在无菌条件下用接种环挑取少量奶油制品于MRS液体培养基中,37 ℃培养24 h后,从液体培养基中挑取一环菌液在溴甲酚紫平板上划线,置于培养箱中37 ℃厌氧、倒置培养24 h。将平板上能使周围紫色变为黄色的菌落进行反复分离纯化至单菌落[11-15]。将各菌株编号后进行革兰氏染色与过氧化氢酶实验,将G+、过氧化氢酶阴性的菌株接种于MRS半固体培养基中37 ℃培养24 h后,置于4 ℃冰箱中保存。
1.3.2 产CLA乳酸菌的筛选
发酵培养液中加入0.06% LA乳化液(吐温-80、LA和蒸馏水以体积比5∶3∶10进行乳化),用一次性注射器通过已灭菌、膜孔径为0.22 μm的微孔过滤器过滤除菌[7]。初筛菌株在MRS液体培养基中37 ℃活化2 代,在每支试管中(15 mm×150 mm)装入4.5 mL MRS液体培养基,加入0.5 mL LA乳化液,接种量为2%,接种后置于快速混匀器混匀,37 ℃发酵24 h[7]。
1.3.3 菌株产CLA水平检测
CLA标准曲线制作:以正己烷为溶剂,将10 mg CLA标准品定容于100 mL容量瓶中,分别吸取0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50、0.55、0.60、0.65、0.70、0.75、0.80 mL CLA溶液装入10 mL容量瓶,利用正己烷定容[16-19]。以正己烷为参比,在233 nm波长处测定不同质量浓度(0.000~8.000 μg/mL)溶液的吸光度,以CLA质量浓度为横坐标,吸光度为纵坐标,绘制共轭亚油酸标准曲线[5],得到回归方程为y=0.126 7x(R2=0.999 3)。
发酵结束后,将发酵液移入60 mm分液漏斗中,每管发酵液加入20 mL正己烷振荡萃取5 min,静置分层后弃去下层水相液体,用5 mL蒸馏水振荡水洗,静置后弃去下层水相液体,水洗3 遍,将萃取液移至干净小烧杯中,再用垫有滤纸并盛装少量无水硫酸钠的小漏斗进行过滤以除去水分和水溶性物质,直至乳化层消失。将脱水后的正己烷萃取液移入25 mL容量瓶中,正己烷定容,摇匀后进行紫外检测。将未接入菌种的,与发酵培养基同一批次灭菌后的MRS液体培养基按照以上方法培养、萃取、定容,以所得的萃取液为参比液,采用紫外-可见分光光度计在233 nm波长处测定吸光度,根据CLA标准曲线方程计算CLA的生成量。根据发酵液中CLA含量,筛选出产CLA水平高的菌株[15-17]。
1.3.4 菌落与细胞形态特征分析
将高产菌株接种于MRS固体培养基上,37 ℃培养24 h后,观察菌落特征,革兰氏染色后,观察细胞形态[20-25]。
1.3.5 菌株生化特性测定
生化特性测定的主要实验有:糖发酵实验、葡萄糖酸盐实验、明胶液化实验、淀粉水解实验、过氧化氢酶实验、石蕊牛乳实验、吲哚实验、硝酸盐还原实验、V-P(乙酰甲基醇)实验、甲基红实验、脲酶实验和硫化氢实验[20-25]。
1.3.6 菌株生理特性测定
1.3.6.1 不同培养温度对菌体生长的影响
将菌株接入MRS液体培养基中,在10、15、20、25、30、35、40、45、50 ℃条件下分别培养18、24、48、72 h,测定菌液在600 nm波长处的吸光度,以培养温度为横坐标、吸光度为纵坐标绘制曲线[20-25]。
1.3.6.2 菌株液体培养基的最终pH值与生长量测定
从半固体MRS培养基上取菌株一环接种到pH值为7.0的MRS液体培养基中培养,每隔4 h取菌液,测定菌液pH值与600 nm波长处的吸光度,以培养时间为横坐标、pH值与吸光度为纵坐标绘制曲线[20-25]。
1.3.6.3 菌株运动性实验
将菌株用接菌针穿刺接种于半固体MRS培养基内,37 ℃培养24 h后,观察菌株运动性[20-23]。
1.3.7 菌株16S rDNA序列分析及系统发育树的构建
Ezup柱式基因组DNA的提取:取1 mL过夜培养的细菌菌液,加入1.5 mL离心管中,室温下8 000 r/min离心1 min,弃上清,收集菌体。加入180 μL溶菌酶溶液,重悬菌液,37 ℃水浴50 min。再加入20 μL蛋白酶K溶液,振荡混匀。56 ℃水浴30 min至细胞完全裂解。加入200 μL Buffer BD,充分颠倒混匀。加入200 μL无水乙醇,充分颠倒混匀。将吸附柱放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部加入吸附柱中,静置2 min,再12 000 r/min离心1 min,倒掉收集管中的废液。将吸附柱放回收集管,加入500 μL PW,10 000 r/min离心30 s倒掉滤液。将吸附柱放回收集管,加入500 μL清洗液,10 000 r/min离心30 s倒掉滤液。将吸附柱重新放回收集管,于12 000 r/min室温离心2 min,除去残留的清洗液[19,26]。取出吸附柱,放入一个新的1.5 mL离心管中,加入70 μL CE Buffer静置3min,12 000 r/min室温离心2 min,收集DNA溶液。提取的DNA进行下一步实验。
PCR扩增:以通用引物7F 5'-CAGAGTTTGA TCCTGGCT-3'和1540R 5'-AGGAGGTGATCCAGCCGCA-3'扩增其16S rDNA片段。PCR反应体系(25 μL):10×PCR Buffer(Mg2+)2.5 μL;2.5 mmol/L dNTP Mix 1 μL;引物F(10 μmol/L)0.5 μL;引物R(10 μmol/L) 0.5 μL;Taq DNA 聚合酶 0.2 μL;基因组DNA 0.5 μL;加ddH2O至25 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30 个循环;最后72 ℃延伸10 min[26-27]。
PCR产物经生工生物工程(上海)有限公司测序。测序结果应用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)上的BLAST程序进行相似性对比分析,并采用MEGA 6软件进行同源性分析,构建系统发育树[19]。
2 结果与分析
2.1 20 株产CLA菌产量
从镶黄旗酸油中分离到11 株产CLA菌株,经镜检,均为G+、杆菌。将11 株菌依次编号为HS1、HS2、HS3、HS4、HS5、HS6、HS7、HS8、HS9、HS10、HS11,CLA产量如图1所示。11 株菌CLA产量的范围在9.379~23.586 μg/mL,其中菌株HS4产CLA的能力最强,产量为23.586 μg/mL,转化率为7.86%。
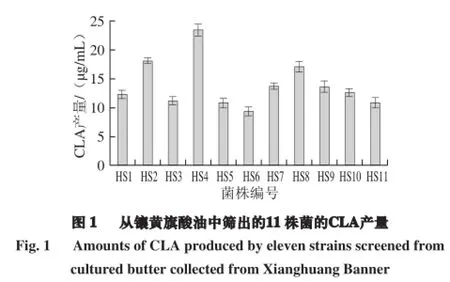
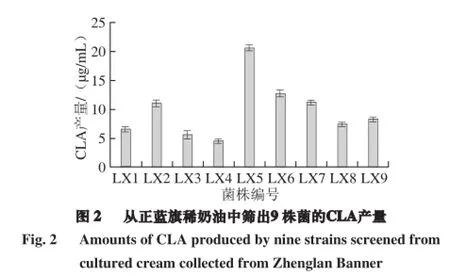
从正蓝旗稀奶油中分离到9 株能产CLA的菌株,经镜检,均为G+、杆菌。将9 株菌依次编号为LX1、LX2、LX3、LX4、LX5、LX6、LX7、LX8、LX9,CLA产量如图2所示。9 株菌CLA产量的范围在4.485~20.508 μg/mL,菌株LX5产CLA的能力最强,产量为20.508 μg/mL,转化率为6.84%。
2.2 高产菌株菌落特征与细胞形态
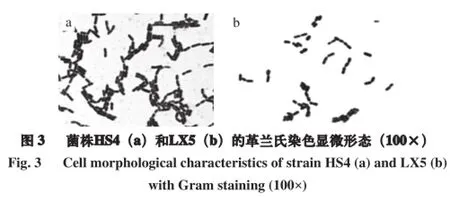
由图3可知,2 株高产CLA菌株菌落形态均为圆形,表面光滑不透明,中央微凸起,HS4的菌落大小在2 mm以下,LX5的菌落大小在2~4 mm,HS4的菌落颜色为白色略带浅黄色,LX5的菌落颜色为乳白色,革兰氏染色均为阳性,均无鞭毛、无芽孢,均为杆菌,排列方式多为单个或短链。
2.3 高产菌株的生化特性

由表1可知,2 株高产CLA菌株能发酵大部分糖类,发酵葡萄糖不产气;HS4不能发酵阿拉伯糖、蜜二糖、鼠李糖、棉子糖、木糖;LX5不能发酵阿拉伯糖、松三糖、蜜二糖、鼠李糖、棉子糖、木糖、山梨醇。
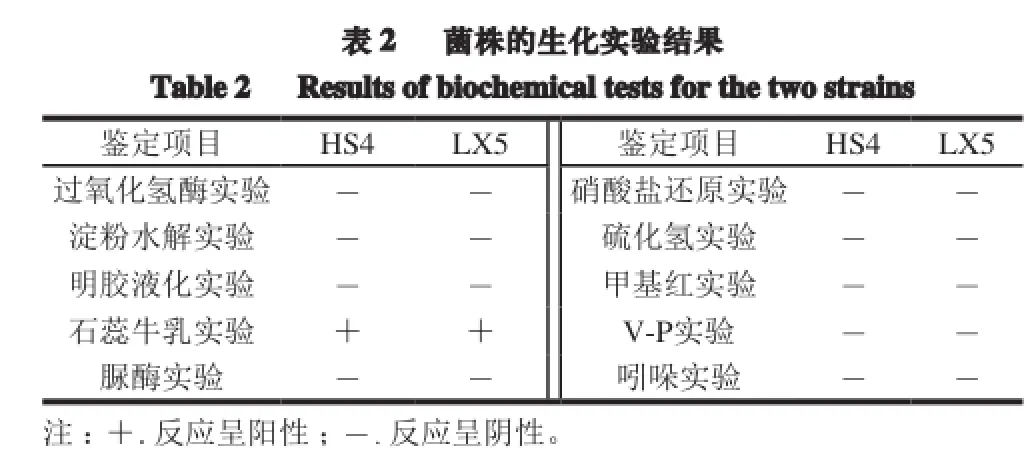
由表2可知,2 株高产CLA菌株除石蕊牛乳实验呈阳性,其他生化实验均呈阴性。
2.4 高产菌株的生理特性
2.4.1 不同培养温度对菌株生长特性的影响
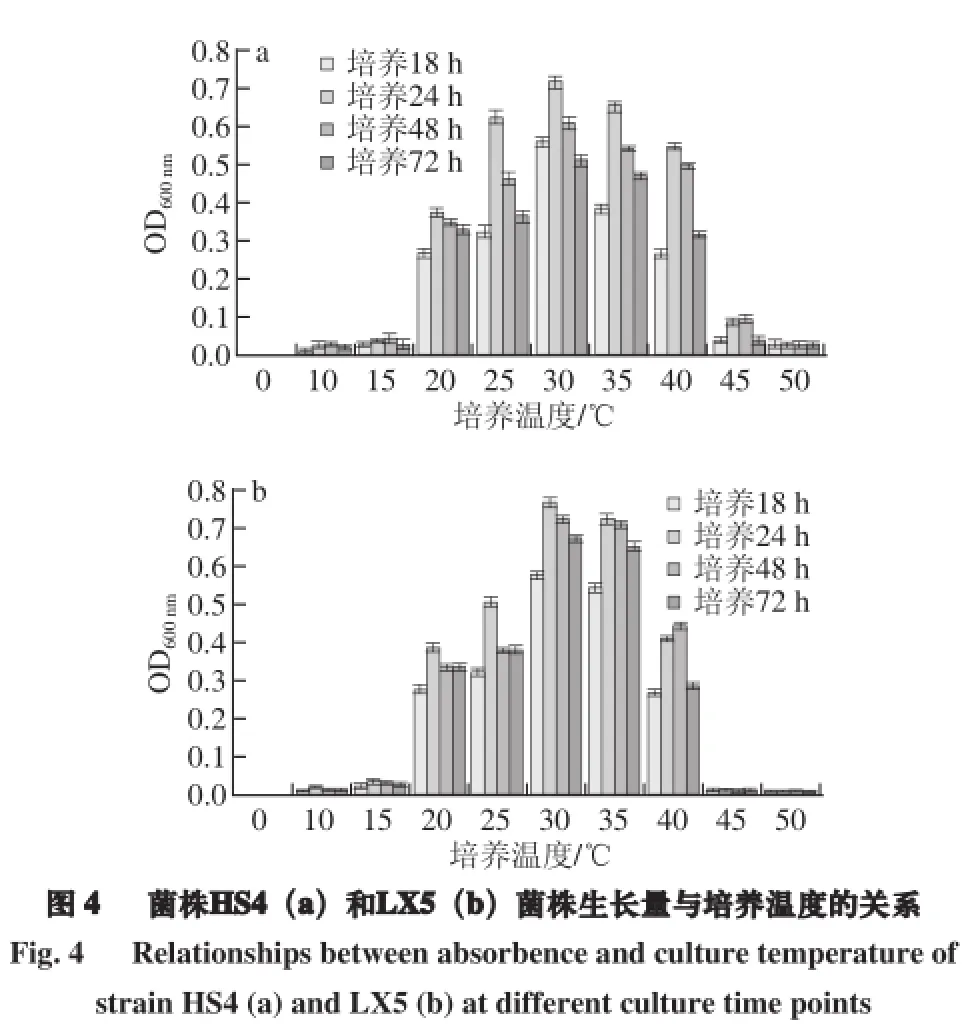
由图4可知,当培养温度为15 ℃时,2 株菌均生长;在15~45 ℃范围内,各菌株生长量随培养温度的升高先增大后减少;50 ℃时HS4基本不生长;45 ℃时菌株LX5基本不生长。HS4的最适生长温度为25~35 ℃;LX5的最适生长温度为30~35 ℃。
2.4.2 菌株液体培养基的最终pH值与生长量测定结果
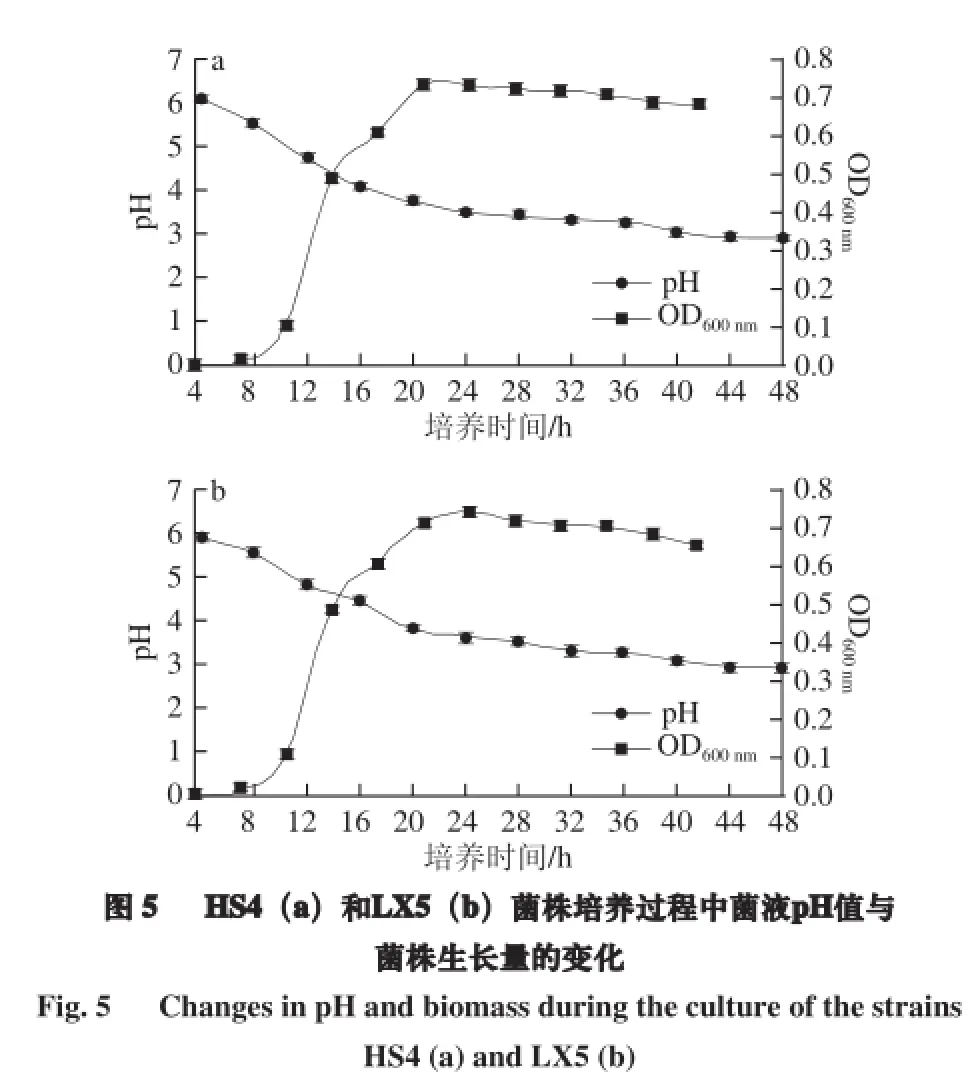
由图5可知,各菌株的菌液pH值在24 h前下降较明显,菌体生长迅速,24 h后pH值变化趋于平缓,菌体生长量有下降趋势;HS4菌液pH值的变化范围为2.92~6.11,OD600nm值变化范围为0.001~0.733;LX5菌液pH值的变化范围为2.93~5.91,OD600nm值变化范围为0.002~0.741。
2.4.3 菌株运动实验结果
菌株HS4、LX5均无运动性,在半固体MRS培养基内均生长在穿刺线上,边缘清晰,无扩散痕迹。
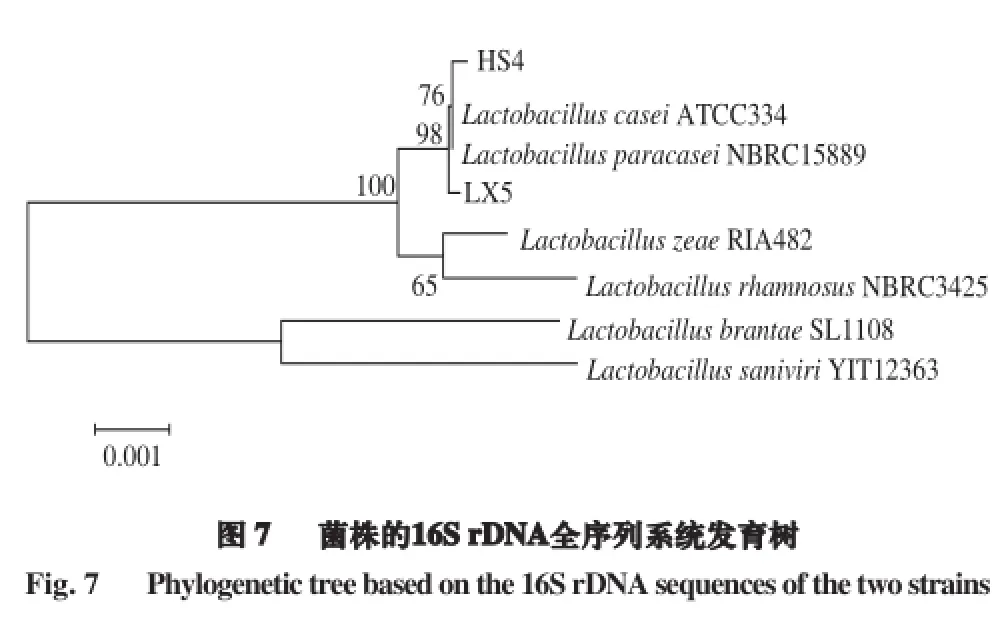
2.5 菌株16S rDNA序列分析及系统发育树的构建
将菌株HS4、LX5利用通用引物进行16S rDNA片段扩增后,2 株菌的扩增产物序列长度均为1 500 bp左右(图6),测序结果表明,菌株HS4序列长度为1 450 bp,LX5为1 465 bp。
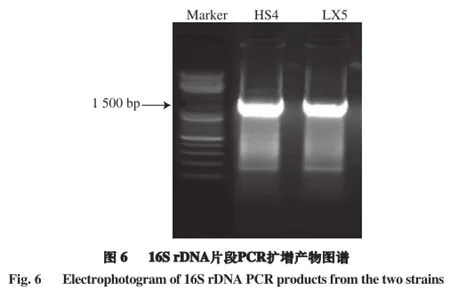
将菌株HS4、LX5的基因序列在NCBI数据库中进行同源性对比分析,结果见表3。菌株HS4与干酪乳杆菌(Lactobacillus casei)相似性最高,相似性达99%,菌株LX5与副干酪乳杆菌(Lactobacillus paracasei)相似性最高,相似性达99%。
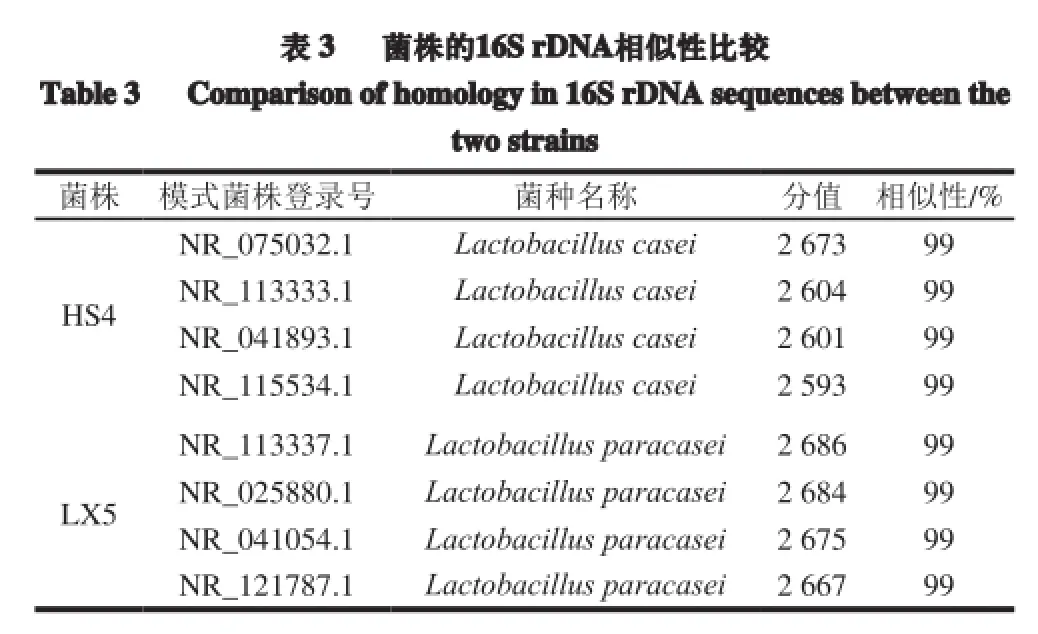
构建系统发育树见图7。菌株HS4与干酪乳杆菌(Lactobacillus casei)亲缘关系最近,菌株LX5与副干酪乳杆菌(Lactobacillus paracasei)亲缘关系最近,再结合菌株的菌落特征、细胞形态及生理生化特性,菌株HS4鉴定为干酪乳杆菌(Lactobacillus casei),菌株LX5鉴定为副干酪乳杆菌(Lactobacillus paracasei)。
3 结 论
本实验筛选出具有高产CLA能力的干酪乳杆菌(Lactobacillus casei)与副干酪乳杆菌(Lactobacillus paracasei),其中副干酪乳杆菌(Lactobacillus paracasei)在目前关于分离筛选产CLA的乳酸菌报道中较为少见,筛选出的2 株高产菌株均具有较强的CLA合成能力,可以作为今后通过优化培养条件、基因诱变、亚油酸异构酶分离提取等方式提高微生物合成CLA效率的出发菌株。从实验结果可以看出,不同的乳酸菌产共轭亚油酸的能力有显著差别,这可能与其自身的CLA代谢机制有关,一些菌株具有将CLA进一步转化为其他代谢产物的能力,游离的LA也会对菌体的生长产生抑制作用,而不同的菌株对LA具有不同的耐受能力,这些因素导致不同的菌株具有不同的CLA转化能力。因此,今后在CLA微生物合成机制、生产CLA的最适反应条件、确定产CLA的最适底物等方面都需要进一步深入研究。
[1] 刘佩, 沈生荣, 阮辉, 等. 共轭亚油酸的生理学功能及健康意义[J].中国粮油学报, 2009, 24(6): 161-165.
[2] 罗玉芬, 徐尔尼, 巫小丹. 微生物生产功能性油脂: 共轭亚油酸的研究进展[J]. 食品工业科技, 2010, 31(5): 377-381.
[3] 陈杭君, 陈丽敏, 郜海燕, 等. 共轭亚油酸的制备、纯化及检测方法研究进展[J]. 中国食品学报, 2012, 12(5): 137-142. DOI:10.3969/ j.issn.1009-7848.2012.05.022.
[4] 李垚, 徐尔尼, 杨欣, 等. 微生物合成共轭亚油酸机理和方法的研究进展[J]. 食品科学, 2014, 35(1): 271-276. DOI:10.7506/spkx1002-6630-201401054.
[5] 张中义, 胡锦荣, 刘萍, 等. 产共轭亚油酸乳酸菌的筛选及产物分析[J]. 工业微生物, 2004, 34(2): 5-9. DOI:10.3321/ j.issn:1007-4333.2004.03.002.
[6] 方丽, 闵伟红, 刘嘉, 等. 产共轭亚油酸鼠李糖乳杆菌的筛选与鉴定[J]. 中国食物与营养, 2012, 18(5): 33-36. DOI:10.3969/ j.issn.1006-9577.2012.05.008.
[7] 罗玉芬. 共轭亚油酸高产菌株的筛选、鉴定、培养基和发酵条件优化及紫外诱变研究[D]. 南昌: 南昌大学, 2011.
[8] 秦敏江. 产共轭亚油酸丙酸菌的筛选及发酵条件研究[D]. 南昌: 南昌大学, 2011.
[9] GUROVICA M S V, GENTILIB A R, OLIVERAC N L, et al. Lactic acid bacteria isolated from fish gut produce conjugated linoleic acid without the addition of exogenous substrate[J]. Process Biochemistry,2014, 49(7): 1071-1077. DOI:10.1016/j.procbio.2004.04.004.
[10] 黄翠丽, 王敏, 成晓杰, 等. 一株产共轭亚油酸瘤胃细菌Streptococcus infantarius RB111的筛选与鉴定[J]. 微生物学通报,2011, 38(1): 78-84. DOI:10.13344/j.microbiol.china.2011.01.019.
[11] PANDIT A, ANAND S, KALSCHEUR K, et al. Production of conjugated linoleic acid by lactic acid bacteria in milk without any additional substrate[J]. International Journal of Dairy Technology,2012, 65(4): 603-608.
[12] 甄妮, 鹿保鑫. 高产共轭亚油酸乳酸菌的筛选及培养条件的确定[J].黑龙江八一农垦大学学报, 2014, 26(6): 49-57. DOI:10.3969/ j.issn.1002-2090.2014.06.012.
[13] ALFONSO L, CUESTA E P, GILLILAND S E. Production of free conjugated linoleic acid by Lactobacillus acidophilus and Lactobacillus casei of human intestinal origin[J]. Journal of Dairy Science, 2003, 86(6): 1941-1946.
[14] ROMERO-PÉREZ G A, INOUE R, USHIDA K, et al. A rapid method of screening lactic acid bacterial strains for conjugated linoleic acid production[J]. Bioscience, Biotechnology, and Biochemistry, 2013,77(3): 648-650.
[15] 刘佩, 周倩, 沈生荣, 等. 产共轭亚油酸植物乳杆菌的筛选、鉴定与诱变[J]. 食品科学, 2010, 31(9): 135-139.
[16] 王英超, 齐树亭, 李天俊, 等. 发酵乳杆菌发酵生产共轭亚油酸[J]. 食品研究与开发, 2013, 34(10): 98-101. DOI:10.3969/ j.issn.1005-6521.2013.010.026.
[17] 李鹏. 产共轭亚油酸菌株的筛选与发酵条件的优化[D]. 大连: 大连工业大学, 2010.
[18] ZENG Z, LIN J, GONG D. Identification of lactic acid bacterial strains with high conjugated linoleic acid-producing ability from natural sauerkraut fermentations[J]. Journal of Food Science, 2009, 74(4):M154-M158.
[19] OGAWA J, KISHINO S, ANDO A, et al. Production of conjugated fatty acids by lactic acid bacteria[J]. Journal of Bioscience and Bioengineering, 2005, 100(4): 355-364.
[20] 曾哲灵, 林江, 徐春涛, 等. 产共轭亚油酸植物乳杆菌的筛选及鉴定[J].食品科学, 2008, 29(10): 399-403.
[21] 周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 2002: 9-28.
[22] 牛天贵. 食品微生物学实验技术[M]. 2版. 北京: 中国农业大学出版社, 2002: 2-51.
[23] 何国庆, 贾庆民, 丁立孝. 食品微生物学[M]. 2版. 北京: 中国农业大学出版社, 2002: 17-73.
[24] 布坎南 R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 8版. 中国科学院微生物研究所, 译. 北京: 科学出版社, 1984: 660-820.
[25] 凌代文, 东秀珠. 乳酸细菌分类鉴定及验方法[M]. 北京: 中国轻工业出社, 1999: 54-57.
[26] 张颖, 陈存社, 卢志兴, 等. 一株产共轭亚油酸乳酸菌的筛选和鉴定[J]. 中国酿造, 2011, 30(12): 51-54. DOI:10.3969/ j.issn.0254-5071.2011.12.015.
[27] 刘海霞, 郑婷, 赵国芬, 等. 酸菜乳酸菌分离鉴定及共轭亚油酸含量分析[J]. 食品研究与开发, 2012, 33(12): 157-186.
Isolation, Screening and Identification of Lactic Acid Bacteria with Conjugated Linoleic Acid-Producing from Traditional Cream Products in Xilingol League of Inner Mongolia
LIU Chunxiao, LI Jiayu, LIU Naiqi, LIU Lijie, ZHANG Jianli, BAI Ying*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China)
The objective of this study was to isolate lactic acid bacteria (LAB) with high ability to produce conjugated linoleic acid (CLA) from traditional cream products in Xilingol League of Inner Mongolia. CLA content in fermented broth was determined by UV-spectrophotometry, and the strains with the highest CLA-producing ability were identified by analyzing their colony characteristics, cell morphology, biochemical and physiological characteristics, and the phylogenetic tree generated with MEGA 6 software based on 16S rDNA sequence. Twenty CLA-producing strains were isolated from traditional cream products, 11 strains of which were present in samples collected from Xianghuang Banner and the remaining 9 strains were found in samples collected from Zhengxianglan Banner. HS4 with the highest CLA-producing capacity among the strains isolated from cream samples collected from Xianghuang Banner was identified as Lactobacillus casei, producing 23.586 μg/mL CLA with a conversion efficiency of 7.86% when it was cultured at an inoculum size of 2% in the presence of 0.06% linoleic acid; among the strains isolated from cream samples collected from Zhengxianglan Banner, LX5 with the highest CLA-producing capacity was identified as Lactobacillus paracasei, producing 20.508 μg/mL CLA with a conversion efficiency of 6.84% under the same culture conditions as described for HS4.
conjugated linoleic acid; traditional cream products; lactic acid bacteria; screening; identification
10.7506/spkx1002-6630-201609035
TS252.5
A
1002-6630(2016)09-0186-06
刘春晓, 李佳宇, 刘乃齐, 等. 内蒙古锡林郭勒盟地区传统奶油制品中产共轭亚油酸乳酸菌的分离筛选与鉴定[J]. 食品科学, 2016, 37(9): 186-191. DOI:10.7506/spkx1002-6630-201609035. http://www.spkx.net.cn
LIU Chunxiao, LI Jiayu, LIU Naiqi, et al. Isolation, screening and identification of lactic acid bacteria with conjugated linoleic acid-producing from traditional cream products in Xilingol League of Inner Mongolia[J]. Food Science, 2016, 37(9):186-191. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609035. http://www.spkx.net.cn
2015-06-14
刘春晓(1989—),女,硕士研究生,研究方向为乳品生物技术与加工工程。E-mail:liuchunxiao1989@sina.com
*通信作者:白英(1968—),女,副教授,博士,研究方向为乳品生物技术与加工工程。E-mail:baiying77@sina.com
