红藻糖苷对超低温冻存微藻的保护作用
2016-11-12李九零周成旭严小军陈海敏
李九零 周成旭 蒋 莹 严小军 陈海敏
(宁波大学浙江省海洋生物工程重点实验室,宁波 315211)
红藻糖苷对超低温冻存微藻的保护作用
李九零周成旭蒋莹严小军陈海敏
(宁波大学浙江省海洋生物工程重点实验室,宁波 315211)
为研究红藻糖苷对超低温冻存微藻细胞的保护作用,研究将3种不同的微藻置于含10% DMSO和不同浓度红藻糖苷的冻存液中,冻存并解冻后,以流式细胞仪检测细胞存活率,测定复养后藻株的生长曲线及相关生理参数。结果显示,由于冷冻损伤,冻存后各种藻细胞的生长速率、细胞密度及生理指标都显著性下降,而红藻糖苷协同DMSO能够显著增加细胞的存活率,尤其15%红藻糖苷能将紫球藻存活率提升20%(P<0.05); 生长曲线得到明显改善; 且对PSII最大光能转化效率也有显著性提高(P<0.05)。总体结果来看,红藻糖苷对超低温冻存微藻,特别是紫球藻具有明显的保护作用,且效果强于蔗糖。
红藻糖苷;海洋微藻;超低温冻存;DMSO
近年来,微藻在能源、保健品、动物饲料等领域都有非常广阔的应用价值和前景,越来越多的被商业开发。传统的微藻种质的保存方法较繁琐,且细胞的污染和变异几率大,容易造成宝贵种质的丢失[1]。超低温冻存技术是一种在极低温度下有效长期保藏有价值种质资源的技术,已经成为传统方法最强大的替代方法[2]。
冻存保护剂(Cryoprotective Additives,CPA)是超低温冻存的关键因素,主要通过减少细胞内冰晶形成而减弱冰冻损伤,一般由渗透性CPA和非渗透性CPA结合使用。前者主要通过渗入细胞后和胞内水形成氢键,从而破坏冰晶体的成核,如二甲基亚砜(DMSO)、甲醇等; 后者则在细胞外形成高渗透压,促进细胞脱水,从而减少冰晶形成,如蔗糖、海藻糖等[3]。小分子糖类是常用的无法扩散穿过细胞膜的非渗透性CPA。
红藻糖苷(α-D-吡喃半乳糖基-(1→2)-D-丙三醇)是来源于红藻的一类低分子量糖苷,是红藻中重要的光合同化产物,也是主要的渗透压调节剂,能够调节潮间带红藻在干出时细胞的失水适应性,以及提高藻类对低温、高盐的适应能力[4,5]。国外有少量报道指出红藻糖苷具有抗氧化[6]、保护细胞失水、保护蛋白质等大分子[7]的多种作用。由于其来源于海洋藻类,对微藻有非常好的相容性,并且具有玻璃态形成、大分子保护、抗氧化性和抗渗透压功能,因此,非常适宜于细胞的冻存。
本实验将红藻糖苷作为非渗透性CPA结合DMSO应用到3种不同微藻的超低温冻存中,检测其对微藻存活率、生长曲线以及生理指标的影响,为微藻超低温冻存的冻存保护液体系的优化提供新的思路。
1 材料与方法
1.1红藻糖苷
本实验所用红藻糖苷提取自坛紫菜,LC-MS确定纯度达到90%[8]。
1.2藻株及培养条件
3种不同种属的微藻株:颗石藻(Pleurochrysis sp.)、小球藻(Chlorella vulgaris)、紫球藻(Porphyridium cruentum)。藻种由宁波大学海洋生物工程重点实验室微藻种质库提供,采用NBM3#培养液配方进行培养,培养温度22℃,光照40 μmoL/(m2·s),光暗循环为L :D=12h :12h。每天定时摇两次,定时测密度,绘制生长曲线。
1.3冻存液的配置
冻存液中渗透性CPA为10%DMSO,非渗透性CPA为红藻糖苷和蔗糖。将不同浓度梯度的红藻糖苷和蔗糖分别溶于DMSO中,再用3#培养基稀释到所需浓度[10%、20%和30%(w/v)],每个梯度设3个平行,0.22 μm滤膜过滤灭菌后4℃保存。不加非渗透性CPA的作为空白组。
1.4超低温冻存方案
待微藻生长至对数生长期时离心(5000 r/min,10min)收集藻细胞,用新鲜培养基调节密度至5×107/mL左右。将750 μL藻液和750 μL冻存母液加入1.8 mL冻存管中,移液枪吹打混匀后室温平衡30min,4℃放置30min后预冻至-80℃,10h后直接投入液氮保存48h。
1.5指标检测
40℃水中快速解冻后,5000 r/min离心10min弃上清,用新鲜培养基洗涤2次,再以1.5 mL新鲜培养基重新悬浮。
存活率的检测使用荧光素二乙酸酯(FDA)标记活的藻细胞,流式细胞仪检测冻存藻株的存活率。FDA用丙酮配置为10 mg/mL母液后保存于-20℃,每次实验前,FDA工作液由超纯水稀释到0.04 mg/mL。参照Abdallah[9]和Altaf[10]的方法并稍加调整,对于颗石藻和紫球藻,以200 μLFDA工作液和300 μL藻液混匀后室温避光孵育10min; 对小球藻,100 μLFDA工作液和300 μL藻液混匀后室温避光孵育5min。冰激10min停止反应后离心去除染液,将细胞稀释至5×105/mL,上流式细胞仪FL1通道检测FDA荧光强度。检测时以未染色的热激死亡细胞为阴性对照。
复养后生长曲线的测定将藻液添加到含20 mL新鲜培养基的三角瓶中进行培养,培养条件和冻存前一致,每天测定细胞密度,直至进入衰退期,绘制生长曲线。
复养后对数期生理指标叶绿素荧光是微藻光合作用的良好指标,通过对各种荧光参数如光能转化效率、电子传递速率等的分析,可以得到有关的光能利用信息,反映其生长状态[11]。
培养冻存藻株进入对数生长期后,取样4 mL,暗处理20min后使用叶绿素荧光仪测定藻株的Fv/Fm(PSII最大光能转化效率)。
1.6统计分析
实验数据以mean±SD表示,采用SPSS 17.0 软件系统进行单因素方差分析。
2 结果
2.1红藻糖苷对冻存藻细胞存活率的影响
藻细胞存活率是检测冻存效果最直接、最重要的指标。本研究选择了10%DMSO作为渗透性CPA,在此基础上分别添加不同浓度的红藻糖苷。结果显示(图1、图2),红藻糖苷能够在DMSO的基础上不同程度增加3种藻的细胞存活率,如15%红藻糖苷将颗石藻的存活率从46.08%增大到64.13%,将紫球藻的存活率从63.06%增大到84.44%,将小球藻的存活率从51.04%增大到65.79%。这说明其作为非渗透性CPA对微藻冻存具有保护作用,并且效果随浓度增大而增强。和蔗糖组相比,二者都有保护效果,但整体而言,红藻糖苷的保护效果优于蔗糖,特别是对紫球藻的效果显著优于蔗糖,其中15%红藻糖苷协同DMSO的保护作用高达84.44%,比单独DMSO保护作用增强了20%之多(P<0.05)。

图1 流式细胞仪对紫球藻存活率检测的比较Fig. 1 Comparison of survival levels of Porphyridium cruentum
2.2红藻糖苷对藻细胞生长曲线的影响
从生长曲线可以看出(图3),由于受到冷冻损伤,细胞密度都出现明显降低,单独DMSO处理的藻细胞在整个生长周期的细胞密度都偏低。添加红藻糖苷后,对三种藻的生长速率都有所提高,其效果要优于蔗糖组。但对颗石藻和小球藻,其红藻糖苷对生长曲线的提高效果不是很明显。而对紫球藻则有较大的提高,特别是在平台期后,10%和 15%红藻糖苷处理的藻细胞密度基本能达到未冻存对照组的水平。
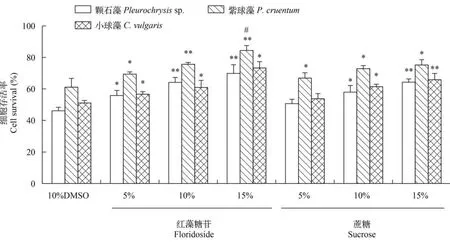
图2 红藻糖苷对3种微藻超低温冻存解冻后存活率的影响Fig. 2 The effect of floridoside on survival of 3 strains of cryopreserve microalgae

图3 复养后藻株的生长曲线Fig. 3 Growth cruves of re-culrured microalgae
2.3红藻糖苷对冻存微藻的生理参数的影响
Fv/Fm(PSII最大光能转化效率)是能有效反映微藻光合效率的指标。图4结果显示,冻存后3种微藻的光合效率普遍有所下降,特别是DMSO单独处理的3种微藻的Fv/Fm值都出现极显著下降(P<0.01)。但添加了红藻糖苷或蔗糖后,3种藻的Fv/Fm都出现显著的提高,但不存在浓度变化趋势,红藻糖苷组中以5%的效果最好。而蔗糖在恢复3种藻的光合效率方面也有非常好的作用,红藻糖苷不与其存在显著性差异。
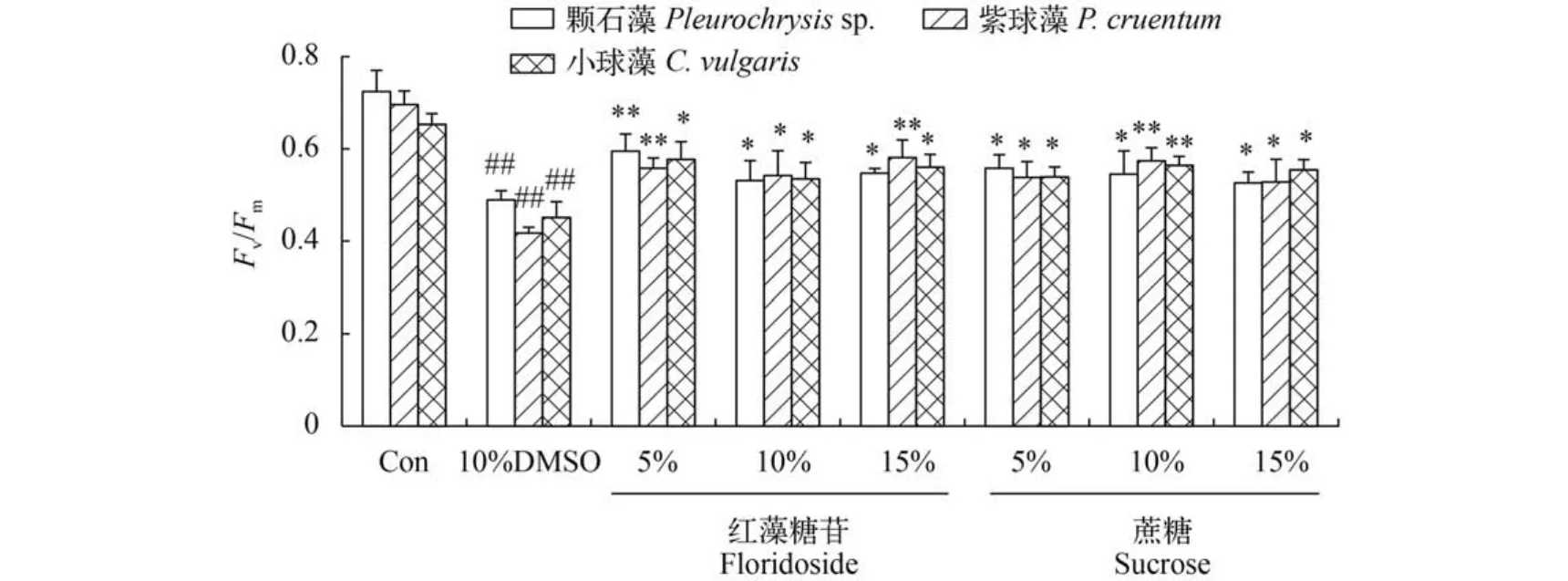
图4 红藻糖苷对3种微藻超低温冻存解冻后生理参数的影响Fig. 4 The effect of floridoside on Fv/Fmof 3 strains of cryopreserve microalgae
3 讨论
在冻存液中添加非渗透性CPA的方法广泛应用于海洋微藻的超低温冻存,但目前主要使用的是蔗糖、葡萄糖等常见糖类,由于这些糖是细胞初级代谢的主要糖类,所以极易被微生物利用,易造成保存微藻的污染[12]。而本研究将来源于海洋红藻的红藻糖苷作为一种新型非渗透性CPA应用到3种不同的微藻冻存中,由于红藻糖苷是一种半乳糖甘油结构,不被微生物所利用,因此不会引起污染问题。本研究中发现红藻糖苷具备了蔗糖同样的渗透性效果,并且在提高存活率和恢复生长方面更优于蔗糖,其中15%的红藻糖苷效果更好。能显著降低低温损伤、提高微藻存活率、并改善复苏后的生长曲线及光合呼吸指标,尤其对同样是红藻的紫球藻保护效果最佳。
超低温冻存微藻的整个冻存及解冻过程,细胞会面临渗透压的影响、各种氧化损伤、溶质损伤、膜成分丢失、细胞膜脱水、蛋白质变性、溶酶体破坏、膜渗漏破裂等[13]问题。而红藻糖苷作为一种天然的海洋生物资源,尽管到目前为止报道相对较少,但是它在几个方面的特点非常适合于海洋藻类的冻存。首先,红藻糖苷是红藻中重要的抗渗透压物质。细胞在冻存时,由于胞外水的冻结会导致胞内水分易渗出胞外,而红藻糖苷可以吸附在细胞表面形成黏液层,阻止水分的流失,并通过增大溶液黏度阻止冰晶的生长对细胞的破坏[14]。另外,红藻糖苷还具有抗氧化作用,不仅可以清除各种自由基(DPPH、羟自由基、烷基自由基、超氧阴离子自由基等),还可以降低细胞内活性氧水平[15]。细胞冻存及解冻过程中膜蛋白的各种氨基酸如赖氨酸、精氨酸等极易受到氧化攻击而导致羰基(主要是醛和酮)的积累,红藻糖苷则可以显著抑制此类氧化过程而保护膜蛋白[6]。
所以红藻糖苷较于蔗糖、葡糖糖等具有更好的抗氧化、保护大分子、保水等生物学功能。此外,红藻糖苷来源于红藻,它对藻类的相容性会更好,特别是红藻,本研究中观察到红藻糖苷对紫球藻的冻存保护作用就要优于其他两种藻,说明红藻糖苷更适合于红藻的冻存。
综上所述,红藻糖苷可作为微藻超低温保藏中的非渗透性保护剂,它与DMSO联合使用,可显著提高微藻的存活率、生长曲线,并提高微藻的光合效率。
[1]Larkum A W D,Ross I L,Kruse O,et al. Selection,breeding and engineering of microalgae for bioenergy and biofuel production [J]. Trends Biotechnology,2012,30(15):198—205
[2]Bui T V L,Ross I L,Jakob G,et al. Impact of procedural steps and cryopreservation agents in the cryopreservation of Chlorophyte Microalgae [J]. PloS One,2013,8(11):e78668
[3]Lin X Y,Liu H Q,Yuan W S. Progress in the cryopreservation of marine microalgae [J]. Journal of Jiangsu Agricultural Sciences,2014,42(1):190—194 [林小园,刘红全,袁卫生. 海洋微藻的玻璃化冻存技术研究进展. 江苏农业科学,2014,42(1):190—194]
[4]Liu H,Koh K,Kim J,et al. The effects of betonicine,floridoside,and isethionic acid from the red alga Ahnfeltiopsis flabelliformison quorum-sensing activity [J]. Biotechnology and Bioprocess Engineering,2008,13(4):458—463
[5]Karsten U,Gors S,Eggert A,et al. Trehalose,digeneaside,and floridoside in the Florideophyceae(Rhodophyta)-a reevaluation of its chemotaxonomic value[J]. Phycologia,2007,46(2):143—150
[6]Yong X L,Yong L,Sang H L,et al. Inhibitors of oxidation and matrix metalloproteinases,flridoside,and D-isofloridoside from marine red alga Laurencia undulata [J]. Agricultural and Food Chemistry,2010,58(1):578—586
[7]Product containing an extract of red algae of the genus Porphyra and methods for protecting cells. United States Patent,US20040228875-A1
[8]Chen J J,Song D D,Luo Q J,et al. Determination of floridoside and isofloridoside in red algae by high-performance liquid chromatography tandem mass spectrometry[J]. Analytical Letters,2014,47(14):2304—2322
[9]Abdallah O,Sébastien B,François P,et al. Inhibitory effects of silver nanoparticles in two green algae,Chlorella vulgaris and Dunaliella tertiolecta [J]. Ecotoxicology and Environmental Safety,2012,78(1):80—85
[10]Altaf H P,Nasarul I. Comparative assessment of QSTR models based on density functional,hartree-fock,AM1,and PM3 methods for acute toxicity of aliphatic compounds toward Vibrio fischeri [J]. International Journal of Quantum Chemistry,2013,113(6):830—839
[11]Wu X H,Zheng L L,Song L R. Development on a cryopreaervation protocol of microcystis aeruginosa using penetrating and non-penetrating cryoprotectants [J]. Acta Hydrobiologica Sinica,2012,36(2):344—350 [吴兴华,郑凌凌,宋立荣. 渗透与非渗透性抗冻剂联用技术对铜绿微囊藻的超低温保藏研究. 水生生物学报,2012,36(2):344—350]
[12]Chen Y M,Shi Y,Wang M Z,et al. The proceeding on exploiting and utilization of feed microalgae in mariculture [J]. Biotechnology Bulletin,2015,31(9):60—65 [陈艳梅,石阳,王明兹,等. 海产养殖饵料微藻开发利用进展. 生物技术通报,2015,31(9):60—65]
[13]Kruuv J,Glofeheski D,Levoek J. Interaetions between cryoproteetors and cryosensitizers [J]. Cryobiology,1990,27(3):232—246
[14]Liao D,Chen X,Zhang Y. Progress in the protective effect of trehalose on cryopreservation [J]. Journal of Guangdong Agricultural Sciences,2011,18(1):83—85[廖丹,陈雪,张原. 海藻糖抗冻保护作用研究进展. 广东农业科学,2011,18(1):83—85]
[15]Kang H K,Chang H S,Park Y. The Effects of marine carbohydrates and glycosylated compounds on human health[J]. International Journal of Molecular Sciences,2015,16(3):6018—6056
THE CRYOPROTECTIVE EFFECT OF FLORIDOSIDE ON MICROALGAE
LI Jiu-Ling,ZHOU Cheng-Xu,JIANG Ying,YAN Xiao-Jun and CHEN Hai-Min
(Marine Biotechnology Laboratory of Zhejiang Province,Ningbo University,Ningbo 315211,China)
This study was designed to determine the protective effects of floridoside on cryopreservation of marine microalgae. Three strains of microalgae were cryopreservated by combination of 10% DMSO and different concentrations of floridoside. After frozen-thaw process,the cell viability was determined by performing flow cytometry with fluorescein diacetate(FDA). Growth curve and physiological parameter(Fv/Fm) were also detected. Results revealed that freezing caused significant decrease on the growth rate of three microalgae,moreover,growth curve and physiological parameters of thawed microalgae were also impacted severely. Combination of floridoside and DMSO significantly improve viability of three microalgae. Especially,15% of floridoside could increase the cell viability of Porphyridium cruentum by 20%(P<0.05) than that only using DMSO. Growth curve were resumed remarkably,and physiological parameter,PSII was also improved. These findings indicated that appropriate concentration of floridoside might be used as a better cryoprotectant to cryopreserve microalgal species,especially P. cruentum. The protect effect was better than sucrose.
Floridoside; Marine microalgae; Cryopreservation; DMSO
Q-33
A
1000-3207(2016)05-1020-05
10.7541/2016.132
2015-09-02;
2016-01-25
浙江省重大科技专项(2012C12907-6); 国家公益性行业(海洋)科研专项经费项目(201105023)资助 [Supported by Major Science and Technology Projects in Zhejiang Province(2012C12907-6); National Public Welfare Industry(Marine) Research Projects(201105023)]
李九零(1990—),女,河南焦作人; 硕士; 主要研究方向为海洋生物活性物质。E-mail:89628638@qq.com
陈海敏,研究员; E-mail:chenhaimin@nbu.edu.cn
