江苏盐城地区异育银鲫大红鳃疾病病原学研究及病理学观察
2016-11-12汪开毓陈俊杰刘天强康岳华
刘 韬 汪开毓, 陈俊杰 刘天强 李 茂 康岳华 段 靖 贺 扬
(1. 四川农业大学鱼病研究中心,成都 611130; 2. 四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130;3. 通威股份动物保健研究所,成都 610000)
江苏盐城地区异育银鲫大红鳃疾病病原学研究及病理学观察
刘韬1汪开毓1,2陈俊杰1刘天强3李茂3康岳华3段靖1贺扬1
(1. 四川农业大学鱼病研究中心,成都 611130; 2. 四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130;3. 通威股份动物保健研究所,成都 610000)
为鉴定近期江苏盐城地区养殖异育银鲫“大红鳃”疾病病原,研究从患病濒死鱼中分离到两株致病菌并对其理化特性、分子生物学、感染病理学进行了研究,同时开展了鉴别诊断和回归试验以及药敏检测。结果显示,两分离株理化特性与温和气单胞菌(A. sobria)特征相符,与GenBank中A. sobria的gyrB基因同源性达99%以上,在系统发育树上均与A. sobria聚为一族。同时与鲤科疱疹病毒2型(CyHV-2)鉴别诊断结果表明,患病鱼组织中CyHV-2检测为阴性。组织学上,鳃和肾组织具有典型病理变化。人工感染两株A. sobria后,鱼体出现与自然发病相似的“大红鳃”症状,并能从发病鱼组织中再分离到相同病原菌; 而人工感染CyHV-2组织匀浆后的鲫虽然出现死亡,但无“大红鳃”症状出现。综上,确认此次“大红鳃”疾病的病原为A. sobria。药敏实验表明,分离菌株对诺氟沙星、氧氟沙星、氯霉素三种药物敏感。研究为临床上更好的预防异育银鲫“大红鳃”疾病奠定了基础。
异育银鲫;温和气单胞菌;大红鳃;CyHV-2;病理组织学
异育银鲫“大红鳃”病是2011年开始出现在江苏地区鲫养殖业中的高发病[1]。“大红鳃”是江苏盐城地区俗称,其名称的由来主要是因为患病鱼鳃丝颜色如“西瓜样”鲜红,同时多伴有淡黄色腹水症状[2]。为切实了解该病流行情况,本实验室前期对其在盐城地区的发病经过进行了初步调研。该病在水温为20℃左右时最易暴发,而随养殖温度的升高,该病发生逐渐减少,温度升高到30℃则无“大红鳃”的出现。一般地,每年“大红鳃”暴发时间基本为5月中旬至6月中旬,而本次“大红鳃”病暴发时间为5月中旬至7月中旬。该病发病对象主要为异育银鲫,是中国科学院水生生物研究所利用天然雌核发育技术经人工授精繁育的一种鲫养殖新对象(目前已形成规模化养殖)[3]。2014年(去年)江苏盐城地区养殖异育银鲫几乎全年都暴发有“大红鳃”,同时伴发有鲤疱疹病毒2型(CyHV-2)感染,推测是由于当地去年全年水温较低所致(基本没有超过30℃)。一般情况下患“大红鳃”症状的鱼死亡率并不高,约在20%以下,且可用抗生素较好控制该病,但如不加以治疗或错误用药则会造成其死亡率大幅升高(据了解,单个150亩的养殖池塘最高可达每日5000—8000尾损鱼量)。“大红鳃”疾病已成为当地鲫养殖业中的常发病,近年来已造成严重经济损失。现有文献认为该病病原为细菌、病毒和寄生虫等综合因素引起,但其确切病原至今不明[4]。本研究通过对本次“大红鳃”患病鱼的分子生物学、病理学和动物实验的研究阐明了其致病病原,并分析了其致病机制,为盐城地区鲫养殖业中“大红鳃”疾病的防治奠定了一定基础。
1 材料与方法
1.1病料样品、主要试剂及实验动物
江苏盐城患病异育银鲫,体质量250—300 g。健康异育银鲫,体质量250—350 g,由四川农业大学鱼病研究中心提供。CyHV-2病毒粗提液由四川农业大学鱼病研究中心提供。普通琼脂培养基、脑心浸液培养基(BHI); 细菌生化微量鉴定管购自杭州微生物试剂有限公司(批号:20150322); 细菌基因组DNA提取试剂盒、动物组织DNA提取试剂盒、Taq DNA聚合酶、dNTP、DNA分子Marker均购自宝生物工程(大连)有限公司; 药敏纸片购自杭州微生物试剂有限公司(批号:20150401)。
1.2细菌分离和生化鉴定
取患病鱼肾脏组织样品,划线接种于营养琼脂平板,28℃培养24h,挑取形态一致的优势菌群进行纯化培养; 将纯培养的菌再次划线接种于营养琼脂平板,28℃培养24h,观察菌落形态; 挑取单个菌落做革兰氏染色,观察菌体形态; 参照微量生化反应管说明书鉴定分离菌纯培养物。
1.3分子生物学诊断
以分离菌DNA为模板,gyrB基因的上、下游引物为:5′- GAAGTCATCATGACCGTTCTGCA(TC)GC(TCAG)GG(TCAG)GG(TCAG)AA(AG)TT(TC)GA-3′/5′-AGCAGGGTACGGATGTGCGAGCC(AG)TC(TCAG)AC(AG)TC(TCAG)GC(AG)TC(TC AG)GTCAT-3′。PCR扩增gyrB基因条件为:94℃5min; 94℃ 1min,54℃ 1min,72℃ 2min,30个循环;72℃ 5min。PCR产物由上海生工生物工程股份有限公司测序。测得序列通过NCBI中的BLAST进行相似性分析,NJ法构建系统进化树。
提取患病鱼和健康鱼的肾脏组织DNA。参考文献[5]设计和合成CyHV-2的DNA聚合酶413 bp片段的上、下游引物:5′- AGTCCATAGTGTCTAGG AGCGA -3′/5′-AGTGTGTTTTACAGCGTTCTCG-3′。PCR反应条件为:94℃ 5min; 94℃ 1min,54℃1min,72℃ 2min,30个循环; 72℃ 5min。PCR产物直接进行琼脂糖凝胶电泳检测。
1.4人工感染实验
细菌攻毒实验:将分离纯化细菌接种于BHI平板28℃培养36h后,经0.65%无菌生理盐水洗涤并配制成细菌悬液,分别稀释成1×108、1×107和1×106cfu/ mL 3个浓度,腹腔注射健康异育银鲫。注射剂量0.2 mL/尾,10尾/组,对照组注射等量无菌生理盐水。在试验期间水温(23±1)℃,每天观察及记录实验鱼的症状和死亡情况,并对死亡鱼或濒死鱼及时剖检和分离细病原菌,连续观察7d。
病毒攻毒实验:选取暂养14d,250—300 g的健康异育银鲫20尾,平均分成两组,回归感染组每尾腹腔注射病毒粗提液0.2 mL,对照组每尾腹腔注射过0.22 μm滤器的磷酸盐缓冲液0.2 mL,试验期间水温(23±1)℃,统计死亡结果,观察死鱼症状,并随机抽取组织匀浆组死鱼和对照组鱼开展PCR检测。
1.5病理标本采集
观察病鱼体表,鳃丝以及内脏器官等病理变化,并取患病鱼鳃、肝、肾、脾,固定,脱水,石蜡包埋,HE染色,中性树脂胶封片,Nikon E800显微镜观察,拍照。
1.6药敏试验
采用纸片扩散法,病原菌接种BHI肉汤,28℃震荡培养18—24h,参照麦氏比浊管调整菌液浓度1.5×108cfu/mL将菌液均匀涂布BHI平板,贴上药敏纸片,28℃培养18—24h,测量抑菌圈大小并判定结果。
2 结果
2.1发病鱼症状
患病异育银鲫食欲大幅下降,离群独游,鱼体黑瘦,鳞片松动,鳃部黏液增多,呈“西瓜样”鲜红色(图1A),但鳃鲜红的症状仅在鱼体脱离水体后5—10min内能观察到,而后鳃丝颜色转为暗红。此外,其他鱼体症状包括鳃盖出血,鳍条尖发白(图1B),部分患病鱼腹腔内有淡黄色腹水(图1C),肾脏轻微肿大,充血,质地柔软,容易剥离(图1D),部分患病鱼的鳃丝上寄生有鳃孢子虫(图1C),部分患病鱼腹腔内有腹孢子虫寄生(图1F)。
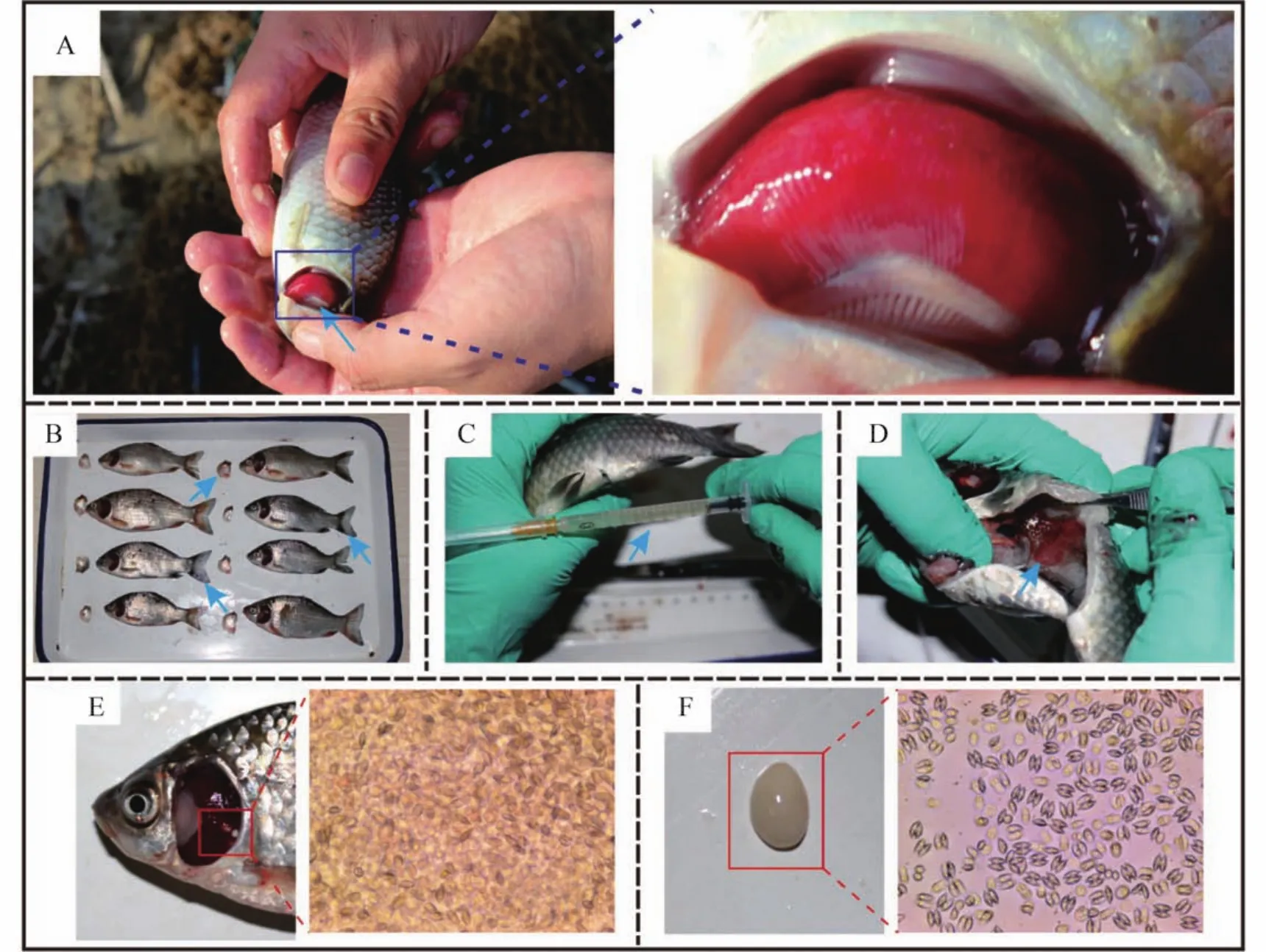
图1 患病鱼典型症状Fig. 1 Typical symptom in diseased fish
2.2病原检测
从盐城地区5个大红鳃疫点采集典型症状的垂死鱼,病变组织涂片的革兰氏染色可见革兰氏阴性短杆菌(→)(图2Ⅰ)。取样于普通琼脂平板上划线,经28℃恒温培养24h获得2株革兰阴性短杆菌,暂定名为JSYC-1和JSYC-2。分离菌在普通琼脂平板上形成边缘整齐隆起、光滑半透明的灰白色圆形菌落; BHI平板上比普通平板上生长更好,菌落更大,呈淡黄色、半透明、光滑、边缘整齐。光学显微镜下观察分离菌为革兰阴性短杆菌,散在排列,成熟的为杆状,未成熟的为短杆状,无芽胞(图2Ⅱ)。肾脏组织切片HE染色后,可在肾间质观察到短杆状细菌(→)(图2Ⅲ)。两株菌PCR扩增出的gyrB基因引物PCR扩增均获得长度为1200 bp左右的片段,片段测序后上传在GenBank中的登陆序号分别为KT724350和KT724351。两菌株的gyrB基因同源性为93.26%,与GenBank的温和气单胞菌(GQ232760和GQ205451)同源性最高。选取了GenBank其中部分温和气单胞菌属的细菌和常见气单胞菌菌属以及肠杆菌科细菌的gyrB基因序列,用Neighbor-Joining方法进行了系统发育学分析,结果显示,KT724350和KT724351两菌株均与温和气单胞菌聚为一簇(图2Ⅳ)。此外,CyHV-2的特异性PCR检测结果表明,大红鳃患病鱼组织中不存在CyHV-2病毒(图3)。

图2 分离株形态及系统进化分析Fig. 2 Morphology of isolates and phylogenetic analysis

图3 CyHV-2特异性PCR检测Fig. 3 PCR detection of CyHV-2
2.3分离株生化鉴定
两菌株均具有运动性; 氧化/发酵、氧化酶、MR-VP、苯丙氨酸脱氨酶、赖氨酸脱梭酶、硝酸盐还原、吲哚、明胶液化、七叶灵、D-葡萄糖产气、D-葡萄糖产酸、半乳糖、纤维二糖、海藻糖、半乳糖苷阳性; 鼠李糖、枸橼酸盐、精氨酸双水解酶、鸟氨酸脱按酶、丙二酸、KCN、蜜二糖、棉籽糖、山梨醇、赤鲜醇、卫矛醇、木糖、阿东醇、阿拉伯糖、乳糖阴性。两株细菌鉴定结果符合气单胞菌的特征。
2.4人工感染实验
分离菌株和CyHV-2组织匀浆经人工感染异育银鲫后,均表现出较强致病力(表1)。健康异育银鲫感染后可见同自然病例相似“大红鳃”症状和剖解病变,对照组鱼未表现任何症状,剖解亦无病变,鳃为正常暗红色。同时,CyHV-2的组织匀浆组鲫虽然也有较高死亡率,但发病鱼无“大红鳃”症状,鳃仍然为正常暗红色。此外,从人工感染发病死亡的异育银鲫体内再次分离细菌,获得与攻毒分离株形态特征一致的菌株,并再次感染成功,证明所分离的细菌为异育银鲫的致病菌。
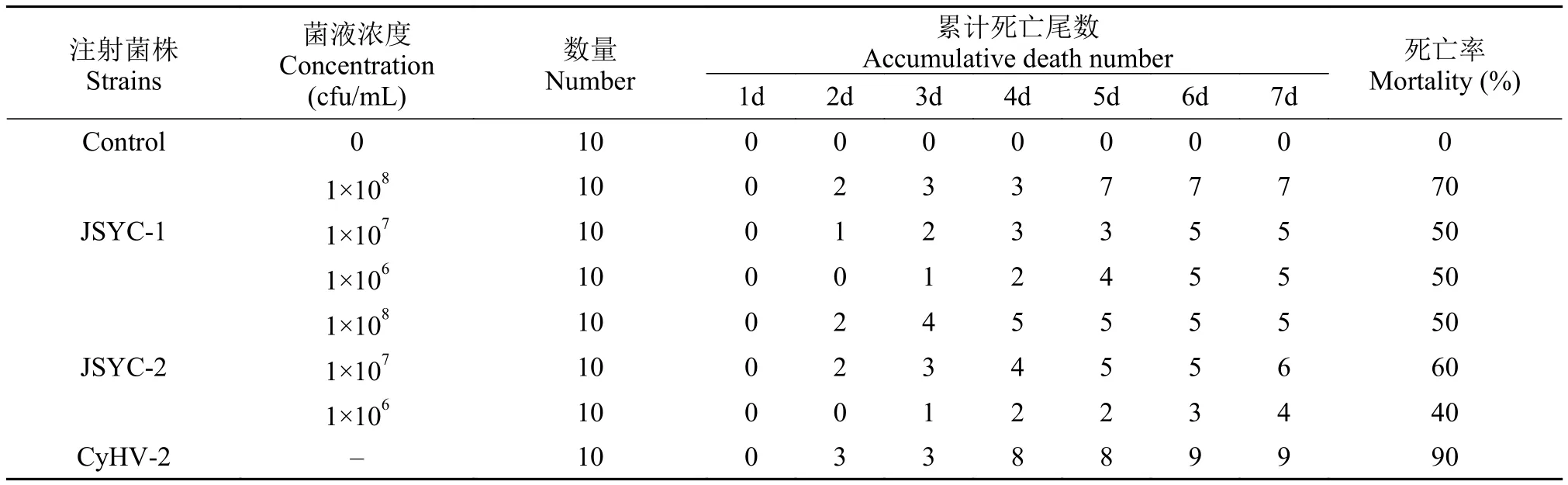
表1 人工感染试验结果Tab. 1 Artificial infection results of the isolated strains
2.5组织病理学观察
肝脏中央静脉淤血(图4A),肝血窦中有炎性细胞浸润(图4B); 脾脏未见明显病理变化(图4C); 鳃丝严重增生(图4D),鳃丝间出血,有大量规整血细胞聚集(→)(图4E,F),部分鳃小片充血(→)(图4G),鳃丝充血(→)(图4H),甚至在鳃小片尖端形成血肿(→)(图4I); 肾脏肾小管上皮细胞发生颗粒变性或脂肪变性,肾小管中形成大量细胞和蛋白成分的各种管型(→),同时肾间质区域内存在大量炎性细胞(图4J,K,L),集合管中也形成大量管型(→)(图4M,N),肾静脉有炎性细胞浸润(→)(图4P),肾小管中大量浆液性渗出物(→)(图4P,Q,R)。
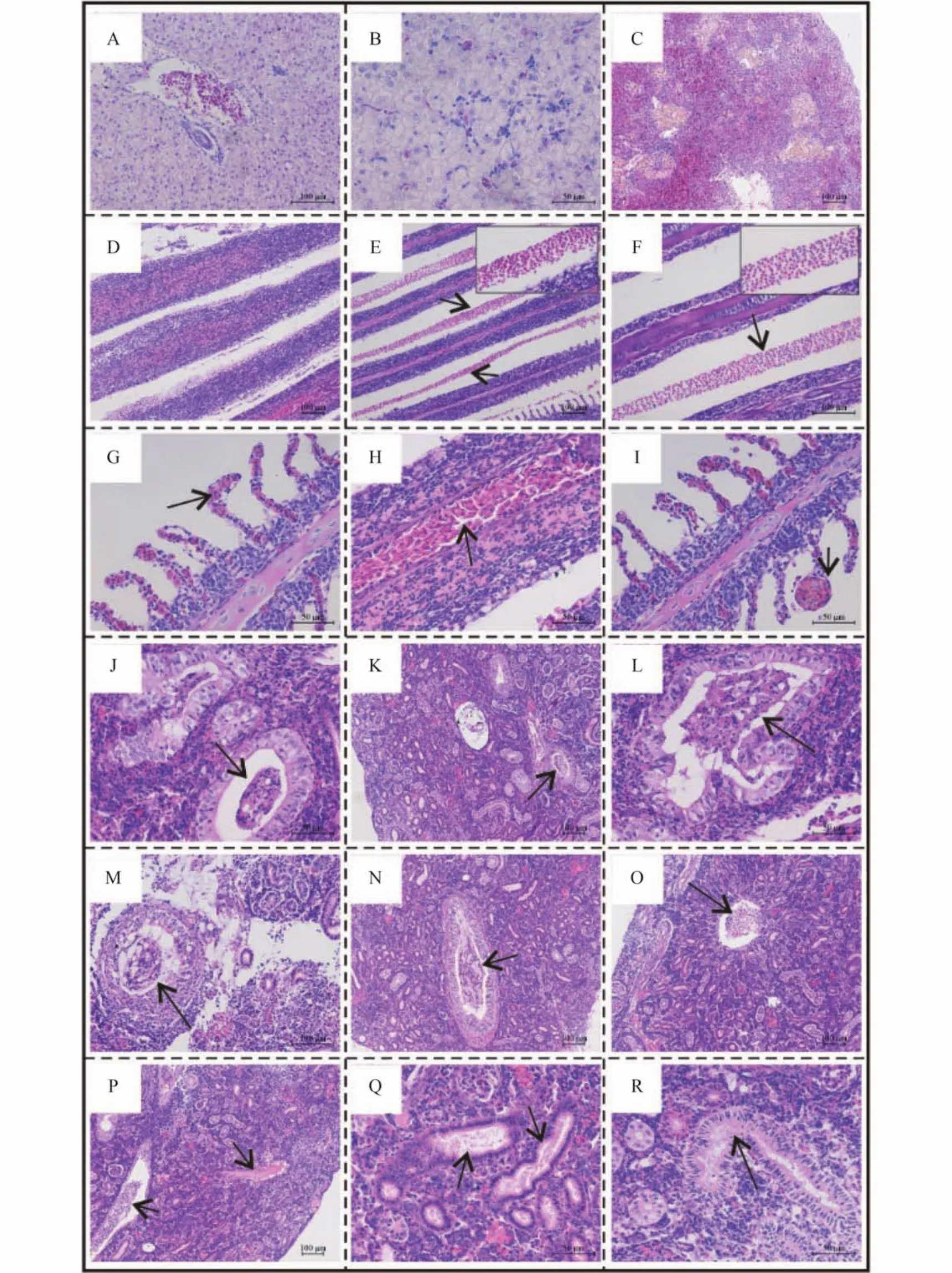
图4 患病异育银鲫组织病理变化Fig. 4 Histopathological changes of diseased Carassius auratus gibelio
2.6药敏试验
分离菌对23种抗生素的敏感性试验结果见表2。两分离株均对氧氟沙星、诺氟沙星、氯霉素三种抗生素敏感,同时都对苯唑西林、万古霉素、氨苄西林、青霉素、克林霉素等抗菌药物有耐药性。
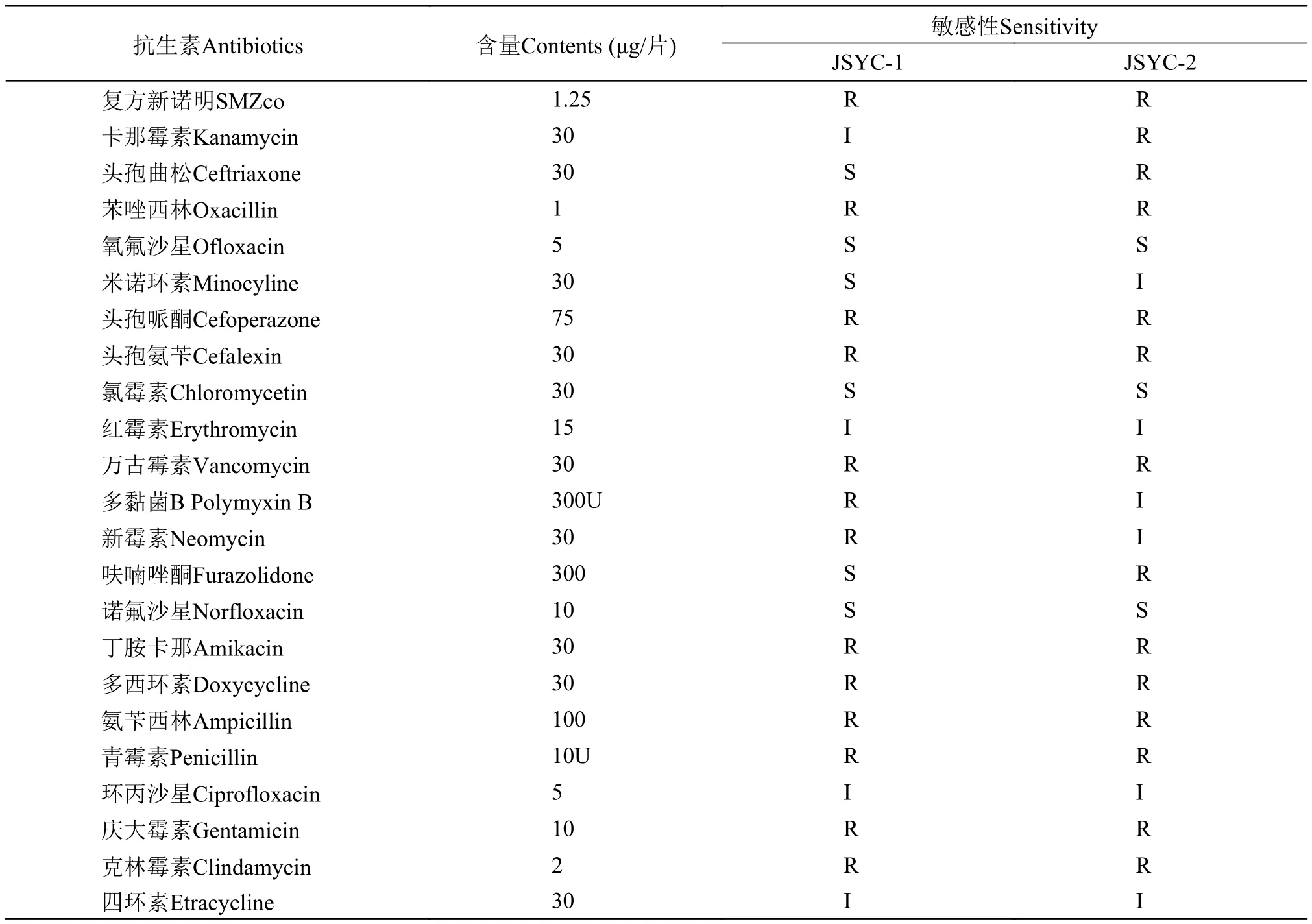
表2 分离菌株对抗菌药物的敏感性Tab. 2 Chemotherapeutants sensitivities of the isolated strains
3 讨论
3.1“大红鳃”疾病的原发性病原
近年来,由于对江苏地区异育银鲫“大红鳃”疾病重视程度不够,关于该病的研究较少,其病原学问题至今不明,这一直是困扰当地从业者和学界的难题。在过去的经验中,“大红鳃”患病鱼组织DNA中往往都能不同程度地检测到鲤疱疹病毒2型(CyHV-2)的阳性条带,但同时也能分离出各种不同类型的细菌[6—9]。因此,“大红鳃”疾病的病原学研究中最困难的一点就是要区分其病原是细菌还是病毒,或者需要明确这二者中哪一个是原发性因素,从而导致了另一个的继发感染。本研究通过分子生物学诊断并结合前期流行病学调查以及后期回归实验综合确认异育银鲫的“大红鳃”疾病病原为温和气单胞菌(A. sobria)。首先,分子水平的检测表明患“大红鳃”鱼体中并不存在CyHV-2的拷贝,同时又能从当地各疫点患病鱼体中分离到A. sobria; 其次,人工感染实验表明虽然分离的A. sobria和含有CyHV-2的组织匀浆都能感染异育银鲫并产生较高致死率,但是仅A. sobria能引起患病鱼产生“大红鳃”的症状,而病毒匀浆却不能复制出该症状; 最后,从流行情况分析,这两种病原虽然都在盐城地区流行,但是二者的流行经过和发病条件却相差较大。综合以上结果,本研究判定“大红鳃”患病鱼的原发性病原为A. sobria。虽然张晓君等[10]报道了A. sobria能感染异育银鲫并检测了其相关致病因子。但是A. sobria仍然是水产养殖业中的一种重要的条件致病菌[11,12],具体是何因素诱发了该菌感染异育银鲫并引起“大红鳃”的症状还需要进一步研究。
3.2细菌感染的病理学机制
本实验病理学分析中发现,A. sobria感染异育银鲫后主要损伤鱼体鳃和肾脏,从而严重破坏鱼体呼吸系统和免疫系统,从而有利于该病原的进一步感染和增殖。其中,鳃部病理观察发现,鳃严重增生,鳃小片和鳃丝内部个别区域有血肿形成,鳃小片间未见出血现象,但在鳃丝之间可见大量规整的红细胞聚集,这说明鳃丝之间有较大的出血区域,这也表明“大红鳃”的表观症状正是由鳃丝之间的大出血导致。同时鳃部病变也为其继发感染鳃孢子虫和腹孢子虫等创造了条件。在病理条件下,肾脏滤出的蛋白质以及细胞或碎片在肾小管(远曲)、集合管中凝固后,可形成圆柱形蛋白聚体,称为管型。本研究中的患病鱼肾脏间质区域内大量炎性细胞浸润,肾小管中形成大量炎性细胞管型和蛋白管型,表明A. sobria会严重损伤肾实质和肾小管,从而破坏鱼体特异性免疫系统,其与徐敬钧等[13]报道的A. sobria感染似鲇高原鳅的病例症状相符。所以,A. sobria感染的的异育银鲫鳃部非特异防御能力和特异性免疫能力均受重创,为其继发感染其他类型的细菌或病毒创造了条件。这也同样佐证了临床分离病原中存在多种细菌和病毒的现象。
3.3药物敏感试验
药敏实验分析发现2株A. sobria均对沙星类药物和氯霉素敏感。考虑到,氯霉素毒性较大且为禁用抗生素,所以临床用药建议选择沙星类药物毒性较低的抗生素进行紧急治疗。
本研究对江苏盐城地区异育银鲫“大红鳃”大面积流行的病因做出了准确诊断,为该地区鱼病预防和合理用药提供了新的思路。同时,本研究通过组织病理学指出了异育银鲫自然感染A. sobria后的发病机理,为A. sobria致病机理的进一步研究奠定了基础。
[1]Sun Q,Ruan J M,Hu K,et al. Case analysis of red-gills and gill hemorrhagic disease in Sheyang city Jiangsu province [J]. Scientific Fish Farming,2012,(11):64—65[孙琪,阮记明,胡鲲,等. 江苏射阳县大红鳃病与鳃出血病的案例分析. 科学养鱼. 2012,(11):64—65]
[2]Li J L,Wang C B. Hazards and control of red-gills disease in Carassius auratus gibelio [J]. Fishery Guide to be Rich,2011,(16):52 [黎俊龙,王持标. 鲫鱼大红鳃病的危害与诊治. 渔业致富指南,2011,(16):52]
[3]Jiang L F,Xun Y P,Pan P S. Hazards and control of redgills disease in fish [J]. Contemporary Aquaculture,2013,(11):68 [姜礼燔,许云萍,潘培松. 鱼类大红鳃病的危害及其防治. 当代水产,2013,(11):68]
[4]Wu T,Ding Z F,Zhu C Y,et al. Epidemiological investigation and survey of gill hemorrhagic disease in silver prussian carp(Carassius auratus gibelio) [J]. Fisheries Science,2014,33(5):283—287 [吴霆,丁正峰,朱春艳,等. 异育银鲫鳃出血病流行病学调查和研究. 水产科学. 2014,33(5):283—287]
[5]Yang Z X,Li G L,Wang Y,et al. Primary establishment of LAMP method for cyprinid herpesvirus 2 detection [J]. Applied Mechanics and Materials,2014,602:1823—1828
[6]Xu J,Zeng L,Zhang H,et al. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp,Carassius auratus gibelio in China [J]. Veterinary Microbiology,2013,166(1):138—144
[7]Hine P M,Tham K M,Morrison R. Cyprinid herpesvirus 2 in New Zealand goldfish [J]. Surveillance,2006,33(4):3—5
[8]Wu T,Ding Z,Ren M,et al. The histo-and ultra-pathological studies on a fatal disease of prussian carp(Carassius gibelio) in mainland China associated with cyprinid herpesvirus 2(CyHV-2) [J]. Aquaculture,2013,412:8—13
[9]Zhang X J,Yan B L,Bing X W,et al. Detection of hemolysin gene and phenotypic and molecular identification of pathogenic Aeromonas sobria from gibel carp(Carassius auratus gibelio) [J]. Journal of Hydroecology,2010,3(4):102—107 [张晓君,阎斌伦,邴旭文,等. 异育银鲫病原温和气单胞菌表型及分子鉴定与溶血素基因检测. 水生态学杂志. 2010,3(4):102—107]
[10]Hu L L,Fang W H,Liang S C,et al. Isolation,identification and drug sensitive test of Aeromonas sobria from goldfish [J]. Journal of Shanghai Ocean University,2008,17(3):285—290 [胡琳琳,房文红,梁思成,等. 金鱼温和气单胞菌的分离鉴定及药敏试验. 上海水产大学学报. 2008,17(3):285—290]
[11]Shen J Y,Zhang Z Y,Qian D,et al. Studies on humoral immune response of trionyx sinensis to Aeromonas sobria inactived vaccine [J]. Acta Hydrobiologica Sinica,2003,27(1):27—30 [沈锦玉,张志育,钱冬,等. 中华鳖对温和气单胞菌体液免疫应答规律的研究. 水生生物学报. 2003,27(1):27—30]
[12]Lu W H,Wang A L,Chen J C. Study on antioxidation function of micropterus salmoides tissues by Aeromonas sobria artificial infection [J]. Hubei Agricultural Sciences,2009,48(7):1719—1721 [卢卫红,王安利,陈健酬. 大口黑鲈感染温和气单胞菌抗氧化功能的研究. 湖北农业科学,2009,48(7):1719—1721]
[13]Xu J J,Geng Y,Wang K Y,et al. Isolation,identification and pathogenicity of Aeromonas sobria from Triplophysa siluroides [J]. Sichuan Journal of Zoology,2014,33(5):708—714 [徐敬钧,耿毅,汪开毓,等. 似鲶高原鳅温和气单胞菌的分离鉴定及其感染的病理损伤. 四川动物,2014,33(5):708—714]
ETIOLOGY INVESTIGATION AND HISTOPATHOLOGICAL STUDY ON “REDGILL” OF SILVER PRUSSIAN CARP(CARASSIUS AURATUS GIBELIO) IN YANCHENG CITY
LIU Tao1,WANG Kai-Yu1,2,CHEN Jun-Jie1,LIU Tian-Qiang3,LI Mao3,KANG Yue-Hua3,DUAN Jing1and HE Yang1
(1. Fisheries Department of Sichuan Agricultural University,Chengdu 611130,China; 2. Key Laboratory of Animal Disease and Human Health of Sichuan Province,Sichuan Agricultural University,Chengdu 611130,China; 3. Tongwei Animal Health Research Institute,Chengdu 610000,China)
Two Aeromonas sobria isolates,isolated from cultured Carassius auratus gibelio during an outbreak of mass mortality in Yancheng city of China,were identified to the species level by phylogenetic analysis based on gyrB gene and biochemical tests. The isolates were identified to be the pathogeny of “Red-Gill” through investigating for the virulence of bacteria by recurrent tests and histopathology. We also described the macroscopic and microscopic lesions in Carassius auratus gibelio naturally infected with A. sobria. Our findings confirmed that the 2 isolates,rather than cyprinid herpesvirus 2,were the primary pathogen of “Red-Gill” disease and damaged the immune system in Carassius auratus gibelio. The results of drug sensitivity tests showed that the bacterial isolates was sensitive to ofloxacin,chloromycetin and norfloxacin; While,resistant to oxacillin,vancomycin,ampicillin,penicillin,clindamycin etc. Together,our findings demonstrate the pathogenesis of Aeromonas sobria in Carassius auratus gibelio and establish the foundation for “Red-Gill” in cultured Carassius auratus gibelio.
Carassius auratus gibelio; Aeromonas sobria; Red-Gill; CyHV-2; Histopathology
S941.41
A
1000-3207(2016)05-0928-07
10.7541/2016.120
2015-09-14;
2016-01-20
教育部《长江学者和创新团队发展计划》创新团队项目(IRT0848)资助 [Supported by the Program for Changjiang Scholars and Innovative Research Teams in the Sichuan Agricultural University(No. IRT0848)]
刘韬(1989—),男,四川德阳人; 硕士研究生; 主要从事细菌分子生物学研究。E-mail:liutao1232123@163.com
汪开毓,E-mail:kywang1955@126.com
